Introducción
El albendazol es un fármaco ampliamente utilizado en el tratamiento de la parasitosis. Su efectividad está probada para varias especies de parásitos y es el tratamiento de elección para la cisticercosis y la enfermedad hidatídica en los Estados Unidos 1. Es usado además para tratar la estrongiloidiasis, teniasis, ascariasis, anquilostoma, tricuriasis, oxiuriasis, entre otras 1. La absorción de este fármaco es errática y se absorbe mejor cuando se consume con comidas grasosas 1,2,3. El albendazol es un profármaco que se convierte en el metabolito activo sulfóxido de albendazol por el metabolismo de primer paso en el hígado y sus metabolitos se excretan por la orina 1,2. Su efecto está mediado por la inhibición de la síntesis de microtúbulos en las células del parásito 1-5.
Los efectos secundarios del albendazol son infrecuentes, especialmente cuando se administra durante 1-3 días; cuando ocurren usualmente son leves. Los efectos secundarios más frecuentes son molestias epigástricas, diarrea, náuseas, mareo, dolor de cabeza, malestar e insomnio. La terapia prolongada lleva más comúnmente a reacciones adversas como malestar abdominal, dolor de cabeza, fiebre, fatiga, alopecia, aumento de enzimas hepáticas y pancitopenia 1,3,4.
Los reportes de lesión hepática inducidas por albendazol son raros 6-14 y, de acuerdo con investigaciones, los episodios recurrentes son aún más raros 10,14. A continuación se reporta un caso de hepatitis recurrente relacionada con el uso empírico por temporadas de albendazol.
Informe de caso
Una mujer de 36 años se presentó en la oficina del especialista con un problema en el hígado. 3 semanas antes desarrolló una fiebre de 38 °C, mialgia y dolor de garganta. También reportó presentar orina oscura, náuseas y astenia. Recordaba haberse automedicado con albendazol antes de la aparición de sus síntomas y reportó el uso del medicamento cada verano. Tenía una historia de insomnio y episodios recurrentes de diarrea, fiebre, malestar general, mialgia e ictericia por 3 años consecutivos durante los meses de septiembre, noviembre y diciembre. Negó fumar, tomar alcohol, haberse hecho transfusiones de sangre o usar drogas ilegales. No presentó historia familiar de enfermedades hepáticas.
El examen físico del paciente mostró una esclerótica anictérica sin signos de lesión hepática, no presentaba asterixis. Las pruebas de laboratorio revelaron niveles de hemoglobina de 12,8 g/dL, hematócrito de 38,7 %, conteo de leucocitos de 4,830/mm3 y conteo de plaquetas de 180 000/mm3. Las pruebas bioquímicas hepáticas dieron los siguientes resultados: aspartato-aminotransferasa (AST) = 1304 U/L, alanina-aminotransferasa (ALT) = 2220 U/L, fosfatasa alcalina (ALP) = 158 U/L, gamma-glutamil transferasa (GGT) = 123 U/L, bilirrubina total = 5,89 mg/L, bilirrubina directa = 3,89 mg/L y actividad de protrombina de un 71 %. Los niveles de ceruloplasmina (27,7 mg/dL), ferritina (145 μg/dL) y la saturación de transferrina (49 %) fueron normales. Los exámenes de antivirus de la hepatitis A (anti-VHA) inmunoglobulina G (IgG) e inmunoglobulina M (IgM); antígeno de superficie del virus de la hepatitis B (HbsAg); IgM, anticuerpos antihepatitis B core (anti-HBc) y anti-HBc total, antivirus de la hepatitis C (anti-VHC) y serología antivirus de la inmunodeficiencia humana (anti-VIH) fueron negativos. Las pruebas para los siguientes anticuerpos fueron negativas: anticuerpos antinucleares, antimúsculo liso, antimicrosomales tipo 1 de hígado/riñón y anticuerpos antimitocondriales. La Figura 1 muestra la evolución de los valores de aminotransferasa de hasta más de 10 veces los valores normales más altos, después de la primera exposición a albendazol.
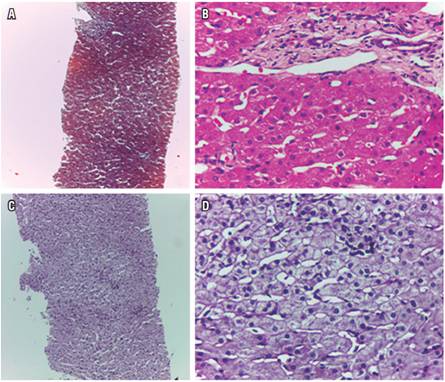
Una exacerbación ocurrió 60 días después de interrumpir el fármaco, seguida de una normalización progresiva. Un nuevo episodio similar al original apareció 10 meses después de una reexposición (Figura 1). Al paciente se le realizó biopsia de hígado, la cual reveló cambios reactivos mínimos no específicos (Figura 2).
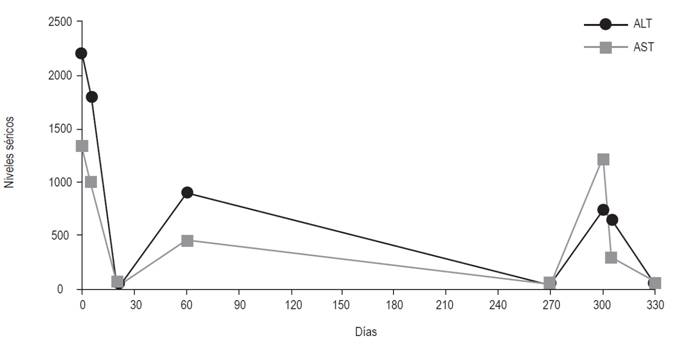
Figura 1 Evolución de aminotransferasas luego de suspender el medicamento y volverlo a administrar pasados 10 meses.
Discusión
Se diagnostica una hepatitis aguda a partir de la presencia de ictericia, o síntomas de enfermedad aguda no específicos, acompañados de elevación en la actividad de AST o ALT 15,16. Los valores discriminantes más importantes para reconocer la lesión hepática aguda fueron 200 U/L para AST y 300 U/L para ALT 15. Diferentes etiologías tienen presentaciones clínicas similares como la hepatitis por virus hepatotrópicos, la lesión hepática inducida por fármacos (DILI), hepatitis autoinmune, hepatitis isquémica, colangitis biliar primaria, colangitis esclerosante primaria, enfermedad de Wilson, hepatitis alcohólica, enfermedades cardíacas y de la tiroides, entre otras. Sin embargo, los niveles de aminotransferasa en suero 10 veces mayores a los límites normales más altos y los niveles de GGT cercanos a los normales restringieron el diagnóstico diferencial a algunas etiologías específicas entre las cuales se encuentran la hepatitis por virus hepatotrópicos; DILI; hepatitis autoinmune; hepatitis isquémica; hepatitis alcohólica; e infecciones como dengue, virus de Epstein-Barr, citomegalovirus y toxoplasmosis 15,16.
DILI es una enfermedad con presentación clínica variable, con un espectro que va desde la insuficiencia hepática asintomática a la enfermedad hepática crónica 6,15,16,17. Es una condición difícil de identificar y su diagnóstico se realiza por exclusión con base en la historia clínica, la historia de uso de fármacos y la evaluación del perfil bioquímico del hígado del paciente 17,18.
Los tipos de fármacos responsables de los casos de DILI en una población cambian de acuerdo con la ubicación geográfica. En países occidentales, la mayoría de casos se asocia con antibióticos, anticonvulsivos y agentes psicotrópicos. Mientras que en Asia son los suplementos dietéticos herbales, más que los medicamentos convencionales, la principal causa de DILI 18.
El patrón hepatocelular es más prevalente en los pacientes más jóvenes, mientras que en los pacientes más viejos la colestasis es más común 19. Más de un 17 % de los casos se atribuye a reacciones idiosincráticas y no es común la insuficiencia hepática. No hay maneras estandarizadas y globalmente reconocidas de predecir reacciones adversas 6.
Para este caso, la paciente en cuestión era asintomática y tenía una historia de automedicación con albendazol de venta libre. Las infecciones por anquilostomas, por ejemplo, se consideran una de las principales causas de pérdida de sangre patológica en los países tropicales y subtropicales 20. La higiene por sí sola puede controlar la enfermedad del anquilostoma; no obstante, este método es poco eficaz 20. La administración de antihelmínticos como tratamiento preventivo y terapia antihelmíntica masiva se recomienda en entornos específicos 20,21. En ausencia de una higiene adecuada, la Organización Mundial de la Salud (OMS) recomienda que el tratamiento antihelmíntico se repita cada 6-12 meses 20. Sin embargo, estas recomendaciones no se siguen siempre y el uso no supervisado ni restringido de un fármaco antihelmíntico de venta libre en dosis desconocidas puede exponer al paciente a situaciones de riesgo como el DILI. Como lo reporta este estudio, el albendazol puede causar un daño hepático significativo y, dado que los efectos secundarios no son triviales, el médico siempre debe considerar una lesión hepática inducida por albendazol cuando se han excluido otras causas.
Teschke y colaboradores llevaron a cabo una revisión sistemática de 2906 casos de DILI (22) y observaron que el 14 % de los diagnósticos presuntivos de esta condición se realizó sin eliminar satisfactoriamente otras posibles etiologías. En este informe de caso, los episodios de alteración de enzimas hepáticas coincidieron con el período en que el paciente usó el medicamento. La posibilidad de hepatitis viral se descartó por la serología negativa. Además, debido a la recurrencia de la enfermedad, el principal diagnóstico diferencial sería la hepatitis autoinmune, que también se descartó por la prueba de autoanticuerpos negativa y por el reporte de la biopsia, que demostró que no había daño hepático significativo. Aunque las pruebas de laboratorio no siguieron una presentación clásica, también se descartaron causas menos probables; se excluyeron enfermedades por acumulación debido a los niveles normales de ceruloplasmina y ferritina. Asimismo, los valores de GGT cercanos a los normales no sugirieron enfermedad colestática.
Ya que el DILI se diagnostica por exclusión, no hay criterios absolutos o métodos diagnósticos específicos para diagnosticar de manera precisa esta condición. Como consecuencia, para este propósito se utilizan escalas diagnósticas. La escala más usada es el Método de Evaluación de Roussel Uclaf del Concejo para las Organizaciones Internacionales en Ciencias Médicas (CIOMS/RUCAM) 23,24,25. Esta escala mide la probabilidad de que un fármaco esté ligado a la aparición de lesión hepática. Para este caso el paciente obtuvo un puntaje de 10, que indica una alta probabilidad de que el albendazol fuera la causa de su lesión hepática. Aunque los incrementos transitorios en los niveles de aminotransferasa son efectos adversos comunes (aproximadamente 10 % de los casos) 26,27,28, la prevalencia de hepatitis aguda ocasionada por este medicamento es rara.
Conclusiones
Es necesario ser cauteloso con las ideas preconcebidas que se tienen sobre medicamentos considerados inocuos, como se evidencia en este caso. Este reporte no pretende desincentivar la administración no burocrática o experimental de medicamentos antihelmínticos por parte de profesores, miembros de familia u otro personal no profesional en salud, incluidos aquellos indicados por la OMS en áreas endémicas. No obstante, extrapolar esta recomendación para áreas de baja prevalencia, como el sur de Brasil 29, puede ser, como mínimo, una negligencia. Es ideal agilizar el proceso de combatir helmintos; sin embargo, se debe fomentar la necesidad de realizar monitorizaciones de calidad que eviten vacíos y causen reacciones adversas como la hepatitis inducida por fármacos. Igualmente, la automedicación de cualquier tipo de fármaco potencialmente perjudicial siempre debe evitarse.











 text in
text in