Introducción
Como resultado del aumento de resonancias magnéticas (RM) y tomografías axiales computarizadas (TAC) abdominales que se realizan actualmente se ha experimentado un aumento en el número de quistes pancreáticos diagnosticados, que a su vez son de menor tamaño, identificándose en un 3 % de los TAC y hasta un 20 % de las RM realizadas por otros motivos 1,2. Adicionalmente, múltiples estudios han demostrado que la prevalencia de estas lesiones aumenta con la edad 3,4, lo cual implica un consecuente aumento del número de quistes pancreáticos con el envejecimiento actual de la población. En un reciente estudio prospectivo de cohortes poblacionales tras la realización de colangiorresonancia magnética (colangio-RM) se llegaron a encontrar quistes pancreáticos hasta en el 49,1 % de la población del estudio, aunque se estableció un bajo punto de corte (tamaño: 2 mm) 3. No obstante, la mayor parte de estas lesiones se diagnostican de forma incidental y generalmente son inferiores a 10 mm 3,5,6. Este aumento en el número de quistes diagnosticados puede generar un elevado grado de preocupación tanto en pacientes como en médicos debido al potencial de malignización de algunos de ellos y a que no siempre se llega al diagnóstico de certeza, lo que genera en ocasiones la realización de múltiples pruebas costosas, en ocasiones invasivas, e incluso su resección de forma innecesaria que conlleva una no despreciable morbimortalidad.
Las lesiones quísticas pancreáticas engloban una amplia variedad de lesiones incluyendo las lesiones neoplásicas y no neoplásicas (Tabla 1). Dentro del grupo de las no neoplásicas la más frecuente es el pseudoquiste y es importante diferenciarlo de aquellas lesiones neoplásicas, como las neoplasias quísticas pancreáticas (NQP) verdaderas con las que en ocasiones es difícil la diferenciación exclusivamente por criterios morfológicos. Además, tan solo alrededor del 4 % de los quistes asintomáticos será pseudoquistes, siendo la mayoría NQP 7.
La importancia de la correcta identificación de estas lesiones quísticas radica en el potencial de malignidad que presentan algunas de estas, como son la neoplasia quística pseudopapilar, las neoplasias sólidas con degeneración quística y los quistes de estirpe mucinosa, englobándose dentro de esta última categoría la NQM y la neoplasia mucinosa papilar intraductal (IPMN). Las IPMN pueden ser de conducto principal (MD-IPMN), de rama lateral (BD-IPMN) o mixtas. No todas las neoplasias mucinosas presentan el mismo potencial de degeneración. Según publicaciones recientes, las NQM presentan un potencial de malignidad que oscila entre el 10 % y el 17 % 8,9, las MD-IPMN del 38 %-68 % 8,10,11, las BD-IPMN del 12 %-47 % 8,10 y del 8 %-20 % para las neoplasias sólidas pseudopapilares 8. En cambio, los quistes serosos, los quistes simples y los linfoepiteliales se consideran quistes benignos 8, aunque anecdóticamente hay quistes serosos en los que se ha descrito progresión a malignidad 12.
El cáncer de páncreas es una de las causas más frecuentes de muerte relacionada con cáncer y tiene mal pronóstico en el momento del diagnóstico con una supervivencia a 5 años <10 % si se tienen en cuenta todos los tumores, y del 25 % si se consideran solo aquellas lesiones localizadas 13, presentando una mortalidad anual que casi iguala a su morbilidad. Tan solo un 20 %-25 % de los cánceres de páncreas van a ser candidatos a tratamiento quirúrgico al diagnóstico y un 80 % de estas presentarán recurrencia a pesar de la cirugía, por lo que el diagnóstico y tratamiento precoces son fundamentales, siendo de gran importancia la identificación de las lesiones precursoras de adenocarcinoma pancreático, que son las neoplasias pancreáticas intraepiteliales (PanIN) y las NQP 14. Se estima que las lesiones precursoras requieren una media de 11,7 años para evolucionar a malignidad y tardan otros 6,8 años adicionales en metastatizar 15, por lo que teóricamente existe un espacio temporal (ventana diagnóstica) suficiente para detectar estas lesiones de forma precoz. No obstante, en términos generales, el riesgo de malignidad de las NQP detectadas de forma incidental es bajo y representan un 1 %-5 % del total de neoplasias pancreáticas malignas 16.
Tabla 1 Clasificación de las lesiones quísticas pancreáticas
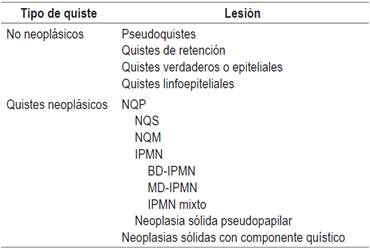
NQP: neoplasia quística pancreática; NQS: neoplasia quística serosa; NQM: neoplasia quística mucinosa; IPMN: neoplasia mucinosa papilar intraductal; BD-IPMN: neoplasia mucinosa papilar intraductal de rama lateral; MD-IPMN: neoplasia mucinosa papilar intraductal de rama principal.
Diagnóstico
Ante el hallazgo de un quiste pancreático el primer paso debe ser diferenciar entre pseudoquiste y NQP fundamentalmente mediante la combinación de historia clínica, antecedentes de pancreatitis, características por imagen y análisis del líquido citológico y bioquímico. Es importante tener en cuenta que los pacientes con neoplasias quísticas pueden presentar pancreatitis y que otros sin antecedente aparente de pancreatitis aguda pueden presentar pseudoquistes 17. El siguiente objetivo diagnóstico debe ser diferenciar entre NQP, detectar las que presentan potencial de malignización (mucinosas y neoplasia sólida pseudopapilar); y, por último, determinar aquellas con sospecha de malignidad.
La aproximación diagnóstica de los quistes pancreáticos está en continua evolución. La mayor parte se detectan de forma incidental en una prueba de imagen radiológica realizada por otros motivos (TAC o RM). La RM es la prueba radiológica de elección para el diagnóstico y seguimiento de las NQP dado que, por su mayor resolución espacial, ofrece mayor sensibilidad para la identificación de lesiones sólidas pancreáticas de pequeño tamaño y, con la secuencia de colangio-RM, permite detectar lesiones quísticas de menor tamaño, definir mejor la afectación del conducto pancreático principal (CPP), la comunicación con este, la presencia de nódulos murales y de septos 18. En cambio, la TAC es de elección para aquellos con sospecha de comportamiento maligno o enfermedad avanzada, detectando la posible invasión local de estructuras y de metástasis 17. No obstante, la precisión para diferenciar entre los distintos tipos de quistes y el riesgo de malignidad solo por criterios clínicos y morfológicos es subóptima dado que las diferentes lesiones pueden presentar características similares, siendo la precisión diagnóstica para determinar el tipo de quiste del 40 %-95 % para la RM/colangio-RM y del 40 %-81 % para la TAC 18.
La ecoendoscopia (ultrasonido endoscópico [USE]) permite valorar los criterios morfológicos y la realización de punción y análisis del líquido 19. Las características endosonográficas que se han relacionado con malignidad son el tamaño superior a 3 cm, la presencia de componente sólido, el engrosamiento mural, la dilatación del Wirsung, el cambio abrupto del calibre del CPP, atrofia distal de la glándula pancreática y la presencia de linfadenopatías 1,10. Pero al igual que con otras técnicas de imagen, las características endosonográficas no son suficientes como predictor individual de malignidad. El tamaño >3 cm se asocia con baja sensibilidad y especificidad (74 % y 49 % respectivamente) para el diagnóstico de neoplasia avanzada 14, y se ha descrito malignidad en lesiones de tamaño inferior 20. La elastografía por ecoendoscopia es una técnica complementaria que, aunque no ha demostrado utilidad en la evaluación de las lesiones quísticas pancreáticas, podría ser empleada para la evaluación de lesiones sólidas pancreáticas 5.
La punción-aspiración con aguja fina guiada por USE (USE-PAAF) es una técnica segura que permite realizar el estudio morfológico de la lesión y la punción-aspiración de su contenido. En un estudio reciente de Kashab y colaboradores se concluyó que la realización de USE-PAAF añadida al TAC o a la RM aumenta la precisión para el diagnóstico de neoplasia en lesiones quísticas en un 36 % y 54 %, respectivamente 21. Al permitir optimizar el diagnóstico y, por tanto, modificar el manejo de estos pacientes, la USE-PAAF se ha convertido en la técnica de elección en el diagnóstico de lesiones pancreáticas 19.
Con el líquido obtenido es posible realizar el estudio citológico, bioquímico y molecular que permitirá definir el tipo de quiste y, en el caso de la citología, detectar la presencia de malignidad (Tabla 2). La citología ofrece un bajo rendimiento diagnóstico con una sensibilidad inferior al 50 % en quistes mucinosos debido a la obtención frecuente de una muestra acelular o paucicelular 22; sin embargo, es de gran utilidad cuando proporciona un diagnóstico específico 1,23, y existen estrategias para aumentar su rendimiento como es el empleo de contraste para visualizar el posible componente sólido y dirigir sobre este la obtención de la muestra, evitando áreas de moco o detrito 24.
Tabla 2 Características generales de los quistes pancreáticos más frecuentes
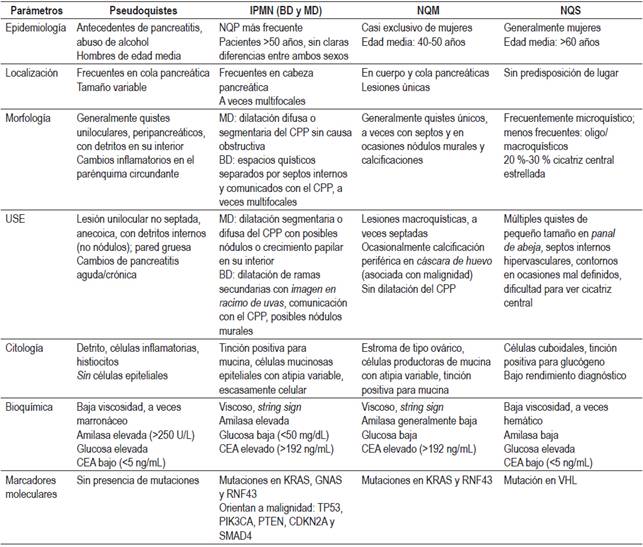
CEA: antígeno carcinoembrionario.
De forma generalizada se recomienda complementar el estudio del líquido mediante el vaciado completo y la obtención del contenido para realizar análisis bioquímico determinando niveles de amilasa, CEA y, según la evidencia reciente, también de glucosa 25,26. Unos niveles bajos de amilasa (<250 U/L) excluyen el diagnóstico de pseudoquiste con una especificidad del 98 % 22, mientras que niveles elevados orientan hacia IPMN o pseudoquiste, aunque al haberse encontrado valores de amilasa elevados en NQP sin comunicación con el CPP sus niveles no se consideran clínicamente relevantes para el diagnóstico diferencial entre diferentes tipos de NQP 27. Los niveles de CEA contribuyen a diferenciar lesiones mucinosas de no mucinosas, pero el punto de corte óptimo no ha sido establecido. El más empleado es 192 ng/mL con una sensibilidad del 73 %, especificidad del 84 % y precisión diagnóstica del 79 % 26. Los niveles de CEA han demostrado superioridad respecto a otros marcadores tumorales estudiados como el CA 19,9, CA 72,4 o el CA 15,3. Recientemente se han publicado estudios que describen que los quistes de estirpe mucinosa contienen niveles inferiores de glucosa que aquellos no mucinosos 25, siendo esta determinación especialmente útil debido a su bajo coste. En concreto, en el estudio de Zikos y colaboradores obtuvieron una sensibilidad y especificidad para la detección de quistes mucinosos con su determinación en laboratorio del 95 % y 57 % respectivamente, y del 88 % y 78 % respectivamente con glucómetro, con 50 mg/dL como punto de corte 25. No obstante, ni los niveles de glucosa ni los de CEA se han relacionado con malignidad. Finalmente, conviene resaltar que a pesar del empleo de criterios morfológicos y del análisis citológico y bioquímico, el diagnóstico en ocasiones sigue siendo subóptimo 28.
Otro punto importante es seleccionar de entre todos los pacientes diagnosticados de quistes pancreáticos aquellos que deben ser estudiados mediante USE o USE-PAAF. Varias guías como la International Association of Pancreatology (IAP) en 2012 10 (conocida como guía de Fukuoka), la Guía Europea sobre NQP 6 en 2013 y, posteriormente, la American Gastroenterological Association (AGA) 23 en 2015 (Tabla 3), por medio de parámetros como el tamaño del quiste, la presencia de componente sólido y de la afectación del conducto pancreático principal, han tratado de identificar aquellas NQP que se beneficiarían de mayor investigación empleando ecoendoscopia y punción para obtener una muestra para análisis del líquido y realizan recomendaciones de seguimiento y de tratamiento quirúrgico 1. Recientemente, tras una reunión en Sendai de la IAP realizada en 2016 y debido principalmente a las restricciones en el seguimiento de las NQP propuestas por la AGA, se llevó a cabo una actualización de las recomendaciones emitidas en la guía de 2012, publicada en 2017, en la que prestan especial interés a la importancia de la presencia de nódulos murales, y se recomienda la cirugía en caso de certeza de nódulo >5 mm en la USE por ser un hallazgo claramente relacionado con malignidad, además de mantener la recomendación de continuar el seguimiento de las IPMN 29.
Tabla 3 Recomendaciones de realizar USE-PAAF diagnóstica
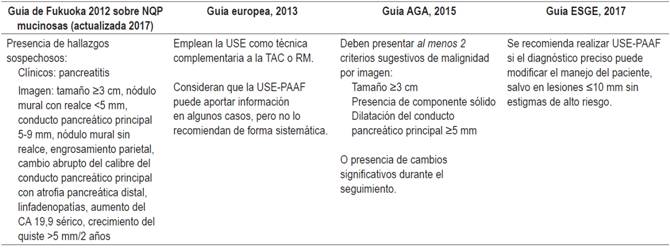
AGA: American Gastroenterological Association; ESGE: European Society of Gastrointestinal Endoscopy.
Sin embargo, los resultados con el empleo de estas guías son subóptimos y han sido criticados por múltiples autores, especialmente las recomendaciones de la AGA acerca de interrumpir el seguimiento 19,30,31. El tratamiento y seguimiento de las BD-IPMN está especialmente poco aclarado 9,19,30,32,33. En esta línea, Lekkerkerker y colaboradores realizaron un estudio retrospectivo en el que incluyeron a 115 pacientes que fueron sometidos a resección de los quistes y evaluaron el porcentaje de cirugías innecesarias y la ausencia de detección de malignidad si se hubiesen empleado las principales guías de práctica clínica. Se concluyó que las guías IAP y la europea conllevan mayor número de cirugías innecesarias, mientras que si se hubiesen seguido las recomendaciones de la AGA se habría evitado la cirugía en un 28 %, aunque un 12 % de las lesiones con displasia de alto grado o invasivas no se habría detectado, lo que demuestra una pérdida de sensibilidad de la AGA para la detección de malignidad 9.
La progresión de células pancreáticas ductales normales a células tumorales se caracteriza por el acúmulo de mutaciones genéticas. El análisis del ácido desoxirribonucleico (ADN) se ha investigado con el fin de contribuir en la diferenciación entre quistes mucinosos (premalignos) de aquellos no mucinosos y para detectar malignidad 28. Diversos estudios han demostrado que existen mutaciones asociadas con un determinado tipo de quistes y que, por tanto, podrían ayudar en su adecuada caracterización 34,35. Las IPMN se asocian con mutaciones en KRAS, GNAS y RNF43; las NQM se asocian con mutaciones en KRAS y RNF43, pero no en GNAS; las NQS pueden presentar mutaciones en VHL; y las neoplasias sólidas pseudopapilares se caracterizan por mutaciones en CTNNB1, pero no en KRAS, GNAS, RNF43 ni en VHL. Además, las mutaciones en TP53, PIK3CA, PTEN, CDKN2A y SMAD4 son típicas de neoplasia avanzada en el seno de un quiste de estirpe mucinosa, por lo que el análisis molecular podría ayudar tanto en la caracterización de quistes como en la identificación de quistes con presencia de malignidad 34,35. Actualmente, las guías de práctica clínica recomiendan la determinación de KRAS y GNAS para la identificación de neoplasias de estirpe mucinosa en aquellos casos en los que existan dudas diagnósticas y en los que su adecuada caracterización pueda modificar el tratamiento 5,18. Para el resto de marcadores son necesarios más estudios aunque es posible que, debido a los resultados preliminares, pueda implementarse en un futuro su uso en casos concretos.
Otra herramienta de la que se dispone actualmente, que no aumenta los efectos adversos y que podría mejorar el diagnóstico es el empleo de contrastes ecográficos (USE-CEH). Estos permiten detectar las estructuras vascularizadas (tabiques y nódulos), mientras que el contenido del quiste (moco, detrito) va a permanecer invisible. Va a ser de utilidad para diferenciar nódulos murales de acúmulos de mucina o de detrito, y para diferenciar los tumores quísticos de los pseudoquistes, puesto que los últimos presentan ausencia de captación en todas las fases salvo aquellos pseudoquistes recientes en los que la cápsula puede realzar 36. La adecuada detección de nódulos murales es subóptima con TAC, RM y USE 37; en diversos estudios se ha demostrado una mejoría en su detección con USE-CEH 38, siendo este punto de especial relevancia puesto que es uno de los criterios para tomar la decisión de tratamiento quirúrgico en pacientes con IPMN o NQM al haberse relacionado con malignidad 10,29,38. En un estudio reciente de 70 pacientes en el que se disponía de pieza quirúrgica se evaluó la precisión de la USE y USE-CEH realizadas de forma preoperatoria y encontraron que la USE-CEH es superior frente a la USE en modo B para determinar si la presencia de nódulo mural se asocia con malignidad (respectivamente, sensibilidad: 97 % frente a 97 %; especificidad: 75 % frente a 40 %; precisión: 84 % frente a 64 %) 38. Además, se concluyó que los nódulos murales con una altura >4 mm detectados con USE-CEH se asociaban con malignidad (Odds ratio [OR]: 56); mientras que, en caso de medirse con USE convencional, el tamaño debe ser mayor (≥8 mm, OR: 15).
Tratamiento y seguimiento
Mientras que la cirugía está indicada en casos sintomáticos, en aquellos con malignidad o quistes de alto riesgo de malignización la dificultad radica en detectar correctamente dichos pacientes. Los pseudoquistes y las NQS presentan un potencial de malignidad nulo o muy bajo, por lo que el tratamiento de estas lesiones queda reservado a los casos sintomáticos y aquellos en los que existan dudas diagnósticas 12. Las guías de Fukuoka, europea y AGA recomiendan el tratamiento quirúrgico de las NQM, la neoplasia sólida pseudopapilar, de los MD-IPMN e IPMN mixtos debido al riesgo de malignidad siempre que el paciente sea candidato quirúrgico 6,10,23. Sin embargo, existen diferencias en el umbral para la recomendación de tratamiento quirúrgico en el caso de las BD-IPMN (Tabla 4) 1. En el caso de las IPMN multifocales se recomienda evaluar y recomendar el tratamiento atendiendo a las características individuales de cada lesión 39.
Tabla 4 Indicaciones de tratamiento quirúrgico según las principales guías
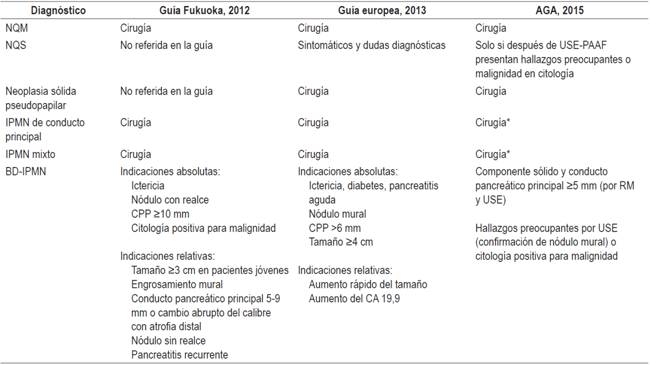
*Aunque requiere, además de la dilatación del CPP, confirmación de nódulo sólido o de citología positiva para malignidad.
La indicación de seguimiento va a depender del tipo de quiste e implica la evaluación del tamaño y de la morfología en busca de parámetros precoces que sugieran una posible malignización mediante RM o USE. Los intervalos recomendados de seguimiento son variables según las diferentes guías. La guía de Fukuoka recomienda seguimiento con RM o USE con periodicidad variable en función del tamaño de los quistes, e interrumpir el seguimiento en NQM y NQS resecados en ausencia de neoplasia invasiva. En cambio, la AGA recomienda interrumpir el seguimiento de los quistes pancreáticos tras 5 años en ausencia de cambios y de aquellas NQM, NQS e IPMN resecadas sin displasia de alto grado ni carcinoma invasivo 10,30.
Es importante conocer que la simple presencia de una IPMN implica un mayor riesgo de desarrollar cáncer de páncreas que el de la población general 7,13,31, habiéndose descrito un riesgo hasta 19,6 veces superior 2. Según estudios realizados, varios autores han informado que en pacientes intervenidos de IPMN existe riesgo de desarrollar nuevas IPMN, de recurrencia de IPMN y de desarrollar adenocarcinoma pancreático metacrónico en el páncreas remanente 40. Además, este riesgo de adenocarcinoma pancreático se mantiene tras más de 5 años de seguimiento 31, por lo que se recomienda mantener el seguimiento a largo plazo 7. Por ello, múltiples autores han criticado la guía de la AGA y proponen un abordaje alternativo a estas guías incluyendo el descenso del umbral para la realización de USE-PAAF y la determinación de marcadores moleculares 19,33.
Conclusiones
Las NQP son un hallazgo frecuente en pruebas de imagen. La importancia de su caracterización radica en el potencial de malignidad que presentan algunas de ellas. Inicialmente, se debe excluir el diagnóstico de pseudoquiste y diferenciar entre neoplasias de estirpe mucinosa (IPMN y NQM) y serosa (NQS). En muchos casos, el diagnóstico por criterios clínicos y morfológicos no va a ser definitivo, por lo que es necesario realizar USE-PAAF con análisis citológico y bioquímico, planteándose el análisis molecular en centros especializados y como una herramienta que en el futuro próximo pueda contribuir a identificar en casos dudosos los quistes mucinosos y a detectar la presencia de malignidad. Una vez se han diagnosticado MD-IPMN, IPMN mixto o NQM se recomienda realizar tratamiento quirúrgico en aquellos casos en los que sea posible. El manejo de los BD-IPMN se realiza en función de los criterios de alarma propuestos por las guías de práctica clínica. Las NQS no precisan tratamiento salvo en casos sintomáticos o en aquellos en los que existan dudas diagnósticas. Actualmente se recomienda no interrumpir el seguimiento de los IPMN incluso después de haber sido sometidos a resección quirúrgica por el riesgo de desarrollar nuevas IPMN o adenocarcinoma pancreático a largo plazo.











 text in
text in 


