Introducción
La enfermedad inflamatoria intestinal (EII) comprende la enfermedad de Crohn (EC), la colitis ulcerativa (CU) y la colitis indeterminada (este último término en la actualidad se considera reservado para patólogos cuando tienen el espécimen de una colectomía en pacientes con hallazgos sobrepuestos o no definitorios entre EC y CU) 1.
La etiología y la patogénesis exacta aún se desconocen, pero la hipótesis actual relaciona a la EII con la desregulación del sistema inmune gastrointestinal en individuos genéticamente predispuestos 2. Algunos autores mencionan la importancia de vías patógenas como interleucina 23 (IL-23), que media la defensa microbiana y la inflamación intestinal; y genes como el receptor de IL-23 (IL-23R) e interleucina 12B (IL-12B) se han asociado 3,4. Estos genes y otros como el de la proteína tirosina-cinasa 2 (TYK2), la cinasa Janus 2 (JAK2), el transductor de señal y el activador de la transcripción 3 (STAT3) también están asociados con psoriasis 2.
La incidencia de EC y CU es 3,8 a 7,5 veces mayor en pacientes con psoriasis que en la población general 5. En ambas patologías, los anticuerpos antifactor de necrosis tumoral alfa (anti-TNF α) como el infliximab y el adalimumab tienen un efecto benéfico, lo que respalda la hipótesis de vías inflamatorias comunes dirigidas tanto a la piel como al intestino. La EII y la psoriasis podrían superponerse, o incluso la psoriasis se podría presentar de forma paradójica en personas que hayan recibido anti-TNF para EII. (se estima que las lesiones psoriasiformes en la piel podrían ocurrir en 1,62 %-8,8 % de los pacientes con EII tratados con anti-TNF) 6,7. La aparición de lesiones psoriasiformes no está asociada con el sexo, duración de tratamiento o actividad de la EII 8,9,10. En muchos individuos, el control de la EII podría impactar positivamente en la mejoría o resolución de lesiones de la psoriasis.
La CU es la forma más común de EII. En el estudio realizado en el Hospital Pablo Tobón Uribe (HPTU) en Medellín, Colombia, la relación entre CU y EC fue 4,9:1 (CU en 80,7 %, EC en 15,8 %) 11. La incidencia de CU es variable: según la población estudiada, entre 1,2 a 20,3 casos por cada 100 000 personas/año 7. La etiología es desconocida y multifactorial; se ha descrito que la historia familiar de EII incrementa el riesgo; la apendicectomía en jóvenes, así como el hábito de fumar podrían ser factores protectores 1,12. La CU se caracteriza por la presencia de inflamación crónica y difusa en la mucosa rectal y colónica 1. En el curso natural de la enfermedad alternan frecuentemente brotes de actividad inflamatoria con períodos de remisión y existe una elevada tendencia a la recurrencia 13.
Caso clínico
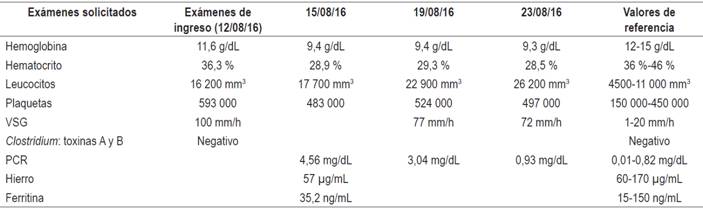
Una paciente de 50 años, con historia personal de CU (diagnóstico en el 2009) y psoriasis (diagnóstico en 1996) fue conocida en el HPTU en agosto de 2016 por cuadro de dolor anal y disquecia de al menos 2 meses de evolución, asociados con diarrea acuosa, sangre y, en la última semana, exacerbación de sus síntomas, teniendo en promedio 10-12 deposiciones al día; y dolor abdominal tipo cólico a diario. En la revisión por sistemas refirió intenso prurito y rascado frecuente de las lesiones en la piel. En el examen físico se notó con palidez mucocutánea; deshidratada; afebril; con dolor abdominal sin irritación peritoneal; con múltiples placas descamativas activas en cara, tronco y extremidades; múltiples máculas de hiperpigmentación y erosiones de rascado en la piel (Figura 1 A y B). Se hospitalizó y se solicitaron estudios de ingreso (Tabla 1), en los que se identificó anemia leve y marcada elevación de reactantes de fase aguda. En la colonoscopia solo se llegó hasta el ángulo esplénico por severos cambios inflamatorios y sangrado fácil con el roce del equipo, y por el alto riesgo de perforación se decidió suspender a ese nivel (Figura 2). Se solicitaron exámenes para descartar procesos infecciosos sobreagregados (toxina A y B para Clostridium negativa, inmunohistoquímica de citomegalovirus [CMV] en el tejido negativa). Inicialmente, se manejó con hidrocortisona 100 mg cada 8 horas durante 5 días, mesalazina oral en gránulos 1 g/8 h y mesalazina en enemas 4 g/día.
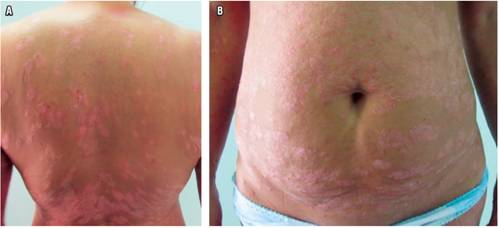
Figura 1 A. Foto del dorso de la paciente, donde se evidencian múltiples lesiones descamativas, eritematoedematosas, con erosiones de rascado. B. Foto de la piel del abdomen, donde se observan múltiples placas eritematosas, descamativas, con erosiones de rascado.
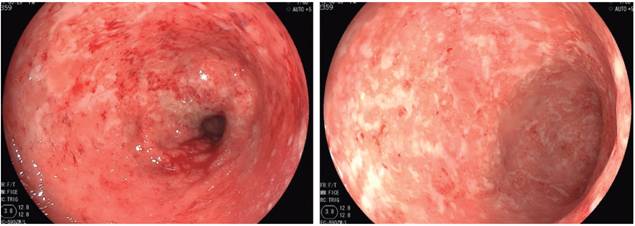
Figura 2 Colonoscopia donde se evidencian severos cambios inflamatorios, dados por la pérdida del patrón vascular normal. Marcado edema, eritema, erosiones múltiples homogéneas y mucosa friable al roce.
Adicionalmente, se revisó la historia clínica extrainstitucional para conocer al detalle el tratamiento previo, en la cual se describían múltiples esquemas recibidos: mesalazina en gránulos 3 g/día, azatioprina 100 mg/día, hierro parenteral quincenal por anemia e infliximab en dosis de 5 mg/kg durante 5 años; durante el último año de uso del infliximab perdió efectividad, por lo que requirió aumentar la dosis hasta 10 mg/kg sin una adecuada respuesta; luego cambian por adalimumab a dosis de 40 mg cada 2 semanas (2014-2015). Con el adalimumab mantenía una frecuencia defecatoria promedio entre 3-6 deposiciones al día, sin sangre, pero a finales de 2015 tuvo una nueva exacerbación y empeoramiento de las lesiones en la piel, por lo que se cambió el manejo a ustekinumab 45 mg subcutáneo (SC) cada 2 meses (2015-2016). Con este último hubo mínima mejoría de los síntomas digestivos, pero hubo un pobre control de las lesiones en la piel. Por recomendación de dermatología se cambió a secukinumab en marzo de 2016 y se continuó con mesalazina y azatioprina hasta la fecha de ingreso a nuestra institución. Con este último tratamiento presentaba una pobre respuesta de las manifestaciones gastrointestinales, por lo cual se hospitalizó.
Durante la hospitalización se observó un alto gasto fecal (con deposiciones sanguinolentas entre 6-7 diarias), anemización progresiva y persistencia de reactantes de fase aguda elevados (Tabla 1). Se realizó un staff de gastroenterología, donde se definió iniciar vedolizumab con esquema de inducción de 300 mg en la semana 0, semana 2, semana 6 y luego cada 8 semanas.
Durante el seguimiento ambulatorio la paciente refirió una notable mejoría, llegando a estar asintomática 3 meses después de iniciado el tratamiento. Se observó la normalización de los reactantes de fase aguda y normalización de la hemoglobina sin requerir administración de hierro parenteral. Además, se suspendió la azatioprina y se adicionó metotrexato a 12,5 mg/semana por su mejor perfil sobre el compromiso dermatológico.
En los controles endoscópicos se evidenció normalización de la mucosa, con biopsias histológicamente normales. Refirió, además, control completo del prurito y no ha requerido más uso de esteroides tópicos.
En el seguimiento a 12 meses ha estado asintomática desde el punto de vista digestivo, en remisión profunda y sin evidencia de actividad de sus lesiones de psoriasis. Se programó para exámenes de seguimiento cada 6 meses y evaluación clínica entre 3-6 meses.
Discusión
El tratamiento de la EII se ha basado principalmente en la estrategia step-up. En CU se considera apropiado el manejo inicial con 5-aminosalicilatos (5-ASA) para CU leve, tanto para inducción de remisión, como para el mantenimiento. En pacientes con enfermedad moderada-severa o leves en quienes falle el tratamiento inicial con 5-ASA está indicado el uso de cursos cortos (entre 2-4 meses) con esteroides. Los pacientes corticodependientes o quienes tengan recurrencias o pérdida de eficacia con el glucocorticoide son candidatos al uso de inmunomoduladores como las tiopurinas (azatioprina, 6-mercaptopurina) y el metotrexato 14; y en individuos corticorresistentes (que no responden a esteroides) o corticodependientes están indicados los anti-TNF como el infliximab, adalimumab, golimumab o certolizumab 15. El problema radica en que un número considerable de pacientes no tiene una respuesta clínica significativa (falla primaria al tratamiento), este fenómeno ocurre entre 10 %-40 % de casos de EC y en casi el 50 % de los pacientes con CU 15,16,17,18; adicionalmente, se describe en especial en EC que hasta 2 tercios de pacientes tienen falla secundaria al tratamiento (falta de respuesta sostenida durante 12 meses de tratamiento continuo) 14,19,20. En los casos de persistencia de la inflamación a pesar de tratamiento óptimo (dosis estándar de anti-TNF y del resto de medicamentos) hay clara indicación para aumentar la dosis o acortar el intervalo de aplicación del anti-TNF 15, como se hizo en esta paciente.
Para la CU en la actualidad se están utilizando nuevos esquemas de tratamiento con mecanismos de acción diferentes que parecen prometedores en pacientes refractarios a los anti-TNF. El vedolizumab es un anticuerpo antiintegrina α4 β7 selectivo en el tracto gastrointestinal, con evidencia creciente en relación con el tratamiento de pacientes con EII, especialmente en CU 1,12,21,22. Incluso se ha usado en casos de exantema psoriasiforme asociado con el uso de anti-TNF 23. Este medicamento fue aprobado por el Instituto Nacional de Vigilancia de Medicamentos y Alimentos (INVIMA) en febrero de 2016 para el uso en Colombia en EII, en pacientes adultos con enfermedad activa moderada-severa, que hayan tenido una respuesta inadecuada, presenten pérdida progresiva o sean intolerantes a los esteroides, inmunomoduladores o anti-TNF α.
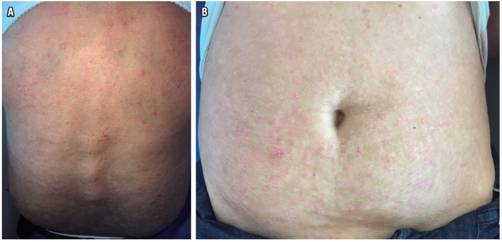
A pesar de no tener suficiente evidencia científica en psoriasis, decidimos utilizarlo en esta paciente ya que había un claro predominio de manifestaciones gastrointestinales, que en este punto podrían llevarla a complicaciones mayores como sangrado severo, anemia, necesidad de transfusión de hemoderivados, megacolon tóxico, perforación e incluso hasta la muerte. Además, ya se había agotado el manejo médico disponible en nuestro medio para su tratamiento. Con esta intervención logramos el control de ambas patologías por la evidencia de cicatrización profunda de la mucosa colónica y control de la psoriasis en el seguimiento a 12 meses (Figura 3 A y B). La mejoría notable en las lesiones de piel fue una ganancia clínica adicional que ha impactado de forma muy positiva en la calidad de vida de la paciente. Consideramos que se requieren serie de casos y estudios controlados para evaluar el impacto del medicamento sobre las lesiones de psoriasis. En lo revisado hasta hoy, este es el primer caso publicado de vedolizumab en un paciente colombiano con CU refractaria y psoriasis.











 texto en
texto en