Introducción
El cáncer gástrico (CG) es un problema de salud pública a nivel mundial, a pesar de la disminución en su incidencia y mortalidad en los últimos años 1. De acuerdo con GLOBOCAN, 1 033 701 nuevos casos por CG se presentaron en 2018 y más de 782 685 muertes por esta enfermedad ocurrieron durante el mismo año 2. El CG en el mundo representa el 5,7 % de todos los nuevos casos de cáncer y el 8,2 % del total de muertes por cáncer 2,3. Japón y Corea tienen las cifras más altas en incidencia en el mundo. Son áreas de alta incidencia: Asia, Europa Oriental, América del Sur y América Central; y son áreas de baja incidencia: el sur del Asia, norte y este de África, Norteamérica, Australia y Nueva Zelandia 4. Japón y Corea tiene las cifras más altas en incidencia en el mundo. En Japón, donde el CG permanece como el tipo de cáncer más común tanto en hombres como en mujeres, las cifras de incidencia son de 69,2/100 000 habitantes y de 28,6/100 000 habitantes, respectivamente 4.
En Colombia, según GLOBOCAN, en 2018 se detectaron 7419 casos nuevos de CG (7,3 %), de los cuales murieron 5505. El CG ocupó en incidencia para ese año el tercer lugar, luego del cáncer de mama y próstata, seguido por el cáncer de pulmón y colorrectal. Para el 2018 el CG representó la primera causa de mortalidad por cáncer (13,7 %) 5.
El riesgo de desarrollar CG se incrementa con la edad, ocurre más frecuentemente entre los 50 y 80 años de edad y es infrecuente en personas menores de 30 años. 6.
A pesar de la importante carga de enfermedad, en Colombia no existe ningún programa de control y prevención de CG, ni tampoco es priorizado como un problema de salud pública. Los trabajos de investigación existentes demuestran que la mayoría de los pacientes con CG presenta estadios avanzados cuando se diagnostica y esto se traduce en cifras muy bajas de supervivencia 7.
El CG es multifactorial, con una compleja interacción de agentes infecciosos (Helicobacter pylori y virus de Epstein-Barr), medioambientales (alta ingesta de sal, consumo de tabaco y dietas pobres en fibra, frutas y verduras) y con componente genético (antecedentes familiares con CG). El agente causal más importante es el H. pylori, una bacteria cuya infección se adquiere en la infancia y, en ausencia de un tratamiento adecuado, puede persistir toda la vida; esto induce una respuesta inflamatoria crónica que condiciona de manera variable al desarrollo de atrofia, metaplasia, displasia y, por último, CG 8.
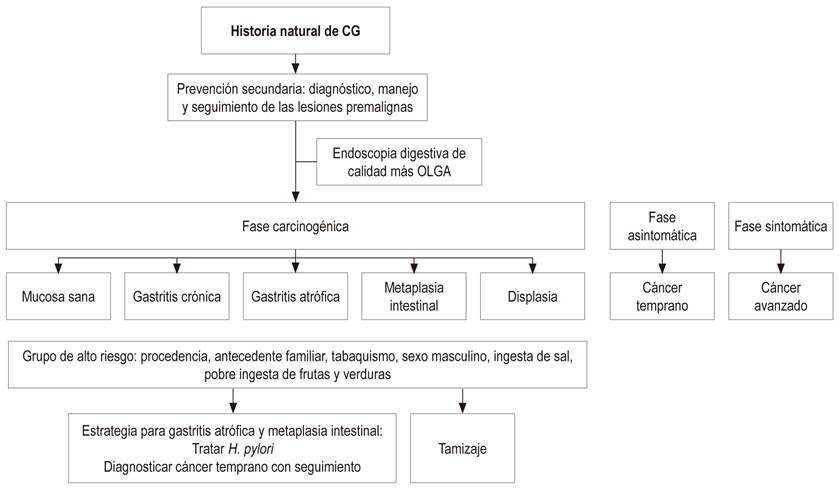
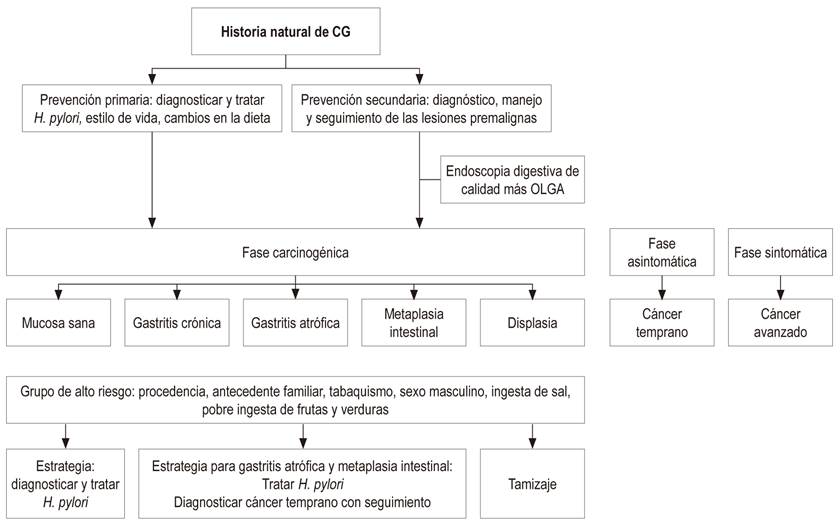
La prevención primaria del CG está dirigida a una dieta adecuada, rica en fibra, con mayor ingesta de frutas y verduras; y a un diagnóstico y tratamiento de la infección por H. pylori tempranamente en la vida, estrategia que debe realizarse antes de que existan cambios en la mucosa gástrica de atrofia y metaplasia intestinal. La prevención secundaria está dirigida al diagnóstico y seguimiento de las lesiones preneoplásicas como la atrofia y la metaplasia intestinal, fundamentadas en una escala de gravedad de acuerdo con la estadificación histológica conocida como el sistema Operative Link on Gastritis Assessment (OLGA) y Operative Link on Gastritis/Intestinal-Metaplasia Assessment (OLGIM)9.
Estas últimas recomendaciones se establecen porque los programas de tamización no son posibles en países con economías bajas o intermedias, como en Colombia, donde los recursos deben estar dirigidos a problemas inmediatos considerados de mayor urgencia 9.
Infortunadamente, en Colombia el diagnóstico se realiza en estadios avanzados, cuando no existe la posibilidad de curación para esta enfermedad. Frente a este problema de salud pública no hay ninguna acción por parte de las autoridades de salud ni del gremio médico; por tanto, debe ser un objetivo proponer a la comunidad médica del país estrategias de trabajo sobre la historia natural que permitan disminuir su incidencia y mortalidad 9.
El CG es una enfermedad prevenible. Existen estrategias dentro de la literatura con adecuados niveles de evidencia que permiten actuar dentro de la historia natural con el objetivo de disminuir su incidencia y las cifras de mortalidad, y mejorar la supervivencia a través de diagnósticos más tempranos. La implementación de estas estrategias de manejo, costo-efectivas, se puede lograr en poblaciones de alto riesgo, de forma racional y similar a como se está trabajando con el cáncer colorrectal 10.
Objetivo general
Colombia no tiene políticas definidas para controlar y prevenir el CG. Por lo anterior, se establece el siguiente objetivo: con el conocimiento de la historia natural, revisar las estrategias de intervención dirigidas a la prevención primaria y secundaria que permitan disminuir su incidencia y mejorar las cifras de mortalidad y de detección temprana.
Historia natural
El entendimiento de la historia natural de un tipo de cáncer es crucial en el diseño de una intervención efectiva 11.
En 1975 Pelayo Correa publicó “Un modelo para el desarrollo del cáncer gástrico”. En este artículo argumentó que el desarrollo del CG de tipo intestinal, el subtipo más común, se originaba de un proceso de 30 a 50 años de duración que comenzaba con la gastritis crónica atrófica y progresaba variablemente a metaplasia intestinal, displasia y cáncer. Se postulaba que los cambios iniciales se producían en la primera década de la vida, cuando ocurría la colonización por el H. pylori. Correa inicialmente postuló que los agentes responsables de promover este proceso lento de gastritis a cáncer estaban relacionados con el medio ambiente, basado en los estudios de personas que migraban de áreas de alto riesgo para CG a zonas de bajo riesgo 12.
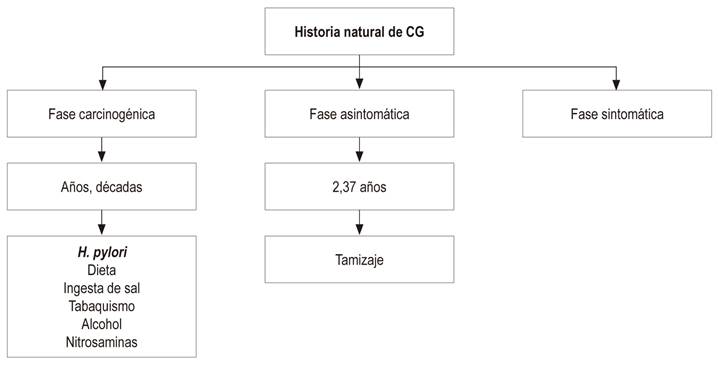
En su historia natural presenta 3 fases: carcinogénica, asintomática y clínica o sintomática (Tabla 1) 11.
Fase carcinogénica (duración de años y décadas)
Gastritis por H. pylori
La hipótesis más aceptada propone a la gastritis crónica por H. pylori como el factor etiológico inicial del CG. Esta infección se adquiere en la infancia. La lenta y variable progresión a atrofia gástrica, metaplasia intestinal, displasia y adenocarcinoma invasor de tipo intestinal es modulada a lo largo de muchos años por factores genéticos, dietéticos y ambientales, lo que ofrece una amplia oportunidad de intervención 11,12.
Bedoya reportó en 2002 que el 88 % de los niños menores de 10 años mostraba algún cambio inflamatorio en la mucosa gástrica y cambios de gastritis crónica atrófica en el 5 % 13.
Archila y colaboradores en una revisión de biopsias gástricas en población de 1 a 16 años encontraron infección por H. pylori en el 59 % de pacientes; en escasa cantidad en el 24,3 %, en moderada cantidad en el 20,1 % y en abundante cantidad en el 14,6 % 13.
El H. pylori es el agente causal más importante involucrado en la génesis del CG. La International Agency for Research on Cancer (IARC) lo consideró un agente carcinogénico tipo I desde 1994. El H. pylori está fuertemente asociado con el CG distal del estómago, aunque no muestra ninguna relación con el CG de la región proximal o cardial. Se ha estimado que más del 75 % de los canceres gástricos en todo el mundo se explica por la infección de H. pylori. También existe evidencia de que la infección por el H. pylori es una condición necesaria, pero no suficiente para explicar la carcinogénesis gástrica 15.
Otros factores etiológicos como el cigarrillo, la ingesta de alcohol y la formación endógena de nitrosaminas, reconocidos por la IARC, pueden estar involucrados en la causalidad del CG. Entre el 11 % y el 18 % de los casos pueden estar asociados con el cigarrillo. La dieta y la nutrición pueden jugar un papel en la oncogénesis gástrica. Existe evidencia consistente en el que la ingesta de frutas y vegetales están asociados con una disminución en el riesgo para esta enfermedad (Figura 1) 15.
El CG está asociado con una historia familiar (componente genético) con un Odds ratio (OR) de 2 a 8, dependiendo del país. También existen estudios de mayor prevalencia de infección por H. pylori y lesiones premalignas en los parientes en primer grado de pacientes con CG, en comparación con los controles 9,16.
La susceptibilidad genética está asumida o relacionada con el CG de tipo difuso causado por una mutación en la E-cadherina, una molécula crucial en el mantenimiento de la arquitectura epitelial 15.
El primer evento crucial en la carcinogénesis gástrica es la infección por el H. pylori, lo que desencadena una activación de la respuesta inflamatoria 15. Sin embargo, a pesar de la alta prevalencia de la infección por H. pylori, solamente una muy pequeña proporción de pacientes infectados desarrollan CG. De 100 pacientes infectados, solo 1 desarrollará CG 17.
Esto obliga a preguntarse por qué y cómo la enfermedad se desarrolla en una minoría de pacientes infectados. Una de las razones es la diferencia en la patogenicidad de la bacteria. Las investigaciones en este campo se han enfocado en la susceptibilidad genética (polimorfismos en genes que gobiernan las respuestas de inflamación gástrica), la heterogeneidad del H. pylori y otras influencias del medio ambiente tales como la sal de la dieta o la presencia de especies no Helicobacter dentro de la microbiota gastrointestinal pueden explicar por qué solamente una pequeña proporción de individuos colonizados por el H. pylori pueden desarrollar el CG 12.
Considerar al CG como la consecuencia de una infección ha permitido el entusiasmo de diagnosticar y tratar al H. pylori en áreas de alta prevalencia de CG 12. Ha sido claro que la mayoría de los CG se deben a la infección por H. pylori más que a factores relacionados con los estilos de vida. Cuando se sospecha que un cáncer es causado por una infección, se requieren medidas preventivas con el objetivo de disminuir su incidencia y mortalidad 12.
La infección por HP es típicamente adquirida en la infancia y se requieren años y décadas para que exista la transformación de la mucosa por el proceso inflamatorio crónico a estados de gastritis atrófica y metaplasia intestinal. Entonces, la erradicación de la bacteria en individuos jóvenes podría evitar esta progresión y de esta forma disminuir el riesgo de desarrollo del CG más adelante 11.
En Japón en 2009 y en 2103 se estableció, con base en estos argumentos, que la estrategia de diagnosticar y tratar a pacientes con gastritis asociada a H. pylori era válido y respaldado por el sistema de seguridad. Esta población, luego del tratamiento erradicador, tendría la mayor proporción de gastritis no atrófica y el seguimiento endoscópico no sería necesario 18.
En la isla de Matsú, en Taiwán, los residentes tienen una alta prevalencia por H. pylori. La incidencia de CG es de 50 por 100 000 habitantes, la cual es aproximadamente 3 a 5 veces mayor a la incidencia de Taiwán. La edad elegida se estableció a los 30 años con el fin de acelerar la eliminación del CG. Un estudio piloto de tamizaje comenzó en esta población de la isla en 2004 con el objetivo de diagnosticar y tratar la infección por H. pylori. Los resultados iniciales fueron muy promisorios. La incidencia de CG disminuyó en un 25 % y la atrofia gástrica en un 77 %, en comparación con los datos históricos 19. Se ha calculado que es necesario diagnosticar y tratar a 15 hombres en la China y 245 mujeres en los Estados Unidos para evitar un caso de CG 20.
La prevención de la adquisición de la infección o el tratamiento erradicador del H. pylori antes del desarrollo de la gastritis atrófica son los mejores medios para reducir o eliminar el CG 21.
En 2005, el premio nobel de fisiología fue otorgado a Marshall y Warren por el descubrimiento del H. pylori y su papel en la gastritis y la úlcera péptica. Además, la inflamación crónica es un factor de riesgo común para la carcinogénesis y se sugirió que la prevención primaria del CG podría ser lograda a través de una estrategia de tamizar y tratar la infección del H. pylori11).
En 2013 un grupo de trabajo de la IARC revisó la evidencia acumulada que soporta el uso de la erradicación masiva del H. pylori como una estrategia para prevenir el CG. Con base en los resultados favorables de estudios clínicos controlados y estudios observacionales, un grupo de expertos confirmó que esta estrategia era efectiva 19. Por este motivo, la IARC recomendó a las agencias de cuidado de salud incluir esta estrategia en los programas nacionales de control del cáncer.
En enero de 2014 se realizó un consenso global en Kioto, Japón, para evaluar el manejo de la gastritis crónica asociada con H. pylori. De forma similar, en sus conclusiones se estableció que la erradicación del H. pylori podía prevenir el CG y que todos los portadores de H. pylori deberían ser tratados para erradicar este patógeno 21. Si el H. pylori es eliminado de la población, aproximadamente el 75 % de los CG podrían ser eliminados 22.
Nuestra atención debe estar enfocada o dirigida a cómo se realiza esta estrategia, por ejemplo, con la identificación de los pacientes con infección por H. pylori dentro de la población asintomática y la erradicación antes del desarrollo del CG. Sin embargo, la estrategia actual debe depender de la infección por H. pylori y de la incidencia del CG dentro de esa población 23.
En un metaanálisis de 3 estudios (Forman, Parsonnet y Nomura) se encontró un OR de 3,8 de riesgo para desarrollo de CG en personas infectadas por H. pylori frente a personas no infectadas. Uemura mostró que los pacientes infectados con H. pylori y que no eran tratados tuvieron mayor posibilidad de progresión a CG en los siguientes 12 años, en comparación con los pacientes no infectados 12.
Metaanálisis recientes y estudios de bajo poder estadístico indican que la erradicación del H. pylori disminuye el riesgo del desarrollo de CG en aproximadamente el 40 % en estudios de prevención primaria (individuos asintomáticos) y en un 54 % como estrategia de prevención terciaria (previniendo la aparición de un segundo CG después de la resección endoscópica de un CG temprano). No se sabe si el tratamiento erradicador del H. pylori dentro de la cascada de Correa tenga un punto de no retorno 12,24.
En el trabajo de Lee y colaboradores, el cual incluyó 24 publicaciones con más de 48 000 individuos con seguimiento de 34 000 personas/año (14 estudios de prevención primaria y 10 estudios de prevención terciaria), mostró que el beneficio de la erradicación del H. pylori fue más evidente en áreas donde la incidencia de CG es mayor. Sin embargo, la reducción del riesgo fue evidente en casi todo individuo evaluado en el estudio. Es de suponer que las poblaciones de alto riesgo en países de bajo riesgo, incluidos inmigrantes, quienes permanecen infectados desde la infancia, se beneficien de forma importante de la erradicación 12.
544 pacientes con cirugía endoscópica por CG temprano fueron aleatorizados para recibir tratamiento erradicador del H. pylori. El CG metacrónico se detectó en 9 pacientes en el grupo que recibió tratamiento y en 24 pacientes en el grupo que no recibió tratamiento, con una p <0,01. Esto indica que el efecto preventivo de la terapia erradicadora del H. pylori en estos pacientes muestra una reducción significativa del riesgo de CG metacrónico 25.
Una de las estrategias de intervención en la historia natural del CG, específicamente en la fase carcinogénica, es la política de diagnosticar y tratar la infección por H. pylori, especialmente antes de que se presente la atrofia gástrica y o la metaplasia intestinal. Pero también la terapia erradicadora debe realizarse en pacientes con atrofia y metaplasia, si está presente la infección por la bacteria. Existirá un momento de no retorno, en el que la terapia no tendrá ninguna justificación porque el daño de la mucosa está hecho 24.
Algunos investigadores están buscando el punto de no retorno. Cuando el H. pylori genera cambios en el ácido desoxirribonucleico (ADN) de la persona, se llega a un punto en que el daño lo lleva a desarrollar cáncer de manera irreversible, aun erradicando la infección 26. Se está determinando cuál es ese punto de no retorno para definir los momentos en los que se recomienda erradicar la infección con el fin de garantizar la recuperación del daño en la mucosa, detener el proceso y prevenir el desarrollo del cáncer.
Un gran número de los profesionales médicos en Colombia no tiene un claro y profundo conocimiento de lo que implica la gastritis en términos de riesgo, historia natural, intervención y seguimiento cuando tiene que enfrentarse a un reporte de patología de gastritis crónica atrófica con o sin metaplasia intestinal 14.
La incidencia de CG se incrementa con la edad, y la magnitud del resultado de la erradicación del H. pylori en la incidencia del CG depende de la población estudiada 23.
La evidencia sugiere que todos los individuos con gastritis por H. pylori deben ser tratados. En países con poblaciones de alto riesgo para CG, esta estrategia es recomendada para individuos jóvenes, menores de 20 años, teniendo en cuenta que la infección es adquirida en la infancia. Este conocimiento puede tener utilidad clínica para estratificar los individuos con infección por H. pylori en riesgo alto y riesgo bajo para CG, creando un esquema de seguimiento personalizado 12.
La pregunta sería cómo prevenir el CG (Figura 2). Los resultados apoyan la estrategia de erradicar la bacteria en países donde el H. pylori y el CG son comunes. Luego, la estrategia actual debe realizarse dependiendo de la prevalencia del H. pylori y del CG 23. En el consenso de Kioto (2014) los participantes recomendaron de forma unánime la implementación de la terapia de tratamiento erradicador del H. pylori antes de que los cambios precancerosos se desarrollen 21. La razón: se reduce el riesgo de progresión a atrofia gástrica, metaplasia intestinal y se reduce el riesgo futuro de CG.
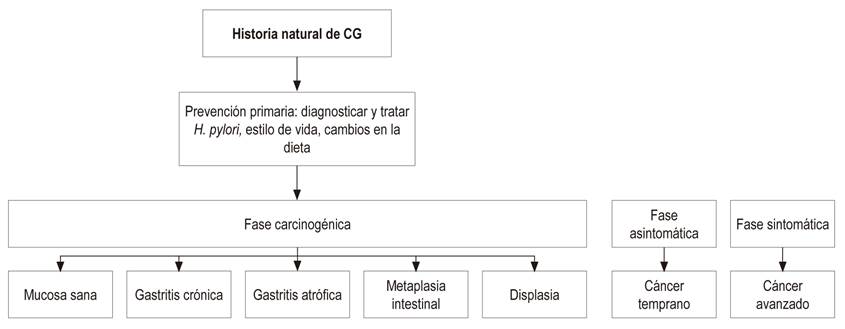
Figura 2 Estrategias de prevención primaria de CG. Tomado de: Lee YC et al. Gut Liver. 2016;10(1):12-26.
Esta estrategia de tamizar y tratar la infección por el H. pylori parece ser el mejor abordaje para disminuir el riesgo de cáncer. Sin embargo, la implementación de esta estrategia a nivel de la población requiere un enfoque sistemático. El programa debe ser también integrado dentro de las prioridades del cuidado de salud a nivel nacional, de forma que permita que los recursos limitados sean efectivamente asignados y utilizados. La implementación puede requerir la adopción de una estrategia apropiada. Dentro de la población hay subgrupos que varían en riesgo, de tal forma que es imposible que el abordaje sea el mismo para todos 11.
Tratar todos los pacientes con infección documentada por histología o prueba rápida de ureasa no se justificaría porque no resultaría costo-efectivo. Es necesario definir un grupo de alto riesgo dentro de la población.
Grupo de alto riesgo
Individuos procedentes de áreas de alto riesgo, especialmente en poblaciones con incidencia mayor de 20/100 000 habitantes, con antecedentes familiares en primer grado con CG, con antecedentes de tabaquismo pesado, ingesta de sal y alcohol (Figura 3) 24,27.
Análisis de costos
La literatura muestra que los programas de diagnóstico y tratamiento para los pacientes con infección por H. pylori es más costo-efectivo en los países donde la incidencia de CG es más alta, en comparación con países de baja incidencia 30,31. Dos estudios demostraron que la edad óptima de tamizaje está entre los 20 a 30 años porque realizarlo en cohortes de mayor edad resultó menos costo-efectivo 32.
La explicación de por qué el tamizaje del H. pylori es costo-efectivo es el resultado del relativo bajo costo de las pruebas y del tratamiento del H. pylori y el hecho que el tamizaje se realiza una sola vez. Los costos estimados para la detección y tratamiento del H. pylori fueron menos del 1 % de los costos del tratamiento del CG en todos los estudios. Por tanto, la estrategia de diagnosticar y tratar el H. pylori es una intervención económica con un considerable ahorro en los costos. El consenso de CG recomienda el tamizaje con una prueba serológica. En las poblaciones de alta prevalencia, la serología domina sobre la prueba de aliento; mientras que en las poblaciones de baja prevalencia, la prueba de antígeno fecal domina sobre las otras dos opciones. Debe tenerse en cuenta que la aceptabilidad de la prueba es uno de los requisitos para la introducción de esta estrategia en la población a estudio. Se ha encontrado que la prueba serológica y el antígeno fecal resultaron más costo-efectivos que la prueba de aliento. Repetir el tamizaje o el tratamiento, o limitar el tratamiento a aquellos con cepas CagA no parece ser costo-efectivo 32.
Un estudio a gran escala para la prevención de cáncer de colon y gástrico a través de la detección de sangre oculta en la materia fecal y antígeno fecal para H. pylori se está realizando en Taiwán. Los pacientes infectados por H. pylori reciben tratamiento y aún se esperan los resultados de este estudio 11.
Atrofia gástrica
Debido a que el CG se desarrolla a través de un largo período de años a décadas, la frecuencia de atrofia gástrica es muy baja antes de los 40 años (<5 %) y el porcentaje de pacientes con CG menores de 40 años corresponde al 5,9 % 33,34.
Un estudio previo de Pelayo Correa realizado en una zona de alta incidencia de CG reportó una prevalencia de gastritis crónica atrófica del 57 %, metaplasia intestinal del 38 % y displasia del 10 % en individuos mayores de 40 años 35. Esto significa que la presencia de lesiones precancerosas y su identificación pueden tomar también varios años. Por ello el seguimiento endoscópico en pacientes con alto riesgo puede ayudar a identificar lesiones malignas en estado temprano cuando son todavía operables y tienen alta probabilidad de ser curadas. Un estudio con seguimiento a 10 años reportó que las cifras de progresión a CG para pacientes con gastritis atrófica, metaplasia intestinal, displasia leve y displasia grave son de 0,8 %, 1,8 %, 4 % y 33 %, respectivamente 36.
Los pacientes con atrofia o metaplasia intestinal extensa deben ser seguidos con endoscopia cada 3 años y los pacientes con atrofia moderada o metaplasia intestinal limitada solo al antro no necesitan seguimiento 37. El manejo debe ser individualizado de acuerdo con otros factores tales como historia familiar de CG, origen geográfico, tabaquismo e ingesta de sal.
La presencia de displasia es un indicador de alto riesgo para CG y debe ser confirmada y clasificada por dos patólogos debido a la variabilidad interobservador.
Las guías europeas han recomendado que los pacientes con gastritis atrófica extensa o metaplasia intestinal extensa deben tener seguimiento endoscópico cada 3 años. La incidencia de CG en 10 años de seguimiento para los pacientes con gastritis atrófica es del 0,8 % y para los pacientes con metaplasia intestinal del 1,8 %, por lo que el seguimiento endoscópico de estos 2 grupos debería ser diferente 37.
Se ha establecido un sistema de evaluación de la atrofia (OLGA), basado en el grado de atrofia y su localización. Cuando se está dentro del dominio del diagnóstico y seguimiento de las lesiones premalignas, se recomienda que los pacientes llevados a endoscopia tengan al menos 5 muestras incluidas 2 del antro, 2 del cuerpo y 1 de la incisura. La necesidad de esta última biopsia se basa en la evidencia de que la prevalencia de metaplasia intestinal es mayor en este sitio, en comparación con cualquier otra parte del estómago. La metaplasia intestinal generalmente se inicia en la incisura y se disemina hacia el antro y hacia el cuerpo 37,38.
Metaplasia intestinal
La metaplasia intestinal se clasifica en completa e incompleta. Si la metaplasia intestinal es reversible o no, es motivo de controversia 39, por lo que se consideraba como un punto de no retorno40. La metaplasia intestinal completa se considera un proceso reactivo de corto tiempo que generalmente regresa, mientras que la metaplasia intestinal incompleta está relacionada con injurias y cronicidad prolongadas, por lo cual es más factible que progrese a displasia 41.
Los pacientes con metaplasia intestinal pueden tener hasta 10 veces más riesgo de CG que la población general 42. Existe controversia acerca de la utilidad de clasificar la metaplasia intestinal en la práctica clínica. La presencia de metaplasia intestinal incompleta incrementa significativamente el riesgo de CG 2,42, en comparación con la metaplasia intestinal completa 37,39.
La prevención y tratamiento de la atrofia gástrica y la metaplasia intestinal disminuyen la prevalencia del CG. La erradicación de H. pylori es el manejo y un paso fundamental. La detección del CG en sus estadios tempranos es la otra estrategia en estos pacientes 40.
Correa propuso un algoritmo para el manejo y seguimiento de las lesiones preneoplásicas. Para pacientes con metaplasia intestinal, debe medirse la presencia de H. pylori y la extensión de la metaplasia intestinal. Si la infección está presente, debe recibir tratamiento; y si la metaplasia intestinal es extensa y es incompleta, la endoscopia digestiva debe repetirse al año y luego cada 3 años si la lesión persiste; de lo contrario no se requiere el seguimiento 43. Por esto, los pacientes con metaplasia intestinal con al menos uno de estos factores de riesgo (metaplasia intestinal incompleta, historia familiar, antecedentes de tabaquismo e ingesta de sal) podrían tener mayor riesgo de desarrollar CG y probablemente se beneficiarían de un control y seguimiento endoscópico más intenso y frecuente 33,37.
La endoscopia digestiva tiene mal rendimiento diagnóstico en Occidente, por lo que el diagnóstico de atrofia gástrica y metaplasia intestinal requiere biopsias sistemáticas del cuerpo y del antro 44. El protocolo para estadificación con el sistema OLGA incluye 5 biopsias: 2 del antro, 2 del cuerpo y 1 de la incisura. Un mayor número de biopsias puede aumentar la sensibilidad (37,38,39.
Un trabajo de casos y controles utilizando el protocolo de OLGA identificó un 61,8 % más de casos de atrofia en comparación con los protocolos con menos biopsias. Esto podría permitir la corrección del subdiagnóstico de la atrofia gástrica 45.
Por lo anterior se justificaría practicar endoscopia digestiva de calidad a partir de los 40 años en la población de alto riesgo en busca de las lesiones premalignas, que dependiendo de su extensión y del riesgo de CG de acuerdo con el sistema OLGA, definirían la frecuencia de la endoscopia como seguimiento 7,33,39.
La metaplasia intestinal es una condición premaligna que puede resultar de un proceso adaptativo a un estímulo del medio como el de la infección por el H. pylori, tabaquismo y alta ingesta de sal 40. En estudios ingleses se evaluaron los beneficios de seguimiento de los pacientes con metaplasia intestinal y se encontró que la incidencia de CG fue del 11 %. El seguimiento endoscópico estuvo asociado con la detección más temprana del CG y mejoría en la supervivencia 40.
En estudios europeos de pacientes con metaplasia intestinal, displasia y seguimiento endoscópico, las cifras de detección de cáncer variaron del 33 % al 85 % 40.
En Estados Unidos (poblaciones de bajo riesgo) el riesgo de progresión es bajo y el seguimiento clínico no está indicado a menos que existan otros factores de riesgo para CG como historia familiar o procedencia de países asiáticos o latinoamericanos 42.
Un consenso europeo sugiere que, si la displasia de bajo grado se detecta en un paciente con metaplasia intestinal, debe realizarse un seguimiento endoscópico con mapeo y biopsias dentro de 1 año. La frecuencia ideal de seguimiento endoscópico no es conocida. El seguimiento puede suspenderse cuando 2 endoscopias consecutivas son negativas para displasia. A diferencia de los pacientes con displasia de bajo grado, los de alto grado deben ser llevados a resección quirúrgica o endoscópica, debido a la alta probabilidad de coexistir con adenocarcinoma invasor. El 25 % de los pacientes con displasia de alto grado puede progresar a adenocarcinoma en 1 año. Si se identifica la infección por H. pylori, debe erradicarse (permanece la controversia de si debe realizarse la erradicación empírica cuando se diagnostica la metaplasia intestinal) 42.
La presencia de metaplasia intestinal incompleta es un predictor reconocido de mayor riesgo para el desarrollo de displasia de alto grado o CG en áreas con alta prevalencia como Japón. Varios estudios han concluido que la metaplasia intestinal incompleta identifica pacientes con alto riesgo de desarrollar CG y ellos requieren seguimiento intensivo (Figura 4) 46.
Displasia
La displasia gástrica es una lesión precancerosa y es el penúltimo estado en la cascada de la oncogénesis gástrica, como lo formula Correa. Por esto la identificación, manejo y seguimiento de esta lesión es importante en la detección temprana y prevención del CG. La displasia usualmente se clasifica como de bajo y alto grado 47.
Los pacientes con displasia generalmente son hombres y 10 años más jóvenes que sus familiares con CG (61,35 años para displasia y 70 años para CG) 47.
La displasia puede encontrarse en cualquier parte del estómago, pero la mayoría de las veces se encuentra en el antro. También la mayoría de las veces la displasia se descubre incidentalmente durante endoscopias de tamizaje 47.
El riesgo real de progresión de la displasia a carcinoma no está claro. Es difícil establecer la historia natural de la displasia. Sin embargo, varios estudios han demostrado que la displasia de alto grado tiene un alto riesgo de progresar a carcinoma o cursar con carcinoma sincrónico. Se han reportado cifras que varían del 60 % al 85 % en un intervalo de 4 a 48 meses. También se sabe que el 25 % de los pacientes con displasia de alto grado al cabo de 1 año han progresado a carcinoma 39,47).
En relación con su manejo, las lesiones de alto grado requieren resección endoscópica, debido a su potencial de progresión a carcinoma y a la coexistencia con el carcinoma. Cuando las lesiones no están bien definidas endoscópicamente, se recomienda que se les realice seguimiento 1 año después del diagnóstico. Las lesiones con displasia de alto grado deben manejarse con resección endoscópica 47.
En ocasiones la resección endoscópica está indicada no solo como diagnóstico sino como tratamiento de la displasia.
Fase asintomática (de tamizaje)
Es el período asintomático durante el cual un cáncer puede detectarse a través de exámenes de tamizaje antes de que los síntomas típicos del diagnóstico aparezcan. Esta fase está definida como el tiempo desde el inicio del cáncer hasta el inicio de los síntomas. Es el momento ideal para los programas de tamizaje (11.
Este período es un concepto teórico, actualmente imposible de medir en cada caso particular, pero es el parámetro estadísticamente más importante para definir el intervalo del tamizaje en la población general 11. Este tiempo se ha definido para el CG de 2,37 años en promedio y es el soporte para el intervalo de tamizaje cada 2 años, como lo han sugerido los coreanos 11. Sin embargo, cambia con la edad del siguiente modo: en la población de 40 a 49 años es 1,25 años; de 50 a 59 años, de 3,18 años; y de 60 a 69 años, de 3,74 años. Esto puede explicar por qué cuando es necesario realizarse el tamizaje con endoscopia en grupos de alto riesgo, este seguimiento debe ser hecho cada año o cada 2 años 11.
Cuando el diagnóstico del cáncer se realiza por tamizaje, la supervivencia puede ser larga y la curación puede ser posible. Sin embargo, el CG tiene un tiempo en esta fase relativamente corto. Los cánceres con fase asintomática larga, como el de próstata, pueden diagnosticarse de forma temprana y asintomática por el beneficio del antígeno prostático específico (PSA), como forma de tamizaje 11.
Por su parte, un CG temprano progresa a CG avanzado en 33 a 48 meses y parte de este tiempo puede cursar asintomático (Figura 5) 49.
Fase sintomática
El CG en su estadio inicial prácticamente es asintomático y cuando aparecen los síntomas la enfermedad se encuentra muy avanzada, momento en el cual el tratamiento quirúrgico curativo frecuentemente es imposible. En esta fase, la supervivencia de los pacientes con CG es de solo el 10 % 50.
El riesgo de desarrollar CG se incrementa con la edad y ocurre más frecuentemente entre los 50 y 80 años de edad. El CG en personas menores de 30 años es raro 6.
En el estudio REGATA, sobre un total de 600 pacientes se encontró que el 5,9 % de ellos era menor de 40 años, 10,1 % se encontraba entre los 40 y los 49 años, 18,9 % entre los 50 y 59 años y el 65,1 % era mayor de 60 años. El CG es dos veces más frecuente en los hombres que en las mujeres. En este mismo estudio, el 65 % eran hombres y el 35 % mujeres 34.
Adrada y colaboradores publicaron en 2008 una serie de pacientes con CG y encontró que el 92,4 % correspondía a lesiones avanzadas 51. Martínez y colaboradores encontraron que el 97 % de los pacientes tenía tumores avanzados 52.
Otro aspecto importante es el costo del manejo de los pacientes con lesiones avanzadas. Gaviria y Cubillos establecieron costos directos (diagnóstico, estadificación, procedimientos médicos y dispositivos médicos) de la atención de los pacientes con CG avanzado, que es de 12 millones para el estadio II y de 27 millones para el estadio III. Se estableció que a mayor estadio de estadificación son mayores los costos (Figura 6) 52.
Conclusiones
El CG es un candidato ideal para implementar estrategias de prevención. Sin embargo, mientras la prevención primaria se facilita por un objetivo reconocido (H. pylori), las estrategias efectivas de prevención secundaria tienen obstáculos como los altos costos y la necesidad de recursos humanos y técnicos significativos.
Hace más de una década un modelo matemático mostró que el tamizaje de la infección por H. pylori y su erradicación podían ser costo-efectivos en países con alta incidencia y mortalidad de CG. También se demostró que el beneficio era solamente significativo en un subgrupo de pacientes sin presencia de lesiones precancerosas. Un metaanálisis de 7 estudios realizados en áreas de alta incidencia de CG demostró una reducción del riesgo de CG entre los pacientes tratados para erradicar el H. pylori (riesgo relativo [RR]: 0,65). Esta estrategia de prevención primaria es costo-efectiva en países con alta incidencia de CG.
El 84 % de los pacientes con CG están por encima de los 50 años, de los cuales el grupo de los 60 a los 70 es el de mayor porcentaje (65,1 %). Los pacientes con displasia generalmente son hombres y 10 años más jóvenes que sus familiares con CG (61,35 años para displasia y 70 años para CG), por lo que la estrategia para la población promedio debería ser 10 años antes; es decir, se debe iniciar la mayor vigilancia endoscópica y estratificación de riesgo por encima de los 50 años.
La incidencia actual del CG en cualquier población es dependiente de un número de variables: proporción con infección por H. pylori, gravedad de la atrofia gástrica y velocidad de desarrollo de la atrofia.
Es necesario cambiar el panorama de esta enfermedad, creando sensibilidad frente a este problema de salud pública dentro del gremio médico y a nivel de los responsables de las políticas de salud. También es necesario el desarrollo de una guía de práctica clínica dirigida a la prevención del CG.
Se deben establecer estrategias de prevención primaria y secundaria que impacten la historia natural del CG.











 text in
text in