Introducción
El patólogo francés Pierre Ménétrier (1859-1935) describió por primera vez la enfermedad que lleva su nombre en Archives de Physiologie Normale et Pathologique en 1888. Ménétrier describió a 7 individuos que exhibían patrones macroscópicos de hipertrofia gástrica: adenomas polipoides y poliadenomas laminares; comparaba la mucosa gástrica engrosada con circunvoluciones cerebrales 1,2; esta enfermedad se considera rara por la Oficina de Enfermedades Raras del Instituto Nacional de Salud de los Estados Unidos de América, lo que significa una prevalencia de menos de 1 en 200 000 individuos; es conocida con otros nombres, dentro de los que se incluyen la gastritis hipertrófica gigante y la gastropatía hipertrófica hipoproteinémica2. Hasta el momento no hay características patognomónicas para diagnosticar la enfermedad de Ménétrier y, por ahora, su diagnóstico se basa en sus características clínicas y patológicas, lo que plantea un desafío diagnóstico y terapéutico, debido a la naturaleza rara de la enfermedad y la falta de criterios diagnósticos claros.
Caso clínico
Es un paciente masculino de 19 años, con cuadro clínico que inició a los 12 años de edad con síntomas referidos como dolor y distensión abdominal, durante su infancia tardía y adolescencia tuvo un peso y talla bajos para la edad, desde ese entonces fue manejado por distintas especialidades hasta 2016, cuando ingresó a nuestro servicio para la realización de endoscopia de vías digestivas altas (EVDA), como parte de la evaluación solicitada por el médico tratante, y se encontraron pliegues gástricos gruesos en el fondo y en el cuerpo con una clara disminución de la distensibilidad (Video 1); desde el punto de vista clínico, refirió astenia y dispepsia como síntomas predominantes al examen físico como hallazgos relevantes; presentó palidez y edema grado II de miembros inferiores.
Video 1. Endocopia de la enfermedad de Ménétrier. Observe los pliegues gástricos proximales engrosados y con edema. https://youtu.be/sQNxWFhjeq0
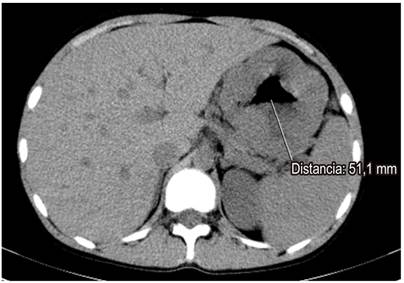
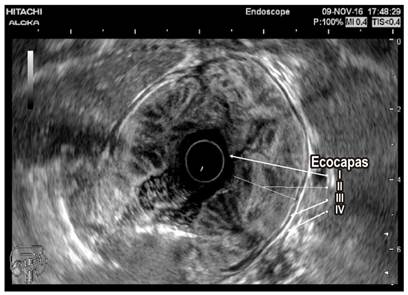
Se solicitaron paraclínicos (hemograma, albúmina, nitrogenados y uroanálisis) y se encontró anemia normocítica, normocrómica, heterogénea (hemoglobina de 11,2 g/dL), albúmina sérica de 2,8 g/dL, con creatinina de 0,8 mg/dL (normal) y uroanálisis sin proteinuria. Dado el hallazgo clínico, paraclínico y endoscópico, se decidió ampliar los estudios con tomografía axial computarizada (TAC) de abdomen, en la que se observan las paredes gástricas engrosadas con compromiso difuso y simétrico marcado de los pliegues gástricos, sin evidencia de lesiones nodulares con un espesor máximo de 53 mm (Figura 1). Se solicitó adicionalmente ultrasonografía endoscópica (USE) gástrica y desde el punto de vista endoscópico se encontraron hallazgos similares a los descritos en la EVDA; y en el tiempo ecográfico se encontró engrosamiento de la pared gástrica dependiente de la ecocapa I y II (mucosa y muscular mucosa, respectivamente), con espacios anecoicos en la ecocapa II, respetando la ecocapa III y IV (submucosa y muscular propia, respectivamente) (Figura 2).
Histológicamente, en las biopsias tomadas en la EVDA se reportaron como una gastritis hiperplásica con “patrón de enfermedad de Ménétrier”, Helicobacter pylori negativo (Operative Link on Gastritis Assessment [OLGA]: 0). En el último control de julio de 2017, el paciente presentó un aumento de los síntomas dados por dolor y distensión abdominal asociado con vómito, náuseas y anasarca, por lo que se decidió proponer el manejo quirúrgico.
Discusión
La enfermedad Ménétrier se encuentra predominantemente en hombres, con edades que oscilan entre 30 y 60 años, aunque también se han reportado casos en la infancia; clínicamente presentan dolor abdominal, náuseas, vómitos y edema de los tejidos periféricos (desequilibrio de la presión osmótica por la filtración selectiva de proteínas a través de la mucosa gástrica) 3. Esta enfermedad tiende a ser progresiva, aunque su fisiopatología aún se desconoce. En modelos animales, con ratones transgénicos que sobreexpresan el factor de crecimiento transformante alfa (TGF-α) en el estómago desarrollan cambios que se asemejan a los encontrados en la enfermedad de Ménétrier; además, el receptor para el factor de crecimiento epidérmico (RFCE) en las células de moco foveolar está sobreestimulado por su ligando: el TGF-α, lo que causa un exceso de secreción de moco y malabsorción de nutrientes.
Desde el punto de vista clínico, por lo general muestra un curso de inicio insidioso con características progresivas que se asocian con un mayor riesgo de cáncer gástrico, aunque la magnitud de este riesgo no es del todo clara y puede oscilar entre 0 % y 10 % según distintos autores 3,4. Sin embargo, también se han descrito variantes con cuadros clínicos diferentes de inicio abrupto, que se presentan más frecuentemente en la población infantil que muestra una remisión espontánea en relación con el tratamiento de las infecciones asociadas como la infección por citomegalovirus (CMV) o la infección por H. pylori; también algunos autores han descrito su asociación con enfermedades autoinmunes como la enfermedad inflamatoria intestinal, colangitis esclerosante y espondilitis anquilosante, lo que sugiere un componente inmunológico a su patogénesis aún no del todo esclarecido 2,5.
Endoscópicamente, los pliegues de la mucosa gástrica se muestran marcadamente gruesos, lo que afecta principalmente al cuerpo y al fondo respetando el antro; el pH gástrico se incrementa debido a la pérdida de células parietales y la producción de moco espeso es copiosa, secundaria a la hiperplasia foveolar que se presenta de forma más comúnmente masiva, lo que causa a menudo el aumento en el grosor de la mucosa de 1 cm o más (en nuestro caso clínico alcanza hasta los 5 cm), lo que es una condición necesaria para el diagnóstico 5.
Las alteraciones histológicas descritas muestran un número reducido de células parietales y células principales, las glándulas oxínticas son atróficas y las glándulas profundas pueden ser dilatadas quísticamente, la lámina propia muestra una cantidad variable de infiltración de células inflamatorias predominantemente crónicas con eosinófilos dispersos, junto con hiperplasia de músculo liso y edema asociado a una disminución en el número de las glándulas fundidas, que son reemplazadas por glándulas mucosas (metaplasia pseudopilórica). Esta arquitectura de la mucosa totalmente anormal genera una pérdida de proteínas, la cual se aumenta con la presencia de úlceras superficiales (frecuentemente presente) 4,5,6.
El diagnóstico diferencial gira en torno a otras entidades que engrosen los pliegues gástricos como gastritis linfocítica, síndromes polipósicos, pólipos hiperplásicos, linitis plástica y linfoma, entre otros (Tabla 1). La USE constituye una herramienta útil para el diagnóstico diferencial ya que puede excluir un engrosamiento de origen vascular en el que las biopsias podrían producir complicaciones hemorrágicas importantes, por lo que se recomienda que la USE preceda a la decisión de realizar biopsias en los casos de engrosamiento de los pliegues gástricos; además, apoya el diagnóstico de enfermedad de Ménétrier cuando el engrosamiento se origina en la ecocapa II (Figura 2) 6,7.
Tabla 1 Diagnóstico diferencial
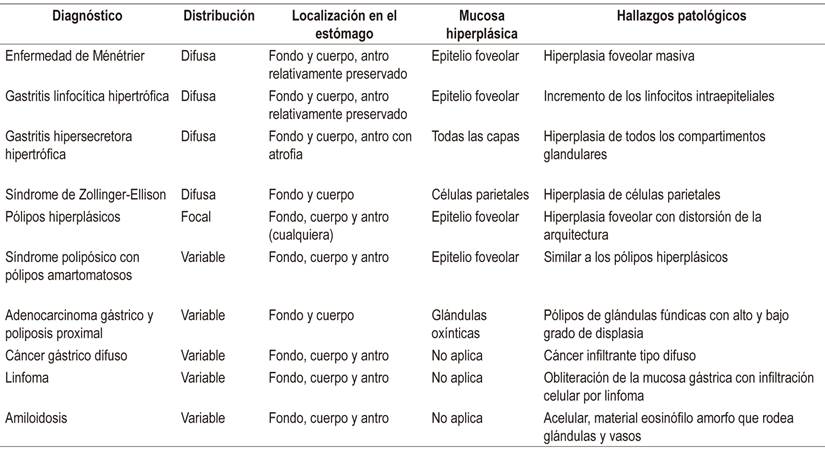
Tomado de: Silva PH et al. Rev Assoc Med Bras (1992). 2016;62(6):485-9.
El tratamiento suele ser quirúrgico, los pacientes a menudo se someten a gastrectomía parcial o total y actualmente se considera el tratamiento de elección. Sin embargo, se han propuesto diferentes terapias farmacológicas alternativas, por ejemplo, con cetuximab semanalmente, lo que muestra una mejoría en la calidad de vida en todos los pacientes. A pesar de esto, algunos pacientes seguidos hasta los 40 meses requirieron gastrectomía a largo plazo, por lo que el uso del cetuximab se ha recomendado como primera línea para el manejo de la enfermedad de Ménétrier en el escenario clínico de la recaída posterior a la gastrectomía 6. Otros fármacos que también se han utilizado como la famotidina y la cimetidina han mostrado resultados favorables: se ha reportado la disminución de los síntomas y, en el caso de la cimetidina, disminución de la pérdida de proteínas. Los esteroides y antibióticos también se han utilizado con resultados contradictorios. Cabe resaltar que, dada la baja prevalencia de esta enfermedad, ninguno de estos tratamientos incluye ensayos clínicos con la rigurosidad metodológica requerida y por ahora se consideran experiencias anecdóticas 8.
Conclusión
La enfermedad de Ménétrier es reconocida como una enfermedad rara y, en consecuencia, su diagnóstico es de difícil abordaje, pero es de crucial importancia dado el riesgo de malignidad asociada. Debido a la evidencia disponible, el tratamiento recomendado en la actualidad es predominantemente quirúrgico, aunque existen otros tratamientos que podrían implantarse en escenarios clínicos puntuales como en el caso de la recaída.











 text in
text in