Introducción
La poliposis adenomatosa familiar (PAF) es una enfermedad de transmisión hereditaria con un patrón autosómico dominante 1, caracterizada por un defecto del gen APC 2, localizado en el brazo largo del cromosoma 5q21 3,4,5. Solo el 25 %-30 % de los pacientes no posee evidencia clínica o genética de PAF en los miembros de la familia 6. La incidencia de PAF documentada en registros familiares va de 1 a 7000-16 000 nacidos vivos y representan aproximadamente el 0,5 % de todos los cánceres colorrectales 4. La edad promedio de inicio es de 16 años 5 y la progresión al cáncer colorrectal (CCR) ocurre a la edad de 40-50 años con penetrancia casi completa 7.
La manifestación primaria de la enfermedad es la aparición de múltiples pólipos (cientos o miles) sobre la mucosa rectocolónica, duodenal y gástrica 8,9; de estructura histológica glandular tubular, vellosa o mixta; esta no determina un factor predictor significativo para la aparición de cáncer, como sí resulta el tamaño de los pólipos 10. Suele presentar manifestaciones extracolónicas, como pólipos gástricos y del intestino delgado 1, y extraintestinales que incluyen hipertrofia congénita del epitelio pigmentario de la retina, fibrosis mesentérica difusa (tumores desmoides), osteomas del maxilar inferior (en el 90 % de los casos), del cráneo y huesos largos (variante fenotípica descrita como síndrome de Gardner), y diversas anormalidades dentales 11. También se producen neoplasias del sistema nervioso central como meduloblastoma (síndrome de Turcot), de la glándula tiroides, del sistema hepatobiliar y de las glándulas suprarrenales 7,8,12.
El abordaje diagnóstico más importante de PAF es mediante el tamizaje en pacientes con antecedentes familiares 13. Sin embargo, se cree que un tercio de todos los casos es debido a mutaciones de novo4 y sin presentar antecedente familiar alguno, lo que determina un mayor reto diagnóstico con implicaciones negativas en el pronóstico. El tratamiento quirúrgico es el indicado 1 y está dirigido a evitar el desarrollo de CCR, cuyo riesgo de aparición es muy elevado 14, y es inevitable cuando la enfermedad sigue su curso natural en pacientes que no se someten a un manejo quirúrgico 15.
PRESENTACIÓN DEL CASO
Se presenta el caso de una paciente femenina de 25 años, quien manifestó cuadro clínico de 1 mes de evolución, caracterizado por evacuaciones con sangre, no diarreicas y sin moco, en número de una 1 por día, de predominio matutino. Concomitantemente, presentaba dolor abdominal generalizado postevacuatorio, tipo cólico, de fuerte intensidad y que cedía luego de aproximadamente 1 hora. Además, se le asociaron cambios en el patrón evacuatorio en cuanto a la frecuencia (3 evacuaciones/día que se modificaron a 1/día).
Antecedentes personales y familiares
Diagnóstico endoscópico de gastritis crónica desde los 13 años, con hallazgo de pólipo sésil único. Una abuela falleció a los 69 años por cáncer de mama, una abuela estaba viva con diagnóstico de artritis reumatoide y la madre estaba viva con diagnóstico de fibroma uterino. La paciente negó todo tipo de antecedente familiar de CCR, pólipos o PAF.
Examen físico
Peso: 45 kg, talla: 168 cm, índice de masa corporal (IMC): 15,9. Abdomen plano, con ruidos hidroaéreos presentes, blando, depresible, doloroso a la palpación profunda en el hemiabdomen inferior, sin signos de irritación peritoneal ni visceromegalias. Tacto rectal: esfínter anal normotónico y normotérmico; paredes rectales con múltiples masas palpables, de diverso diámetro, no dolorosas; ampolla rectal con heces pastosas, punta de guante con escasa cantidad de sangre. El resto de evaluación resultó dentro de los límites normales.
Paraclínicos realizados
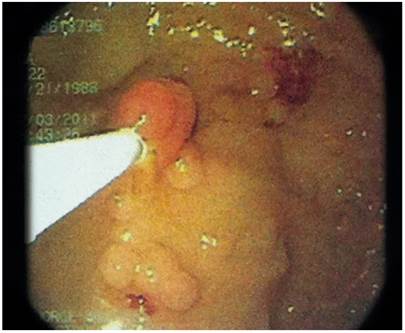
Se realizaron exámenes de laboratorio que abarcaban hemograma y química sanguínea, y se encontraron entre los parámetros normales. Además, se indicaron estudios de imagen como radiografía abdominal con uso de enema baritado y se evidenciaron alteraciones del marco colónico con acumulación de secreción (Figura 1). En la rectosigmoidoscopia se apreciaron múltiples pólipos (>100) de diversos tamaños que oscilan entre 5 mm y 3 cm, algunos pediculados y otros sésiles, de aspecto tubulovelloso, desde el colon ascendente distal hasta el recto (Figuras 2 y 3).
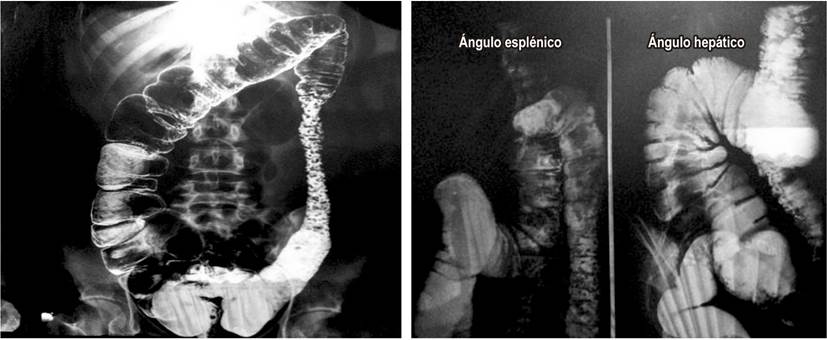
Figura 1 Radiografía abdominal en proyección anteroposterior, de pie, con uso de enema baritado. Se evidencia engrosamiento de las paredes colónicas, dilataciones irregulares del marco colónico, aumento y heterogeneidad de secreción en el colon ascendente y en el ángulo hepático, así como en el colon descendente y sigmoides con imágenes polipoideas múltiples y signos correlativos con úlceras en collar.
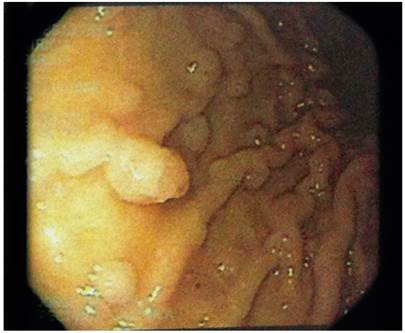
Figura 3 Rectosigmoidoscopia. Se evidencian múltiples pólipos sésiles, de aspecto velloso, de diámetros diversos.
Se realizó una gastroduodenoscopia que mostró la presencia de punteado blanco algodonoso en la segunda porción del duodeno con múltiples lesiones polipoideas sésiles en el cuerpo y el fondo gástrico (Figura 4).
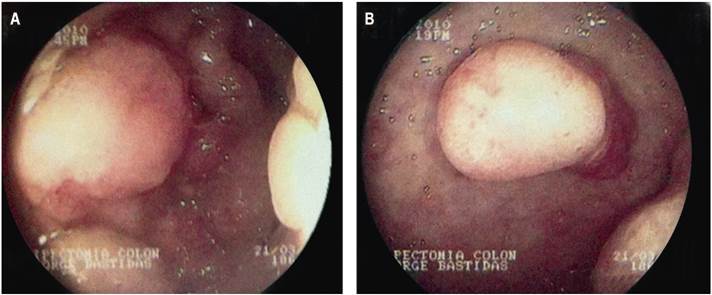
Figura 4 Gastroduodenoscopia. Fondo (A) y cuerpo (B) gástrico con múltiples pólipos sésiles de diámetros diversos.
El estudio histopatológico de los hallazgos reportó:
Mucosa del colon sigmoides: adenoma tubular con displasia de alto grado focal (10 %).
Pólipos del colon transverso: adenoma tubulovelloso con predominio del componente adenomatoso, en el 80 % del material examinado, con áreas focales de displasia de alto grado.
Pólipos en el cuerpo gástrico: pólipos hiperplásicos de tipo oxíntico con dilatación de criptas glandulares e inflamación crónica de la mucosa.
Según la evidencia obtenida por la clínica y los estudios complementarios del paciente, se estableció el diagnóstico de PAF.
Tratamiento y evolución
Se indicó una colectomía total más resección de los dos tercios superiores del recto con anastomosis ileorrectal y en una primera intervención se dejó ileostomía de protección. Se obtuvo tejido ileal, colónico y rectal, cuyo análisis anatomopatológico reportó incontables estructuras polipoides en su mayoría constituidas por adenomas tubulovellosos, con evidencia de displasia de alto grado, pediculados y sésiles, asentados sobre la mucosa con cambios hiperplásicos multifocales. Dicha intervención evoluciona favorablemente.
Se reingresó a los 6 meses para cirugía programada de restitución terminoterminal, con complicación en el postoperatorio inmediato de íleo paralítico, superado bajo tratamiento médico. En el año posterior a la intervención, presentó 3 episodios de obstrucción intestinal que ameritaron resolución quirúrgica. En el último episodio se evidenció un hallazgo de absceso intraabdominal en la fosa ilíaca y el flanco derecho que ameritó un manejo con bolsa de Bogotá, que requirió la hospitalización durante 8 meses con evolución favorable. Actualmente, la paciente se encuentra en buenas condiciones generales, con tránsito intestinal regular y sin ningún otro concomitante.
Discusión
A pesar de que la PAF es una enfermedad estudiada y descrita, su prevención y diagnóstico precoz son los inconvenientes más comunes y decisivos para el pronóstico. En este punto radica la relevancia de esta revisión, considerando que la totalidad de los casos evolucionan en malignidad de no ser tratados 13. El diagnóstico se basa en aspectos clínicos y endoscópicos 12. La aparición progresiva de los pólipos deriva en la presencia de sangre en la materia fecal (visible o no) gracias principalmente a que los pólipos sangran hacia su estroma 8, que es el síntoma más común 1. Otros síntomas pueden ser flatulencia, cambios en el patrón evacuatorio o dolor postevacuatorio en el hemiabdomen inferior tipo cólico 7,8. La exploración anorrectal puede evidenciar la presencia de pólipos si estos prolapsan a través del recto 1. Es también de gran importancia el interrogatorio que incluya los antecedentes familiares de pólipos colónicos y de cáncer de colon 15, tomando en cuenta que alrededor de un tercio de los pacientes no posee antecedente familiar relacionado alguno, como lo fue la paciente estudiada.
El diagnóstico se establece mediante criterios clínicos y se excluye por medio de un colon por enema con bario y aire, con la presencia de pólipos de naturaleza adenomatosa, o una colonoscopia total, la cual permite evidenciar lesiones de mayor tamaño y la toma de biopsia para descartar malignidad 16. Esto diferencia la enfermedad en su variación clásica (>100 pólipos) o atenuada (<100 pólipos) 7. Es necesaria la búsqueda de hallazgos extracolónicos, principalmente la presencia de pólipos duodenales 17 e hiperpigmentación epitelial de la retina, ya que esta última se observa en el 83 % de las familias con PAF 7, así como la tamización de familiares y la determinación del gen APC 2,14, a pesar de no haber sido posible el estudio genético en esta paciente por motivos socioeconómicos.
La cirugía es el pilar fundamental para el manejo de la PAF, en particular cuando existe una mutación entre los codones 1251 y 1309, los cuales expresan un fenotipo más grave 13. Con la individualización del estado de cada paciente y según su correlación genotipo-fenotipo existen opciones quirúrgicas que incluyen: proctocolectomía total con ileostomía permanente, colectomía con anastomosis ileorrectal (AIR) o proctocolectomía con anastomosis con bolsa ileoanal (IPAA). El primer abordaje no se realiza de manera profiláctica y es indicado en pacientes con poliposis rectal extensa, cáncer de la porción distal del recto o en los cuales la vigilancia pertinente se hace imposible. Por su parte, la colectomía AIR y la proctocolectomía IPAA son técnicas profilácticas llevadas a cabo en pacientes asintomáticos en riesgo, determinado por pruebas genéticas o colonoscopias predictivas. Sin embargo, el riesgo de desarrollar cáncer en la porción rectal conservada luego de 20 años es del 25 %, por lo que se requiere vigilancia periódica particularmente estricta 13,18.
En pacientes con variante atenuada, de fácil seguimiento y con menos de 20 pólipos rectales cuyo tamaño sea <5 mm, se considera el tratamiento médico (19,20. El uso de antiinflamatorios no esteroideos (AINE) como sulindac y celecoxib ha demostrado tener la mayor eficiencia para reducir la cantidad y el tamaño de los adenomas colorrectales caracterizados por los altos niveles de expresión de ciclooxigenasa 2 (COX-2) 20,21. Su uso es aceptado como terapia adyuvante al tratamiento quirúrgico mas no como alternativa a este 22. La resolución quirúrgica es controvertida en pacientes portadores asintomáticos para los cuales, sin embargo, se recomienda la intervención al final de la adolescencia (14.
En individuos en riesgo, con evidencia de poliposis sin PAF o variante atenuada se sugiere la colonoscopia anual o una sigmoidoscopia flexible desde la pubertad 5,10,19. La vigilancia en pacientes sometidos a colectomía con AIR mediante rectoscopia debe ser iniciada 6 meses después de la cirugía y luego 1 vez al año. El seguimiento inicial es el mismo para los pacientes de proctocolectomía con IPAA, con seguimiento posterior cada 2 o 3 años 18,22. Esta periodicidad está condicionada por los hallazgos de la exploración basal o previa (número de adenomas, tamaño e histología de estos), así como la presencia de síntomas o de mutaciones en el gen APC (10.
La alta relación que tiene el estudio exhaustivo de cada paciente con respecto a su correcta terapia y mejor pronóstico demuestra el papel crucial que significa el análisis permanente de guías diagnósticas y constante investigación del tema, ya que alrededor del 30 % de los pacientes con esta enfermedad no posee historia familiar de la misma 4. Esto deriva en que, como en el caso presentado, el diagnóstico se realice en una edad más tardía y en la presencia de síntomas, lo que implica un mayor riesgo de morbimortalidad y desarrollo de CCR 4. Estudios posteriores sobre la genética y epidemiologia de los pacientes sin historia familiar permitirán mejorar las bases diagnósticas y el manejo clínico de los mismos.











 text in
text in