Introducción
La infección por H. pylori es una de las infecciones bacterianas más frecuentes en adultos a nivel mundial 1. En países en desarrollo, se estima que tiene una prevalencia por encima del 70 %, mientras en países desarrollados es cercana al 35 % 2. Esta bacteria coloniza el estómago y suele producir síntomas en el 32 % de los casos, siendo los más frecuentes el dolor abdominal, la regurgitación, la pirosis, las náuseas y la hiporexia 3. En la actualidad, la Organización Mundial de la Salud (OMS) ha catalogado al H. pylori como un agente carcinógeno tipo 1, debido a su estrecha relación con el cáncer gástrico 4. Por esta razón, se recomienda su inmediata erradicación al momento del diagnóstico, ya que es un microorganismo de alta patogenicidad 5.
En la actualidad, el tratamiento de primera línea para erradicar el H. pylori es la terapia triple estándar (TTE), la cual consiste en la administración de dos antibióticos (amoxicilina 2 g dos veces al día y claritromicina 500 mg dos veces al día) y un inhibidor de bomba de protones (omeprazol 20 mg dos veces al día) de forma diaria por dos semanas 5. Hasta la década pasada, con esta terapia, en el mejor de los casos, se alcanzaban tasas de erradicación del H. pylori del 77-82 % 6,7; desde entonces, se han propuesto diferentes modificaciones a la TTE con el objeto de incrementar estas tasas, entre las que podemos destacar la terapia cuádruple, la secuencial, la híbrida y la adyuvante con vitaminas C y E 8. Precisamente, esta última ha generado gran expectativa al tratarse de una terapia relativamente inocua y accesible, y porque, según algunos reportes, puede contribuir a elevar las tasas de erradicación por encima del 90 % 9. En el caso de la vitamina C, se ha demostrado que su efecto adyuvante se debe a su capacidad de inhibir la formación de compuestos N-nitroso y metabolitos reactivos de oxígeno en la mucosa gástrica 10, ambos considerados vitales para el crecimiento y la carcinogenicidad del H. pylori11. Por su parte, el efecto adyuvante de la vitamina E se debe a su capacidad para inhibir la peroxidación de los lípidos y el estrés oxidativo a nivel del microambiente creado por esta bacteria en la mucosa gástrica 12, también considerados factores esenciales para el crecimiento y patogenia del H. pylori13.
Los primeros estudios que evaluaron los efectos de la terapia adyuvante con vitaminas C y E arrojaron resultados poco favorables 14. De hecho, el primer metaanálisis publicado por Li en el 2011 planteó que las evidencias disponibles hasta ese momento para recomendar dicha terapia carecían de hallazgos significativos (riesgo relativo = 0,93; intervalo de confianza (IC) del 95 %: 0,56-1,53) 15. Sin embargo, los nuevos estudios realizados muestran resultados satisfactorios y significativos, y le atribuyen a la terapia adyuvante con vitaminas C y E tasas de erradicación que sobrepasan el 20 % de diferencia frente a la terapia triple estándar 16. Estos valores podrían ser incluso mayores en el caso de pacientes con bajos niveles de capacidad antioxidante y anemia ferropénica, según los últimos reportes publicados 17,18. Esto último es muy importante debido que en el Perú, la prevalencia de anemia ferropénica supera el 40 % 19, y en las regiones de la selva peruana, incluyendo el departamento de San Martín, estos valores oscilan alrededor del 24 % 20. En la mayoría de casos, esta patología carencial está asociada con la mala absorción del hierro en presencia de bajas concentraciones de vitamina C 21; por esta razón, el presente estudio intenta determinar la efectividad atribuible al uso de antioxidantes (vitaminas C y E) como tratamiento adyuvante a la TTE para H. pylori en una cohorte de pacientes de la Amazonía peruana.
Materiales y métodos
Diseño del estudio
Se realizó un estudio de cohorte retrospectivo, en el distrito de Tarapoto, provincia de San Martín (6°29′00″S, 76°22′00″O, población ~118,000), departamento de San Martín, en la región del nororiente del Perú. Se evaluó a toda la cohorte de pacientes con infección por H. pylori diagnosticados en el Hospital del Seguro Social (EsSalud) de Tarapoto entre los meses de julio a diciembre del 2016, quienes recibieron como tratamiento la TTE en adyuvancia con las vitaminas C y E (expuestos). Con la finalidad de estimar el efecto atribuible del tratamiento adyuvante con las vitaminas C y E, se comparó a la cohorte de expuestos con una cohorte de no expuestos. Para ello, se tomó una muestra (1:1) al azar (por muestreo aleatorio simple) del total de pacientes que durante el mismo período de tiempo fueron diagnosticados con infección por H. pylori, tratados con la TTE y no fueron expuestos a la terapia adyuvante con vitaminas C y E. Para comparar la efectividad del tratamiento, ambas cohortes (expuestos y no expuestos) fueron seguidas retrospectivamente para medir y comparar la tasa de erradicación del H. pylori. Con el objeto de evitar sesgo de información, se planteó a priori que para declarar la erradicación del H. pylori, esta debía ser confirmada por histopatología posendoscopía digestiva alta al término del tratamiento.
Población y muestra
La cohorte de expuestos estuvo constituida por todos los casos de pacientes que cumplieron con los siguientes criterios de inclusión: adultos con edades comprendidas entre los 18-60 años, sintomáticos (dolor abdominal, regurgitación, pirosis, náuseas y/o hiporexia), con diagnóstico histopatológico de infección por H. pylori, que recibieron como tratamiento la TTE en adyuvancia con vitaminas C y E. Por su parte, la cohorte de no expuestos fue tomada al azar (muestra 1:1) entre todos los pacientes con diagnóstico histopatológico de infección por H. pylori, que solo recibieron como tratamiento la TTE. En ambas muestras se excluyeron a todos los casos que cumplieron cualquiera de los siguientes criterios: tratamiento previo para H. pylori, antecedentes de úlcera gástrica o duodenal, neoplasia de cualquier índole, ser portadores de alguna enfermedad metabólica, mujeres gestantes o en período de lactancia, tratamiento previo con antibióticos <6 meses, alergia a penicilinas u otros antibióticos, y antecedentes de cirugía gástrica previa. En cuanto al tamaño de muestra, se estimó que se requeriría mínimo de 50 pacientes (25 expuestos y 25 no expuestos) para encontrar diferencias en las tasas de erradicación >25 %, y se asumió una tasa de erradicación en los no expuestos del 70 %, un IC exploratorio del 90 % y un poder de estudio del 80 %. Independientemente de ello, para maximizar el poder de estudio a priori, se previó incluir a todos los pacientes expuestos que cumplieran con estos criterios de selección durante el período de estudio
Terapia triple estándar para el H. pylori
Todos los pacientes infectados por el H. pylori recibieron la TTE de forma gratuita, la cual fue proporcionada por el hospital del Seguro Social (EsSalud) de Tarapoto. La TTE es considerada como la primera línea de tratamiento contra el H. pylori8, y consiste en la administración por vía oral de amoxicilina (1 g dos veces al día), claritromicina (500 mg dos veces al día) y omeprazol (20 mg dos veces al día) por 14 días.
Terapia triple estándar en adyuvancia con vitaminas C y E
El uso de una forma adyuvante de las vitaminas C y E junto a la TTE es producto del surgimiento de nuevas y potenciales alternativas terapéuticas contra el H. pylori. Esta terapia consiste en la administración de la vitamina C (500 mg dos veces al día) y E (200 UI dos veces al día) 30 días después de haber finalizado la TTE 9.
Recolección de datos
En todos los casos se utilizó como fuente primaria de información las historias clínicas del hospital del Seguro Social (EsSalud) de Tarapoto, donde fueron tratados tanto los expuestos como los no expuestos. En el caso de los expuestos, todos los datos de interés fueron tomados de sus historias clínicas conforme fueron identificados por el investigador principal (Wildor Samir Cubas, WSC); mientras que en el caso de los nos expuestos, primero se procedió a la elaboración de un marco muestral con los números de historias clínicas según el orden cronológico, se tomó la muestra y, recién en una segunda instancia, se procedió al levantamiento de los datos. En ambos casos se levantaron como variables de interés la edad, el género, el ámbito laboral, la procedencia, la sintomatología principal, el tiempo de enfermedad y los hallazgos endoscópicos e histopatológicos pre y posexposición a las terapias asignadas. Todas las variables de interés del estudio fueron medidas de manera estándar, y recogidas de manera retrospectiva de las historias clínicas de cada sujeto de estudio. Para facilitar la recolección de los datos, se elaboró una lista de chequeo con rangos de valores y categorías preestablecidas a fin de garantizar un levantamiento fidedigno de los datos. Terminado dicho proceso, los datos fueron doblemente digitados, y cualquier discrepancia se resolvió revisando de nuevo las historias clínicas.
Análisis de datos
Se realizó un análisis descriptivo de las características clínico-epidemiológicas basales de la población de estudio. Para ello, se calculó la media, la desviación estándar (DE) de las variables cuantitativas, la frecuencia absoluta y la relativa de las variables cualitativas. Asimismo, con el objeto de analizar la comparabilidad de las características basales de los expuestos y no expuestos, se utilizó la prueba exacta de Fisher y la prueba χ² para la comparación de proporciones. Finalmente, para la estimación de la efectividad atribuible a la terapia adyuvante con los antioxidantes (vitaminas C y E), se realizó un análisis de regresión de Poisson multivariante, utilizando el método de modelos anidados para aislar dicho efecto controlado por sus características basales. En este análisis se tomó como potenciales factores de confusión la edad, el género, la adherencia al tratamiento, el tiempo de enfermedad y el número de síntomas. En todos los casos, el análisis de los datos se realizó utilizando el paquete estadístico STATA MP v13, y considerando un IC del 95 %.
Consideraciones éticas
El comité de ética del Hospital Nacional Docente Madre Niño “San Bartolomé”, en Lima, Perú, revisó y aprobó el protocolo de este estudio. Se respetó la confidencialidad de la información, y no fue necesario el uso del consentimiento informado, porque los datos se obtuvieron de forma retrospectiva.
Resultados
Características de la población de estudio
Durante el período comprendido entre julio-diciembre del 2016, se evaluó un total de 50 pacientes con infección por H. pylori, quienes recibieron la terapia erradicadora según su asignación metodológica, de los cuales cinco pacientes (10 %) fueron excluidos del análisis porque no completaron el tratamiento. De estos cinco, dos pertenecían al grupo de los expuestos y tres al grupo de los no expuestos. Entre los 45 pacientes analizados, no se encontraron diferencias entre los expuestos y no expuestos (23 frente a 22) en términos de predominio del género masculino (65 % frente a 64 %) y edad promedio (38 ± 11 frente a 36 ± 10 años), la cual fue de 37 ± 11 años (rango: 19-59 años). La mayoría de los pacientes procedía de la ciudad de Tarapoto (74 % frente a 64 %), y el resto de las zonas rurales de la periferia (26 % frente a 36 %); la mayoría trabajaba en el sector público (52 % frente a 63 %), los restantes eran trabajadores del sector privado (39 % frente a 31 %) o desempleados (9 % frente a 5 %). El principal motivo de consulta de los pacientes en el servicio de Gastroenterología del Hospital del Seguro Social (EsSalud) de Tarapoto fue el dolor abdominal (43 % frente a 40 %), seguido de la regurgitación (22 % frente a 27 %), pirosis (17 % frente a 18 %), hiporexia (13 % frente a 5 %) y náuseas (4 % frente a 9 %). El tiempo de presentación de las manifestaciones clínicas en los participantes fue, en la mayoría de los casos, mayor a siete días (74 % frente a 77 %). Según los hallazgos endoscópicos encontrados previos a la terapia erradicadora, las lesiones gástricas más frecuentes en los pacientes analizados fueron gastritis antral (43 % frente a 55 %), pangastritis (43 % frente a 27 %) y metaplasia intestinal leve (13 % frente a 18 %).
Efectividad de las terapias erradicadoras para H. pylori
La efectividad global de las terapias erradicadoras para H. pylori, expresadas como la tasa de erradicación, se estimó en un 87 % (IC del 95 %: 76 % a 97 %); mientras que las tasas de erradicación específicas encontradas en la muestra de los expuestos y no expuestos fueron del 91 % (IC del 95 %: 79-100 %) frente a 82 % (IC del 95 %: 64-99 %), respectivamente. Con estas tasas de efectividad se estimó la razón de tasas de incidencias de 1,12 (IC del 95 %: 0,88 a 1,41).
Discusión
La terapia adyuvante con vitaminas C y E ha sido reportada como una alternativa efectiva para incrementar la tasa de erradicación de H. pylori atribuible a la TTE. Sin embargo, aunque tal podría ser el caso de los pacientes infectados con H pylori en la Amazonía peruana, los resultados de nuestro estudio no nos permiten ser concluyentes al respecto. De hecho, si bien nuestros datos sugieren un efecto favorable a la terapia adyuvante (incremento en la tasa de erradicación = 9,5 %; 91 % frente a 82 %; razón de tasas de incidencia = 1,11; IC del 95 %: 0,92 a 1,36); lo cierto es que, en nuestro estudio, tal efecto resultó estadísticamente no significativo (Figura 1). Esto podría deberse a dos razones: por un lado, que dicho efecto no exista; por otro lado, que de hecho exista, pero su magnitud sea tan pequeña como para haber sido detectada con un poder de estudio tan pequeño como el nuestro.
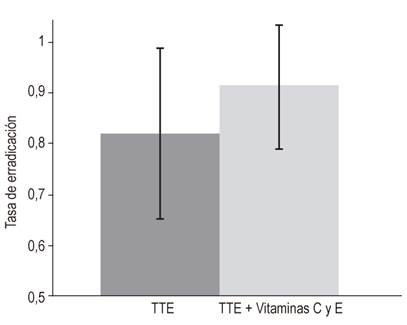
Figura 1 Efectividad atribuible al uso de las vitaminas C y E como tratamiento adyuvante a la terapia triple estándar para pacientes infectados con H. pylori, en una población de la Amazonía peruana. El tratamiento adyuvante con las vitaminas C y E podría ayudar a incrementar las tasas de erradicación obtenidas con TTE en los pacientes infectados con H. pylori (91 % frente a 82 %, razón de tasas de incidencia =1,11; IC del 95 %: 0,92 a 1,36).
De acuerdo con algunos estudios previos, las tasas de erradicación atribuibles a la TTE en adyuvancia con las vitaminas C y E pueden ser tan altas como 94 % 9. Esta tasa de erradicación es muy similar a la encontrada en nuestro estudio (91 %) (Tabla 1). Estos valores obtenidos podrían explicarse debido a que la población estudiada probablemente contaba con algún nivel de deficiencia de su capacidad antioxidante, debido que este escenario se evidenció en un estudio experimental llevado a cabo en Asia, donde la muestra infectada por H. pylori, además, presentó bajos niveles de capacidad antioxidante, y que después de la administración de la terapia erradicadora en adyuvancia con vitaminas C y E se obtuvieron tasas de erradicación superiores a la terapia estándar 16. Posteriormente, estudios reportaron que individuos con bajos niveles de antioxidantes estaban relacionados con la persistencia y una mayor virulencia por H. pylori, y que además la mejora del mismo afectaría la supervivencia de dicha bacteria 22,23. Otro factor involucrado en la patogenia por H. pylori es su relación directa con la anemia ferropénica en los individuos infectados, debido a que existe una mala absorción del hierro en presencia de bajas concentraciones de antioxidantes, como es el caso de la vitamina C producto de la infección por H. pylori17,21. De tal manera que esto podría sumarse a la problemática de un país sudamericano como el Perú, cuyos últimos reportes de prevalencia de infección por H. pylori y anemia superan el 60 % y 40 %, respectivamente19,24; y en regiones de la Amazonía peruana, incluyendo el departamento de San Martín, los valores de la anemia oscilan alrededor del 24 % 20.
Tabla 1 Tasa de erradicación de H. Pylori según la exposición a la terapia con vitamina C y E
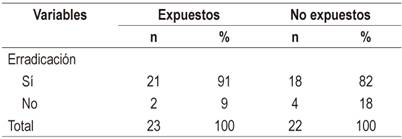
Tomada de: historias clínicas de pacientes infectados con H. pylori del Servicio de Gastroenterología del Hospital del Seguro Social (EsSalud) de Tarapoto, entre los meses de julio a diciembre del 2016.
Los hallazgos encontrados en nuestro trabajo nos indican que la TTE en adyuvancia con las vitaminas C y E cuenta con resultados terapéuticos superiores frente a la TTE en monoterapia (91 % frente a 82 %) y, teniendo en cuenta la estrecha relación que guardan la infección por H. pylori, la anemia y los bajos niveles de antioxidantes, podemos inferir que la suplementación con las vitaminas C y E en las terapias erradicadoras podrían haber mejorado indirectamente los niveles de antioxidantes en los sujetos de estudio, lo cual contribuye de alguna forma al éxito de las tasas de erradicación de H. pylori por encima del estándar. A pesar de la existencia de estudios en la década pasada que plantean que las evidencias disponibles para recomendar dicha terapia carecen de hallazgos significativos 15, en la actualidad se han venido desarrollando diversos trabajos con la finalidad de demostrar la efectividad terapéutica de la terapia erradicadora en adyuvancia con las vitaminas C y E 25,26,27.
Al igual que con otros estudios, las infecciones por H. pylori fueron observadas con mayor frecuencia en pacientes adultos24,28,29 del género masculino 30,31. Sin embargo, contrario a lo esperado, se observó que la mayoría de los pacientes infectados con H. pylori (68 %) procedían de las zonas urbanas de Tarapoto, y los restantes de las áreas rurales (Tabla 2). Esto puede deberse a un efecto del diseño, toda vez que las infecciones por H. pylori son comúnmente reportadas como asociadas a malas condiciones socioeconómicas y a servicios básicos deficientes con acceso limitado a agua potable; sin embargo, en el Perú, disponer de agua potable no parece ser suficiente para prevenir nuevas infecciones por H. pylori. De hecho, según un estudio reciente llevado a cabo en la ciudad de Lima, donde la mayoría de la población tiene acceso a agua potable, es común encontrar restos de material genético de H. pylori en el agua potable 32. Y lo que es más preocupante aún, no es raro encontrar cepas de H. pylori resistentes a niveles estándar de hipoclorito de sodio (cloro) 33.
Tabla 2 Características de la población
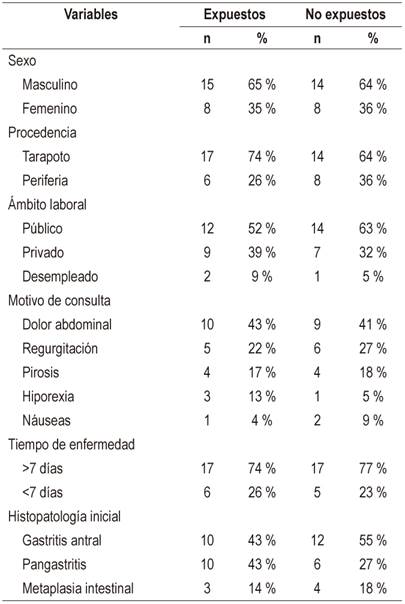
Tomada de: historias clínicas de pacientes infectados con H. pylori del Servicio de Gastroenterología del Hospital del Seguro Social (EsSalud) de Tarapoto, entre los meses de julio a diciembre del 2016.
En conclusión, se puede decir que el tratamiento adyuvante con vitaminas C y E podría ayudar a incrementar la efectividad atribuible a la TTE para H. pylori en los pacientes de la Amazonía peruana; sin embargo, para demostrar ello se recomienda realizar más investigaciones de tipo experimental con la finalidad de obtener una mayor evidencia terapéutica.











 text in
text in 


