Introducción
La infección por el virus de la hepatitis C (VHC) y la diabetes mellitus (DM) son dos de los principales problemas en salud pública a nivel mundial que impactan los sistemas de salud y tienen una carga económica global alta en los sistemas financieros, principalmente en los países en vías de desarrollo 1,2.
En la actualidad, se define la DM como un grupo de enfermedades metabólicas cuya característica en común es la hiperglucemia producida por un déficit en la secreción o acción de la insulina, o por ambos 3. La hiperglucemia crónica en la DM se ha asociado a largo plazo con daño, disfunción y falla de varios órganos, principalmente ojos, riñones, nervios, corazón y vasos sanguíneos; lo cual afecta la calidad de vida y aumenta la mortalidad 3,4.
La DM puede ser clasificada dentro de dos grandes tipos: tipo 1 (DM1) y tipo 2 (DM2). La DM1 corresponde al 5 %-10 % de la DM. Se caracteriza por la destrucción de las células β del páncreas, que conlleva a un déficit absoluto de insulina, y se debe a un mecanismo autoinmune. Se asocia con el haplotipo HLA-DR/DQ. Los marcadores de destrucción autoinmunitaria son positivos y se encuentran anticuerpos contra las células del islote (ICA) u otros autoanticuerpos contra la descarboxilasa del ácido glutámico (anti-GAD), anticuerpos antiinsulínicos (anti-IA) y anticuerpos anti-tirosina fosfatasa (IA-2, IA-2 beta) 5,6. La DM2 afecta al 90 %-95 % de los pacientes con DM. Se caracteriza por la resistencia a la insulina y el déficit relativo de esta, en mayor o menor grado; además, puede presentar un aumento de la producción de glucosa hepática. Probablemente haya diferentes causas que originen este tipo de DM, pero la etiología específica no se conoce exactamente 7.
La infección crónica por el VHC tiene una prevalencia entre 1,2 %-3,8 % según la región geográfica 8; aproximadamente, 130-175 millones de personas están actualmente infectadas, una población adicional de 3-4 millones serán infectadas cada año y 350 mil personas mueren por año 9. Es la principal causa de trasplante hepático en países desarrollados y la principal causa de morbilidad y mortalidad relacionada con el hígado 10,11.
El VHC es una causa frecuente de enfermedades hepáticas crónicas, incluidas la hepatitis, cirrosis y carcinoma hepatocelular (CHC); asimismo, se ha involucrado en la patogénesis de varias enfermedades autoinmunitarias y reumatológicas como artritis, vasculitis, síndrome sicca, porfiria cutánea tarda, liquen plano, nefropatías, enfermedades tiroideas y fibrosis pulmonar; y en el desarrollo de desórdenes linfoproliferativos de células β 12,13. Adicionalmente, se ha asociado con varias manifestaciones extrahepáticas, incluidas las alteraciones metabólicas, dentro de las que se encuentra la DM 14.
El objetivo de este trabajo es revisar la evidencia que asocia la infección crónica por VHC y la DM en diferentes campos: epidemiología, patogénesis, cuadro clínico, tratamiento y prevención.
Metodología
Para la realización del presente trabajo se realizó una búsqueda de la literatura utilizando los siguientes términos MeSH y palabras clave en la estrategia de búsqueda: hepatitis C, hepatitis C chronic, diabetes mellitus, epidemiology, physiopathology, diagnosis, therapeutics, antiviral agents.
La búsqueda se limitó a estudios realizados en humanos, en inglés y español, publicados desde la descripción inicial de la asociación en 1994 hasta noviembre de 2018. Las bases de datos electrónicas investigadas fueron Cochrane, Central de Ensayos Controlados, Medline, Embase y Science Citation Index. Adicionalmente, se realizaron búsquedas manuales. Se eligieron las publicaciones más relevantes según los autores.
Generalidades
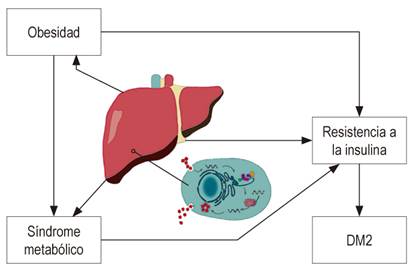
El hígado juega un papel importante en el metabolismo de los carbohidratos. Las enfermedades hepáticas crónicas presentan con alta prevalencia alteraciones en la homeostasis de la glucosa, intolerancia a los hidratos de carbono y resistencia a la insulina, lo cual puede eventualmente llevar a DM (Figura 1)15,16,17. Asimismo, la elevación moderada y asintomática de aminotransferasas es frecuente en pacientes con DM, especialmente aquellos con DM2, y se ha relacionado con infiltración grasa del hígado 18.
La progresión de la fibrosis hepática es responsable del desarrollo de resistencia a la insulina y DM2; sin embargo, la DM también puede ocurrir en etapas tempranas de la enfermedad hepática 19,20. Inicialmente, se consideraba el daño a largo plazo del hepatocito, como causa de las alteraciones en la homeostasis de la glucosa, pero diferentes estudios han evidenciado que los pacientes con otras patologías hepáticas crónicas como la infección por virus de la hepatitis B (VHB) tienen baja prevalencia de DM, en comparación con pacientes con hepatitis C crónica 21-24.
La prevalencia de anticuerpos VHC en la población con DM2 varía entre 1,78 % y 12,1 % 25,26. Estudios de corte transversal y con un grupo control de individuos no diabéticos establecieron una prevalencia más alta de anticuerpos VHC en pacientes con DM2 que en la población general 27-30. Contrario a lo evidenciado en DM2, la prevalencia de anticuerpos VHC en sujetos con DM1 no excede la prevalencia esperada en la población general 31. El estudio NHANES III encontró en personas mayores de 40 años con infección por VHC tres veces de probabilidad de tener DM2 con respecto a aquellos no infectados, y no se detectó una asociación con la DM1 32. Otro gran estudio basado en la comunidad estableció que la positividad de anticuerpos VHC estuvo fuertemente asociada con DM2 entre los 39 a 49 años de edad 33.
Cuando los pacientes infectados por VHC y cirrosis son evaluados, la prevalencia de DM2 es más alta que la reportada en pacientes con hepatitis crónica, y varía de 19,6 % a 50 % 34. Un estudio prospectivo que comparó 50 pacientes con cirrosis debido a infección por VHC y 50 pacientes con cirrosis sin infección por VHC encontró una mayor prevalencia de DM en los pacientes infectados con VHC y valores más altos de insulinemia basal; parecería que la presencia de enfermedad hepática avanzada es un factor diabetogénico fuerte, igual que la infección por VHC en sí misma 34.
La consecuencia clínica de la alta prevalencia de infección por VHC en DM2 es que las elevaciones leves de aminotransferasas séricas no deben atribuirse automáticamente a enfermedad por hígado graso no alcohólico y, por ello, las pruebas para la infección por este virus en pacientes diabéticos con perfil hepático alterado deben ser mandatorias 35.
Hay información insuficiente acerca de la duración de la infección por VHC y DM que permita evaluar su relación temporal. Un estudio reportó que todos los pacientes con infección de VHC y DM2 tenían historia previa de transfusión de hemoderivados entre 10 y 20 años antes del inicio de la DM 31. En otro estudio se diagnosticó DM2 18 años después de la infección por VHC 36. Cuando la secuencia temporal es caracterizada en pacientes diabéticos VHC positivos, el diagnóstico de la infección precedió a la DM en un 73 % de los casos 37.
En el 52 % de las personas con infección por VHC y DM2 hay factores de riesgo para infección por el virus antes del inicio de la DM, mientras que ninguno tuvo factores de riesgo para infección por el virus después del inicio de la DM 15. La ausencia de cualquier factor epidemiológico para infección por VHC entre los pacientes diabéticos y la evidencia que sugiere que la infección precede a la DM soporta la idea de que el virus puede causar o predisponer a las personas infectadas por VHC para que desarrollen DM; sin embargo, las conclusiones definitivas se deben realizar con estudios prospectivos. La edad, obesidad, historia familiar de DM, origen afroamericano y coinfección de VHC y virus de inmunodeficiencia humana (VIH) son factores de riesgo asociados con el desarrollo de DM entre personas infectadas con VHC 38,39. Por el contrario, la relación entre DM2 y los genotipos del VHC permanece controversial con respecto a la existencia de algún genotipo específico que predisponga o proteja del desarrollo de DM en pacientes infectados 40.
La diabetes mellitus postrasplante (DMPT) es una condición médica que surge durante el seguimiento de receptores de trasplante renal y hepático, la cual ha incrementado su incidencia en las últimas décadas 41. Existen factores de riesgo independientes para su desarrollo tales como agentes inmunosupresores para prevenir y tratar el rechazo, origen del donante y los relacionados con el receptor 42. La infección crónica por VHC es una de las indicaciones actuales que llevan a trasplante hepático ortotópico. La prevalencia de DMPT en receptores de trasplante hepático infectados con VHC está entre 40 %-64 %, significativamente más alta que la prevalencia reportada en pacientes trasplantados por otras causas de insuficiencia hepática. Además, se ha establecido que el VHC es un factor de riesgo independiente para el desarrollo de DMPT 42. La infección por VHC puede alcanzar una incidencia de 50 % en pacientes con enfermedad renal terminal y se ha identificado como un factor de riesgo independiente para el desarrollo de DMPT después de un trasplante renal 43. Todos estos datos refuerzan la hipótesis de que el VHC es más una causa que una consecuencia de la DM. Adicionalmente, la relación entre VHC y DM puede contribuir sustancialmente al papel perjudicial del virus en la supervivencia del paciente y el injerto después del trasplante hepático o renal 43.
Se ha explorado el vínculo entre la infección por VHC y la DM mediante la evaluación de la prevalencia no solo de la DM, sino también de la glucosa alterada en ayunas (GAA). En una cohorte de pacientes con hepatitis crónica por VHC se observó un incremento de casi 3 veces la prevalencia de anormalidades en la glucosa en comparación con los pacientes negativos de VHC o con otras hepatopatías (32 % frente a 12 %). Entre los pacientes con infección por VHC se encontró una mayor prevalencia de DM y GAA (17 % frente a 7 %, y 15 % frente a 5 %, respectivamente). No se observaron diferencias en pacientes cirróticos con o sin infección por VHC. Estos hallazgos sugieren que la conexión genuina entre la infección del VHC y la DM se inicia en las etapas tempranas de la enfermedad hepática 40.
La alta prevalencia de alteraciones en el metabolismo de la glucosa encontradas en pacientes con infección por VHC sugiere que deben considerarse un grupo de alto riesgo para desarrollar DM y GAA; y por tanto, se debería realizar tamización para DM. Lecube y colaboradores realizaron una prueba de tolerancia oral a la glucosa (PTOG) en 50 pacientes positivos de VHC y 50 pacientes negativos de VHC con hepatitis crónica en quienes la DM no se había diagnosticado. Ambos grupos se emparejaron por edad, índice de masa corporal (IMC) y sexo. La PTOG permitió diagnosticar 18 % de casos nuevos de DM y 30 % de GAA en pacientes positivos de VHC en comparación con los pacientes negativos de VHC (4 % y 18 %, respectivamente) 44.
En la Tabla 1 se definen los criterios para el diagnóstico de DM según la Asociación Americana de Diabetes (ADA) 45.
Mecanismos patogénicos involucrados en la acción diabetogénica del vhc
Efectos del VHC y resistencia a la insulina
El VHC es hepatotropo y no citopático; su genoma se ha identificado en tejidos más allá del hígado, incluídas las células acinares pancreáticas y células epiteliales del ducto pancreático 46. Estudios post mortem revelaron que el VHC se replica en el páncreas y modelos animales sugieren un efecto directo de la infección en la resistencia a la insulina a nivel hepático 47.
El virus tiene un genoma de ácido ribonucleico (ARN) de 9,6 Kb, que codifica aproximadamente 3010 aminoácidos y son transportados en proteínas estructurales (core, E1, E2) y proteínas no estructurales (NS3-NS5B). Estas proteínas juegan un papel importante en el desarrollo de resistencia a la insulina y estrés oxidativo por medio de especies reactivas de oxígeno a nivel celular 48. La proteína core, sola o en combinación con otras proteínas virales, incrementa la fosforilación del sustrato del receptor de insulina tipo 1 (SRI-1), el cual es la base de la resistencia a la insulina 49. El SRI-1 fosforilado activa la fosfatidilinositol 3 cinasa (PI3K), y la activación de PI3K y Akt es esencial para muchos de los efectos metabólicos de la insulina (Figura 2) 50; por ello, los defectos a nivel de la asociación de PI3K con SRI-1 y la pérdida de activación de la PI3K pueden contribuir a la resistencia a la insulina y prevalencia incrementada de DM en sujetos infectados con VHC. Este mecanismo, por último, promueve la translocación del transportador 4 de glucosa (GLUT4) a la membrana plasmática para mejorar la captación de glucosa 51. Además, la proteína core puede directamente activar los inhibidores de la señalización de la insulina, tales como mTOR (blanco de rapamicina en células de mamífero), SOCS-3 (supresor de señalización de citocinas) y JNK (cinasa c-Jun N-terminal) 52. Adicionalmente, el VHC aumenta el estrés en el retículo endoplasmático, lo cual activa la proteína fosfatasa 2A (PP2A), que inhibe dos reguladores claves en la gluconeogénesis: proteína cinasa activada por el monofosfato de adenosina (AMPK) y Akt 52.
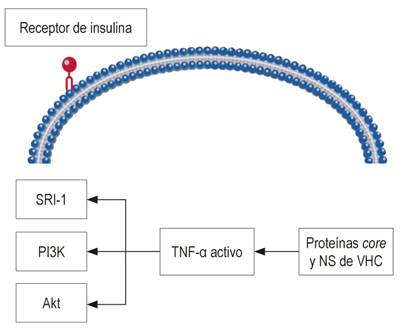
Figura 2 Mecanismo por el cual el VHC interfiere en la señalización de la insulina. TNF-α: factor de necrosis tumoral alfa.
Reciente evidencia soporta la existencia de un componente extrahepático de resistencia a la insulina inducida por el virus; de este modo, la patogénesis molecular de las alteraciones del metabolismo de glucosa observadas en la infección por VHC son mucho más complejas de lo que se creía 51.
Citocinas proinflamatorias
Las estrategias virales de evasión inmune innatas y las determinantes genéticas humanas son la base de la transición de infección aguda hacia la persistencia viral e infección crónica. Los factores genéticos del huésped pueden influenciar el resultado de la infección y la respuesta a la terapia antiviral. Estudios recientes revelan una compleja interacción entre el contexto genético del paciente con factores virales y del huésped relacionados con el desencadenante inmune innato, que dicta el control de la infección e inmunidad del VHC 53.
Más allá de los efectos directos del VHC en SRI-1/PI3K, la proteína core puede inducir resistencia a la insulina indirectamente por medio de la estimulación de la secreción de citocinas proinflamatorias. En pacientes con VHC crónica, la inflamación inducida por el virus produce hipersecreción de citocinas proinflamatorias resistentes a la insulina, como la interleucina 6 (IL-6) y el TNF-α 52,54,55. Las citocinas proinflamatorias también regulan los supresores de proteínas de la señal de las citocinas como parte de un circuito de retroalimentación negativo al atenuar la señal de estas 56. Este fenómeno puede contribuir a un incremento en la gluconeogénesis debido a la pérdida de la inhibición mediada por Akt de la expresión del gen de la fosfoenolpiruvato carboxicinasa (FEPCK). En este contexto, es interesante anotar que la leptina puede modular la acción de la insulina en las células hepáticas por antagonizar la fosforilación de SRI-1 estimulada por insulina, incrementando la expresión del gen FEPCK y disminuyendo la expresión de la glucocinasa, lo cual resulta en un aumento de la gluconeogénesis 57. Con el incremento en la gluconeogénesis, después de la infección por VHC, hay mayor producción y acumulación de lípidos mediada por la inhibición de la AMPK 58. El efecto estimulante de lipólisis por el TNF-α lleva a niveles séricos elevados de ácidos grasos libres, los cuales reducen la sensibilidad a la insulina 59,60.
Las citocinas son mediadores intercelulares involucrados en el control viral y el daño hepático inducido por el VHC. La compleja red de citocinas que opera durante la infección inicial permite el desarrollo coordinado y efectivo de las respuestas inmunes innata y adaptativa; sin embargo, el virus interfiere con las citocinas en varios niveles y escapa a la respuesta inmunitaria induciendo un perfil Th2. La incapacidad para controlar la infección lleva al reclutamiento de infiltrados inflamatorios en el parénquima hepático por interferón gamma (IFN-γ) e induce quimiocinas CXCL9, CXCL10 y CXCL11, lo cual resulta en un daño hepático sostenido y eventualmente cirrosis 61,62. Eslam y colaboradores encontraron polimorfismos en la región IFNL3 (IL-28B) asociados con recuperación espontánea, e inducida por el tratamiento de la infección 63.
Las enfermedades sistémicas extrahepáticas más importantes relacionadas con VHC (crioglobulinemia mixta, desórdenes linfoproliferativos, enfermedades autoinmunitarias de tiroides, DM2) están asociadas con alteraciones en la regulación compleja de la red citocina/quimiocina, involucrando quimiocinas proinflamatorias y respuesta Th1 61,62.
Infección por VHC y DM1
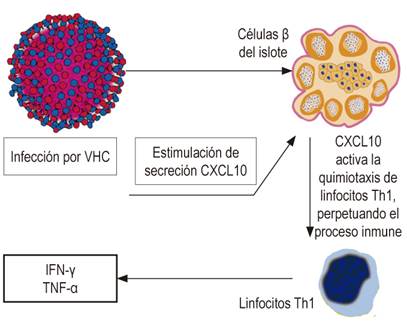
Distintos mecanismos se han postulado. Así como el VHC puede infectar tejidos extrahepáticos, la participación de este en el inicio de DM1 aún no se ha aclarado 64. Más allá de los mecanismos directos no demostrados, la infección por VHC inicia o acelera una reacción inmunitaria contra las células β. La infección de células β por VHC puede regular la expresión y secreción del gen CXCL10 y reclutamiento de linfocitos Th1, que secretan IFN-γ y TNF-α, los cuales inducen la secreción de CXCL10 por células β y de este modo perpetúan la cascada inmunitaria; dicha cascada puede llevar a disfunción de células β en sujetos predispuestos genéticamente (Figura 3) 65. Adicionalmente, se sugiere el mimetismo molecular con un desencadenante de autoinmunidad relacionada con el VHC, la descarboxilasa del ácido glutámico (GAD) comparte una secuencia de 65 aminoácidos similar con regiones antigénicas de la poliproteína del virus 66. Otra posibilidad es la inducción de anticuerpos reactivos contra GAD y el desarrollo de DM mediada por interleucina 18 (IL-18) y otras citocinas proinflamatorias 67. La IL-18 juega un papel patogénico en DM1 porque está involucrada en la aceleración del desarrollo de la enfermedad manifiesta, puede inducir respuesta Th1 y Th2 dependiendo de las citocinas circundantes, además de jugar un rol patogénico en distintas enfermedades incluida la insuficiencia hepática aguda 67,68. Otras citocinas proinflamatorias, tales como, TNF-α e IL-1B, que están elevadas en pacientes con hepatitis aguda, pueden también inducir diabetes autoinmune 69.
Sobrecarga de hierro
Altas concentraciones de ferritina están asociadas con resistencia a la insulina y con riesgo incrementado de DM2 en personas sanas. En los pacientes infectados con VHC se ha reportado el incremento de los niveles de ferritina 70. La ferritina es un reactante de fase aguda que puede estar alterado por procesos inflamatorios, y la evidencia sugiere que en DM2 existe un bajo grado de inflamación. Los pacientes con infección por VHC sin DM no tienen niveles altos de ferritina, por lo cual se sugiere que la DM, y no la infección por VHC, es un factor de riesgo para concentraciones altas de hierro; sin embargo, hacen falta más estudios prospectivos que evalúen esta relación 70. Adicionalmente, los depósitos de hierro hepáticos pueden causar resistencia a la insulina al interferir con la capacidad de la insulina de suprimir la producción de glucosa hepática 70.
Esteatosis hepática
Es más frecuente en infección por VHC que en infección por VHB y ocurre en más del 50 % de pacientes con VHC crónica 71. La esteatosis leve se asocia con IMC elevado y obesidad visceral, mientras que la esteatosis moderada a grave es causada directamente por el virus 52. Las diferencias genotípicas en términos de progresión de las alteraciones hepáticas también se han descrito. La esteatosis en infección por VHC genotipo 4 es una expresión de síndrome metabólico causado por la activación de mecanismos proinflamatorios, así como la obesidad y la resistencia a la insulina. El grado de esteatosis en este genotipo es independiente de la carga viral y la terapia antiviral no la mejora 72. El genotipo 3a se relaciona principalmente con esteatosis grave 52.
La esteatosis hepática puede contribuir a DM asociada con el VHC por daño en la capacidad de la insulina de disminuir la gluconeogénesis y favorecer la fibrosis hepática 71.
DM en infectados con VHC tratados con interferón alfa (IFN-α)
Algunos estudios han mostrado una alta prevalencia de marcadores de autoinmunidad pancreática en pacientes con infección por VHC durante o después de la terapia con IFN-α, probablemente debido a los efectos inmunoestimuladores de estas citocinas 73. El IFN-α tiene actividad antiviral, antiproliferativa e inmunomoduladora; en individuos predispuestos, puede inducir un proceso diabetogénico. Por esta razón, los autoanticuerpos de células del islote y anti-GAD deben ser investigados antes y durante el tratamiento para identificar individuos con alto riesgo de desarrollar DM1 73. Algunos pacientes pueden desarrollar autoinmunidad pancreática de novo y estar en riesgo de desarrollar DM. Los pacientes que son inicialmente positivos para autoanticuerpos organoespecíficos (especialmente autoanticuerpos específicos de páncreas y tiroides) y aquellos quienes hacen seroconversión están en alto riesgo de desarrollar enfermedad autoinmunitaria clínica después del tratamiento 74. El IFN-α incrementa la expresión de antígenos HLA clase I, activa las células NK (natural killer) y linfocitos T, y puede ser un importante cofactor en el desarrollo de una reacción inmunitaria Th1 75. La suspensión oportuna de la terapia es raramente acompañada por regresión clínica de la DM 74.
Cáncer en infección por VHC y DM
La principal característica de los pacientes diabéticos es la resistencia a la insulina, la cual es crucial para la progresión de la fibrosis y su impacto negativo en la respuesta al tratamiento con antivirales en sujetos con VHC crónica 76. La reducida sensibilidad a la insulina es la base de la hiperinsulinemia compensatoria y los niveles elevados de factor de crecimiento similar a la insulina tipo 1 (IGF-1), el cual estimula la proliferación celular e inhibe la apoptosis. Este fenómeno tiene fuertes efectos mitogénicos en una amplia variedad de líneas celulares cancerígenas 77. Al mismo tiempo, la insulina activa el receptor de IGF-1, que tiene un efecto promotor de crecimiento que incluye la modulación de la progresión del ciclo celular. El exceso de insulina puede llevar indirectamente al desarrollo de cáncer por la regulación del nivel de proteína 1 ligada a IGF, lo que incrementa el nivel y biodisponibilidad de IGF-1 circulante. La obesidad e inactividad física también causan hiperinsulinemia y por esto también se asocia con progresión acelerada de cáncer 78.
La VHC crónica es una forma progresiva de enfermedad hepática que lleva a cirrosis y CHC 13. Los pacientes con infección por VHC diabéticos tienen un riesgo incrementado de CHC en comparación con individuos no diabéticos, por lo que la DM parece tener un impacto selectivo en el desarrollo del CHC 79. Es así como los pacientes con DM2 en quienes se logra un buen control glucémico alcanzando niveles de HbA1c <7 % se puede reducir el riesgo de CHC 80.
Tratamiento y prevención
Estudios clínicos en pacientes con infección por VHC han reportado mejoría en el control glucémico y resistencia a la insulina con los agentes antivirales de acción directa (AAD) en pacientes con o sin DM81,82,83. Los pacientes diabéticos quienes reciben AAD deben ser monitorizados estrictamente para reducir los medicamentos antidiabéticos, principalmente insulina y sulfonilureas, para evitar hipoglucemias 84.
Con la llegada de las terapias para VHC se han encontrado relaciones interesantes, identificando que los primeros tratamientos basados en interferón actuaban como facilitadores en el desarrollo de DM 85. Sin embargo, con las terapias antivirales orales, se ha observado un descenso en la incidencia de DM: en 5127 pacientes tratados para VHC se encontró una incidencia del 6,2 % entre quienes alcanzaron una respuesta virológica sostenida, en contraste con un 21,7 % de los pacientes que tuvieron falla terapéutica después de 3,7 años de seguimiento (Hazard ratio ajustado [aHR] = 0,79; intervalo de confianza [IC] 95 %: 0,65-0,96) 86. Li y colaboradores realizaron seguimiento a 1395 pacientes con infección por VHC y DM2 tratados y con respuesta virológica sostenida por un lapso promedio de 2,7 años, y se observó un descenso significativo en las complicaciones como síndrome coronario agudo (Hazard ratio [HR] = 0,36; p <0,001) enfermedad renal crónica terminal (HR = 0,46; p <0,001), evento cerebrovascular (sub-Hazard ratio [sHR] = 0,34; p <0,001), y retinopatía (sHR = 0,24; p <0,001), al comparar con pacientes no tratados 87.
Se ha podido identificar mejoría en otras variables vinculadas con la DM, como la HbA1c, demostrando en estudios recientes que la caída en HbA1c fue mayor en aquellos pacientes quienes alcanzaron respuesta virológica sostenida (0,6 % a 0,98 %) con respecto a quienes fallaron en el tratamiento 88,89, estos beneficios endocrinos proveen una justificación adicional para considerar el tratamiento antiviral en todos los pacientes con infección por VHC y DM 89. Adicionalmente, el tratamiento de la infección por VHC en pacientes con DM podría disminuir la prevalencia de complicaciones, entre ellas, nefrológicas crónicas relacionadas con esta 90.
Diferentes factores pueden alterar esta respuesta, como el genotipo del virus, factores genéticos del hospedero y comorbilidades 91. Algunas investigaciones han reportado que la obesidad y la hipercolesterolemia son factores potenciales que interfieren con la respuesta viral sostenida 92. Esto sugiere opciones terapéuticas adicionales para la infección por VHC que incluyen cambios en la dieta, medicamentos antidiabéticos y estatinas. En el contexto de los antidiabéticos orales no es claro si el mejor enfoque es usar una biguanida, como la metformina 93. Con respecto a las estatinas, estas son capaces de inhibir la replicación del VHC in vitro, pero no in vivo94.
La relación potencial entre infección por VHC y el desarrollo de DM incrementa la necesidad de implementar medidas de prevención; estas deben ser dirigidas a cambios en el estilo de vida que pueden reducir el riesgo de desarrollar infección por VHC y DM, tamización regular para DM en pacientes con infección por VHC y análisis de otros factores de riesgo que pueden acelerar la progresión de ambos, tales como obesidad, dislipidemia y consumo de alcohol 95.
Son necesarios estudios adicionales para mejorar las políticas de prevención y fomentar programas adecuados y costo-efectivos para la vigilancia y tratamiento de pacientes diabéticos con VHC crónica, por lo cual se debe implementar un tratamiento multifactorial para curar dos enfermedades: DM y VHC crónica.
Conclusiones
La infección por VHC y DM son dos desórdenes con un alto impacto en la salud a nivel mundial. Hay alta prevalencia de DM2 en pacientes infectados por VHC con hepatitis crónica y evidencia creciente que soporta el concepto que esta infección es un factor de riesgo para desarrollar DM o alteraciones en el metabolismo de los hidratos de carbono. Los mecanismos específicos a través de los cuales el VHC está asociado con DM parece involucrar efectos virales directos, resistencia a la insulina, citocinas proinflamatorias, quimiocinas, supresores de señalización de citocinas y otros mecanismos inmunomediados. Estos mecanismos son iniciados en las etapas tempranas de la enfermedad hepática.
La edad, obesidad, historia familiar de DM, origen afroamericano y coinfección VHC-VIH son factores de riesgo asociados con el desarrollo de DM entre personas infectadas con VHC. En estos pacientes se deben realizar estudios para evaluar alteraciones en el metabolismo de los carbohidratos. Se han reportado pocos datos de la asociación de VHC crónica y DM1. La terapia con IFN-α puede estimular autoinmunidad pancreática y, en ciertos casos, llevar al desarrollo de DM1. Los pacientes diabéticos con VHC crónica tienen riesgo incrementado de desarrollar cirrosis y CHC en comparación con los pacientes con VHC crónica no diabéticos. El tratamiento con AAD mejora el control glucémico y la resistencia a la insulina. Se necesitan estudios adicionales para mejorar políticas de prevención y fomentar programas adecuados y costo-efectivos para el diagnóstico, tratamiento y seguimiento de pacientes diabéticos con VHC crónica.











 text in
text in