Introducción
Las lesiones sólidas del páncreas representan un grupo heterogéneo de entidades que pueden ser clasificadas como neoplásicas y no neoplásicas. Las lesiones neoplásicas son las más comunes, estas incluyen adenocarcinoma, tumores neuroendocrinos, tumor pseudopapilar sólido, pancreatoblastoma, linfoma, metástasis y neoplasias misceláneas raras 1. El adenocarcinoma ductal es el tumor maligno más frecuente del páncreas y representa cerca del 90% de todas las neoplasias malignas pancreáticas 2. Es una causa significativa de mortalidad, la tasa de sobrevida a 5 años es menor del 5%, pero puede alcanzar el 20% en pacientes seleccionados con tumores no invasivos a quienes se ha realizado resección quirúrgica y su objetivo es detectarlo en estadios tempranos 3. Actualmente, el ultrasonido, la tomografía computarizada y las imágenes por resonancia magnética son el pilar en la evaluación del 80%-85% de las lesiones sólidas en páncreas 4. El diagnóstico preoperatorio de las lesiones sólidas pancreáticas es un reto, a pesar del avance tecnológico en las imágenes. La ecoendoscopia más punción con aguja fina es considerado el método de elección para detectar y diagnosticar estas lesiones 5. El rendimiento diagnóstico es altamente sensible y específico; sin embargo, varios factores afectan este rendimiento, dentro de estos se encuentran la experiencia del ecoendoscopista, posición del equipo, momento del día, número de aguja, técnica utilizada, característica de las lesiones, número de pases, citólogo en sala, pancreatitis crónica, entre otros 6-16.
Para el abordaje de las lesiones sólidas en páncreas se han desarrollado dos técnicas principales de succión: técnica seca y técnica húmeda 17. La técnica seca estándar (TS) consiste en los siguientes pasos: visualización por ecoendoscopia de la lesión en una posición óptima, inserción de la aguja (calibre 22), selección de la línea de punción, puncionar con la aguja, remoción del estilete, succión por jeringa de vacío, movimientos de un lado para otro de la aguja, retiro de la aguja y expulsión de la muestra de la aguja utilizando el estilete 18. La técnica húmeda ha sido desarrollada recientemente para mejorar la calidad de las muestras. En esta técnica, antes de puncionar la lesión se retira el estilete (aguja calibre 22) y se prelava con 5 mL de solución salina para reemplazar la columna de aire con líquido. Una jeringa de 10 mL se prellena con 3 mL de solución salina y se utiliza para aspirar luego de realizar la punción de la lesión. Una vez la aguja está dentro de la lesión, esta se mueve 3 veces de un lado para otro, esta maniobra se repite 4 veces (pases), para un total de 12 movimientos. Al retirar la aguja, el aspirado se libera en una lámina y se aplica aire, esto es más eficiente y seguro para sacar el aspirado que reinsertar el estilete 17,19. Un metaanálisis reciente mostró mayor sangrado en el grupo donde el estilete fue reinsertado para sacar el aspirado 20. La técnica híbrida (TH) consiste en realizar los mismos pasos de la técnica húmeda inicial, pero colocar en la aguja una jeringa premontada con vacío, la cual se activa una vez la aguja está dentro de la lesión.
El objetivo del presente trabajo es determinar el rendimiento diagnóstico de la técnica de succión seca estándar versus la técnica de succión húmeda híbrida en el estudio de lesiones sólidas del páncreas en una institución hospitalaria de tercer nivel en Bogotá.
Materiales y método
Este trabajo presenta la experiencia en una institución hospitalaria de tercer nivel en Bogotá. Se utilizó un diseño prospectivo, con ocultación única, aleatorizado y controlado para investigar qué técnica de punción con aguja fina guiada por ecoendoscopia en lesiones sólidas de páncreas permite obtener la cantidad de tejido adecuado para el diagnóstico patológico. Se incluyeron pacientes con diagnóstico de lesión sólida en páncreas, que ingresaron a sala de procedimientos para realización de ecoendoscopia más punción con aguja fina entre mayo de 2014 y junio de 2016. Los criterios de inclusión y exclusión se resumen en la Tabla 1 y Tabla 2. Los procedimientos se realizaron en la sala de gastroenterología de un hospital de tercer nivel en Bogotá, bajo sedación guiada por anestesiólogo, con una combinación de propofol más remifentanilo. Todas las punciones fueron guiadas por ecoendoscopia con un equipo marca Pentax, un endosonógrafo lineal y realizadas por un endoscopista experimentado en procedimientos intervencionistas, con más de 1000 ecoendoscopias con punción realizadas.
Tabla 1 Criterios de inclusión y exclusión

ECOG: Grupo Cooperativo Oncológico del Este; INR: índice internacional normalizado.
Se utilizaron agujas de aspiración para ecoendoscopia número 22 gauge (Boston Scientific). Se usó la técnica de succión híbrida y la técnica de succión seca (10 mL) estándar con estilete para la toma de biopsias, con un total de 3 pases y 4 movimientos dentro de la lesión, según las recomendaciones descritas en la literatura 17,18,19. Las muestras se extendieron en láminas y se fijaron en alcohol etílico, estas se enviaron para estudio patológico por un especialista en citología del páncreas, el cual no conocía el método TH vs. TS utilizado para obtener las muestras. La información se recopiló en Google Drive y se obtuvieron variables cuantitativas discretas, las cuales se expresaron en frecuencias absolutas y relativas, calculando la frecuencia relativa porcentual, con lo que se calculó la estimación de riesgo (odds ratio - OR) y se determinó la capacidad de cada técnica para obtener la suficiente cantidad y calidad de muestra, que permitiera obtener un diagnóstico patológico.
Resultados
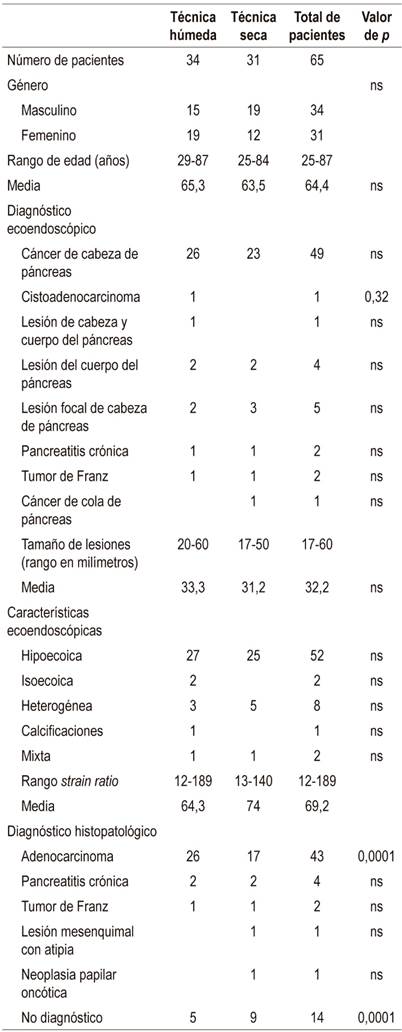
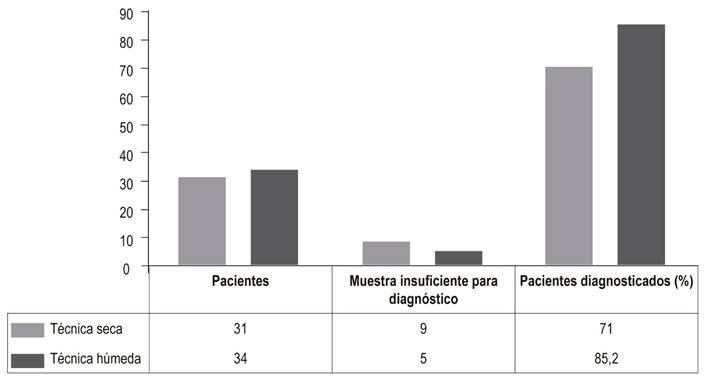
Se recolectaron los datos de 65 pacientes a quienes se les realizó ecoendoscopia más punción por diagnóstico de lesión sólida en páncreas, 34 (52,3%) pacientes se realizaron con la técnica híbrida y 31 (47,7%) pacientes con la TS, con estilete cuyas características se resumen en la Tabla 3. Se encontró que la frecuencia relativa porcentual respecto a la técnica de punción con aguja fina guiada por ecoendoscopia en lesiones sólidas de páncreas que permite obtener la cantidad de tejido adecuado para el diagnóstico citológico fue de 85,2% para la TH y 71% para la TS (Figura 1), por lo que se observa un aumento en el rendimiento del 14,2% a favor de la técnica húmeda híbrida, con un OR de 2,35 (IC 95% 1,2-4,7).
Discusión
La ultrasonografía endoscópica (USE) ofrece una excelente visualización del páncreas desde el duodeno o el estómago, lo que logra producir imágenes de alta resolución, por lo que se considera como uno de los métodos más precisos para la detección de lesiones focales pancreáticas, especialmente en pacientes con tumores pequeños (3 cm o menos) 22. Adicionalmente, la USE tiene la capacidad de obtener muestras para el diagnóstico patológico al utilizar punción guiada con aguja fina, la cual actualmente se considera una técnica de imagen segura y precisa para el diagnóstico tisular en pacientes con lesiones pancreático-biliares, siendo particularmente útil para diagnosticar tumores de páncreas y orientar la tomar decisiones terapéuticas 23. Se ha encontrado que, para estos carcinomas, esta tiene una sensibilidad diagnóstica del 54%-96%, una especificidad del 96%-98% y una precisión diagnóstica del 83% al 95% 24,25,26.
Como resultado de su utilidad demostrada se ha intentado aumentar su rendimiento diagnóstico y acercarlo cada vez más al 100%, lo que ha impulsado el desarrollo de varias agujas para la realización de la punción, que incluyen calibres 25, 22 y 19. Particularmente, las agujas de calibre 25 son más fáciles de manejar, causan menos complicaciones (sangrado) y a su vez tienen una menor probabilidad de obtener muestras contaminadas con sangre cuando se comparan con las agujas de calibres 19 y 22 9,27,28,29. Adicionalmente, se ha demostrado que las agujas de calibre 25 tienen un mejor rendimiento diagnóstico en tumores pancreáticos sólidos, cuando se comparan con las de calibre 22 (sensibilidad combinada: 93% para agujas de calibre 25 frente a 85% para agujas de calibre 22 para los diagnósticos realizados basados en citología) 10.
A pesar de esto, los resultados de cuatro metaanálisis disponibles sobre este tema son contradictorios. Existe una evidencia consistente de que la calidad citológica de las muestras obtenidas con las agujas 25 y 22 es similar y no se han demostrado ventajas convincentes de la aguja 25 frente a la 22, o viceversa, en términos de rendimiento técnico, facilidad de uso o perfil de seguridad. En consecuencia, en este estudio se decidió utilizar en los dos grupos, tanto para técnica húmeda como para técnica seca, agujas de calibre 22, con el fin de evitar un factor de confusión 8,10,11,18,30,31. Aunque esta técnica se considera como segura no está exenta de complicaciones (0%-3,4%), siendo la más frecuente la pancreatitis leve 31,32,33.
Adicionalmente, existen factores que aumentan el riesgo de complicaciones pospunción en relación con las características del tejido objetivo, como las masas pequeñas (≤20 mm) y los tumores endocrinos 31,32,33,34. Se han informado complicaciones raras, pero graves, como sangrado (0,2%), ruptura de seudoaneurisma, pseudoquiste pancreático, absceso y casos reportados de siembras de cáncer 31,35,36,37. Las complicaciones infecciosas, bacteriemia o sepsis en las punciones de las lesiones sólidas pancreatobiliares se presentan del 0%-1%; sin embargo, en este estudio no se presentó ninguna complicación documentada de sangrado o infección 37,38.
La técnica empleada al realizar el procedimiento tiene como principio básico la visualización de la lesión diana por ultrasonografía. Se localiza el abordaje de punción (posición del transductor, presencia de vasos sanguíneos, cantidad de tejido interpuesto entre el transductor y la lesión, entre otros), se avanza una aguja elegida para puncionar la lesión, se retira el estilete (si se usa), se aplica succión, se avanza la aguja y se retira a través de la lesión para obtener material celular, finalmente, se retira la aguja y se recoge el tejido para el examen citopatológico. Distintas variaciones en la técnica han sido motivo de estudio, orientadas a determinar cuáles cambios en la técnica pueden mejorar el rendimiento diagnóstico, dentro de los que cabe resaltar la selección del sitio de punción y de la aguja, uso del estilete, succión, número de punciones y uso de un citopatólogo in situ23,31,39.
De estas modificaciones, algunas han mostrado resultados favorables respecto al aumento del rendimiento diagnóstico, dentro de las cuales se encuentran, en primer lugar, el posicionamiento; este procedimiento se realiza de una manera más cómoda cuando el ecoendoscopio se encuentra en una posición estable con la punta recta, lo que permite un fácil paso de la aguja de punción, esto generalmente se logra mejor desde la posición transgástrica que en la transduodenal 18,40. Es importante recoger muestras de secciones múltiples de una lesión pancreática (múltiples punciones y técnica abanico [fanning]), ya que las lesiones neoplásicas pueden ser de naturaleza heterogénea, con centros necróticos acelulares, por lo que es crucial enfocarse en múltiples áreas de la lesión, especialmente en la periferia. Actualmente se recomiendan 5 punciones con técnica fanning para lesiones sólidas en páncreas 13,18,39. Esta técnica consiste en cambiar la posición del ángulo de la aguja utilizando los mandos y el elevador (uña) de manera intermitente para tomar muestras sucesivas de múltiples áreas de la lesión, lo que aumenta la cantidad de tejido luego de la punción, por lo que se implementó como parte del protocolo del presente estudio 13,31,41.
Otro aspecto por resaltar, dada la evidencia creciente a favor, es la presencia de un citopatólogo en la sala de endoscopia donde se realiza el procedimiento denominado ROSE (por sus siglas en ingles), lo que implica la evaluación de los frotis directos obtenidos en la sala de endoscopia por un citopatólogo, que utiliza un microscopio óptico con retroalimentación inmediata al endosonografista sobre la calidad de las muestras para el diagnóstico y si se requieren muestras adicionales 15,18,31,39,41.
Numerosos estudios han confirmado la superioridad de ROSE en términos de aumentar el rendimiento diagnóstico al limitar el número de pases y disminuir el número de muestras inadecuadas 15,18,40-45. Sin embargo, en nuestro medio, la posibilidad de contar con un citopatólogo en la sala de endoscopia es bastante limitada, dado el aumento de los costos; por lo que en nuestro estudio no se logró adoptar esta recomendación. Se decidió realizar 5 punciones y utilizar la técnica fanning según lo recomendado por la Sociedad Europea de Endoscopia Gastrointestinal como protocolo de punción 18.
En la actualidad se sabe que la baja celularidad de los aspirados obtenidos a través de USE-PAF es una causa común de la ausencia de diagnóstico, lo que genera la necesidad de repetir los procedimientos, aumenta el costo y retrasa el diagnóstico, esto, a su vez, impide implantar estrategias de tratamiento en forma temprana, con consecuencias en la morbilidad y mortalidad para los pacientes 44,45. Inicialmente se desarrollaron técnicas de succión seca y húmeda para mejorar el rendimiento de las punciones de lesiones sólidas localizadas en el mediastino o intrabdominales, pero aún no se ha recomendado como técnica USE-PAF estandarizada. Cuando se aplica la técnica seca se ha encontrado una mayor celularidad en las muestras del tejido, pero puede haber más contaminación sanguínea, por tanto, afectar la calidad general de la muestra 20,46.
Respecto a la técnica húmeda, su superioridad teórica se basa en un modelo de fluido computacional tridimensional dinámico, que ha sugerido que debido a que el agua es un fluido menos compresible que el aire, una aguja llena de agua es superior a una aguja llena de aire, ya que permite una aspiración más rápida del material en el extremo distal de la aguja 17. Los resultados de nuestro estudio evidencian que la muestras obtenidas con la técnica húmeda fueron suficientes para obtener un diagnóstico patológico en el 85,2% para la técnica húmeda y el 71% para la técnica estándar, con un aumento en el rendimiento del 14,2% respecto a la técnica húmeda. Estos resultados se correlacionan con lo encontrado por Attam y colaboradores, que compararon la técnica de succión húmeda con la técnica seca en un total 117 pacientes y mostraron que la técnica de succión húmeda aumentó significativamente la adquisición de tejido con mejor rendimiento diagnóstico, el cual fue calculado de 85,5% versus 75,2% (P <0,035); sin embargo, no hubo diferencia en la cantidad de contaminación sanguínea entre las 2 técnicas 19.
Otro estudio piloto realizado por Berzosa y colaboradores en 15 pacientes con lesiones sólidas, en el que se comparó las técnicas de aspiración húmeda, híbrida y seca de USE-PAF, en donde el objetivo fue determinar la muestra adecuada para proporcionar un diagnóstico patológico final, así como el volumen de material aspirado y el rendimiento diagnóstico (maligno o no maligno) para cada técnica (47). No se encontraron diferencias significativas entre las técnicas híbridas, húmedas y secas (87%, 87% y 67%, respectivamente), sin embargo, esta diferencia tal vez no fue detectada en este estudio piloto dada su poca potencia estadística 17.
Aunque aún no se conoce la causa exacta por la que la técnica húmeda proporciona una mayor celularidad en las muestras obtenidas, existen diferentes teorías, algunas de ellas basadas en modelos computacionales que muestran que una aguja llena de agua es superior a una aguja llena de aire, ya que permite una aspiración más rápida del material en el extremo distal de la aguja, como ya habíamos anotado, lo que permite una mejor transmisión de la succión aplicada, en comparación con una columna de aire dentro de la aguja. La solución salina puede recubrir el revestimiento interno de la aguja, por tanto, cambiar las propiedades de la superficie, lo que facilita el movimiento del aspirado hacia la aguja. Además, la columna de solución salina puede actuar como un estilete, lo que reduce potencialmente la contaminación del tejido durante la punción en una lesión y mantiene la aguja desatascada 17,18,47.
Adicionalmente, la técnica húmeda permite un cambio en las propiedades de la superficie interna de la aguja hueca cuando está recubierta con solución salina normal, lo que puede reducir la fricción entre el aspirado de tejido y la pared de la aguja, esto permite un movimiento más suave del material dentro del canal de la aguja 17. Dadas las condiciones en las que se realizó este estudio, consideramos que la principal limitante es la ausencia de la evaluación rápida en la sala de endoscopia por un citopatólogo, sin embargo, consideramos que en la mayoría de los centros de endoscopia en Colombia no es factible, esto, como ya fue anotado, puede conducir a un aumento en el número de muestras inadecuadas, por tanto, puede afectar el rendimiento diagnóstico 48. Otra limitante es que el tamaño de la muestra es pequeño, aunque este es mucho mayor que el estudio de Barsa y colaboradores. También, sería importante que se hubiera medido el volumen de material en cada grupo, sin embargo, nuestro objetivo era la sensibilidad en el diagnóstico.
Conclusión
Los hallazgos previamente descritos sugieren que la técnica húmeda híbrida aumenta la celularidad significativamente en las muestras obtenidas de lesiones sólidas del páncreas cuando se compara con la técnica convencional, siendo una técnica de fácil aplicación en el contexto de la ausencia de un citopatólogo en la sala de endoscopia. Además, la implementación de esta técnica no implica un costo adicional y, dado que este trabajo y otro internacional (más pequeño) sugieren esta superioridad, debería ser la técnica de elección cuando se punciona una lesión sólida del páncreas.











 texto en
texto en