Introducción
Los pacientes hospitalizados en la unidad de cuidados intensivos (UCI) tienen mayor riesgo de hemorragia digestiva alta (HVDA), especialmente por úlceras de estrés 1,2. Su aparición se asocia con resultados adversos, que incluyen aumento de la mortalidad (2 a 4 veces) y una mayor estancia en la UCI (4 a 8 días más) 3,4. La incidencia del sangrado gastrointestinal en la UCI varía de 0,17% a 7,0% 3,5. La endoscopia de las vías digestivas altas (EVDA) es el examen de elección para los pacientes con HVDA, incluidos los de UCI, y es tanto diagnóstico (examen macroscópico de las lesiones, toma de biopsias) como terapéutico (hemostasia con diferentes modalidades) 5,6. Su desempeño está bien demostrado en pacientes con HVDA 7,8,9,10. Sin embargo, frecuentemente también se realiza en pacientes admitidos a la UCI por otros motivos; en estos casos, las indicaciones son mucho más debatidas; además, el descubrimiento de una lesión de la mucosa puede no requerir ningún tratamiento endoscópico ni farmacológico (gastritis, esofagitis, entre otros) 5,7,11,12.
Dentro de las causas de HVDA en pacientes de la UCI están las várices esofágicas o gástricas, esofagitis, úlceras y gastritis erosivas hemorrágicas relacionadas con el estrés 13. Se ha estimado que hasta el 90% de los pacientes críticos puede presentar daño de la mucosa gastroduodenal después de 3 días de hospitalización en UCI y ese daño puede progresar a úlceras y producir sangrado, así como también sangrado por gastritis erosiva 14. Sin embargo, el sangrado clínicamente importante ocurre en solo 2% a 3% y las úlceras por estrés se identifican endoscópicamente como la fuente del sangrado en menos del 50% de esos pacientes 4,15,16. Estos datos han planteado la discusión sobre la necesidad real de la EVDA, teniendo en cuenta los costos y el impacto real que tendría su utilización indiscriminada en ese tipo de pacientes, más aún porque solo un pequeño porcentaje progresa hacia un sangrado gastrointestinal manifiesto y clínicamente importante 17.
Otras afecciones menos comunes responsables del sangrado alto son el síndrome de Mallory-Weiss y las lesiones vasculares 13. Los principales factores de riesgo identificados para VDA en UCI incluyen ventilación mecánica por más de 48 horas, coagulopatía activa, enfermedad hepática y renal 5,18,19. Otros factores de riesgo son el choque, falla hepática y renal, sepsis, trauma múltiple, quemaduras de más del 35% de la superficie corporal, trasplante de órganos, trauma de cráneo o raquimedular, antecedente de enfermedad ulcerosa previa e hipoalbuminemia 20-24.
En nuestro medio no encontramos publicaciones sobre la prevalencia de las diferentes lesiones sangrantes del tracto digestivo superior en pacientes hospitalizados en la UCI, como tampoco la frecuencia de hemostasia endoscópica en ellos. Teniendo en cuenta la escasa información disponible se decidió realizar el presente trabajo en la Unidad de Gastroenterología de la Clínica Fundadores de Bogotá, identificando los pacientes con HDA de la UCI a quienes se les hubiera realizada EVDA.
Materiales y métodos
El presente es un estudio de corte transversal basado en los hallazgos de EVDA de pacientes de la UCI de la Clínica Fundadores, que requirieron el procedimiento por HVDA. Se incluyeron los pacientes adultos mayores de 18 años, atendidos durante el período comprendido entre el 1 de enero 2003 al 31 de diciembre del 2017.
Criterios de inclusión
Se incluyeron pacientes hospitalizados en UCI por enfermedades críticas, quienes presentaron HVDA después de 24 horas de hospitalización y se les realizó EVDA.
Criterios de exclusión
Pacientes de UCI a quienes se les hubiera realizado EVDA por indicación diferente a HVDA. También se excluyeron los pacientes con EVDA incompleta, los hospitalizados en la unidad de cuidados intermedios y mujeres embarazadas. No se incluyeron quienes estaban hospitalizados en UCI por HVDA severa.
La información fue obtenida de los informes de EVDA de la unidad de gastroenterología correspondiente a la UCI y la revisión de la respectiva historia clínica de los pacientes identificados. Las diferentes variables de cada paciente fueron registradas y consignadas en un instrumento de recolección de datos elaborado para la presente investigación. Debido a que solo se incluían pacientes con EVDA se desconoce el número de pacientes que existieron durante el período de estudio en UCI con HVDA a los que no se les realizó endoscopia.
Objetivo general
Determinar el requerimiento de hemostasia endoscópica en pacientes en la unidad de cuidado intensivo con hemorragia de vías digestivas altas.
Análisis estadístico
Las variables cualitativas se presentaron en forma de números absolutos y proporciones, específicamente se calculó la prevalencia de la siguiente forma: prevalencia = (número de pacientes con el hallazgo endoscópico/total de la población recogida) x 100. La prevalencia se estratificó por los distintos grupos etarios. Finalmente, las variables cuantitativas se presentaron en forma de medida de resumen y dispersión según su distribución estadística, la cual fue evaluada mediante la prueba de Shapiro-Wilk. Se consideró una significancia estadística cuando el valor de p era menor de 0,05.
Resultados
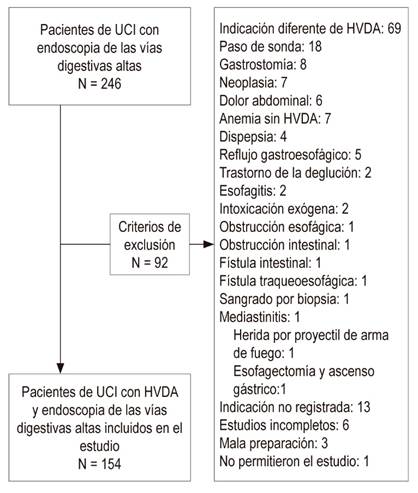
Durante el período de estudio se practicaron 246 EVDA a paciente de la UCI. Se excluyeron 92 (69 por indicación diferente a sangrado de vías digestivas altas (18 para paso de sonda nasoentérica, 8 para gastrostomía endoscópica, 7 por neoplasia, 6 por dolor abdominal, 4 por anemia, 4 por dispepsia, 3 por cirrosis conocida, 3 por varices esofágicas, 2 por reflujo gastroesofágico, 2 por trastorno de la deglución, 2 por esofagitis, 2 por intoxicación exógena, 1 por obstrucción esofágica, 1 por obstrucción intestinal, 1 por fístula intestinal, 1 por fístula traqueoesofágica, 1 por sangrado por biopsia, 1 por mediastinitis, 1 por herida por proyectil de arma de fuego, 1 por esofagectomía y ascenso gástrico), 13 por indicación no registrada, 6 estudios incompletos, 3 por preparación inadecuada y 1 paciente que no permitió la realización del examen; finalmente se incluyeron 154 EVDA (Figura 1); hubo 99 hombres (64,29%) y 55 mujeres (35,71%), con una mediana de edad de 68 años, la mitad de ellos entre 59 y 76 años.
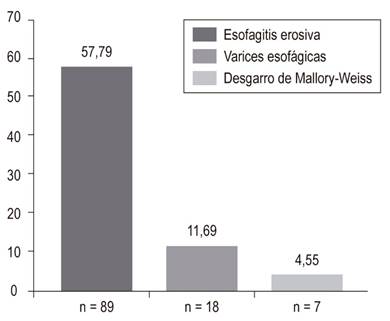
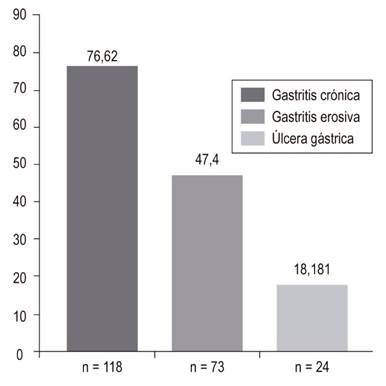
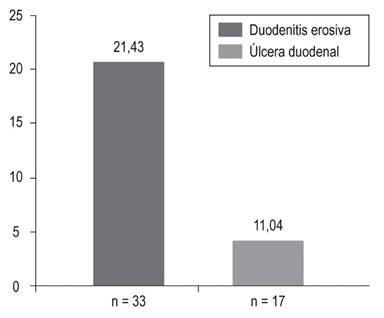
Los hallazgos en la EVDA a nivel del esófago, estómago y duodeno se muestran en las Figuras 2,3y4, respectivamente.
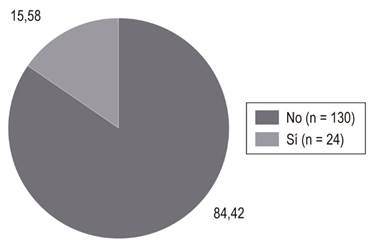
Algún tratamiento endoscópico de las diferentes lesiones se realizó en 24 pacientes (15,58%) y no fue necesario en los restantes 130 pacientes (84,4%) (Figura 5). Dentro de los diagnósticos registrados en las historias clínicas para hallazgo de varices esofágicas, la principal patología fue la cirrosis Child Pugh C con encefalopatía, siendo en su mayoría secundaria a diabetes mellitus y alcohol. Sin embargo, para el resto de los hallazgos se presenta información ambivalente debido al gran número de patologías y comorbilidades con las que cursan los pacientes críticos (sepsis, choque, falla cardíaca, insuficiencia renal, falla respiratoria, coagulopatía, entre otras).
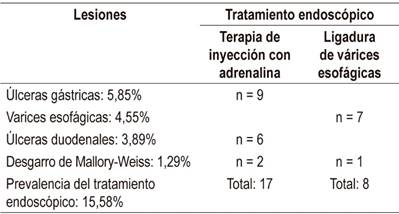
Las diferentes modalidades endoscópicas terapéuticas utilizadas se muestran en la Tabla 1. En todos los pacientes se logró hemostasia de las lesiones sangrantes.
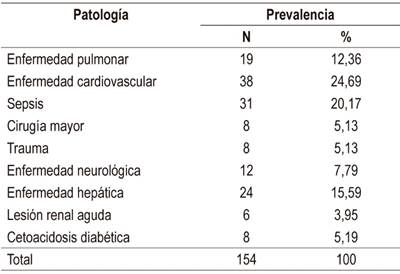
La prevalencia de las principales patologías responsables del ingreso a UCI se muestra en la Tabla 2.
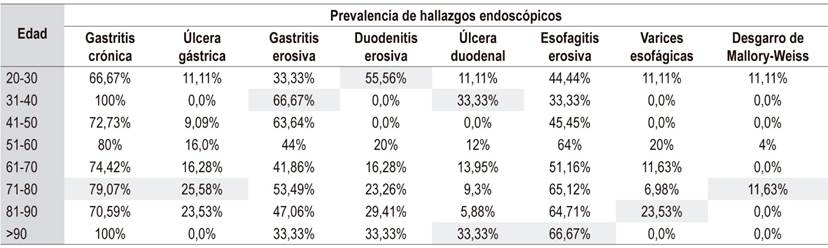
La prevalencia de ventilación mecánica fue del 20% (n = 30) y la profilaxis con inhibidores de bomba de protones (IBP) fue del 32% (n = 49). La distribución de las lesiones por grupo etario se muestra en la Tabla 3.
Discusión
En el presente estudio, el 15% de los pacientes con HVDA hospitalizados en UCI requirió tratamiento endoscópico. La necesidad de EVDA terapéutica encontrada es similar a un estudio de la Universidad de Pensilvania en el que se estudiaron 66 pacientes de la UCI, y 15% ameritó terapia endoscópica hemostática 25. Otro estudio realizado por Kim y colaboradores en la Universidad de Seúl en 66 pacientes encontró una prevalencia para manejo endoscópico del sangrado en un 19% 26.
La endoscopia de vías digestivas altas en pacientes críticos con hemorragia digestiva es frecuentemente solicitada tanto para fines diagnósticos como terapéuticos; sin embargo, distintas lesiones de la mucosa identificadas por este medio no requieren ningún tratamiento endoscópico, lo que aumenta los costos derivados de la atención del paciente y la probabilidad de complicaciones 7,27. En general, estos pacientes mueren a causa de la gravedad de la condición médica subyacente o por disfunción multiorgánica más que por causa del sangrado 28.
Lee y colaboradores realizaron un estudio prospectivo en 105 pacientes de unidad de cuidado crítico con sangrado gastrointestinal y encontraron una prevalencia para enfermedad erosiva del 21,9% 11. En nuestro estudio, la gastritis erosiva presentó una prevalencia del 47,4% (n = 73), sin embargo, ninguna de estas lesiones requirió tratamiento endoscópico. Por lo anterior, la relevancia clínica de estas lesiones es controvertida, ya que solo un pequeño porcentaje progresa hacia un sangrado gastrointestinal manifiesto y clínicamente importante 17,22.
A nivel esofágico, el hallazgo más frecuente fue la esofagitis erosiva, la cual la presentó más de la mitad de los pacientes (59%), superior a lo publicado previamente 25,29,30,31. Este hallazgo demuestra nuevamente que en la mayoría de las EVDA de pacientes de UCI con HVDA se encontrarán lesiones que no ameritan endoscopia terapéutica, por tanto, no habrá un impacto en el manejo de los pacientes 7. El desgarro de Mallory-Weiss (DMW) se presentó en 8 pacientes (4,55%). En ninguno de estos pacientes se necesitó terapia endoscópica. El DMW está relacionado con el aumento súbito de la presión intragástrica o intraabdominal, que se trasmite a la unión esofagogástrica 32. Los factores de riesgo incluyen náuseas severas, vómito, hipotrauma abdominal cerrado, resucitación cardiopulmonar, tos, gritos, barotrauma y convulsiones; en nuestra serie fueron menos frecuentes que en otras publicaciones (8%) y los múltiples factores predisponentes explicarían esa diferencia 10,33. No obstante, sería importante disminuir al máximo los factores relacionados, ya que el DMW puede profundizarse y producir ruptura transmural, lo que conduce al síndrome de Boeerhäve 34.
La prevalencia encontrada en este estudio para úlcera gástrica fue del 18,18% (n = 28). En Eslovenia, Skok y colaboradores en el año 2005, en un estudio de cohorte prospectivo en 486 pacientes, encontraron una prevalencia de úlcera gástrica en 84 pacientes, con una prevalencia del 17,3% 35. Sin embargo, el requerimiento de tratamiento endoscópico por úlcera gástrica en nuestra población fue solo del 5,8% (9 pacientes). Un estudio francés observacional retrospectivo entre 2007 a 2012 en 88 pacientes, que evaluó el impacto clínico de la EVDA en pacientes críticos con sospecha de sangrado, encontró que solo el 3,5% de los pacientes requirió manejo endoscópico para úlcera gástrica 7. Estos resultados son importantes, ya que la EVDA es un procedimiento relativamente costoso, que no está exento de riesgos, todo lo cual se incrementaría al utilizarlo en forma generalizada 35.
En nuestro estudio entre pacientes con HVDA que requirieron terapia endoscópica, las causas no varicosas fueron el doble que las varicosas (11,03% vs. 4,55%), similar a otros estudios 36. Hubo 17 pacientes con úlcera duodenal (11,04%), el cual es la mitad de lo informado en la literatura 29. Desconocemos la razón de la discrepancia, pero pudiera estar relacionado con la prevalencia de Helicobacter pylori (H. pylori), la frecuencia de utilización de IBP profiláctico y el tipo de patología crítica de los pacientes, especialmente ventilación mecánica, coagulopatías activas, enfermedad hepática y enfermedad renal. En nuestro estudio, muchos pacientes tenían las patologías predisponentes mencionadas y la utilización de IBP profilácticos fue del 32% de los pacientes. Los IBP profilácticos han demostrado que disminuyen significativamente los sangrados clínicamente importantes comparados con el placebo (2,5% vs. 4,2%) y son recomendados en esas circunstancias 2,37.
Muchos médicos aún tienen temor a utilizar los IBP de manera profiláctica por los riesgos teóricos sobre posibles efectos adversos, como neumonía, isquemia miocárdica, C. difficile, entre otros 15. Sin embargo, la evidencia que soporta estas afirmaciones es muy débil y hasta el momento solo se ha establecido asociación y no causalidad 38. En nuestro estudio, la duodenitis erosiva fue superior a lo informado en la literatura (21,43% vs. 6%), sin embargo, no se identificó sangrado activo con esa patología en nuestros pacientes 29,34.
El presente estudio tiene limitaciones, tales como ser retrospectivo y, debido a las múltiples patologías concomitantes y diagnósticos cambiantes, no fue fácil determinar los factores de riesgo que predisponen a sangrados altos, que ameritarían tratamiento endoscópico y así evitar el 85% de EVDA innecesarias.
En conclusión, el 15% de los pacientes necesitó terapia endoscópica en los pacientes con HVDA de cuidados intensivos. Se necesitan trabajos prospectivos, de preferencia multicéntricos, que permitan identificar los factores de riesgo que puedan predecir la necesidad de EVDA terapéutica en pacientes con HVDA. En los pacientes que no tengan esos predictores se recomendaría tratarlos empíricamente con IBP y evitar gastos innecesarios en EVDA diagnósticas. Hasta el momento, en la literatura publicada se han identificado los pacientes con riesgo de HVDA hospitalizados en UCI, pero no los que, teniendo sangrado, podrían necesitar una EVDA terapéutica.











 texto en
texto en