Introducción
La alergia a la proteína de la leche de vaca (APLV) es una condición clínica de origen inmunológico, que inicia a temprana edad y constituye la forma de alergia alimentaria más frecuente en los primeros meses de vida, incluso en niños de edad preescolar. Durante el primer año de vida, la proteína de la leche de vaca (PLV) suele ser el primer antígeno al cual se enfrentan los niños alimentados con leche materna o con fórmulas para lactantes 1,2.
Así, la APLV se ha convertido en un importante problema de salud, debido a sus manifestaciones clínicas y a sus consecuencias. Es probable que la APLV pueda estar asociada al desarrollo de otro tipo de alergias como asma, dermatitis atópica y rinitis 1,2.
La información sobre la incidencia y la prevalencia de la APLV es difícil de establecer, validar y comparar, dados los múltiples factores como un reducido número de estudios epidemiológicos, las deficiencias o inconsistencias en el diseño de los estudios, la falta de estandarización en el método de diagnóstico (autorreporte, prueba de reto, niveles de inmunoglobulina E [IgE] específica, prueba de punción, entre otros) y datos reportados principalmente con relación a las reacciones rápidas (se desconoce lo acontecido con reacciones de hipersensibilidad tardía).
Además, gran parte de los datos disponibles se relacionan con alergia a otros alimentos más que a la PLV. En efecto, los reportes resultantes de encuestas (autorreporte) pueden corresponder a diagnósticos errados (intolerancia) o a niños a quienes no les gustan ciertos alimentos, y, finalmente, las manifestaciones de la APLV no necesariamente son gastrointestinales.
De acuerdo con el estudio europeo EuroPrevall, la incidencia de la APLV es de 1-4 %, pero disminuye al 1-2 % cuando se hacen estudios más específicos 3. En Estados Unidos de América, se publicaron revisiones en 2007 y 2010 en las cuales se reporta una prevalencia de APLV del 3 %, según una encuesta. Dichos resultados no corresponden con los de estudios específicos como la prueba de punción o el reto a la PLV, en los que la prevalencia ha oscilado entre el 0,6 y el 1 %. En general, la prevalencia podría ser, aproximadamente, del 1 % 4,5.
Entre tanto, los reportes específicos de la APLV en Latinoamérica son escasos. De acuerdo con cifras reportadas por Ávila Castañón y colaboradores, la prevalencia de alergia a la leche (prueba de punción) en pacientes del Hospital Infantil de México es de 7,7 %. En Chile, Martínez reportó cifras de prevalencia de APLV que oscilaron entre el 2,5 y el 7,1 % (prueba de punción). Se debe considerar que la prevalencia depende del tipo de estudio realizado (encuesta, prueba de punción, IgE específica, prueba de radioalergoabsorbencia [Radio Allergo Sorbent Test, RAST]) 6,7.
La información epidemiológica sobre la APLV en Colombia es escasa. De acuerdo con los resultados publicados por Marrugo (encuesta), la prevalencia de la APLV en niños entre 1 y 8 años es del 2,5 %, mientras que entre los 9 y 16 años es del 11,1 % 8. Según la publicación de Acevedo, la prevalencia de APLV en niños <2 años es del 1,8 % 9. Los resultados de estos estudios, sin embargo, no se pueden considerar concluyentes en cuanto a su representatividad de la población colombiana en general 8-12.
Las manifestaciones gastrointestinales de la APLV no son específicas y pueden confundirse con las de la enfermedad por reflujo gastroesofágico (ERGE), los trastornos gastrointestinales funcionales, la intolerancia a la lactosa o las reacciones a alimentos de origen no alérgico. Este escenario da como consecuencia una alta probabilidad de sobre o subdiagnóstico.
En consecuencia, es un reto para el médico hacer un diagnóstico temprano y correcto de la APLV, así como establecer un manejo oportuno y apropiado de la enfermedad, con el fin de mejorar el pronóstico de los pacientes y de minimizar la carga de esta. En respuesta a estas situaciones, un grupo de médicos con experiencia y conocimiento en el campo de la APLV decidieron reunirse y desarrollar un documento de posición. Con ello apuntan a proponer un enfoque práctico sobre la definición, el diagnóstico y el tratamiento de la APLV en el paciente pediátrico.
Materiales y métodos
Las recomendaciones de este documento se basan en la revisión de la literatura científica de mejor calidad disponible sobre la APLV y en la experiencia de un grupo de médicos especialistas en diversas áreas de la pediatría (alergólogos, gastroenterólogos, nutriólogos y epidemiólogos clínicos), procedentes de diferentes regiones de Colombia. Posterior a la revisión de la literatura, se realizó una reunión para discutir las recomendaciones hasta lograr un acuerdo.
Recomendaciones
Definiciones
Atopia: es la predisposición genética del individuo a producir cantidades elevadas de IgE ante antígenos específicos 1,13.
Intolerancia alimentaria: es una reacción adversa a un alimento, no relacionada con un mecanismo inmunológico. Un ejemplo de ello es la intolerancia a la lactosa, que no es mediada inmunológicamente, sino provocada por la deficiencia funcional de la enzima lactasa (β-galactosidasa), que ocasiona la absorción incompleta de la lactosa 1,13.
Alergia: es una reacción de hipersensibilidad mediada por mecanismos inmunológicos específicos. En la mayoría de los niños, esta condición es mediada por la IgE, con la expresión fenotípica de atopia, con o sin eccema atópico, rinitis alérgica o asma. Otros niños presentan manifestaciones gastrointestinales no mediadas por la IgE (mediadas por células), frecuentes en los síntomas de la enfermedad 14.
Alergia a la proteína de la leche de vaca (APLV): es una reacción de hipersensibilidad mediada por mecanismos inmunológicos específicos y reproducibles, que causa manifestaciones clínicas adversas. La reacción inmune puede ser mediada por la IgE, no mediada por la IgE o mixta. Se trata de una alergia a epítopos de origen proteico 1,13,14.
Diagnóstico clínico
Factores de riesgo
Entre los factores de riesgo asociados con la aparición de la APLV se incluyen madre fumadora, padres y hermanos atópicos; nacimiento por cesárea; inicio de fórmula láctea en los primeros días de vida; lactancia por menos de 3 meses; madre con más de 30 años; prematuridad, e hiperbilirrubinemia 1,15-20 (Tabla 1).
Manifestaciones clínicas
Las manifestaciones clínicas de la APLV se pueden presentar en cualquier edad. Por tanto, los siguientes factores deben ser investigados en pacientes con sospecha de APLV 1,14,21:
Síntomas inmediatos mediados por IgE
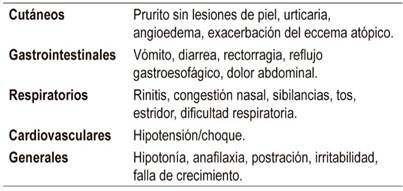
Son síntomas cuya severidad puede ir de leve a grave y que se desarrollan en los minutos siguientes a la exposición al alérgeno. Además, comprometen la piel (urticaria, angioedema), el tracto gastrointestinal (vómito, enterocolitis), el sistema respiratorio (sibilancias, estridor, disnea) y el sistema cardiovascular (Tabla 2). En lactantes pequeños, los síntomas pueden ser inespecíficos, como palidez y adinamia 22,23,24.
Asimismo, la anafilaxia es uno de los síntomas inmediatos y se define como una reacción alérgica grave sistémica o generalizada. Esta se constituye en la manifestación más crítica de la APLV inmediata, la cual causa una mortalidad cercana al 10 % 1,25,26,27.
Síntomas tardíos no mediados por IgE o mixtos
Se presentan varias horas o días después de la ingesta del alérgeno (Tabla 3). Estos síntomas comprometen predominantemente el tracto gastrointestinal, pero casi siempre son múltiples 2,14,19,28,29.
Tabla 3 Síntomas tardíos no mediados por IgE o mixtos

Modificada de las referencias 2, 14, 19, 28 y 29
Entre los síntomas gastrointestinales tardíos más comunes se pueden mencionar vómito, irritabilidad (cólico), disfagia, diarrea, estreñimiento, falla del crecimiento y rectorragia.
Además de la sintomatología, el diagnóstico clínico puede hacerse por medio de la eliminación de alimentos (leche y sus derivados o cualquier alimento que contenga ingredientes lácteos) y provocación (protocolos de reto/desafío alimentario, doble ciego controlado con placebo, que son considerados el tratamiento de referencia). Así pues, el tratamiento de referencia del diagnóstico clínico es la eliminación de la PLV durante 2-4 semanas y la reintroducción de la PLV en forma de reto/desafío abierto o reto/desafío ciego (reto/desafío diagnóstico) 18,20.
Diagnóstico diferencial
Es importante considerar otras entidades que podrían confundirse con APLV, como la intolerancia a la lactosa, la acidosis tubular renal, la hipertrofia pilórica, la fibrosis quística o enterocolitis, la enfermedad por reflujo gastroesofágico, entre otras condiciones.
Recomendaciones
Es fundamental elaborar una historia clínica que incluya la determinación de factores de riesgo para APLV y que permita establecer un diagnóstico temprano.
Antes de diagnosticar una nueva alergia o una alergia múltiple, se debe pensar que el paciente puede estar expuesto a la ingesta de derivados ocultos de la leche o a trazas en los alimentos.
La mayoría de los síntomas alérgicos inducidos por la leche se desarrollan en minutos u horas después de la ingesta, excepto en las alergias gastrointestinales.
La APLV, clásicamente, presenta signos y síntomas en la piel, el tracto gastrointestinal y el tracto respiratorio.
Se debe realizar un diagnóstico diferencial de la APLV.
Los cambios de la microbiota intestinal son responsables, en parte, del aumento de la presencia de enfermedades alérgicas. Lo ideal sería entonces mejorar la microbiota intestinal desde el inicio (procurando un parto vaginal, el inicio de leche materna en la primera hora de vida y evitando el uso indiscriminado de antibióticos), con el fin de disminuir el riesgo de aparición de estos cuadros 30,31.
Diagnóstico: laboratorio clínico y pruebas inmunológicas
El manejo de cada paciente debe ser individualizado, a partir de la realización de diferentes recursos diagnósticos.
Pruebas diagnósticas
Prueba de provocación oral alimentaria: el tratamiento de referencia para el diagnóstico de la APLV es la prueba de exposición que debe ser realizada por el médico especialista (gastroenterólogo o alergólogo). No se recomienda efectuar pruebas de reto/desafío, si no se dispone de la experiencia y el conocimiento necesarios para garantizar la seguridad del paciente. Las pruebas de provocación oral con leche de vaca son diagnósticas in vivo, desplegadas para confirmar definitivamente una sospecha preliminar de la APLV.
Una prueba que deriva en una reacción clínica se define como positiva o provocación fallida, mientras que una sin reacción clínica se denomina provocación negativa o aprobada. Así, una provocación positiva indicará la dosis tolerada, si la hay, y permitirá la planificación de dietas de exclusión parcial o completa de PLV 14,18,20.
Exámenes paraclínicos básicos: cuadro hemático, frotis de sangre periférica, ferritina, proteínas totales y diferenciales.
Valoración nutricional: todo paciente requiere una evaluación nutricional completa para detectar el riesgo nutricional de ingesta de alérgenos.
Prueba intraepidérmica: tiene una alta sensibilidad, así como un alto valor predictivo negativo, pero baja especificidad. Confirma la sensibilización, pero no es diagnóstica de APLV.
Niveles de IgE específicos: se ha establecido, específicamente, para leche de vaca un punto de corte >5 KU/L en <1 año y >15 KU/L en >1 año, con probabilidad del 95 % en una prueba de exposición oral positiva 14.
Prueba dérmica de sensibilización: no se recomienda su uso en pacientes con una alergia alimentaria especialmente mediada por la IgE 14.
Recomendaciones
La mayoría de los pacientes vistos en la consulta pediátrica presentan procesos no mediados por la IgE y no requieren de pruebas inmunológicas diagnósticas.
En pacientes con sospecha de APLV, con cuadro clínico compatible de reacciones mediadas por la IgE o mixtas, y en pacientes con manifestaciones no mediadas por la IgE, pero que no responden al tratamiento, se solicitan las siguientes pruebas: IgE específica (prueba RAST o ImmunoCAP) y prueba de punción para leche de vaca. Luego de ello, se remite el paciente al especialista (gastroenterólogo o alergólogo pediatra).
No se recomienda evaluar la IgE sérica total en estos pacientes.
Las reacciones tardías no tienen pruebas diagnósticas convencionales. El diagnóstico es clínico por exclusión y por provocación.
Si un paciente presenta una respuesta negativa a las pruebas inmunológicas, esto no descarta un proceso no mediado por la IgE.
Diagnóstico por endoscopia digestiva
El principal factor que se debe considerar para solicitar una evaluación endoscópica del paciente con APLV es su sintomatología (independientemente de la edad) y la sospecha de esofagitis eosinofílica, o los pacientes con proctocolitis alérgica que presentan anemia y que persisten con manifestaciones no sólo de sangrado sino distensión abdominal y vómito persistente, las cuales pueden tener un componente mixto 32,33,34.
Indicaciones de la endoscopia digestiva alta y baja en APLV
La realización de pruebas endoscópicas en un paciente con diagnóstico de APLV no es una práctica común en este grupo de enfermedades, dado que el diagnóstico es clínico. Por tanto, la decisión de efectuar estas pruebas se basa en criterios clínicos bien definidos, según las características del paciente, su estado nutricional, pruebas de laboratorio y las manifestaciones clínicas evidentes. Las indicaciones de endoscopia digestiva se pueden observar en la Tabla 4 35,36.
Tabla 4 Indicaciones de la endoscopia digestiva

FPIES: síndrome de enterocolitis inducida por proteínas alimentarias (Food Protein-Induced Enterocolitis Syndrome). Modificada de las referencias 35 y 36.
De otro lado, en los pacientes con procesos no mediados por la IgE, las indicaciones para remitirlos al especialista, quien considerará la realización de una endoscopia se pueden observar en la Tabla 5.
Hallazgos endoscópicos sugestivos de APLV
Los hallazgos endoscópicos son inespecíficos y en diversas ocasiones no ayudan al diagnóstico de la proctocolitis inducida por la APLV. Entre los hallazgos endoscópicos sugestivos de alergia, principalmente cuando se sospecha de una esofagitis eosinofílica, se incluyen surcos lineales (33-48 %), anillos circulares (44-55 %), alteración del patrón vascular (41 %), pápulas blanquecinas (27 %), estenosis parciales (10-39 %) y estenosis completas (9 %).
La endoscopia puede ser normal en el 7-32 % de los casos. Aunque los hallazgos endoscópicos sean normales, se deben tomar biopsias proximales y distales del esófago; de antro y cuerpo en el estómago, el duodeno y el bulbo, y en el colon de íleon, ciego y todos los cuadrantes para efectuar el estudio de gastroenteropatía eosinofílica, enfermedad celíaca, presencia de Helicobacter pylori, entre otras 32,33,34.
Recomendaciones
Se sugiere que los procedimientos endoscópicos sean realizados por gastroenterólogos pediatras experimentados.
Se recomienda la toma de biopsias de esófago, estómago, bulbo, duodeno, íleon, ciego y los cuadrantes del colon, y que se solicite un recuento de eosinófilos por campo y la clasificación de Marsh para la enfermedad celíaca.
Manejo nutricional
Conceptos básicos
El manejo nutricional del paciente debe ser individualizado y se requiere de un equipo multidisciplinario que incluya a un profesional en nutrición experto en el abordaje de la APLV.
De acuerdo con las recomendaciones de las guías de acción contra la alergia a la leche de vaca (Diagnosis and Rationale for Action against Cow’s Milk Allergy, DRACMA) es necesario considerar los siguientes aspectos 14:
Se debe realizar una estricta vigilancia nutricional durante el proceso.
Se recomienda una dieta de eliminación de mínimo 6 meses (<1 año).
La dieta de eliminación debe ser estricta, efectiva y completa. Se requiere evitar la inhalación y el contacto de la piel con productos o trazas que contengan PLV.
Todas las dietas de eliminación deben ser nutricionalmente seguras. Es necesario evitar restricciones de macro y micronutrientes. Nunca se deben restringir otros tipos de alimentos si el diagnóstico es de APLV (huevo y pescado, entre otros).
Objetivos del manejo nutricional
El objetivo del manejo nutricional en los pacientes con APLV es mantener un adecuado estado nutricional, a fin de garantizar el crecimiento y el desarrollo del niño 37,38.
Fórmulas
A continuación, se describen algunos factores que deben considerarse a la hora de elegir una fórmula para el manejo nutricional de los pacientes con APLV 37,39 (Tabla 6).
Fórmulas hipoalergénicas
Estas cumplen el criterio definido de 90 % de tolerancia clínica (intervalo de confianza [IC], 95 %) en niños con alergia comprobada a la PLV. Se incluyen en las fórmulas hipoalergénicas las fórmulas extensamente hidrolizadas (FEH) y las fórmulas de aminoácidos libres (FAA) (Tabla 7).
Tabla 7 Fórmulas hipoalergénicas

APLV: alergia a la proteína de la leche de vaca; DRACMA: acción contra la alergia a la leche de vaca (Diagnosis and Rationale for Action against Cow’s Milk Allergy); IgE: inmunoglobulina E; FPIES: síndrome de enterocolitis inducida por proteínas alimentarias (Food Protein-Induced Enterocolitis Syndrome)
Reto o desafío terapéutico
Se recomienda realizar el primer reto/desafío entre los primeros 6 meses y 1 año después del diagnóstico, en pacientes con síntomas leves.
En caso de anafilaxia, el reto/desafío se realiza, como mínimo, 1 año después del episodio, bajo monitorización y vigilancia, preferiblemente en un centro hospitalario. Dicho reto lo determina el especialista competente.
No es conveniente realizar el reto/desafío al mismo tiempo que se inicia la alimentación complementaria en el niño (6 meses de edad), pues si se presentan síntomas no se puede definir si son por causa de la alimentación complementaria o del reto/desafío.
Recomendaciones en el embarazo y la lactancia materna exclusiva
No existe evidencia del beneficio en la restricción de alérgenos a la madre durante el embarazo, como métodos de prevención de la aparición de una APLV. Se debe evitar la restricción alimentaria a la madre durante la gestación y apuntar a una dieta adecuada, variada y balanceada que mantenga el peso recomendado.
La lactancia exclusiva se asocia a múltiples beneficios y no se recomienda restringir la PLV a las madres como una forma de prevención. La lactancia es ideal de forma exclusiva hasta los 6 meses de edad, y de forma complementaria hasta los 24 meses o hasta que la madre o el hijo lo decidan.
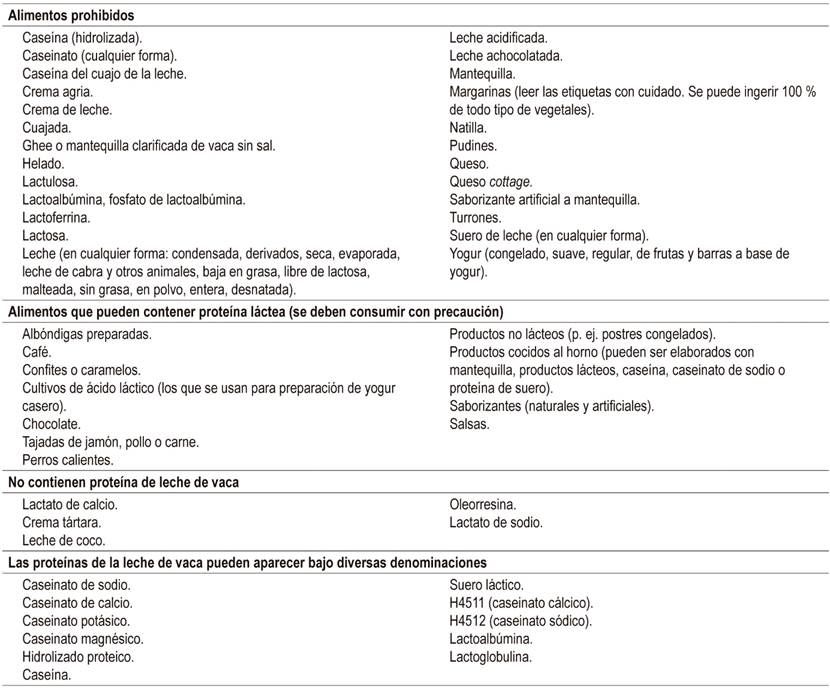
En pacientes con APLV, se requiere la estricta eliminación de la PLV de la dieta de la madre y del lactante. Se indica a la madre una dieta de eliminación de toda fuente de proteína láctea y se deben dar suplementos de calcio. Asimismo, se requiere informar a los padres y los cuidadores sobre las vías de sensibilización del niño y la revisión cuidadosa de las etiquetas de los productos que puedan tener componentes de proteína láctea (p. ej. cosméticos, jabones, cremas, lociones, pañitos húmedos, salsas, entre otros) (Tabla 8).
Se recomienda motivar a las madres para continuar con la lactancia materna. Las manifestaciones gastrointestinales mejoran a las 2 semanas y las dermatológicas, a las 6 semanas de iniciar la restricción. Estas manifestaciones no constituyen una razón para retirar la lactancia materna. Si no hay mejoría, la madre se debe remitir al especialista antes de suspender la lactancia materna o restringir otros.
La alimentación complementaria se puede introducir entre los 4 y 6 meses de edad. Hay mayor riesgo de alergia si se introducen alimentos sólidos antes de los 4 meses.
No existe evidencia de que retrasar la introducción de alimentos considerados alergénicos (p. ej. huevo, fresas), antes del primer año, reduzca el riesgo de alergia (población general y atópica) 41.
No hay evidencia clara de que las fórmulas parcialmente hidrolizadas y las FEH prevengan algún tipo de alergia ni que sean mejores que la leche materna.
Recomendaciones en niños que no reciben leche materna
Las fórmulas recomendadas en APLV son las FEH y las FAA.
Los niños requieren de suplementación con micronutrientes como el calcio (cuando no se puede garantizar un volumen mínimo de 500 mL de leche materna o de fórmula), el hierro (en sangrado importante o en los pacientes con ferropenia) y la vitamina D (si se demuestra su deficiencia).
Si la APLV persiste después del primer año, se requiere el uso de fórmulas especiales diseñadas para esa edad.
No existe evidencia en Colombia de que las fórmulas llamadas hipoalergénicas (HA) o Confort sirvan para tratar a los pacientes con APLV o para la prevención de esta.
No se recomienda el uso de bebidas elaboradas a base de almendras, arroz, coco y soya, entre otras, dada la alta probabilidad de reacción cruzada y debido a un aporte nutricional insuficiente.
Manejo farmacológico e inmunoterapia
No existe un tratamiento farmacológico específico para el manejo de la APLV. Sin embargo, en los casos de alergia severa mediada por IgE, como la anafilaxia, la adrenalina es el tratamiento de elección.
La vida media de la adrenalina es corta y pueden requerirse varias dosis. En Colombia, su uso es intrahospitalario (no hay autoinyectores). Así, ante la presencia de una reacción anafiláctica se recomienda asistir inmediatamente al servicio de urgencias. Para el manejo de la anafilaxia con adrenalina intrahospitalaria, la dosis recomendada es de 0,15 mg intramuscular, sin diluir, en <25 kg, con jeringa de aguja recambiable 21 corta en tercio medio y lateral de muslo. Repetir la dosis en 10-15 min si no hay respuesta. En >25 kg, la dosis es de 0,3 mg (guía de anafilaxia de la Academia Europea de Alergia e Inmunología Clínica [European Academy of Allergy and Clinical Immunology, EAACI ]) 47,48.
En la última década, se ha investigado sobre otras terapias alternativas para el manejo de la APLV. Entre estas opciones se incluyen la inmunoterapia alérgeno específica, la terapia biológica, la medicina china y el uso de probióticos o prebióticos.
Inmunoterapia
Su objetivo es desensibilizar al paciente, o sea, aumentar el umbral de reactividad a un alérgeno y generar una tolerancia sostenida durante meses o años sin tratamiento adicional. Sin embargo, esta meta no siempre se alcanza y lo deseable es que no haya una reacción severa ante una exposición accidental 49-51 (Tabla 9). El tratamiento implica que el paciente esté recibiendo permanentemente dosis del alérgeno. Los primeros estudios de inmunoterapia en alergia alimentaria se hicieron en alergia al maní. La eficacia global de este tratamiento es del 35 %.
Tabla 9 Tipos de inmunoterapia.
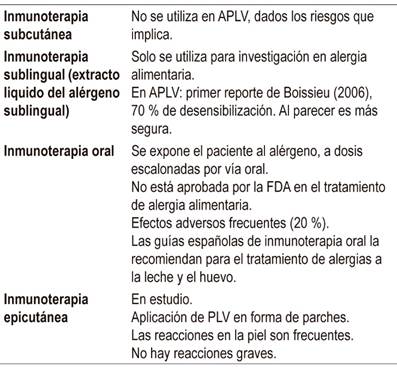
APLV: alergia a la proteína de la leche de vaca; PLV: proteína de la leche de vaca; FDA: Administración de Medicamentos y Alimentos (Food and Drug Administration). Modificada de las referencias 49-51
En síntesis, la inmunoterapia oral es más efectiva, pero presenta mayores eventos adversos, mientras que la epicutánea es menos efectiva, aunque se asocia a una menor aparición de eventos adversos.
Terapia biológica
El omalizumab, el ligelizumab y el quilizumab son terapias biológicas que se encuentran en investigación para el tratamiento de la APLV, principalmente de tipo IgE, y como coadyuvantes de la inmunoterapia 52,53.
Medicina tradicional china
Las fórmulas herbales para el tratamiento de alergias alimentarias (Food Allergy Herbal Formula, [FAHF]) 1 y 2 consisten en una mezcla de hierbas chinas, cuyos ingredientes activos son la berberina y la limonina. Hasta el momento son tratamientos experimentales. En consecuencia, no se recomiendan.
Probióticos y prebióticos
No existe aún evidencia concluyente de que los probióticos y los prebióticos sean eficaces en el tratamiento de la APLV o en la prevención durante el último trimestre de embarazo y los primeros meses. Los datos sugieren que suplementar las fórmulas hidrolizadas con ciertas cepas de probióticos puede tener beneficios en términos de tolerancia oral, principalmente en el eccema atópico. Sin embargo, se requieren investigaciones adicionales para definir la especie, la dosis y los tiempos de terapia. La guía de 2016 de la Organización Mundial de Alergia (World Allergy Organization, WAO) sugiere el uso de probióticos, exclusivamente, en niños no lactados 40,54.
Recomendaciones
La dieta de eliminación sigue siendo el tratamiento de elección para la APLV.
La inmunoterapia es el tratamiento más prometedor en un futuro mediato.
Otras terapias coadyuvantes parecen mejorar la eficacia de la inmunoterapia y disminuir los efectos adversos, sin que exista aún evidencia suficiente para hacer una recomendación.











 texto en
texto en