Introducción
Las biomoléculas glucosamina y condroitina, como componentes naturales del cuerpo humano, son vitales para la estructura del sistema cartilaginoso, pero aplicadas en forma exógena pueden tener efectos tanto favorables, como perjudiciales.
Aunque actualmente en Perú la Dirección General de Medicamentos, Insumos y Drogas (DIGEMID) no justifica su uso para el tratamiento de osteoartritis, dado su alto costo 1, en algunos centros de Estados Unidos y el Reino Unido se ha aprobado su prescripción, en vista de la mayor repercusión de sus efectos beneficiosos 2.
Sin embargo, a pesar de su aparente inocuidad, su uso no está exento de efectos adversos, tales como molestias gastrointestinales, somnolencia, alteraciones dermatológicas, cefalea e incluso puede llegar a producir eventos cardiovasculares 3.
Asimismo, se pueden producir alteraciones bioquímicas como la presentación de una lesión hepática en las formas hepatocelular, colestásica y mixta, con repercusiones tanto clínicas como bioquímicas. En efecto, su uso puede conducir a situaciones extremas como una falla hepática fulminante y la muerte. Estos desenlaces ya han sido reportados en varios casos y algunos de ellos han sido demostrados mediante una biopsia hepática 4-10.
Presentamos el caso de una paciente que tuvo una lesión hepática con patrón hepatocelular, inducida por la glucosamina-condroitina, en un hospital público de Lima (Perú).
Presentación del caso
Paciente mujer de 65 años, natural de Abancay, con antecedente de osteoartritis en la rodilla derecha. Desde hace 1 año, la paciente se encuentra en tratamiento con naproxeno, en forma irregular, mientras que el tratamiento esporádico para el asma crónica se realiza con salbutamol y con el uso reciente de un medicamento comercial basado en glucosamina-condroitina, por 10 días. La paciente niega la ingesta de alcohol y de productos herbáceos, así como antecedentes familiares de importancia.
La mujer acude a emergencia dado que presenta un tiempo de enfermedad de 1 día de evolución, con un cuadro clínico caracterizado por dolor torácico asociado a malestar general y 3 episodios de hemoptisis, en un volumen total aproximado de 300 cm3. Durante el examen físico en emergencia, luce ligeramente pálida y en un aparente regular estado general, pero hemodinámicamente estable.
No se aprecian estigmas de hepatopatía crónica y no hay signos de visceromegalia, ni adenopatías. Por tanto, se realiza una tomografía espiral multicorte de tórax con contraste y se diagnostican bronquiectasias y enfermedad pulmonar intersticial difusa.
Los exámenes de laboratorio de emergencia muestran los siguientes resultados:
Hemoglobina (Hb): 11,3
Leucocitos: 3940
Plaquetas: 191 000
Transaminasa glutámica-oxalacética (TGO): 672
Transaminasa glutámico-pirúvica (TGP): 689
Bilirrubina total (BT): 0,71
Bilirrubina directa (BD): 0,38
Proteínas totales (PT): 8,21
Albúmina (Alb): 4,2
Fosfatasa alcalina (FA): 160
Gamma-glutamil transpeptidasa (GGT): 244
Tiempo de protrombina (TP): 14,2
Índice internacional normalizado (International Normalized Ratio, INR): 1,2
Creatina-fosfocinasa (Creatine Phosphokinase, CPK) total: 136
CPK-MB: 24
Lactato deshidrogenasa (LDH): 764
Virus de la inmunodeficiencia humana (VIH): no reactivo
Ferritina: 124,5
T4 libre: 1,51
Hormona estimulante de la tiroides (Thyroid-Stimulating Hormone, TSH): 3,36
Entre tanto, los marcadores virales para hepatitis A, B, C, D y E fueron negativos, mientras que los marcadores de los anticuerpos antinucleares (Antinuclear Antibodies, ANA), antimúsculo liso (Anti-Smooth Muscle Antibodies, ASMA), antimitocondriales serotipo M2 (Anti-mitochondrial Antibodies, AMA M2), antimicrosomal hígado/riñón (Liver Kidney Microsome Antibodies, LKM-1) y anticitoplasma de neutrófilos (Antineutrophil Cytoplasmic Antibody, ANCA) fueron negativos. La inmunoglobulina G marcó 1842 y la inmunoglobulina M estuvo en 31,7 (dentro de los rangos normales).
La ecografía abdominal durante la hospitalización mostró la existencia de barro biliar y meteorismo intestinal incrementado; hígado de tamaño normal; bordes uniformes y parénquima homogéneo. No se evidenciaron lesiones focales ni difusas. Además, las vías biliares intrahepáticas no se observaron dilatadas. El colédoco y la vena porta tuvieron un calibre normal.
La paciente es dada de alta, luego de haber mejorado su proceso respiratorio dos semanas después. Se indicaron medicamentos para la mejoría de su enfermedad de fondo, así como también se sugirió la no ingesta de glucosamina-condroitina, sustancias que dejó de consumir unos días antes de la admisión en el hospital.
Después de 2 meses del alta, la paciente acude al hospital y muestra una mejoría clínica. Sus controles de laboratorio presentan los siguientes resultados:
Hb: 12,1
Hematocrito (Hcto): 36,2 %
Leucocitos: 4260
Ab: 0 %
Plaquetas: 208 000
TP: 14,7
INR: 1,31
TGO: 37
TGP: 25
BT: 0,57
BD: 0,24
FA: 223
GGT: 57
PT: 7,29
Alb: 4,06
En la Tabla 1 se describen los datos de la bioquímica hepática de la paciente.
Tabla 1 Resultados de los exámenes de biometría hepática de la paciente con hepatotoxicidad por glucosamina-condroitina
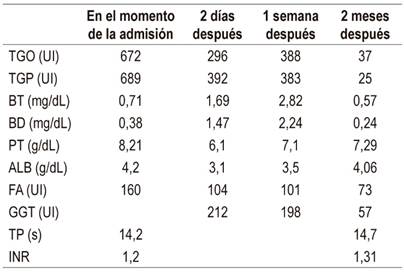
TGO: transaminasa glutámico-oxalacética (valor negativo [VN]: 0-35 UI); TGP: transaminasa glutámico-pirúvica (VN: 0-35 UI); BT: bilirrubina total (VN: 0,3-1,2 mg/dL); BD: bilirrubina directa (VN: 0-0,3 mg/dL); PT: proteínas totales (VN: 6-8 g/dL); ALB: albúmina (VN: 3,5-5,5 g/dL); FA: fosfatasa alcalina (36-129 UI); GGT: gamma-glutamil transpeptidasa (VN: 8-78 UI); TP: tiempo de protrombina (VN: 10-14 s); INR: índice internacional normalizado (International Normalized Ratio) (VN: <1,4)
Discusión
La glucosamina y la condroitina son biomoléculas que se pueden encontrar en forma natural dentro del cuerpo humano y mantienen la integridad del sistema cartilaginoso, a través de múltiples procesos 11.
La glucosamina es un componente de la familia de los glicosaminoglicanos que se encuentra en la matriz cartilaginosa y en el líquido sinovial. Puede tener efectos medicinales cuando se administra externamente 12, sobre todo en enfermedades osteoarticulares como la osteoartritis, en la cual se ha comprobado su efectividad y seguridad para mitigar los síntomas 13. Sin embargo, no se ha demostrado su uso como profilaxis para evitar la aparición de la osteoartritis 14.
El caso descrito se trata de una paciente que tuvo un daño hepático del tipo hepatocelular, directamente relacionado con la ingesta de un medicamento comercial basado en glucosamina-condroitina. Se menciona que el tiempo de inicio de las alteraciones hepáticas oscila entre 1 y 4 semanas, luego de iniciar la ingesta del medicamento, y su patrón de lesión es típicamente hepatocelular, como en nuestro caso, o mixto. El mecanismo por el cual se produce dicha hepatotoxicidad aún permanece desconocido 15.
Es importante recalcar que la paciente en ningún momento presentó un cuadro clínico asociado con hepatopatía como astenia, prurito, ictericia y náuseas. En contraste, Smith y Dillon 4 publicaron tres casos de hepatopatía en pacientes que consumieron preparados herbáceos que contenían glucosamina: dos de ellos llegaron a tener un daño hepatocelular y uno derivó en una falla hepática fulminante y la muerte.
Dos de los tres pacientes tuvieron un cuadro clínico asociado con hepatopatía (ictericia y prurito), los cuales mostraron una mejoría (al igual que la bioquímica hepática), luego de retirar los suplementos herbáceos. Asimismo, el paciente que no mostró sintomatología tuvo una remisión bioquímica al retirar dichos suplementos.
Ebrahim y colaboradores 5 reportaron a una paciente con malestar general e ictericia y a partir de sus exámenes de laboratorio revelaron que tenía un patrón mixto de lesión hepática (hepatocelular y colestásica). Estas alteraciones fueron asociadas a la ingesta de suplementos de glucosamina dos semanas previas a la admisión. La mejoría clínica y bioquímica se vio luego de una semana de retirar el medicamento y en cuatro semanas se normalizó completamente.
Estos hechos son similares a los de nuestra paciente, que dejó de tomar el medicamento unos días antes de ingresar al hospital, y posterior a ello, se observó que los valores disminuyeron hasta en un 50 % (con respecto a las transaminasas); luego de ocho semanas volvieron a la normalidad.
Por su parte, Yang y colaboradores 6 reportaron el caso de una paciente que tuvo un daño hepático mixto luego de consumir un producto comercial que contenía glucosamina-condroitina y productos herbáceos. Este evento es similar al nuestro, con una exposición a glucosamina-condroitina.
Un punto importante para dicho caso fue la demostración, mediante biopsia, del daño hepático, lo cual no se pudo realizar en nuestro estudio, ya que la paciente no lo requirió por presentarse asintomática. Del mismo modo, Linnebur y colaboradores 7 demostraron la asociación de dicho producto comercial y el daño hepático, a partir del reporte de dos casos de hepatotoxicidad relacionada con glucosamina-condroitina.
De otro lado, Ossendza y colaboradores 8 describieron un caso con elevación de transaminasas y bilirrubina (daño hepatocelular), traducidas clínicamente en prurito e ictericia, asociadas a la ingesta en dosis terapéuticas de glucosamina, que remitieron luego de retirar el medicamento. Es importante recalcar que nuestra paciente, en cierto momento de la evolución, comenzó a presentar un incremento de la bilirrubina.
Asimismo, podemos mencionar el caso único reportado por Stephen y colaboradores 9, el cual se trató de un paciente que se presentó con ictericia y colestasis, cuya etiología fue incierta durante tres meses de estudio. Posteriormente, se determinó la asociación directa de sus síntomas con la ingesta de glucosamina-condroitina y se demostró una lesión colestásica por medio de una biopsia hepática.
Es importante mencionar el trabajo desarrollado por Cerda y colaboradores 10, el cual estuvo basado en la realización de un cuestionario a 151 pacientes con enfermedad hepática crónica subyacente, a fin de determinar la asociación de la ingesta de glucosamina-condroitina y las alteraciones de las pruebas hepáticas. Los autores lograron establecer que dos pacientes (uno de ellos incluyó un cuadro clínico) tuvieron alteraciones en las transaminasas y en las enzimas de colestasis asociadas con el medicamento.
En síntesis, nuestro paciente se suma a la estadística de los pocos casos registrados hasta el momento de hepatotoxicidad inducida por glucosamina-condroitina. En efecto, este es el primer caso reportado en Perú.
Por tanto, recomendamos seguir investigando las etiologías de todas las alteraciones en las pruebas hepáticas de nuestros pacientes que llegan a la admisión hospitalaria, tanto en emergencias como en la consulta externa y la hospitalización. Solo así podremos incrementar la casuística de la lesión hepática inducida por drogas y tener un mejor panorama acerca de esta creciente patología.











 text in
text in 


