Introducción
La microbiota más abundante y mejor estudiada en el cuerpo humano reside en el tracto intestinal. Su impacto extiende los límites de la interfaz mucosa, ya que desempeña un papel esencial en las funciones sistémicas, como el desarrollo del sistema inmunitario 1. Antes que apareciera la penicilina en la década de los 40, las enfermedades infecciosas eran la principal causa de muerte del ser humano, y lo siguen siendo en gran parte del mundo. En efecto, se ha visto un aumento significativo de la resistencia bacteriana a los antimicrobianos, lo cual ha suscitado una gran preocupación, dado que esto constituye un obstáculo para el tratamiento de agentes infecciosos, pero también genera un gran interés respecto al desarrollo de nuevas estrategias terapéuticas 2.
Una de estas estrategias es el trasplante de microbiota fecal (TMF), el cual se define como la introducción de una suspensión de microbiota fecal, debidamente procesada y derivada de un donante sano, que es inoculada en el tracto gastrointestinal de un individuo enfermo. En vista de que este no es un concepto terapéutico, en los últimos años el TMF ha generado gran interés, pues se ha convertido en la terapia de elección para el tratamiento de infecciones causadas por Clostridioides difficile (anteriormente denominada Clostridium difficile) 3. Así, el TMF ya no se considera una práctica médica alternativa, sino que ha ganado la aceptación como una terapia valiosa en la actualidad, aunque todavía es poco conocida a nivel mundial. Su popularidad se ha acrecentado por su facilidad de uso, factibilidad y eficacia 4.
Metodología
Para el desarrollo de la presente revisión de tema, se realizó una búsqueda de la literatura utilizando los siguientes términos DeCS (Descriptores en Ciencias de la Salud) y MeSH (Medical Subject Headings), así como palabras clave en la estrategia de búsqueda: disbiosis, microbiota fecal, trasplante de microbiota fecal, bacterioterapia, infección, Clostridium difficile.
La búsqueda se limitó a estudios elaborados en humanos, en idiomas inglés, francés y español, publicados desde 2013 hasta el presente. Las bases de datos electrónicas investigadas fueron Science Direct, Redalyc, PubMed y NCBI. Además, se realizaron búsquedas manuales en bases de datos para literatura gris y Google Académico. Se eligieron las publicaciones más relevantes según los autores.
Microbiota intestinal
La microbiota intestinal consta de numerosas bacterias, virus y hongos que viven en el contenido intestinal (masa fecal), así como en el moco que cubre la mucosa intestinal. Estos dos hábitats constituyen dos ecosistemas comensales microbiológicos separados, que tienen diferentes funciones en la interferencia entre ellos y el organismo del huésped. En la actualidad, se han identificado más de 1000 géneros de bacterias intestinales 5.
En estados de salud, la microbiota intestinal se ha compuesto de cuatro familias de bacterias: Bacteroidetes, Firmicutes y, en menor medida, Proteobacteria y Actinobacteria6. La exploración de este ecosistema, que coexiste con el organismo humano, ha sido posible con la introducción de técnicas de investigación de ADN molecular, con la secuenciación de ARN ribosómico 16S (ARNr) 7. Esto se da en virtud de que los métodos microbiológicos clásicos utilizados para identificar cepas de bacterias u hongos, como el cultivo microbiológico, son ineficaces en el caso de la microbiota humana, ya que algunas cepas bacterianas del intestino no pueden cultivarse en condiciones de laboratorio.
Así pues, el número de células bacterianas existentes en el tracto digestivo humano del individuo sano alcanza los 100 billones, 10 veces más que el de células del cuerpo humano 5. Por tanto, la microbiota intestinal desempeña un papel clave en la salud y se reconoce cada vez más como un contribuyente a varios estados de enfermedad, cuando se produce un desequilibrio 8 llamado disbiosis, y, en comparación con la microbiota de controles sanos, tiene una menor abundancia de bifidobacterias y una mayor abundancia de bacterias gramnegativas 9. Estas últimas tienen múltiples funciones que involucran el sistema inmunitario de mucosas y la resistencia a la colonización contra, por ejemplo, el Clostridioides difficile10.
TMF e infección por clostridioides difficile (ICD)
La microbiota es considerada un tejido y en el TMF se utiliza para implantar la suspensión de microbiota fecal de un donante sano en el tracto gastrointestinal de una persona enferma o un receptor 11. Esto, con el objetivo de recuperar la composición microbiana 12. Dicho proceso, además, mejora el estado disbiótico, mediante el aumento de la diversidad general y la restauración de la funcionalidad de la microbiota 3.
Con este panorama, el TMF se está usando cada vez más para tratar la ICD, dado que el C. difficile es un bacilo grampositivo, anaeróbico, formador de esporas, asociado con infecciones endógenas (colonización) o exógenas (infecciones asociadas a la atención en salud / consumo o indicación de antibióticos de amplio espectro). La patogénesis se atribuye, principalmente, a las toxinas A (una enterotoxina), la toxina B (una citotoxina) y la toxina binaria 13.
La ICD ocasiona, principalmente, úlceras pseudomembranosas y disbiosis, debido a un sobrecrecimiento de esta bacteria a nivel gastrointestinal, inducido por antibióticos como el metronidazol, la vancomicina y, más recientemente, la fidaxomicina o la rifaximina 14,15. Estas terapias desencadenan eventos adversos como daño y muerte de la microbiota gastrointestinal humana, por lo que el TMF se considera una alternativa para corregir el desequilibrio subyacente en esta patogénesis y proporcionar a los pacientes enfermos una microbiota con alto grado homeostasis estructural y funcional, derivada de un donante adecuado 12.
En este sentido, Clostridioides difficile es la causa principal de diarrea asociada a los antibióticos, principalmente en pacientes hospitalizados en el mundo occidental, y se asocia con una alta morbimortalidad, así como con el uso de recursos sanitarios. Los aislados clínicos de Clostridioides difficile toxigénico son genéticamente diversos y se ha informado que algunos ribotipos hipervirulentos, como el 027, generan brotes en instalaciones de atención médica 16. Las manifestaciones clínicas de la ICD varían desde diarrea autolimitada, diarrea profusa, hasta colitis pseudomembranosa, íleo severo, megacolon tóxico, peritonitis e incluso choque o fallas orgánicas 13.
Asimismo, un número significativo de pacientes no responden al tratamiento inicial o sufren una recurrencia (2-38 %) en las primeras 8 semanas 17. La ICD recurrente se define como aquel episodio que ocurre hasta 8 semanas luego del inicio de una ICD previa, cuyos síntomas se hayan resuelto 18.
Es importante conocer la composición de la microbiota de los pacientes antes y después del trasplante, a fin de poder identificar los cambios generados 19. El TMF representa una terapia antibacteriana de muy bajo costo y es la más prometedora para el tratamiento de pacientes con ICD recurrente o refractaria al tratamiento con antibióticos. En efecto, se ha demostrado la superioridad del TMF en múltiples series de casos. Recientemente, en ensayos clínicos aleatorios prospectivos experimentales, se observó una resolución de la infección en más del 90 % de los pacientes 20.
Abordaje histórico del TMF
Aunque parezca extraño, el TMF no es un concepto terapéutico nuevo. Existen datos muy antiguos que se refieren a él de manera más o menos directa. Por ejemplo, en el siglo IV, durante la dinastía china Dong Jin, el médico Ge Hong describió con buenos resultados la administración oral de una suspensión preparada a base de heces humanas en pacientes con intoxicación alimentaria o diarrea severa 21. Más tarde, Li Shizhen utilizó diversos preparados fecales para tratar todo tipo de males digestivos como diarreas, vómitos, dolor, fiebre o estreñimiento, a lo que llamó sopa amarilla. De igual manera, se destaca la ingesta de heces para aliviar ciertos padecimientos intestinales del ganado, descrita en el siglo XVII por Fabrizio d’Aquapendente 20,22.
La ICD fue descrita por primera vez en 1978. Desde entonces ha sido señalada como la primera causa de diarrea intrahospitalaria y el principal origen identificable de diarrea asociada al uso indiscriminado de antibióticos 23. Durante la Segunda Guerra Mundial, los beduinos en el desierto norteafricano indicaban a los soldados la ingesta de heces de dromedario para tratar la disentería y otras enfermedades producidas por Clostridioides difficile.
El éxito del TMF en la medicina moderna fue reseñado por primera vez por Eiseman y colaboradores, en 1958. Estos investigadores administraron microbiota en enemas a pacientes con colitis pseudomembranosa 22, con el objetivo de desplazar los microbios patógenos del intestino, mediante el restablecimiento de una comunidad microbiana saludable. Con ello buscaron generar resultados eficientes para tratar la ICD 24. Dicho abordaje de la enfermedad, que desafió conceptualmente la visión vigente en aquella época de la microbiota como un elemento nocivo, cayó en el olvido de la comunidad científica durante más de medio siglo.
A partir de la última década, el TMF se ha posicionado como una de las terapias con mayor interés teórico y práctico en el ámbito de la gastroenterología, los procesos autoinmunitarios y las enfermedades metabólicas 17. Desde entonces, en la medicina moderna, los primeros TMF exitosos fueron reportados en 1958 por Eiseman y sus compañeros de trabajo, que trataron a 4 pacientes con colitis pseudomembranosa, causada por Clostridioides difficile, anteriormente llamada Clostridium difficile.
Es así como, desde entonces, se han informado de manera constante las tasas de resolución del 70 al 90 %, después de un TMF, para la infección recurrente de ICD, tanto en los estudios observacionales como en los ensayos aleatorios 25. De igual forma, en 2013, Van Nood y colaboradores realizaron una publicación sobre su primer ensayo clínico aleatorizado, controlado y abierto, que examinó las ventajas terapéuticas del TMF en comparación con el tratamiento con vancomicina 26.
Procedimiento del TMF
La selección y el cribado del donante en el TMF no se han estandarizado, por lo que los criterios en los diversos estudios son variables. Los tipos de donantes seleccionados pueden clasificarse en cuanto a su relación con el receptor en 4 grupos: familiares de sangre (54 %), individuos con contacto íntimo con el paciente (marido, esposa o pareja) (8 %), voluntarios sanos sin relación con el receptor (25 %) y donante no especificado (12 %) 22. Aunque se dice que el TMF es un procedimiento seguro, confiable y que no muestra ningún efecto adverso hasta el momento, a nivel teórico se habla acerca de riesgos que se pueden generar durante su realización, tales como la trasmisión de agentes infecciosos que desencadenan enfermedades a los receptores 13.
Por tanto, para evitar estas alteraciones, en primer lugar se recomienda realizar una serie de exámenes al donante como analítica sanguínea: hemograma y perfil viral (inmunoglobulina M [IgM] anti virus de la hepatitis A [VHA], antígeno de superficie [HBsAg]), inmunoglobulina G (IgG) e IgM anti virus de la hepatitis C (VHC), IgM anti virus de la hepatitis B (VHB), IgG anti VHC, virus de inmunodeficiencia humana (VIH) (1 y 2), anti virus linfotrópico humano (Human T-Lymphotropic Virus, HTLV) y sífilis (reagina plasmática rápida [RPR] y prueba de absorción de anticuerpos treponémicos fluorescentes [Fluorescent Treponemal Antibody-Absorption, FTA-ABS]).
Del mismo modo, es necesario realizar una prueba de reacción de la polimerasa en cadena (Polymerase Chain Reaction, PCR) en las heces para identificar microorganismos enteropatógenos y toxinas de Clostridioides difficile, así como un coprológico seriado (Giardia sp., Cryptosporidium sp., Cyclospora sp. e Isospora sp.) 27 y cuestionarios a fin de detectar conductas de riesgo 17.
Asimismo, se efectúa la selección del donante, considerando factores como su comportamiento sexual, transfusiones de sangre, su historial de viajes, antecedente de cirugía mayor en el aparato digestivo (se excluye la apendicectomía) 23, proceso oncológico activo o historia de cáncer en los últimos 10 años, enfermedad inflamatoria intestinal o dispepsia funcional 23 y otros aspectos que aumenten el riesgo de padecer una enfermedad transmisible 17.
Con respecto a la preparación del receptor, el acondicionamiento del colon parece reducir la densidad de bacterias como Clostridium difficile e incluso de sus esporas inactivas. Por ello, aunque su relación directa con la eficacia del TMF no ha sido demostrada, se recomienda el uso de soluciones evacuantes el día previo al procedimiento en aquellos pacientes cuya situación clínica lo permita, independientemente de la vía elegida para realizarlo 22.
Una vez se concluye la amplia selección y revisión de donantes (potenciales), se reciben las heces, las cuales deben procesarse lo más pronto posible (dentro de las primeras 6 h) para mantener la viabilidad de la microbiota del donante. Se agrega un crioprotector a la suspensión fecal a fin de permitir un adecuado almacenamiento a −80 °C. Además, se debe almacenar una parte alícuota de cada donación para un posible análisis en caso de un evento adverso grave 28.
De la misma forma, la suspensión de heces del donante se puede mantener a una temperatura ambiente por hasta 3 h, o refrigerada a 4 °C durante 6 h 29. Con ello se demuestra que el almacenamiento con mejor viabilidad se observa al suministrar glicerol, debido a que este favorece la viabilidad de la microbiota fecal. En efecto, se ha descubierto que los aislamientos de Escherichia coli son viables (y en proporción similares a las muestras frescas), luego de 1 año de almacenamiento congelado de las heces de lactantes y terneros, en 10 % de caldo de glicerol a −70 °C 30.
Entre tanto, la ruta de administración preferida para el TMF sigue siendo un tema de discusión. En la actualidad, se han establecido distintos procedimientos para la realización del TMF, y las vías utilizadas han sido la digestiva superior y la digestiva inferior. Esta elección varía según la situación clínica del paciente 31.
El uso del tubo digestivo superior por vía nasogástrica o nasoduodenal es posible, fácil, de menor costo y supone un menor riesgo de perforación intestinal en comparación con la colonoscopia. Sin embargo, tiene la desventaja de que puede favorecer el sobrecrecimiento bacteriano en el intestino delgado. Además, es factible que no alcance los sitios distales con mayor afección y puede producir síntomas desagradables para el paciente, como el reflujo o la distensión abdominal 32,33.
Asimismo, el TMF por vía superior puede realizarse mediante cápsulas ingeridas 34. De hecho, un estudio reciente mostró altas tasas de curación en pacientes tratados con TMF por cápsula oral, un método que puede disminuir la incomodidad del enfermo. Sin embargo, esta práctica requiere la ingestión de grandes cantidades de cápsulas, las cuales no están fácilmente disponibles 30.
De otro lado, la administración a través del tubo digestivo inferior se realiza mediante una colonoscopia (la vía de elección) o mediante enemas. La colonoscopia permite la visualización directa de la mucosa, aunque puede asociarse con un mayor riesgo de perforación, sobre todo en pacientes con megacolon tóxico 32,35.
Efectividad y desventajas del TMF
La alta efectividad del TMF, con una respuesta >80 % en revisiones sistemáticas en el escenario de la ICD recurrente, ha estimulado el interés de esta terapia tanto en pacientes, médicos e investigadores como en la industria farmacéutica. Así pues, el TMF ya no es considerado un recurso excepcional en la ICD recurrente y cada vez más se practica de forma común 36.
Ahora bien, las desventajas de esta terapia se pueden clasificar de acuerdo con su aparición a corto y largo plazo. Las primeras se relacionan con la manifestación de dolor abdominal, distensión, flatulencia, diarrea y fiebre, mientras que las segundas incluyen síntomas como perforación, hemorragia y depresión cardiorrespiratoria 37. También se han reportado casos de transmisión de agentes infecciosos y bacteriemia.
Además, los efectos a largo plazo tienen relación con la modulación de ciertas enfermedades como obesidad, diabetes mellitus, ateroesclerosis, hígado graso, enfermedad inflamatoria intestinal, síndrome de intestino irritable, asma y autismo 31,34.
A continuación, se identifican los principales estudios de revisión sistemática y de literatura, con hallazgos representativos en cuanto a la efectividad y los eventos adversos presentados luego de un TMF (Tabla 1) 17,34,38-41:
Tabla 1 Eficacia frente a eventos adversos del TMF
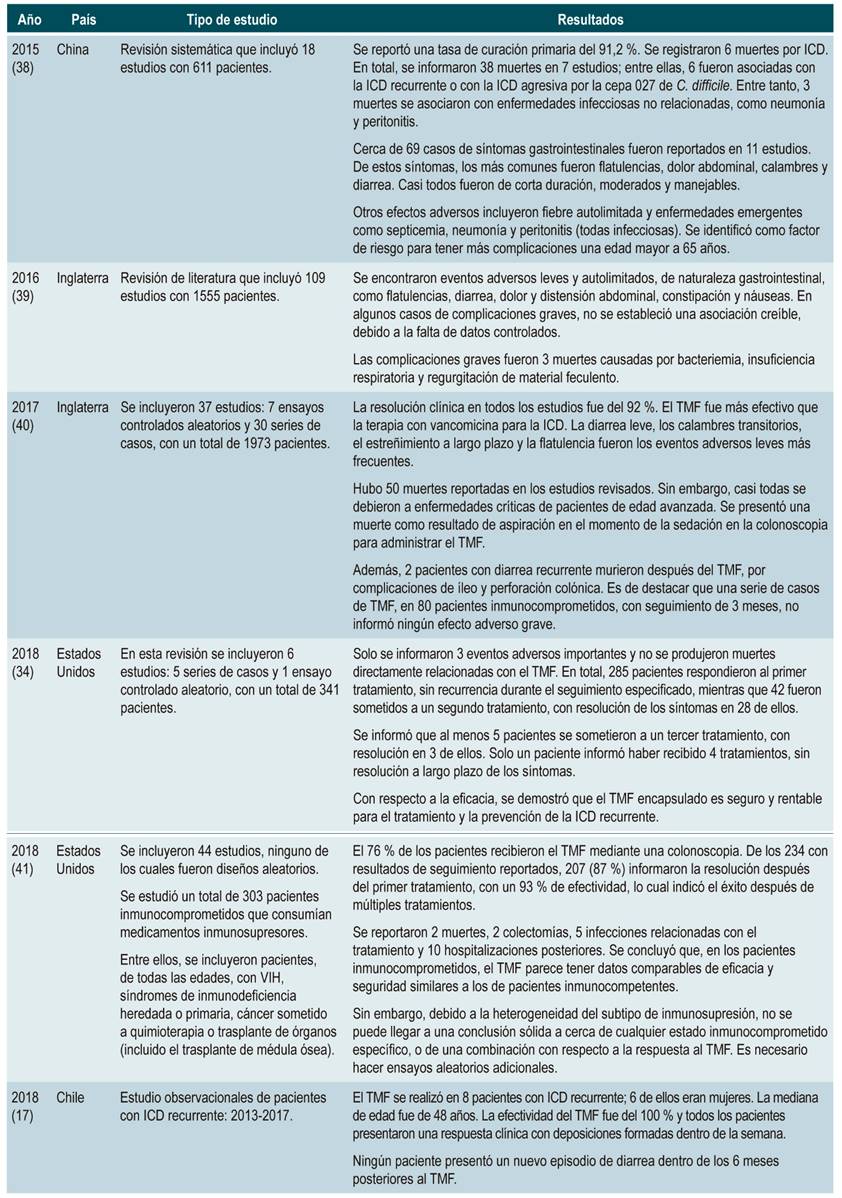
TMF: trasplante de microbiota fecal; ICD: infección por Clostridioides difficile; C. difficile: Clostridioides difficile. Tomada de las referencias 17, 34, 38-41.
De acuerdo con lo anterior, se identificó que el TMF parece ser efectivo y se convierte en una estrategia aparentemente segura en el tratamiento de la ICD recurrente y refractaria. En efecto, está documentado que la tasa de resolución de la ICD es directamente proporcional al volumen de heces infundido. A su vez, la recurrencia del cuadro clínico se asocia con el peso de heces usado en el trasplante 17. La eficacia es similar en estudios controlados y no controlados. Asimismo, se han notificado más eventos adversos en el TMF para el tratamiento de la enfermedad inflamatoria intestinal que para la ICD. Además, no existen ensayos controlados con placebo verdaderos que investiguen la eficacia del TMF.
Otros usos del TMF
En la actualidad, el TMF se está convirtiendo en una opción de tratamiento de alta efectividad para las ICD y otras disbiosis, así como para encefalopatías hepáticas, el síndrome de intestino irritable y la enfermedad inflamatoria intestinal. Estos trastornos metabólicos afectan en gran medida a los pacientes 42. Hoy se habla que el TMF, incluso, puede tener un papel importante en el tratamiento de la obesidad 43, la psoriasis, el cáncer y la enfermedad de Parkinson 44.
Dentro de ese contexto, están en marcha ensayos clínicos para el uso del TMF en el tratamiento de la enfermedad inflamatoria intestinal, las encefalopatías hepáticas, la colangitis esclerosante primaria, la pancreatitis aguda, el estreñimiento, la esteatorrea, la erradicación de bacterias multirresistentes en portadores fecales, el VIH y la epilepsia 32.
Entre tanto, en pacientes con trastorno del espectro autista se han observado alteraciones gastrointestinales como disbiosis, con la presencia de infección por el género Clostridium, incluidas cepas de Clostridioides difficile. Sin embargo, esta no es la única cepa susceptible de cursar con alteraciones del comportamiento en niños autistas. También se han descrito otros microorganismos como Candida spp. Así pues, se considera que el TMF regenera la microbiota intestinal, a partir de la producción de abundante diversidad de microrganismos bacterianos 45.
Por otro lado, se realizó un estudio abierto de pequeño ensayo clínico, fase I, en 18 niños entre 6 y 17 años, que consistió en el tratamiento combinado de antibiótico por 2 semanas, limpieza intestinal y luego TMF con dosis inicial alta, seguido de dosis diarias de mantenimiento más bajas durante 7-8 semanas. En él se evidenció un cambio significativo relativo a la abundancia de Bifido bacterium spp., Prevotella spp. y Desulfovibrio spp. en el control de la composición de la microbiota. Se observó una mejoría de los síntomas gastrointestinales, así como en el comportamiento del lenguaje (25 %), la interacción social, la conducta repetitiva, la hiperactividad y la irritabilidad, lo cual se mantuvo durante 8 semanas 46.
Estudios recientes relacionan la microbiota intestinal con la fisiopatología de la obesidad. El uso del TMF en la obesidad y la diabetes mellitus tipo 2 se fundamenta en la composición de la microbiota intestinal, ya que esta varía significativamente entre los sujetos obesos y delgados. Se ha publicado, además, que el grupo que recibe TMF tiene un significativo aumento de la sensibilidad a la insulina postrasplante 2. Los resultados de las investigaciones de pacientes con síndrome metabólico o diabetes tipo 2 son alentadores a la luz de la pandemia de obesidad en expansión, y requieren una mayor exploración. También se necesitan estudios adicionales para determinar los efectos de las alteraciones de la microbiota en el crecimiento tumoral y terapias contra algunos tipos de cáncer 47.
Conclusiones
Si bien existen diversas técnicas para realizar el TMF de acuerdo con diversos protocolos, el procedimiento en sí mismo se considera seguro. Además, se observa la necesidad de estandarizar y aleatorizar ensayos controlados para calificar y cuantificar los riesgos del TMF. Este procedimiento terapéutico, económicamente accesible, sencillo y validado con evidencia científica, abre el panorama de investigación en otras enfermedades del ser humano, tanto digestivas como extradigestivas, que representan altos costos sanitarios, reingresos, estancias hospitalarias prolongadas y morbimortalidad elevada.











 text in
text in 



