Introducción
Helicobacter pylori (H. pylori) es un bacilo gramnegativo, microaerófilo y pleomórfico, de aproximadamente 3,5 μm de longitud y 0,5 μm de diámetro, que afecta alrededor de la mitad de la población mundial 1,2. Los reportes de la infección varían, y se presentan prevalencias del 79,1 % en África, el 63,4 % en Latinoamérica y el Caribe, el 54,7 % en Asia, el 37,1 % en Norteamérica y el 24,1 % en Oceanía 3,4.
Esta infección alcanza niveles más altos en países en desarrollo, dado que existe una relación bien establecida entre su aparición, el estatus socioeconómico y las condiciones de higiene 3,5. La forma de transmisión no es clara, pero se plantea que se adquiere en la infancia por vía fecal-oral y es más frecuente de forma intrafamiliar 6. Otros estudios sugieren que también se obtiene por el consumo de agua o verduras contaminadas 7,8.
En 1994, la Organización Mundial de la Salud (OMS), a través de la Agencia Internacional de Investigación sobre el Cáncer (International Agency for Research on Cancer, IARC) clasificó a H. pylori como un carcinógeno tipo I 9. La infección con este microorganismo es el principal factor de riesgo para el desarrollo de cáncer gástrico (CG), con una relación significativa positiva y un riesgo relativo del 3,8 10. El CG causó la muerte de 782 685 personas en el mundo en 2018 10,11.
Entre tanto, Colombia tiene una alta incidencia de infección por H. pylori12. El manejo de esta se realiza sobre la base del consenso internacional de triple terapia (inhibidor de la bomba de protones, amoxicilina y claritromicina o metronidazol) 13. En nuestro país, en 2015, se publicó una guía para el tratamiento de las infecciones por H. pylori. Sin embargo, esta no se utiliza de manera generalizada por los médicos y debe ser ajustada de acuerdo con las tasas de resistencias locales 14.
La falla terapéutica (FT) en la erradicación de H. pylori es multifactorial e involucra factores genéticos, bacterianos y externos del paciente, como la no adherencia al esquema del tratamiento. Así, la principal causa de FT es la resistencia bacteriana a los antibióticos, adquirida durante el tratamiento 15. La resistencia a los antibióticos ocurre por la capacidad de los microrganismos para adaptarse de manera natural a medios hostiles, es intrínseca por la ausencia del sitio de unión del fármaco y adquirida por cambios genéticos. Además, H. pylori es capaz de lograr una diversidad genética por mutaciones y recombinaciones homólogas 16-23. La aparición de cepas resistentes también se asocia con el uso indiscriminado de antibióticos y la falta de adherencia al tratamiento como consecuencia de los efectos adversos de su utilización.
En la actualidad, en Colombia existen reportes de resistencia de H. pylori a amoxicilina, metronidazol, claritromicina, furazolidona, levofloxacina, moxifloxacina y tetraciclina 12,24-29. Con todo ese contexto, el objetivo de esta revisión es describir los patrones de resistencia a dichos antibióticos (amoxicilina, metronidazol, claritromicina, furazolidona, levofloxacina y tetraciclina), los cuales han sido encontrados en el tratamiento de la infección por H. pylori durante los estudios realizados en el país.
Materiales y métodos
Estrategia de búsqueda y criterios de selección
En las bases de datos PubMed (librería nacional de medicina de Estados Unidos, Bethesda, MD), LILACS (Literatura Latinoamericana de Información en Ciencias de la Salud: http://lilacs.bvsalud.org/en) y SciELO (librería científica electrónica: http://www.scielo.org), se realizó búsqueda de artículos con la estrategia: Helicobacter pylori, AND resistencia AND Colombia en español y Helicobacter pylori, AND drug resistance AND Colombia en inglés.
Criterios de inclusión
Se seleccionaron artículos originales, con textos completos, que presentaran datos de resistencia de H. pylori a antibióticos en Colombia, en cualquier año. De estos, se obtuvo información como el primer autor, el año de publicación, el lugar de realización, el año de toma de la muestra, los antibióticos evaluados, el número de muestras (biopsias gástricas o aislados de H. pylori), la prevalencia de la resistencia a antibióticos, el método de evaluación de la resistencia (prueba de epsilometría [E-test], difusión en disco o detección de mutaciones por reacción en cadena de la polimerasa [Polymerase Chain Reaction, PCR]).
Resultados
La estrategia de búsqueda en español e inglés coincidió con 39 artículos. De estos, 23 cumplían con los criterios de inclusión. A continuación, se presenta un flujograma de los artículos incluidos en la revisión una vez aplicada la estrategia de búsqueda (Figura 1). Además, se presenta una tabla resumen con estudios de resistencia de H. pylori realizados en Colombia (Tabla 1).
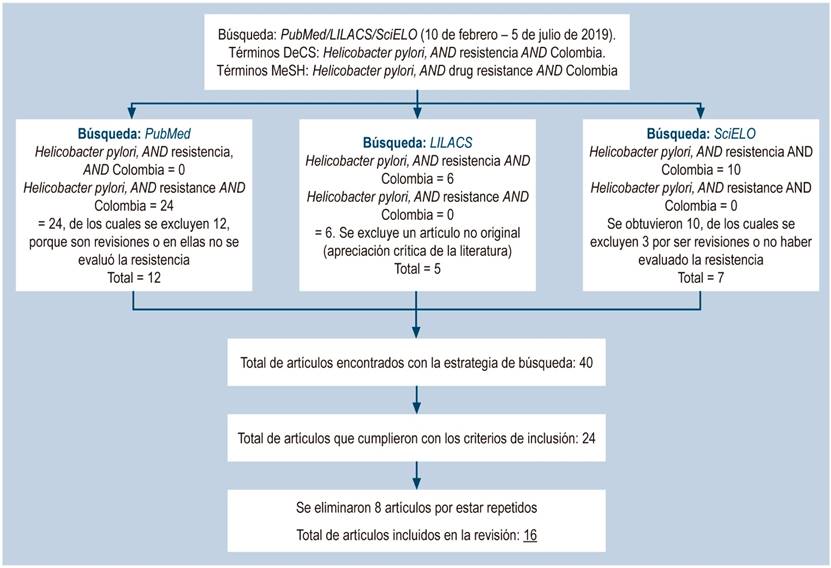
Figura 1 Esquema general de la estrategia de revisión sobre la resistencia de Helicobacter pylori a los antimicrobianos en Colombia. DeCS: descriptores en ciencias de la salud; MeSH: encabezados de temas médicos (Medical Subject Headings).
Tabla 1 Tabla resumen con estudios de resistencia de H. pylori realizados en Colombia
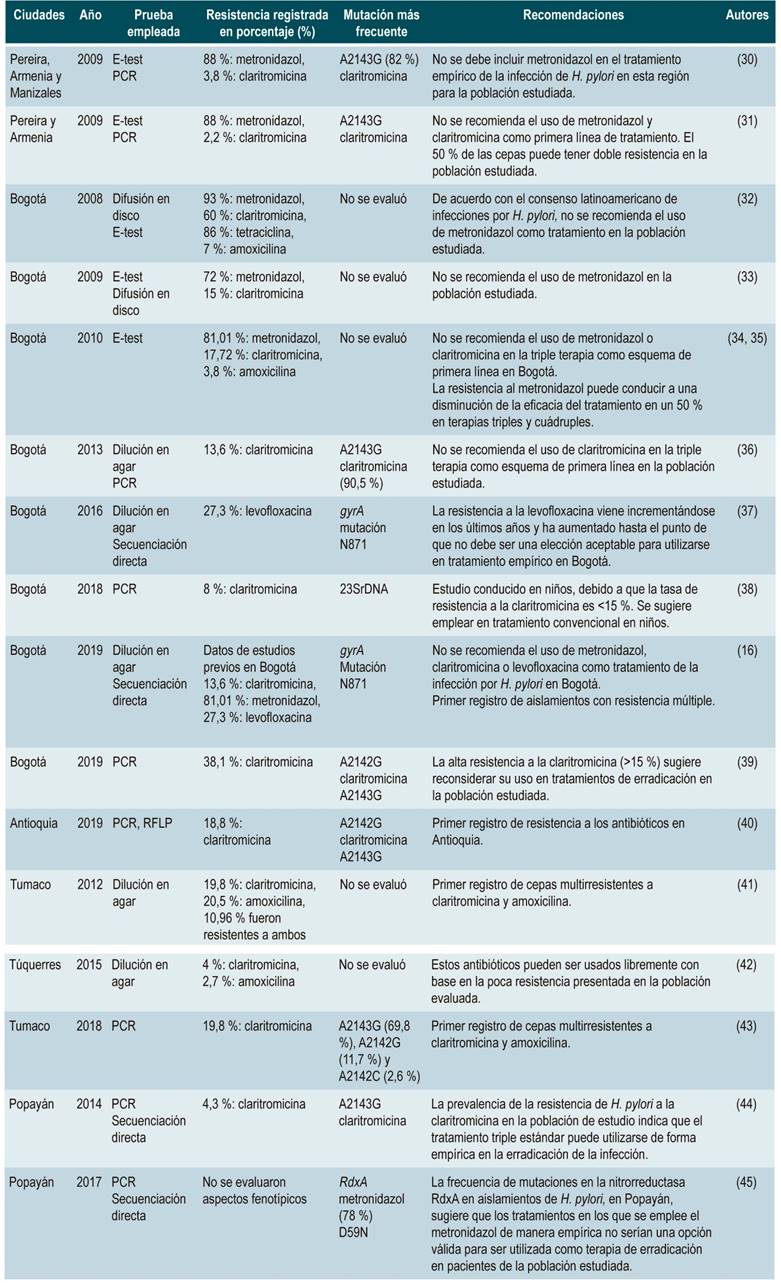
E-test: prueba de epsilometría; PCR: reacción en cadena de la polimerasa (Polymerase Chain Reaction); RFLP: fragmentos de restricción de longitud polimórfica (Restriction Fragment Length Polymorphisms)
Amoxicilina
La amoxicilina es un antibiótico de primera elección para el tratamiento de H. pylori, dada la alta sensibilidad que presenta dicho microorganismo. Este fármaco es una penicilina semisintética que pertenece a los betalactámicos y es un inhibidor de la síntesis del peptidoglicano, ya que bloquea los transportadores denominados proteínas de unión a penicilina (Penicillin-Binding Protein, PBP) 13,30. La bacteria adquiere resistencia a este medicamento por las mutaciones en el gen pbpA (PBP), la producción de β-lactamasas y la presencia de bombas de eflujo. Los últimos dos aspectos se asocian con la resistencia más alta al medicamento 25,31.
Así bien, las mutaciones más frecuentes en el gen pbpA son sustituciones en posiciones específicas: en el aminoácido 556 ocurre una sustitución de una treonina por una serina (Thr556→Ser), en la posición 648 se da un cambio de una lisina por una glicina (Lys648→Gly), en la posición 649 sucede un cambio de una arginina por una lisina (Arg649→Lys) y en la posición 656 se observa un cambio de una arginina por una prolina (Arg656→Pro).
Las primeras cepas de H. pylori resistentes a la amoxicilina se registraron en 1997, en un paciente que había sido tratado previamente 32. En 2009, se describió la aparición de una cepa productora de β-lactamasas (TEM-1), las cuales son capaces de destruir el anillo betalactámico del antibiótico 25. Además, se reportó la presencia de bombas de eflujo en la pared bacteriana, que expulsan el antibiótico hacia el exterior de la célula. Aunque esto solo se observó en cepas in vitro, es preocupante porque las bombas generan que las cepas se vuelvan multirresistentes 31.
En una revisión realizada en 2014 por Camargo y colaboradores, en la cual recopilaron los diferentes estudios de resistencia de H. pylori a los antibióticos en Latinoamérica, se evidenció que Colombia y Brasil presentaron las tasas de resistencia a la amoxicilina más altas, con 7 y 15 %, respectivamente 12. Entre tanto, en 2007, Gómez y colaboradores desarrollaron un estudio en el que encuestaron a 648 médicos (68 %: médicos generales, 19 %: médicos internistas y 13 %: gastroenterólogos) de 9 ciudades de Colombia. Luego de su análisis, los autores señalaron que la amoxicilina fue el antibiótico más prescrito para el tratamiento de H. pylori, con el 73 % 33. En nuestro país, los estudios muestran tasas de resistencia de H. pylori a este antibiótico del 1,9, 3,8 y 9,5 % 34-36.
Metronidazol
La acción bactericida del metronidazol depende de la reducción enzimática. En el caso de H. pylori, que no presenta la enzima superóxido dismutasa, la disminución del metronidazol es efectuada por la NADPH (nicotinamida adenina dinucleótido fosfato) nitrorreductasa y la NAD(P)H flavina oxidorreductasa, para producir radicales aniónicos como derivados nitrosos e hidroxilaminas, las cuales, al unirse al anillo imidazólico, conducen a una inhibición en la síntesis de los ácidos nucleicos 37-39. Los mecanismos de resistencia adquirida por la bacteria apuntan principalmente a mutaciones en el gen RdxA, que codifica la NADPH nitrorreductasa, y el FdxB, que codifica para la ferredoxina 38,39.
Algunos autores afirman que las mutaciones puntuales en el RdxA ocasionan la resistencia al metronidazol y, en menor frecuencia, los cambios en el FrxA. Mientras tanto, otros aseveran que las mutaciones del FrxA solo potencian la resistencia ocasionada por la inactivación del RdxA. Aunque se presentan mutaciones con la pérdida de función del RdxA, no todas las veces dicha pérdida de función implica una disminución de la susceptibilidad al medicamento, lo que conduce a que los resultados genotípicos obtenidos no sean concordantes con los in vitro e in vivo40.
Además, los métodos de dilución en agar y la prueba de epsilometría presentan variabilidad inter e intraprueba y no son exactos, probablemente por el efecto de las condiciones medioambientales necesarias para el cultivo de la bacteria 39,41. Respecto de la prueba de epsilometría, algunos autores sostienen que esta sobreestima la resistencia al metronidazol, por lo que se propone acompañar el diagnóstico de resistencia con pruebas de biología molecular.
En Latinoamérica, la resistencia al metronidazol reportada es >30 %. Sin embargo, en países como Perú y Colombia el promedio documentado es del 66 y el 83 %, respectivamente 12. En nuestro país, diferentes estudios describen datos de resistencia a dicho medicamento, por métodos microbiológicos, que oscilan entre el 72 y el 97,6 % 34-36. Asimismo, en 2017, Acosta y colaboradores evaluaron la frecuencia de mutaciones del RdxA por métodos genotípicos y encontraron que el 78,2 % de los casos (133/170) portaban alguna alteración genética asociada con resistencia al fármaco 42. El metronidazol es uno de los antimicrobianos más prescritos por los médicos generales en Colombia para el tratamiento de H. pylori, con lo cual parecen ignorarse las altas tasas de resistencia 33.
Claritromicina
La claritromicina es un macrólido con actividad bacteriostática y bactericida, que inhibe la síntesis proteica al unirse al componente 23S de la subunidad ribosomal 50S 43. H. pylori adquiere resistencia a este antibiótico por mutaciones en la región peptidiltransferasa del domino V del gen HPrrnB23S, el cual codifica el componente ribosomal 23S 43. Las mutaciones más frecuentes en este gen se localizan en las posiciones 2142, con la transición de una adenina por una guanina (A2142G) y la transversión adenina-citosina (A2142C). La transición de adenina por guanina en la posición 2143 (A2143G) genera un cambio conformacional en el sitio de unión del antibiótico e impide su acción 44,45. Existen otras mutaciones de menor frecuencia como las transiciones T2182C 46, T2717C 47, G2224A, C2245T y T2289C 48.
Con respecto a Latinoamérica, se reportó una prevalencia de resistencia a los macrólidos del 14 % en Argentina y del 13 % en México 12. En Colombia, un estudio de 2009 realizado en el Eje Cafetero registró una baja resistencia a la claritromicina (2,2 %). Sin embargo, este medicamento se utiliza únicamente para el tratamiento de enfermedades respiratorias en la infancia, lo que explicaría la diferencia entre los porcentajes encontrados 33,35.
Por otro lado, los estudios de prevalencia de la resistencia a los macrólidos en el país describen valores que oscilan entre el 13,6 y el 63,1 % 29,34,36,49. En cuanto la resistencia genotípica, se ha determinado que la transición de adenina por guanina en la posición 2143 (A2143G) es la más frecuente (90,5 %), seguida por la transición A2142G (7,1 %) y la A2142C (2,4 %) 29.
Furazolidona
La furazolidona es uno de los nitrofuranos propuestos en el tratamiento de H. pylori como terapia de rescate. Los nitrofuranos son bacteriostáticos, pero a altas dosis son bactericidas, y actúan de forma similar a los nitroimidazoles. El mecanismo de resistencia a este grupo de antibióticos es poco conocido. Se sugiere que las nitrorreductasas implicadas en este proceso son la flavodoxina piruvato oxidorreductasa (codificada por el gen PorCDAB) y la 2-oxoglutarate oxidorreductasa (OorDABC) 50.
Su y colaboradores identificaron mutaciones asociadas con la resistencia a la furazolidona en el gen porD, con transiciones de guanina por adenina en la posición 353 (G353A), adenina por guanina en la posición 356 (A356G) y citocina por timina en la posición 357 (C357T), y en oorD con las transiciones adenina (A041G, A122G) y la transversión (C349A). Sin embargo, algunas cepas resistentes al medicamento no portaban mutaciones, por lo que existe la posibilidad de otras mutaciones aún no determinadas 51. Las evidencias sugieren que otras enzimas activarían los nitrofuranos; no obstante, existen pocos estudios al respecto 52.
En Colombia, solo existe un estudio de resistencia fenotípica en H. pylori, el cual corresponde a un trabajo de grado que registró una resistencia del 4,8 %. Por lo demás, no hay estudios sobre resistencia genotípica a los nitrofuranos 33,53. Por tanto, los nitrofuranos son de poca prescripción y se recomiendan como tratamiento de rescate en países como Brasil, en el que se ha descrito una resistencia del 3 %, similar a la encontrada en Bogotá 12.
Levofloxacina
La levofloxacina es una fluoroquinolona empleada en algunos casos como terapia de rescate en tratamientos no exitosos con claritromicina. Las fluoroquinolonas ejercen su acción al unirse a la subunidad A de la ADN girasa y evitan la formación del tetrámero (dos subunidades A y dos B), con lo cual bloquean la función de esta enzima. La subunidades A y B son codificadas por los genes gyrA y gyrB, respectivamente 37. La resistencia de H. pylori a las fluoroquinolonas se presenta por mutaciones en gyrA y gyrB y por alteraciones de las porinas.
Así, las mutaciones ocurren en la región determinante de resistencia a las quinolonas (Quinolone Resistance Domain Region, QRDR) del gyrA, lo que previene la unión del antibiótico a la girasa, al alterarse el sitio de unión de las quinolonas en el complejo ADN girasa-ADN 54. Las mutaciones descritas causantes de este fenómeno son mutaciones únicas: Asn87 → Lys, Ala88 → Val, Asp91 → Gly, Tyr o Asn, y mutaciones dobles en Asp91 → Asn y en Ala88 → Val 55.
En Colombia, existe un estudio de seguimiento realizado en Bogotá, en el cual se evaluó la resistencia a la levofloxacina en biopsias provenientes de pacientes sometidos a endoscopia, entre 2009 y 2014. Este trabajo halló que, en 2009, la resistencia fue del 11,8 %, mientras que en 2014 fue del 27,3 %. Los autores consideraron que este aumento es resultado del uso de dicho medicamento en tratamientos para infecciones del tracto respiratorio y urinario 56.
Tetraciclinas
Las tetraciclinas son empleadas en los regímenes cuádruples para la erradicación de H. pylori13. Estas presentan un efecto bacteriostático, al unirse de forma reversible a la subunidad ribosomal 30S, e inhiben la síntesis de proteínas. Las mutaciones descritas se hallan en el gen HPrrnA-16S, que codifica para el componente 16S de la subunidad menor (30S). Las más frecuentes involucran a los nucleótidos 926-928 (AGA→TTC). También se han registrado mutaciones dobles A926T/A928C, A926G/G927T, A926G/A928C y puntuales con la transición A926G o la transversión A939C 57-61.
En estudios realizados en Latinoamérica, se han reportado bajos valores de resistencia a la tetraciclina, que oscilan entre el 6 y el 14 % 12. Sin embargo, en el caso de Colombia, Yepes y colaboradores documentaron en 2008 que el 85,7 % (72/84) de las cepas aisladas en su estudio presentaban resistencia a dicho fármaco 34. Este dato difiere en gran medida con lo descrito en el continente.
Discusión
De acuerdo con los porcentajes de resistencia del H. pylori en Colombia, el metronidazol se destaca como el antibiótico que causa mayor resistencia en la bacteria (Tabla 1). En Bogotá, los valores de resistencia registrados oscilan entre el 72 y el 93 % 34,36,62, y en el Eje Cafetero el valor reportado llegó al 88 % 35. Entre tanto, en Popayán se realizó el único estudio genotípico y se encontró que la mutación más frecuente fue en D59N (78 %) 42. Los diferentes autores recomiendan no usar el metronidazol en el tratamiento de la infección por H. pylori en las ciudades del estudio. Por falta de más información, no es posible determinar la situación en el resto del país.
La claritromicina es el antibiótico con más estudios de resistencia en Colombia y muestra diferencias importantes. En el caso de Bogotá, los índices de resistencia a este medicamento han sido muy variables entre estudios: 13,6 y 60 % 29,34,36,62. Por su parte, en Tumaco el valor fue del 19,8 % 63, y en Armenia y Pereira la resistencia fue más baja, pues alcanzó el 2,2 35 y el 3,8 % respectivamente 64.
En Popayán, el valor de resistencia genotípica a la claritromicina fue del 4,3 %; la transición A2143G fue la más frecuente 65, mientras que en Antioquia fue del 18,8 %, con una frecuencia del 81,5 % de la transición A2143G 49.
De igual forma, la resistencia a la amoxicilina se evaluó en 3 estudios; 2 de estos, realizados en Bogotá. En ellos se presentaron cifras del 7 % en 2008 34 y del 3,8 % en 2010 36. El tercer estudio se efectuó en Tumaco y encontró una resistencia del 20,5 % 63.
Con respecto a los valores de resistencia a la levofloxacina en Colombia, se encontró una cifra del 11,8 % de las cepas estudiadas en Bogotá durante 2009, y del 27,3 %, en 2014 56. Los autores sugieren que este medicamento no debe ser considerado como un antibiótico de elección para el tratamiento empírico de la infección. Asimismo, la resistencia a la tetraciclina fue del 85,7 %. Dicho porcentaje proviene del único estudio que se ha desarrollado en nuestro país sobre la resistencia de H. pylori a este fármaco 34.
Por otra parte, 2 estudios han demostrado la aparición de cepas de H. pylori multirresistentes. El primero, realizado en Tumaco en 2012, detectó la presencia de cepas resistentes a la claritromicina y a la amoxicilina 63, mientras que el segundo, desarrollado por Arévalo y colaboradores en 2019, describió el hallazgo de cepas resistentes a 2 o más antibióticos (amoxicilina, claritromicina, levofloxacina y metronidazol). Estas cepas fueron provenientes de aislamientos de pacientes con 3 o 4 tratamientos fallidos 16.
Según la guía de práctica clínica para el diagnóstico y tratamiento de la infección por H. pylori en adultos, en Colombia se recomienda evitar la terapia triple combinada de amoxicilina, claritromicina y metronidazol o levofloxacina como tratamiento de primera línea, dado que existe evidencia que demuestra la resistencia primaria de la bacteria ante este tipo de manejo. Por tanto, se debe partir desde la epidemiología local para sugerir un tratamiento ajustado y adecuado, y evitar emplear antibióticos de manera empírica que puedan derivar en una falla terapéutica 14.
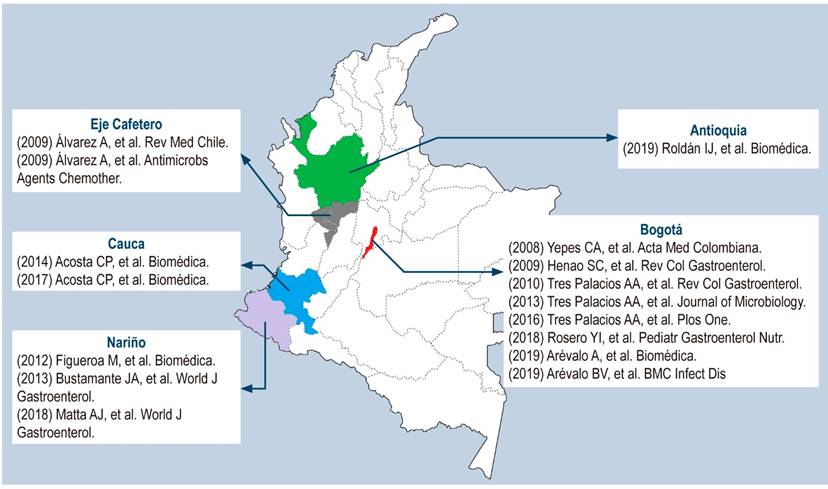
Los datos presentados en esta revisión muestran las variaciones existentes entre las poblaciones y señalan la importancia de determinar el patrón de resistencia de cada una. Esto, con el fin de permitir un seguimiento de la frecuencia con que se presentan las diferentes resistencias de las cepas circulantes en el país.
Es importante mencionar que los datos obtenidos en los estudios recopilados son aplicables solo a la población de estudio y no deben ser extrapolados al país en general. A continuación, se presenta un mapa, a manera de representación gráfica, de los estudios realizados en Colombia, y que fueron incluidos en esta revisión (Figura 2).
Así pues, los hallazgos de esta revisión señalan la necesidad de realizar más estudios que permitan determinar la resistencia de H. pylori en la población colombiana, a fin de definir los antibióticos que deben ser prescritos como primera línea o terapia de rescate.











 text in
text in