Introducción
La pancreatitis aguda (PA) es uno de los trastornos gastrointestinales más frecuentes, sus principales etiologías son los cálculos biliares y el alcohol 1,2.
Según los criterios de Atlanta, para su diagnóstico se requieren dos de los tres siguientes criterios: dolor abdominal compatible con PA, amilasa o lipasa elevados 3 veces sobre el límite superior normal, e imágenes características de PA demostradas por estudios de imagen 3,4.
El 80 % de los casos tiene un curso leve, mientras que un 20 % corresponde a pancreatitis moderadamente grave y grave. De estas, el 33 % presentará una necrosis infectada, alcanzando una mortalidad de aproximadamente 15 %-35 %, siendo la sepsis la principal determinante de la misma. 5.
Consecuencias de la restricción de la dieta
En 1904 el médico ruso Iván Pávlov ganó el premio Nobel en Medicina por sus trabajos en animales, sobre la fisiología de la digestión y la respuesta a los estímulos sobre la secreción de distintas glándulas. Esto fue extrapolado por otros investigadores, quienes asumieron que suprimir el estímulo alimenticio evitaría las distintas fases de la secreción pancreática y, por consiguiente, la liberación de enzimas y mayor daño tisular, teoría que se mantuvo por varios años, incluso actualmente varios médicos ven con recelo administrar alimentos de manera temprana en la PA 6.
Los actuales conocimientos sobre la fisiopatología de la PA han demostrado que la producción de diferentes sustancias proinflamatorias, sumadas a la restricción alimenticia, conducen a una alteración en la motilidad intestinal y en la microbiota sapróbica, facilitando el sobrecrecimiento bacteriano y la alteración de la barrera intestinal, lo que permite la translocación bacteriana mediante los ganglios linfáticos hacia la circulación sistémica, donde las endotoxinas bacterianas provocan la aparición de sepsis y falla multiorgánica 7,8. Esto se observa con mayor detalle en la Figura 1.
Nutrición temprana
Uno de los pilares fundamentales en el tratamiento de la PA durante muchos años fue la restricción de alimentos o el llamado reposo digestivo, mientras “mejoraba” el cuadro de PA, pues se consideraba que los estímulos generados por la alimentación favorecerían la liberación y activación de las enzimas pancreáticas, y generar mayor daño tisular 9. Actualmente, no existen bases que sustenten esta creencia y se ha demostrado en diferentes estudios que el inicio temprano de la nutrición enteral (es decir, en las primeras 24 a 48 horas de haber empezado el cuadro) mejora el balance nitrogenado y disminuye la incidencia de infecciones, la mortalidad y la estancia hospitalaria, y la estimulación pancreática exocrina es mínima 10-12.
Cabe resaltar el alto gasto metabólico producido durante una PA, especialmente en las pancreatitis graves, incrementa los requerimientos de distintos nutrientes encargados de mantener la homeostasis del sistema inmune y la regeneración tisular 13. Según las guías de la European Society for Clinical Nutrition and Metabolism (ESPEN), hasta un 80 % de los casos de pancreatitis aguda grave tiene una pérdida de proteína de 40 g/día llevando hacia un balance nitrogenado negativo 14.
Nutrición enteral frente a la nutrición parenteral
Desde hace aproximadamente 3 décadas se considera que la nutrición parenteral (NP) es la mejor vía de alimentación en PA, principalmente en casos graves, pese a que se conocían sus desventajas como un mayor riesgo de infección del catéter, alteración electrolítica, falla multiorgánica, costo y dificultad de colocación 15,16. Además, se debe considerar la hiperglucemia, la cual está presente en más de la mitad de los casos de NP, y constituye un factor de riesgo adicional para infecciones y mortalidad 17,18.
El conocimiento actual sobre el papel del intestino en la fisiopatología de la PA y la seguridad y tolerabilidad de la nutrición enteral (NE) han desplazado en uso de NP 19. En el metaanálisis de Al-Omran y colaboradores, el cual incluyó a 348 personas, demostró de manera significativa el beneficio de la NE en términos de mortalidad, infección, falla multiorgánica y necesidad de cirugía en comparación con la NP 20. Estos datos fueron corroborados con dos recientes metaanálisis, el primero incluyó a 348 personas y determinó una reducción significativa de la mortalidad y la falla multiorgánica a favor de la NE 21, y el segundo incluyó a 562 personas y determinó que hubo un menor riesgo de infección y necesidad de cirugía con el uso de la NE 22.
Inicio de la nutrición
Recientemente, la Asociación Americana de Gastro-enterología recomendó comenzar la dieta en las primeras 24 horas de iniciado el cuadro, puesto que favorece la integridad y funcionalidad intestinal, mantiene las uniones intercelulares y estimula las enzimas del borde en cepillo, evitando así la translocación bacteriana 23.
En el metaanálisis de Feng y colaboradores que incluyó a 1007 pacientes se determinó el beneficio de la NE en las primeras 48 horas, en términos de falla orgánica y desarrollo del síndrome de respuesta inflamatoria sistémica (SIRS), no encontró diferencia en relación con la mortalidad y la necrosis pancreática 24.
Una reciente revisión sistemática determinó que el inicio temprano de la NE en las primeras 48 horas redujo el riesgo de necrosis infectada, falla orgánica, necesidad de cirugía y mortalidad, comparado con NE tardía y NP 25.
El metaanálisis realizado por Qi y colaboradores determinó que la NE en las primeras 24 horas se asoció con una reducción de complicaciones infeccionas y falla multiorgánica en pancreatitis aguda grave, no se encontró beneficio en pancreatitis leves y moderadamente graves 26.
Una revisión sistemática, realizada en España concluyó que el mejor momento para iniciar la dieta es cuando existe la presencia de ruidos intestinales; además, utilizaron una dieta calórica completa, la cual fue bien tolerada, por lo que se logró reducir la estancia hospitalaria y se mejoró el curso de la PA 27.
Sonda nasogástrica (SNG) frente a la sonda nasoyeyunal (SNY)
Una reciente revisión de Cochrane demostró que no existen diferencias significativas entre el uso de la SNG y SNY, ambas lograron mantener la integridad de la barrea intestinal y la primera demostró ser mejor tolerada 28. En el metaanálisis de Chang y colaboradores no se encontraron diferencias entre el uso de SNG y SNY en términos de eficacia y seguridad 29.
El uso de SNY se reserva para aquellos casos de intolerancia a la SNG, obstrucción al tracto de salida gástrico, obstrucción duodenal y balance energético negativo con el uso de SNG 30. Otro beneficio que demostró el uso de la SNG fue la reducción del dolor, de la necesidad de opioides y de la intolerancia oral 31.
Composición de la dieta
No existe un consenso general sobre la composición ideal y el tipo de dieta, ya que la evidencia actual es limitada. En numerosos estudios se ha demostrado que aquellos que toleran la vía oral se beneficiaron de dietas bajas en grasa de composición sólida o líquida; esto actualmente supondría una ventaja, debido a que la práctica de ir modificando progresivamente la consistencia de la dieta produce un incremento innecesario en los días de estancia hospitalaria 32-35.
En el estudio realizado por Endo y colaboradores en 2018 no se encontró diferencia entre el uso de fórmulas elementales, semielementales y poliméricas 36. Larino-Noia y colaboradores, en un estudio realizado en España, no encontraron diferencias en la tolerancia a la dieta, iniciando la alimentación con una dieta sólida o dieta progresiva 37.
Uso de suplementos
Se ha propuesto el uso de distintos suplementos como probióticos, prebióticos o simbióticos, por su efecto sobre la microbiota y su papel protector, trófico y metabólico; y aunque se ha encontrado que el uso de estos podría asociarse con una disminución de la estancia hospitalaria, todavía no existe evidencia suficiente para recomendar su uso de manera rutinaria 38,39.
Respecto al uso de aminoácidos como arginina y glutamina, los cuales en teoría podrían tener algún beneficio al mantener la integridad intestinal, las guías de la American Society for Parenteral and Enteral Nutrition (ASPEN) no recomiendan su uso rutinario 40.
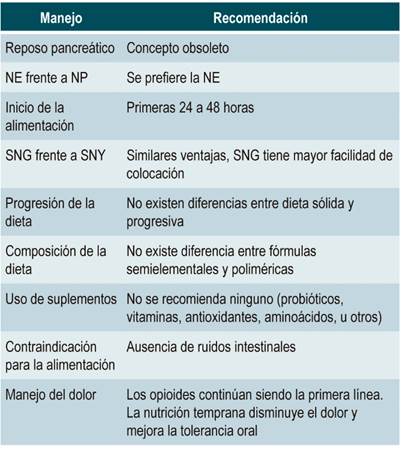
Los ácidos grasos ω-3, antioxidantes y vitaminas, cuya capacidad antinflamatoria podría suponer un beneficio en la PA, tampoco se han recomendado de manera rutinaria, puesto que se requieren más estudios que respalden su uso 41,42. En la Tabla 1 se resumen las principales recomendaciones de la nutrición en PA.
Conclusiones
El concepto de reposo pancreático actualmente es obsoleto. El inicio temprano de la dieta no causa estimulación ni daño pancreático adicional. El efecto benéfico de la alimentación temprana sobre la barrera intestinal se asocia con una menor translocación bacteriana, menor riesgo de SIRS y menor mortalidad. La vía enteral es ampliamente superior a la parenteral. No existen diferencias entre el uso de SNG y SNY, y en caso de estar indicada, se prefiere la SNG por su facilidad de colocación. El dolor no es una indicación para suspender la dieta, por lo que es necesario optimizar la analgesia con el fin de continuar la alimentación, ya que la misma se asocia con una menor necesidad de opioides y disminución de la intensidad del dolor.











 text in
text in