Introducción
El ultrasonido endoscópico (USE) es un método híbrido, en el que se utiliza un equipo de endoscopia como vehículo con un transductor de ecografía de alta resolución en su parte distal. De esta forma se obtienen imágenes endoscópicas y ecográficas con las cuales se pueden explorar lesiones dependientes de la pared gastrointestinal o extradigestivas aprovechando las relaciones anatómicas del tracto gastrointestinal con los órganos intraabdominales. Esta técnica nació en Japón en 1980, en 3 instituciones donde crearon el primer prototipo y fue desarrollado por la compañía Olympus Co Ltd. Este método se diseñó con el fin de crear un instrumento diagnóstico para el estudio del carcinoma pancreático pequeño 1. En Colombia se introdujo esta técnica en 1994 por el Dr. Luis Carlos Sabbagh, quien años más tarde, en respuesta a la necesidad de entrenamiento en países de Centro y Suramérica, fundó el Centro de formación en ultrasonido endoscópico avalado por la Organización Mundial de Gastroenterología. La utilización y aplicaciones del USE se han expandido a muchos sitios en Colombia y en la actualidad hay instituciones grandes en el país donde este método es utilizado por grupos multidisciplinarios con un enfoque diagnóstico y terapéutico.
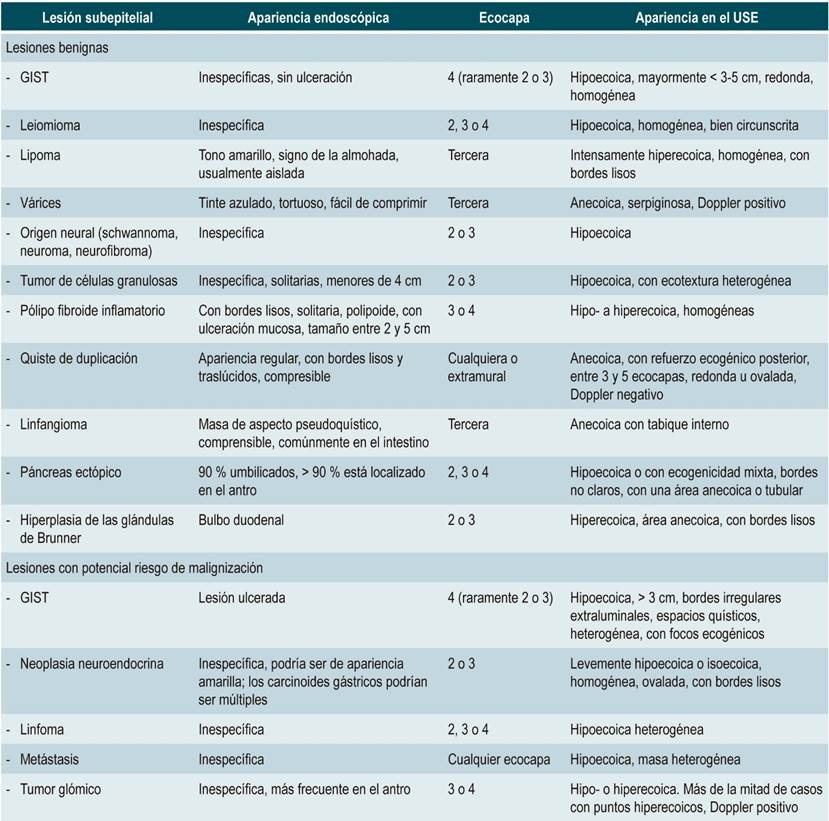
El conocimiento y el avance en esta técnica ha crecido de forma vertiginosa. En la actualidad se dispone de equipos con mejor definición, transductores de excelente resolución utilizados con fines diagnósticos (equipo con transductor radial [Figura 1 A y C] y el equipo con transductor lineal [Figura 1 B y D]) que suele utilizarse para la toma de citología o biopsias con aguja fina de lesiones sólidas y para procedimientos terapéuticos como el drenaje de colecciones y la ablación de tumores sólidos, entre otras aplicaciones.
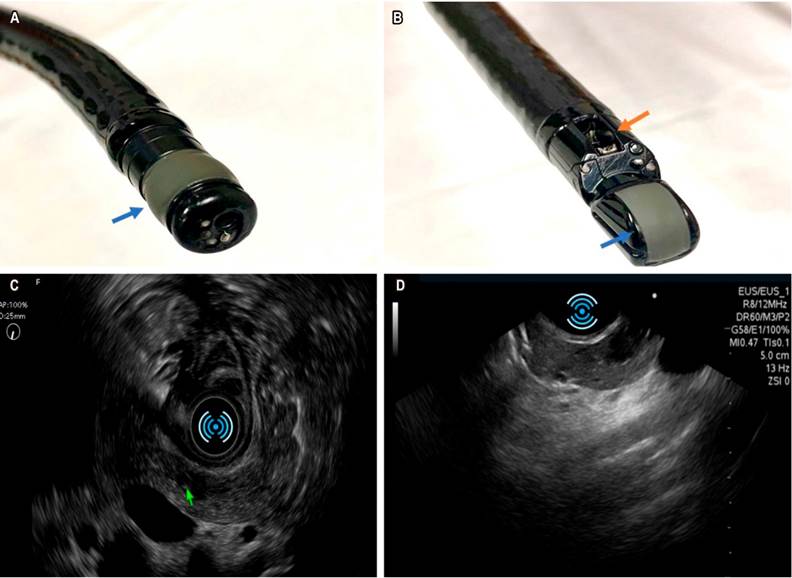
Figura 1 A. Equipo con transductor radial: la visión endoscópica es frontal, la imagen sonográfica es radial; la flecha azul señala el transductor radial. B. Transductor lineal: visión endoscópica oblicua, visión sonográfica sectorial; la flecha azul señala el transductor y la flecha naranja señala el canal de trabajo que queda en disposición perpendicular en relación con el transductor. C. Visión sonográfica radial, documentación de una lesión hipoecoica ovalada en el cuello del páncreas compatible con tumor neuroendocrino. D. Visión con transductor lineal de la misma lesión en el cuello del páncreas.
La Asociación Americana de Gastroenterología considera que tiene privilegios o competencias para realizar este procedimiento un médico gastroenterólogo o cirujano gastrointestinal, que realice un entrenamiento Hands-on en un centro de enseñanza que cuente con un número adecuado de procedimientos/año, además de que el estudiante tenga una experiencia suficiente en la colangiopancreatografía retrograda endoscópica (CPRE). En relación con las competencias para poder realizar con seguridad este procedimiento, diferentes sociedades científicas como la Sociedad Americana de Gastroenterología y Endoscopia Digestiva (ASGE), la Sociedad Europea de Gastroenterología y Endoscopia (ESGE) y la Sociedad Británica de Gastroenterología (BSG) recomiendan que durante el entrenamiento el estudiante realice entre 225-250 procedimientos supervisados por un experto y, de estos, entre 50 y 75 punciones 2,3.
La endosonografía es un método seguro en manos entrenadas. En los procedimientos diagnósticos se describe que las complicaciones son similares a la endoscopia digestiva superior. En los casos terapéuticos que se realizan con el transductor lineal podría aumentar el riesgo de perforación en el cricofaríngeo hasta 2 veces respecto a la endoscopia convencional debido a la mayor rigidez, el mayor diámetro del equipo y la visión endoscópica oblicua 4,5. Además, los riesgos son inherentes a la diana o lesión/colección a puncionar. Los eventos descritos con más frecuencia son perforación (0,03 %), sangrado (0,13 %), pancreatitis aguda en punciones del páncreas (en el rango de 0 % a 2 %) y la peritonitis biliar es extremadamente rara (escasos reportes de casos) 6.
Aplicaciones actuales del use
Evaluación de lesiones subepiteliales (LSE)
Las lesiones subepiteliales son tumores que se originan de capas profundas correspondientes a la capa muscular de la mucosa, capa submucosa o capa muscular propia del tracto digestivo. Son más frecuentemente observadas en el estómago, donde se podrían identificar en una de 1 de cada 300 endoscopias realizadas 6. Se identifican como elevaciones o protrusiones de la mucosa, la mayoría son menores de 2 cm de diámetro, suelen identificarse en la realización de exámenes endoscópicos de rutina en forma incidental. En algunos casos estas lesiones se pueden presentar en el contexto de sangrado, obstrucción o metástasis. La importancia del estudio de las LSE es que la apariencia endoscópica de dichas lesiones puede ser similar y hasta un 15 % de estas pueden ser malignas o con riesgo potencial de malignización 7. La endosonografía se considera como la técnica más precisa para la evaluación de lesiones subepiteliales debido a su capacidad de definir con certeza las capas histológicas y, por tanto, el sitio más probable de origen del tumor (Tabla 1). Además, es superior a otras modalidades de imágenes como la tomografía axial computarizada (TAC) o la resonancia magnética (RMN) en la caracterización de lesiones pequeñas (< 2 cm) 7, ya que puede distinguir con precisión entre la compresión extrínseca del tracto gastrointestinal y un crecimiento intramural.
Tabla 1 Características endoscópicas y endosonográficas de las lesiones subepiteliales en el tracto digestivo
GIST: tumor del estroma gastrointestinal. USE: ultrasonido endoscópico. Adaptado de: Standards of Practice Committee et al. The role of endoscopy in subepithelial lesions of the GI tract. Gastrointest Endosc. 2017;85(6):1117-1132.
En las lesiones de la pared gastrointestinal se logran identificar las 5 ecocapas principales: la primera y segunda (mucosa que incluye la capa muscular de la mucosa), la tercera (submucosa), la cuarta (la capa muscular propia) y la quinta (serosa o adventicia) (Figura 2 A). También permite la medición del tamaño de la lesión y la evaluación de cualquier linfadenopatía asociada para su posterior estadificación. En el grupo de lesiones que tienen un riesgo potencial de malignizarse se encuentra el tumor del estroma gastrointestinal (GIST) y la mayoría de estos son gástricos (constituye entre el 60 % y 70 % de todos los casos) (Figura 2 B), 20 %-30 % se ubican en el intestino delgado y un poco menos del 5 %, en el esófago. Respecto al diagnóstico de GIST, el objetivo de la obtención de tejido es recoger material que demuestre células fusiformes, además de la realización de inmunohistoquímica (IHQ). En la IHQ se recomienda realizar las tinciones de CD117, DOG1, S100, CD34 y PDGFRA; con estas se logra diferenciar de forma adecuada el GIST de otras lesiones subepiteliales 8. Tradicionalmente, la punción/aspiración con aguja fina USE-guiada (USE-PAAF) ha sido el método para obtener tejido. El rendimiento diagnóstico es muy variable (entre 46 % y 93 %) y, en general, es limitado porque el tamaño de muestra podría ser insuficiente para realizar IHQ. En un estudio multicéntrico reciente se compararon la biopsia con aguja fina (USE-BAAF) frente al USE-PAAF en el rendimiento en la obtención de muestras para citopatología, en la capacidad de obtener un diagnóstico basado en IHQ y el rendimiento diagnóstico definitivo. Los resultados en muestras de citopatología fueron de 92 % frente a 46 % (p = 0,001), 89 % frente a 41 % en IHQ (p = 0,001) y 89 % frente a 37 % en diagnóstico definitivo (p = 0,001) entre los grupos BAAF frente a PAAF, respectivamente. Los autores concluyen que el USE-BAAF es superior al USE-PAAF en el rendimiento diagnóstico histológico del GIST 9.
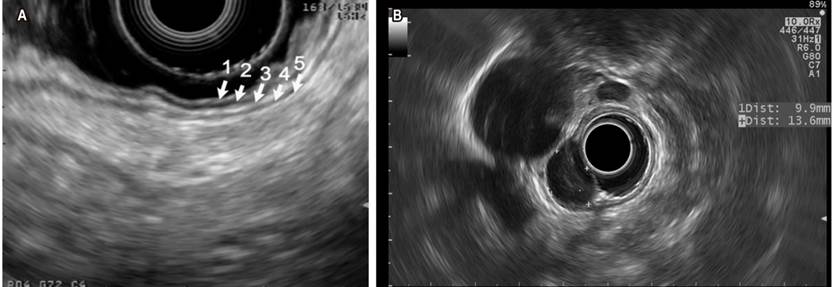
Figura 2 A. Visión endosonográfica con transductor lineal de las ecocapas de la pared gástrica normal. B. Lesión ovalada hipoecoica homogénea correspondiente a GIST de la cuarta ecocapa, evaluada con transductor radial. Imágenes cortesía del Dr. Cañadas, Clínica Marly.
En un estudio publicado recientemente, se observó una precisión general del USE del 64,2 %, en comparación con la TAC, del 50,9 %. En particular, respecto a la precisión del USE frente a la TAC para GIST, leiomiomas y páncreas ectópico, los resultados fueron de 83,9 % frente a 74,2%, 37,5 % frente a 0,0 %, y 57,1 % frente a 14,3 %, respectivamente. La mayoría de los diagnósticos incorrectos en USE se refería a lesiones hipoecoicas originadas en la cuarta ecocapa, y las lesiones mal diagnosticadas más comunes son el GIST que se confunde con leiomioma y viceversa 10.
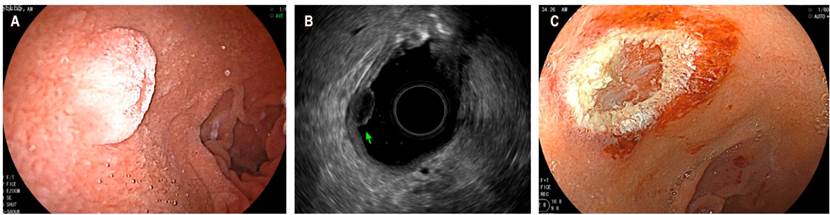
Otra indicación actual del USE es en la caracterización de lesiones subepiteliales, en las que se evalúa su profundidad para definir resecciones endoscópicas. En la Figura 3 se observa un tumor neuroendocrino de la segunda ecocapa donde se realiza mucosectomía con fines curativos.
Diagnóstico y estadificación de tumores de esófago
El cáncer de esófago es la sexta causa de cáncer en el mundo, se diagnostica generalmente en pacientes con síntomas de reflujo de larga data o con disfagia, a quienes se les realiza una endoscopia con toma de biopsias. En ocasiones, el diagnóstico se realiza mediante estudios imagenológicos como la TAC de abdomen en el escenario de dolor abdominal o de pérdida anormal de peso o con menor frecuencia como hallazgo incidental. Por esta razón, la mayoría de veces el diagnóstico de cáncer de esófago se realiza en estadios avanzados.
En la actualidad, para la estadificación de los tumores esofágicos y de la unión gastroesofágica se utiliza la clasificación de la Unión Internacional para el Control del Cáncer (UICC) y la clasificación TNM (tumor, ganglios, metástasis) que se encuentra actualmente en su 8.ª edición. De los cambios de interés entre la 7.ª y 8.ª edición de TNM es la reclasificación de los estadios. El estadio IIIB y IIIC (T3-4a N1-3) de la séptima edición se reclasificaron como estadio IVA, y la enfermedad M1 se clasifica como estadio IVB. Estos pacientes tienen un mal pronóstico, tan pobre como los individuos con enfermedad metastásica. Otro cambio en la 8.ª edición de TNM es la separación de los tumores T1 en tumores T1a y T1b. Esta diferenciación es importante porque el riesgo de metástasis ganglionares aumenta del 3 % al 6 % para los tumores de la mucosa T1a, al 21,24 % para los tumores submucosos T1b 11. Esta diferenciación de los tumores T1 es importante para guiar las decisiones sobre el tratamiento endoscópico frente al quirúrgico 12 y, en este escenario, el papel del USE es fundamental. La estadificación inicial se podría hacer con TAC de tórax y abdomen contrastado para definir si la enfermedad es irresecable o identificar metástasis a distancia. Si se considera que el paciente tiene una enfermedad potencialmente curable, entonces se recomienda la tomografía por emisión de positrones (PET scan), seguida de la endosonografía. La laparoscopia diagnóstica debe realizarse solo en pacientes con un tumor esofágico que se extienda al estómago.
El orden óptimo de realización de las investigaciones es discutible, aunque en general se está de acuerdo con que el PET scan debe realizarse antes que el USE. La enfermedad incurable a distancia detectada en la PET scan evitaría que un paciente se sometiera a el USE, lo que disminuye riesgos y costos relacionados con el procedimiento. Se ha descrito que el USE influye en las decisiones de tratamiento en el 29 % de los pacientes, principalmente en el diagnóstico de metástasis ganglionares y en la definición del volumen tumoral bruto durante la planificación de la radioterapia 12. Se ha demostrado que las mediciones del tumor con PET scan y de la longitud de la enfermedad difieren significativamente, y que tiende a producir menores dimensiones 13. En conclusión, el PET scan es el método de elección para la metástasis, aumentando en un 38 % la eficiencia diagnóstica con respecto a la TAC 14.
En general, se considera que el USE actualmente es el estándar de oro para la evaluación de la etapa locorregional, ya que es el método de elección para la T y la N (Figura 4) 12. Además, tiene la ventaja sobre otros métodos por la posibilidad de realizar punciones o biopsias con aguja fina (aumentado así la especificidad). Se describen 3 limitaciones: que es un procedimiento dependiente del operador, que en la mayoría de casos se requiere sedación y los riesgos inherentes a la técnica y la imposibilidad de pasar la lesión en caso de tumores estenosantes. En este último aspecto, se describe que la falta en el paso de la estenosis tumoral se presenta aproximadamente en el 30 %, estas cifras se reducen hasta el 3 % usando minisondas 15.
Diagnóstico y estadificación de tumores gástricos
El cáncer gástrico se considera el cuarto cáncer más prevalente en el mundo y el tercero en Colombia. Este es considerado el segundo cáncer con mayor mortalidad en el mundo. La detección temprana impacta de forma significativa en el pronóstico, el problema más importante es que la mayoría de pacientes suelen consultar en estadios avanzados de la enfermedad. Para dimensionar el impacto que tiene el momento del diagnóstico, la supervivencia a 5 años en países europeos es entre 10 % y 30 %, mientras que en Japón (donde se hacen campañas masivas de tamización) la supervivencia a 5 años es tan alta como un 90 % 16.
El USE es el mejor método disponible para evaluar los tumores y ganglios. Este tiene mayor rendimiento que la TAC y que la RMN para los ganglios, especialmente porque se pueden obtener muestras mediante punción o biopsia por aspiración con aguja fina, pero no es muy útil para evaluar la metástasis, por lo que habitualmente se solicita esta herramienta como complemento del PET scan, RMN o TAC 17.
En un metaanálisis de 4397 pacientes se pudo establecer la utilidad de la endosonografía para discriminar los carcinomas gástricos superficiales (T1 a T2; con un radio bajo la curva de 0,86) de los avanzados (T3 a T4; con un radio bajo la curva de 0,9). En términos generales, la capacidad de la endosonografía para establecer si se trata de un adenocarcinoma limitado a la mucosa o de un cáncer gástrico invasor se da con una sensibilidad y especificidad de 0,85 (intervalo de confianza [IC] 95 %: 0,78 a 0,91) y 0,90 (IC 95 %: 0,85 a 0,93), respectivamente. En este estudio se pudo establecer que, a pesar del buen rendimiento diagnóstico, la razón de probabilidad positiva y negativa no fue suficiente para recomendarlo como examen único, por lo cual habitualmente se solicita esta herramienta como complemento del PET scan, RMN o TAC 18.
En un estudio europeo en el que se comparó la endosonografía frente a la TAC multidetector (TACMD) en cuanto al rendimiento diagnóstico en la estadificación locorregional del adenocarcinoma gástrico, se evaluaron 77 pacientes quirúrgicos con adenocarcinoma gástrico, de los cuales 42 tuvieron una estadificación preoperatoria completa y, finalmente, fueron incluidos en el estudio. Con respecto a la precisión general de la estadificación T, la endosonografía fue superior al TACMD (62 % frente a 50 %). En un subanálisis de estadios tempranos (T1-T2) y avanzados (T3-T4), la precisión y sensibilidad fueron mayores para el USE (83,3 % frente a 64,29 % y 84,4 % frente a 59,5 %, respectivamente), aunque esto no alcanzó a ser estadísticamente significativo. La precisión y sensibilidad general del USE para la estadificación de la N fue menor que la de la TACMD, aunque ninguna de las comparaciones alcanzó a ser estadísticamente significativa (57 % frente a 64 % y 29 % frente a 55 %). Por lo anterior se concluyó que el rendimiento diagnóstico del USE es similar al de la nueva TACMD con respecto a la estadificación preoperatoria de T y N del adenocarcinoma gástrico; sin embargo, ambas técnicas deben considerarse complementarias hasta que estudios más grandes y aleatorios puedan confirmar estos resultados 19.
Diagnóstico en tumores colorrectales: pólipos rectales de alto riesgo
En lesiones rectales polipoides no pediculadas mayores a 2 cm de diámetro es importante establecer la probabilidad de invasión a capas profundas para definir la mejor técnica de resección (endoscópica mediante mucosectomía frente a disección endoscópica de la submucosa o técnicas quirúrgicas mínimamente invasivas). Algunos expertos sugieren realizar imágenes complementarias como el USE para definir la técnica de resección ideal en lesiones de alto riesgo como en displasia de alto grado, 0-IIa+c de París, extensión lateral no granular, patrón de Kudo V o mayores a 3 cm 20. Las lesiones con invasión profunda de la submucosa (sm) tienen un riesgo elevado de metástasis ganglionar (sm1 del 2 %, sm2 del 8 % y sm3 del 23 %); por tanto, su manejo debe ser quirúrgico. En este contexto, la RNM tiene un rendimiento variable para definir el grado de invasión de las lesiones polipoides en el recto, particularmente en lesiones polipoides T1 (pT1), en las que la precisión de la profundidad de invasión es variable, desde un 25 % hasta un 98 % 21. En un metaanálisis de 42 estudios con 5309 pacientes, se encontró una sensibilidad y especificidad del USE para la estadificación de lesiones rectales T1 del 88 % y 98 % respectivamente; y del 80 % y 96 %, respectivamente, en lesiones T2. Es por esto que el USE se sugiere como la mejor estrategia diagnóstica para abordar lesiones tempranas (pT1), mientras que la RNM se recomienda para valorar lesiones pT2 o más avanzadas 22.
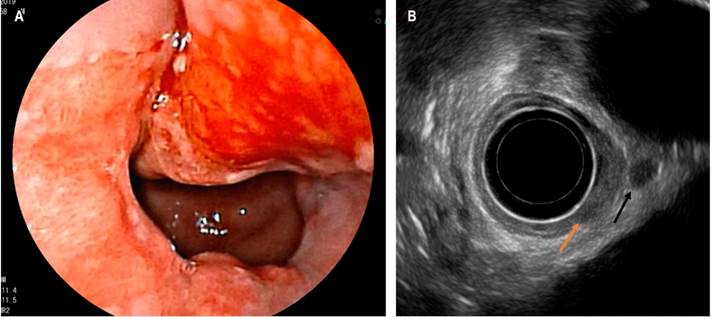
La Sociedad Europea de Radiología Abdominal y Gastro-intestinal (ESGAR), en su guía para el estudio de neoplasias de recto, sugiere que el USE es el método de elección para la diferenciación y estadificación de lesiones T1 rectales (Figura 5) 23. Se ha descrito que, en las lesiones polipoides del recto, el USE reduce el riesgo de carcinoma no diagnosticado del 21 % al 3 %, al compararse con la endoscopia convencional 24. En este contexto, se ha comenzado a valorar el uso de la elastografía por USE para medir las propiedades elásticas como la dureza del tejido y, de este modo, poder diferenciar entre pólipos benignos y malignos rectales. Un estudio demostró que la elastografía podría diferenciar adenomas benignos de adenocarcinoma invasivo con una sensibilidad del 96 %, especificidad del 86 % y una precisión diagnóstica del 94 % al corroborarse con la patología 25.
Cáncer de recto
La adecuada estadificación del cáncer de recto es crucial para establecer el pronóstico y el manejo más apropiado para el paciente. Cuando se utiliza como método de estadificación en cáncer de recto para definir la T (tumor), se propone la clasificación uT (Tabla 2) 26. El USE podría tener la ventaja en estadificar la T en lesiones tempranas (T1), pero su rendimiento es inferior a la RNM en cuanto a la precisión en la estadificación de lesiones T2 en adelante 22. Un metaanálisis publicado en 2004 demostró un rendimiento diagnóstico similar en la estadificación de la N (ganglios) en tumores de recto para el USE y la RNM con una sensibilidad y especificidad del 67 % y 78 % y del 66 % y 76 %, respectivamente 27.
Tabla 2 Estadificación por USE del cáncer rectal (clasificación uT)

Modificado de: Marone P et al. Role of endoscopic ultrasonography in the loco-regional staging of patients with rectal cancer. World J Gastrointest Endosc. 2015;7(7):688-701.
Las guías del National Comprehensive Cancer Network (NCCN) en su versión actualizada del 2020 sugiere que, en las lesiones polipoides con focos de carcinoma invasivo llevadas a resección endoscópica y cuya muestra histopatológica esté fragmentada, con bordes no definidos o con histología no favorable, se debe realizar RNM como primer estudio de estadificación previo a llevar resección quirúrgica ya sea transanal o transabdominal. Esta guía sugiere la realización del USE si la RNM está contraindicada o para lesiones superficiales 28. Para la estadificación inicial de tumores de recto, de igual manera, sugieren como primer estudio la RNM pélvica y se reserva el USE en pacientes con RNM contraindicada. En cuanto al seguimiento de pacientes llevados a resección quirúrgica transanal, sugieren evaluar la anastomosis con USE o RNM cada 3 a 6 meses por los primeros 2 años y luego cada 6 meses por 5 años para descartar recaídas locales 28,29.
Diagnóstico y estadificación de tumores sólidos biliopancreáticos
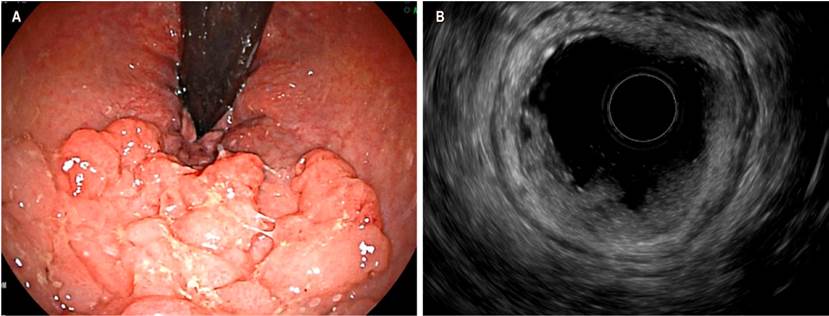
El cáncer de páncreas es altamente letal, es la cuarta causa de muerte por cáncer en Estados Unidos. El tratamiento quirúrgico mediante una duodenopancreatectomía con técnica de Whipple es una opción curativa, pero solo el 15 % de los pacientes es candidato en el momento de presentación. En estadios avanzados, la supervivencia con quimioterapia es 8,5 meses (30). El USE ha sido un método que ha venido ganando terreno en el abordaje de patologías biliopancreáticas, con una precisión diagnóstica que varía entre el 78 % y 98 %. El rendimiento diagnóstico del USE aumenta cuando se adiciona PAAF o BAAF (lesión sólida en la cabeza de páncreas en la que se realizó una PAAF, Figura 6).
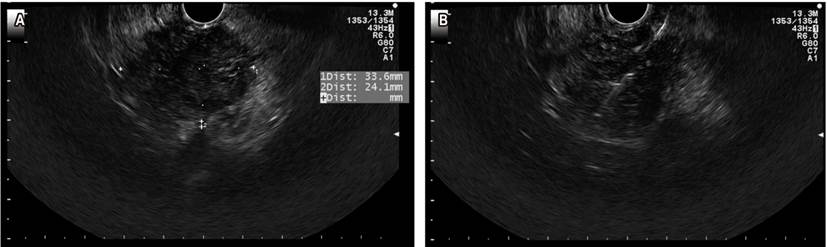
Figura 6 A. Lesión sólida en la cabeza del páncreas. B. PAAF de la lesión. Imagen cortesía del Dr. Cañadas, Clínica Marly.
La precisión diagnóstica está influenciada por factores propios de la lesión como la localización, tamaño y tipo; de aspectos técnicos como el número de pases; la técnica utilizada para el muestreo (aspiración, técnica de slow pull, técnica de Fanning); la experiencia del endoscopista; y entre los factores menos estudiados está la presencia de patólogo en sala.
El USE-PAAF es el método de elección para la toma de muestras de lesiones sólidas pancreáticas 30-32. Se considera que es más sensible que la TAC de abdomen y que la RMN en lesiones menores de 10 mm de tamaño. Además, es un método seguro y costo-efectivo ya que provee un alto rendimiento diagnóstico 33. Consideramos que una de las claves para obtener los mejores resultados en relación con las punciones por USE es obtener un material suficiente/representativo de la lesión y transferir adecuadamente al laboratorio de patología. En algunos centros de referencia mundial se ha realizado el USE-PAAF con patólogo en sala, esto ha permitido disminuir el número de pases y, en general, aumentar el rendimiento de la prueba. Recientemente, el grupo de trabajo del HPTU de Medellín mostró su experiencia preliminar de las punciones y biopsias biliopancreáticas con patólogo en sala (Figura 7). En este trabajo se resalta que dicha estrategia permitió obtener una alta eficiencia diagnóstica (cercana al 90 %), con escasos falsos negativos 34.
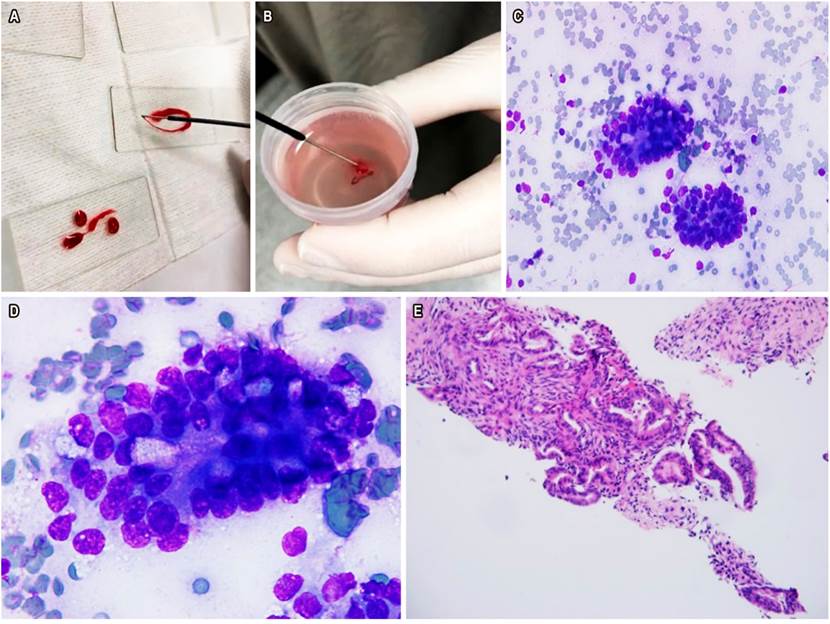
Figura 7 A. Extendido de tejido pancreático en sala de endoscopia. B. BAAF colocada en un frasco con formol. C. Citología con Diff-Quick 40x: evidencia de adenocarcinoma ductal de páncreas. D. Citología Diff-Quick 100x con adenocarcinoma ductal. E. BAAF con evidencia de adenocarcinoma ductal. Imagen cortesía del Dr. Mosquera-Klinger, HPTU.
Aplicaciones en desarrollo
Ablación guiada por endosonografía de tumores neuroendocrinos (insulinoma)
El insulinoma pancreático esporádico es un tumor benigno en las células β de los islotes de Langerhans, generalmente solitario y menor de 20 mm. Cuando es funcionante, los pacientes experimentan síntomas relacionados con la producción excesiva de insulina. Se describe la triada de Whipple (síntomas de hipoglucemia, hipoglucemia venosa, desaparición de síntomas con la corrección en los niveles de glucemia). El diagnóstico es clínico, con confirmación bioquímica y radiológica. El tratamiento suele ser quirúrgico, ya sea mediante duodenopancreatectomía con técnica de Whipple, pancreatectomía distal o total, o enucleación según el tamaño y la localización.
En 1999 se describió la ablación por radiofrecuencia USE-guiada en modelos porcinos 35; posteriormente, se iniciaron a describir casos de tratamientos en lesiones sólidas pancreáticas como una medida paliativa en pacientes con alto riesgo quirúrgico 36-38. En la actualidad, se está desarrollando la ablación USE-guiada como tratamiento de insulinomas pancreáticos en pacientes con múltiples comorbilidades que no sean candidatos a cirugía o quienes rechacen la cirugía 39-43. En Colombia, realizamos los 2 primeros casos de ablación mediante etanolización en 2 mujeres que debutaron con coma en el contexto de hipoglucemia hiperinsulinémica y elevación concomitante del péptido C. En ambos casos, la RMN de abdomen fue reportada como normal y asociada con hallazgos endosonográficos compatibles con tumor neuroendocrino. Resaltamos que en ambos casos se resolvió de forma inmediata la hipoglucemia después de la ablación, sin complicaciones y con una mejoría completa de sus síntomas (en el seguimiento a 12 meses) 44.
Punciones esplénicas por USE
El estudio histológico de las lesiones focales esplénicas o de la esplenomegalia de origen incierto ha sido limitado por el riesgo que supone la realización de punciones a nivel esplénico. El evento adverso más importante descrito es el sangrado (hemoperitoneo o hematoma capsular), aunque también se pueden presentar lesiones de estructuras vecinas como la pleura, el pulmón, el ángulo esplénico del colon y lesiones vasculares per se45,46. Los métodos no invasivos se prefieren a la cirugía, ya que las biopsias esplénicas por laparoscopia requieren anestesia general y están limitadas a casos que tengan lesiones visibles en la superficie del órgano. En cuanto al rendimiento diagnóstico, en un estudio publicado por Werner y colaboradores se logró el diagnóstico en casi el 70 % de los pacientes con biopsias tomadas por laparoscopia 47. Respecto a las biopsias por aspiración percutáneas, el Dr. Soderstrom publicó un trabajo con más de 1000 biopsias por aspiración a ciegas, en las que no hubo complicaciones mayores 48. Posteriormente, aparecieron varios manuscritos que describen las biopsias percutáneas con aspiración por aguja fina, guiada por ecografía y TAC en enfermedades benignas y malignas esplénicas, y mostró buenos resultados en términos de eficacia y seguridad 49-51. En Italia, se realizó un estudio multicéntrico que incluyó 398 pacientes en quienes se realizaron BAAF percutáneas guiadas por ultrasonido 45. En dicho estudio se presentaron complicaciones del procedimiento en el 5,2 % de los pacientes. Las biopsias percutáneas tienen limitaciones en pacientes obesos, con historia de intervenciones quirúrgicas abdominales y con ascitis; además, se requiere en todos los casos el servicio de radiología intervencionista con alta experiencia.
El USE para PAAF del bazo es posible gracias a la proximidad del bazo con la pared gástrica y la ventaja es la visualización en tiempo real de la aguja y de sus movimientos. Recientemente, se publicó la experiencia de un centro europeo, en la que se describió que se obtuvo un diagnóstico histopatológico concluyente en el 66,7 %, de los cuales la mitad se relacionó con linfoma con compromiso esplénico. Uno de los datos más relevantes de este estudio es que no se presentaron complicaciones y se concluye que el USE-PAAF esplénico es necesario o de primera opción en pacientes con sospecha de malignidad o de filiación etiológica incierta, en el escenario de esplenomegalia o lesiones ocupantes de espacio esplénicas sospechosas o de pequeño tamaño que tengan limitaciones a la toma de biopsias percutáneas 52.
Conclusiones
La endosonografía tiene múltiples aplicaciones como método diagnóstico en la estadificación de tumores gastrointestinales. Es un método complementario a otras modalidades de imagen como la TAC, la RMN, PET scan en la estadificación de las neoplasias de esófago, estómago y recto. Tiene mayor rendimiento en la estadificación de la T (tumor) y la N (ganglio) para estas 3 neoplasias.
Es el método de elección en la evaluación de lesiones subepiteliales, ya que puede discriminar con bastante especificidad la ecocapa afectada, así mismo caracterizar el tipo de lesión, tamaño y la ubicación de las mismas.
Es el método con mayor rendimiento diagnóstico en lesiones pancreáticas menores de 10 mm, aumentando su especificidad gracias a la posibilidad de tomar punción con aspiración o biopsias de la lesión.
La ablación USE-guiada es un método prometedor en el tratamiento del insulinoma pancreático funcionante en pacientes no candidatos quirúrgicos o quienes rechacen la cirugía. La otra aplicación emergente es la toma de punciones y biopsias esplénicas USE-guiadas en el escenario de pacientes con fiebre de origen desconocido, pérdida anormal de peso que tengan lesiones ocupantes de espacio o esplenomegalia no filiada.











 text in
text in