Introducción
La acalasia es un trastorno motor primario y una entidad rara con una incidencia anual de 1/100 000 personas1,2. Es una enfermedad degenerativa, adquirida, caracterizada por la pérdida selectiva de neuronas inhibitorias del plexo mientérico que conlleva a alteraciones motoras del esófago, secundario a falta de relajación del esfínter esofágico inferior (de ahí proviene su nombre: a: “sin”, calasia: “relajación”). Poco más del 5 % de estos pacientes será llevado a esofagectomía en estadios avanzados de la enfermedad, con resultados variables en términos de mejoría sintomática y pronóstico a largo plazo 3. Se presenta el caso de un paciente con megaesófago en el contexto de acalasia de largo tiempo de evolución.
Presentación del caso
Hombre de 42 años, conductor, sin antecedentes de importancia, quien consultó por un cuadro de 3 años de evolución de disfagia progresiva inicialmente para sólidos y luego para líquidos, y regurgitación; con un aumento de los síntomas en los últimos 4 meses, se asocia con pérdida de 15 kg de peso (Eckardt 9). Al ingreso tenía signos de desnutrición grave y halitosis, sin disnea, adenomegalias periféricas, visceromegalias o ascitis. Se pasó una sonda nasogástrica y se obtuvo un drenaje alimentario abundante. Se realizó una radiografía de tórax en la que se registró una aparente masa mediastinal que desplaza la línea media (Figura 1). Ante este hallazgo y tos seca persistente, se complementa con una tomografía axial computarizada (TAC) de tórax con contraste, en la que se reportó megaesófago y hallazgos sugestivos de acalasia, sin poder descartar un compromiso neoplásico en la unión gastroesofágica (Figura 2).
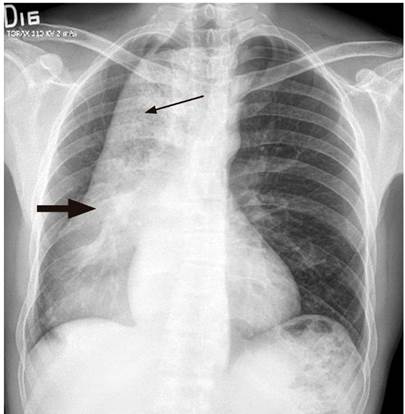
Figura 1 Radiografía de tórax, proyección posteroanterior (PA). Masa mediastinal que se extiende hacia la derecha y posterior al mediastino (flecha gruesa). Nivel hidroaéreo irregular y contenido de opacidad heterogénea, sugestiva de alimento (flecha delgada). Fuente: Unidad de Gastroenterología. Hospital Universitario San Ignacio. Bogotá D.C. Colombia.
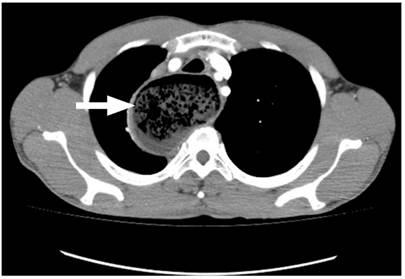
Figura 2 TAC de tórax contrastado. Dilatación esofágica, con diámetro transverso máximo de 7 cm, de paredes tortuosas. Material heterogéneo, sugestivo de contenido alimentario (flecha gruesa). Fuente: Unidad de Gastroenterología. Hospital Universitario San Ignacio. Bogotá D.C. Colombia.
En la esofagogastroduodenoscopia se encontraron restos de contenido alimentario en el esófago, el cuerpo esofágico estaba gravemente dilatado, tortuoso, con angulaciones y la unión gastroesofágica estaba puntiforme, aunque se lograba franquear con dificultad (Figura 3). El esofagograma con bario indicó un cuerpo esofágico gravemente dilatado, con el esófago inferior de patrón sigmoideo (Figura 4).
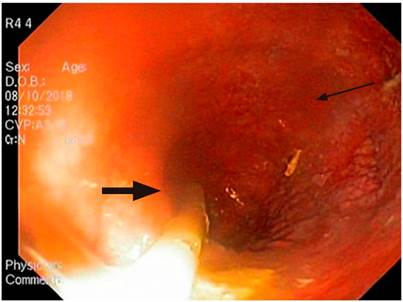
Figura 3 Esofagogastroduodenoscopia (endoscopia de las vías digestivas altas [EVDA]). Luz esofágica en su segmento proximal de calibre aumentado, con presencia de sonda nasogástrica y restos alimentarios no digeridos (flecha gruesa). Mucosa congestiva, sin estigmas de sangrado reciente (flecha delgada). Fuente: Unidad de Gastroenterología. Hospital Universitario San Ignacio. Bogotá D.C. Colombia
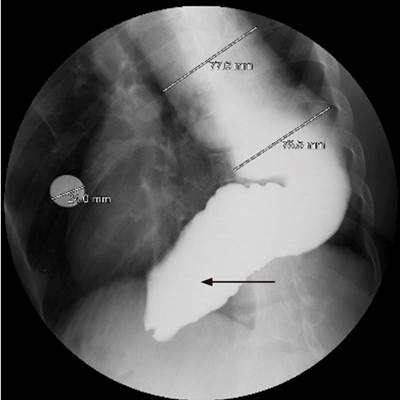
Figura 4 Esofagograma con bario. Unión gastroesofágica por debajo del hemidiafragma izquierdo, en la que se identifica una alteración en la relajación del esfínter esofágico inferior, lo que condiciona el retraso en su vaciamiento. Aspecto sigmoide de esófago distal (flecha delgada). Fuente: Unidad de Gastroenterología. Hospital Universitario San Ignacio. Bogotá D.C. Colombia.
Posteriormente, se realizó una manometría esofágica de alta resolución más impedanciometría (Figura 5), con evidencia del 100 % de ondas fallidas (integral de contractilidad distal [DCI] menor de 100 mm Hg/s/cm), presión de relajación integrada (IRP) elevada mayor de 15 mm Hg, esfínter esofágico superior con una adecuada coordinación faringoesofágica y aclaramiento incompleto del bolo en el 100 % de las degluciones evaluadas, que se interpretó como acalasia tipo I o clásica.
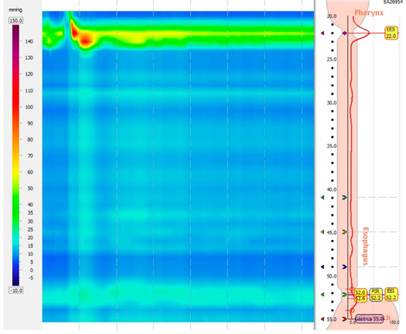
Figura 5 Manometría de alta resolución. Acalasia tipo I o clásica (con IRP elevada mayor de 15 mm Hg y 100 % de degluciones fallidas). Fuente: Unidad de Gastroenterología. Hospital Universitario San Ignacio. Bogotá D.C. Colombia.
Se inició la nutrición enteral para cubrir los requerimientos calóricos basales. Con el fin de descartar como etiología la enfermedad de Chagas, se realizaron las pruebas de inmunofluorescencia indirecta (IFI) y enzimoinmunoensayo (ELISA), que fueron negativas para la fase crónica de la enfermedad, y lo más importante fue que no tenía factores de riesgo para ella. Se llevó el caso a una junta interdisciplinaria (cirugía gastrointestinal, gastroenterología clínica) y se acordó que, como mejor alternativa de manejo en este caso, se debía realizar una esofagectomía. Presentó una aceptable evolución hasta la actualidad, con tolerancia a dieta blanda y con mejoría de su estado nutricional.
Discusión
La acalasia se presenta más frecuentemente entre la quinta y la sexta década de la vida, pero se puede presentar a cualquier edad, sin diferencia entre sexos. Progresa lentamente, con una duración promedio entre 5 y 6 años, siendo la disfagia el síntoma principal 4.
El patrón de la disfagia en pacientes con esófago dilatado es único5; frecuentemente, mejoran el paso de la comida con la ingestión de líquidos o con maniobras como doblar las piernas, pararse o saltar. La pérdida de peso puede ser masiva y la regurgitación nocturna puede ser significativa y acompañarse de síntomas respiratorios como aspiración y tos crónica 6.
Las consecuencias de la enfermedad son notorias con la progresión en el tiempo. El esófago dilatado con comida retenida y la presencia de nivel hidroaéreo en la radiografía de tórax suelen ser hallazgos tardíos 7,8.
En algunos casos el diagnóstico suele retardarse por la asociación existente con síntomas de enfermedad por reflujo, ya que hasta el 47 % presenta pirosis 8,9,10 y la monitorización de pH esofágico puede tener falsos positivos, dado que la fermentación de la comida retenida produce ácido láctico, razón por la cual no está indicado realizar pH-metría de manera rutinaria 11. El mayor rendimiento diagnóstico lo tienen estudios funcionales como el esofagograma y la manometría esofágica de alta resolución (MAR) 1,2,12,13.
Las características manométricas definidas son la aperistalsis y la relajación incompleta del EEI; también puede encontrarse presión elevada del esfínter esofágico inferior (EEI) y presurización esofágica 1,2,8. La ausencia de peristaltismo es un requisito absoluto para el diagnóstico y la relajación incompleta está usualmente presente, aunque puede estar ausente14. Desde el punto de vista manométrico, la aperistalsis debe ser diferenciada de otras causas de la misma como esófago esclerodérmico, posfundoplicatura o esófago de Barrett, lo que hace importante el interrogatorio en la historia clínica para lograr su diferenciación. En la Figura 6 se presenta un algoritmo práctico para la clasificación de la MAR esofágica, según el consenso de Chicago 3.0 15.
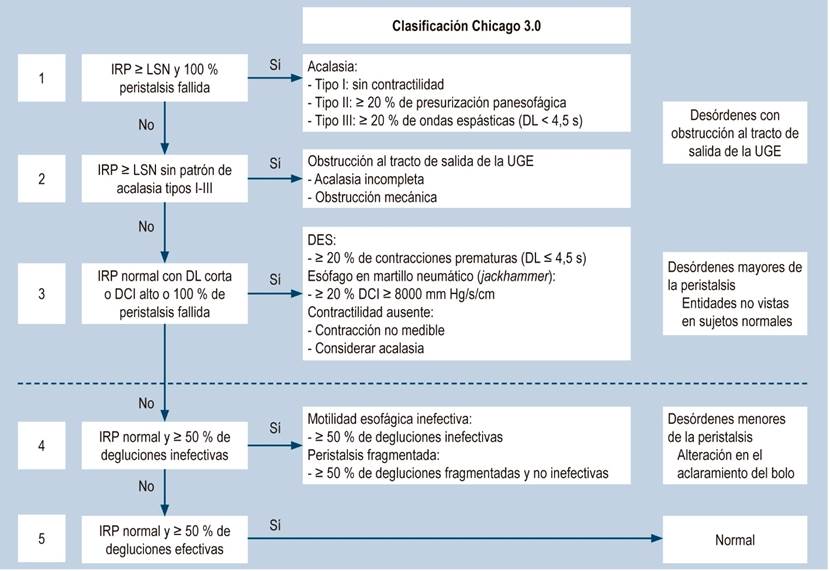
Figura 6 Algoritmo para la interpretación de la MAR esofágica con la clasificación de Chicago 3.0 (15). Tomado de: Hani A et al. Rev Colomb Gastroenterol. 2017;32(4):369-378.
El esofagograma en un paciente con acalasia en estadio final o megaesófago muestra retención del contraste, en un esófago dilatado, tortuoso, tanto en vista sagital como coronal.
Con respecto al tratamiento, ninguna terapia puede restaurar la actividad muscular del esófago denervado. La terapia médica no está recomendada 16,17. La toxina botulínica debe aplicarse en pacientes no aptos a procedimientos más invasivos 18-20 y se piensa que otros procedimientos (dilataciones neumáticas graduadas, miotomía endoscópica por vía oral [POEM] y miotomía de Heller laparoscópica con cirugía antirreflujo) tienen eficacia comparable. La decisión terapéutica debe estar basada en la edad y características del paciente, el tipo de acalasia en la manometría de alta resolución, la preferencia del paciente y la experiencia del centro hospitalario. La dilatación neumática 21 es probablemente menos efectiva en formas raras de acalasia (tipo 3), que se asocia con distensibilidad reducida de la unión gastroesofágica y contracciones espásticas esofágicas, las cuales pueden persistir después de la dilatación.
La miotomía quirúrgica se reserva para pacientes en quienes la dilatación no es exitosa 22, usualmente, después de tres dilataciones fallidas. Produce mejoría en 65 % a 90 % de los pacientes, con un promedio de 80 % 23.
El megaesófago, también llamado esófago sigmoide, resulta de la dilatación crónica del esófago 24. En este grupo de pacientes parece haber mayor prevalencia de enfermedad de Chagas, especialmente en el continente americano, lo que fue descartado en nuestro paciente 25.
Aproximadamente, el 5 % de los pacientes con acalasia progresan a estadios finales de la enfermedad o megaesófago, y requerirán tratamiento quirúrgico; esta enfermedad incurable está frecuentemente marcada por síntomas obstructivos a pesar del tratamiento o pueden progresar a acentuada dilatación esofágica con pérdida de configuración morfológica distal. La terapia quirúrgica en estos pacientes es un reto dada su gran alteración anatómica.
Orringer y Stirling 26 definieron el término megaesófago como un esófago con diámetro mayor o igual a 8 cm por estudio baritado y se considera acalasia avanzada a los pacientes con más de 7 cm de dilatación esofágica, hallazgos de esófago usualmente tortuoso, manométricamente débil y con ausencia de contracciones; mientras que otros autores tienen en cuenta la presencia de una angulación distal y una configuración sigmoidea como predictores de falla a miotomía por la imposibilidad de lograr un gradiente de presión esofágico permisivo para su vaciamiento, lo que confirma que no hay un criterio globalmente aceptado para su definición. En estos casos, se cree que la resección quirúrgica es el procedimiento de elección, como lo fue en el caso presentado, teniendo en cuenta que el megaesófago es un órgano disfuncional y fuente potencial de enfermedad por reflujo gastroesofágico, esofagitis por retención, aspiración traqueobronquial y desarrollo de neoplasia 27,28.
Dentro de los objetivos para realizar esofagectomía propuestos por Panda y Morse, del Departamento de Cirugía de Tórax de Harvard Medical School 29, en pacientes con megaesófago están:
Aliviar los síntomas obstructivos intratables.
Restaurar el tránsito del tracto alimentario y, por tanto, mejorar la nutrición y reducir el riesgo de aspiración.
Remover un megaesófago desfuncionalizado, en el que la estasis predispone a esofagitis y malignidad.
La esofagectomía con reemplazo esofágico permanece como la terapia quirúrgica de elección para pacientes con acalasia en estadio final en quienes fallan las medidas conservadoras. En general, es exitosa en mejorar los síntomas del paciente y la mínima morbilidad y mortalidad dependerá de la experiencia del centro donde se realice.
Por su parte, la experiencia griega en POEM 30 muestra que esta técnica fue exitosa en 2 pacientes mayores de 74 y 92 años de edad con diagnóstico de megaesófago, con POEM anterior previo sin mejoría de los síntomas y a quienes les realizaron POEM posterior, con mejoría clínica de los síntomas de manera significativa, pero son muy pocos los estudios de POEM en este tipo de pacientes. Los estudios de Brasil en megaesófago tratados con POEM se basan principalmente en pacientes con Chagas 31. En la Tabla 1 se resumen las alternativas terapéuticas en el paciente con acalasia, teniendo en cuenta el tiempo promedio de éxito de cada intervención.
Tabla 1 Resumen de alternativas terapéuticas en acalasia 3
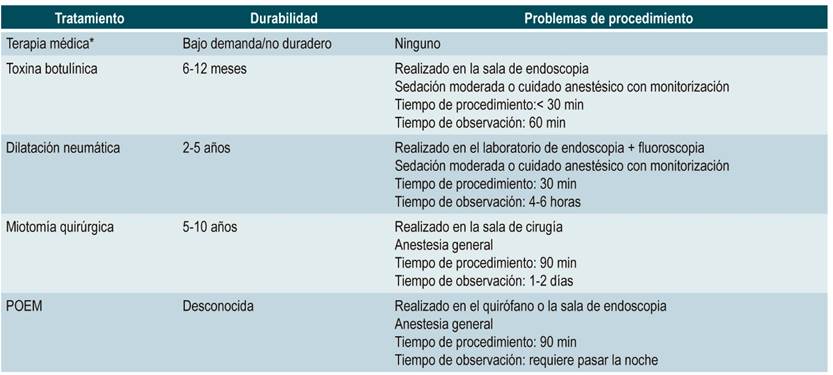
*Calcioantagonistas orales (nifedipina), dinitrato de isosorbida, sildenafilo. Tomado de: Pandolfino JE et al. JAMA. 2015;313(18):1841-1852.
Conclusión
La mayoría de los casos de acalasia pueden ser manejados de manera conservadora con dilatación neumática, miotomía de Heller o POEM, pero en pacientes con megaesófago muchas veces se requerirá la esofagectomía; pocos estudios han mostrado el éxito del POEM en megaesófago o en estadios finales de acalasia, que además incluyen megaesófago por Chagas, una entidad a descartar de manera obligada en América Latina.











 text in
text in 



