Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista colombiana de Gastroenterología
Print version ISSN 0120-9957On-line version ISSN 2500-7440
Rev. colomb. Gastroenterol. vol.36 no.1 Bogotá Jan./Mar. 2021 Epub Oct 20, 2021
https://doi.org/10.22516/25007440.582
Artículos originales
Cohortes de premedicación en endoscopia alta con simeticona, N-acetilcisteína, Hedera helix y validación de la escala visual
1Specialist in Gastrointestinal Surgery and Digestive Endoscopy. Master of Education. Manager, Medical Director. Researcher Jr. Education and Research Group, Universidad del Bosque.
2Surgical Instrument Assistant, Nursing Technician. USALUD Director. Bogotá, Colombia.
3Endoscopy Assistant Nurse. Unidad de Videoendoscopia del Restrepo Ltda. Bogotá, Colombia.
4Anesthesiologist, Compensar. Bogotá, Colombia.
5Nurse, Endoscopy Assistant, Unidad de Videoendoscopia del Restrepo Ltda. Bogotá, Colombia.
6MD. MSc. In Epidemiology. Research professor at Universidad CES. Medellín, Colombia.
Los parámetros de calidad para endoscopia digestiva alta han introducido indicadores intraprocedimiento, dentro de los cuales la adecuada visibilidad de la mucosa, libre de saliva, moco o burbujas, puede aumentar la posibilidad de detección de lesiones en fase temprana. Sin embargo, el uso de mucolíticos y antiburbujas ha mostrado gran variabilidad de eficiencia según las soluciones, concentraciones, tiempos de exposición y escala de visibilidad aplicados.
Objetivos:
Determinar la efectividad de diferentes soluciones de premedicación para la limpieza de la mucosa digestiva; validar, mediante una prueba de concordancia interobservador, una nueva escala de adecuada visualización de la mucosa (TVMS) para el esófago, estómago y duodeno; y reportar eventos adversos o complicaciones relacionadas con las soluciones utilizadas y los procedimientos realizados.
Material y métodos:
Estudio de cohortes prospectivas comparativas. Se incluyeron 412 pacientes adultos, ASA I y ASA II, para endoscopia diagnóstica bajo sedación consciente, distribuidos en 6 cohortes similares, divididas en dos grupos: no premedicación, 2 cohortes C1 (ayuno de 6 a 8 horas)y C2 (agua 100 mL); premedicación, 4 cohortes C3 a C6 (C3: agua 100 m L + simeticona 1000 mg; C4: agua 100 mL + simeticona 200 mg + N-acetilcisteína 600 mg; C5: agua 100 mL + simeticona 200 mg + N-acetilcisteína 1000 mg; C6: agua 100 mL + simeticona 200 mg + Hedera helix 70 mg). Se ingirió la solución 15 a 30 minutos antes del paso por cricofaríngeo. Se realizó la prueba de Kappa para medir la concordancia interobservador de la escala TVMS.
Resultados:
De 412 pacientes, 58% fueron de sexo femenino; 23% (136) fue de cohortes C1 y C2 y 67% (276) fue de cohortes C3 a C6. El tiempo medio de exposición a cada solución fue de 24,4 minutos. El volumen de lavado para lograr una adecuada visualización fue significativamente diferente entre ambos grupos: en los pacientes con premedicación se utilizaron 75,6 mL, mientras que en los pacientes sin premedicación se utilizaron 124 mL (p = 0,000), con una calidad de TVMS excelente de 88,7% frente al 41,4%, respectivamente. La cohorte C4 (agua 100 mL + simeticona 200 mg + N-acetilcisteína 600 mg) mostró ser la más efectiva con una diferencia significativa (p = 0,001) frente a C1 (ayuno) y C2 (placebo con agua 100 mL), y también tuvo una eficiencia superior frente a C3, C5 y C6 en su orden. No se presentaron eventos adversos o complicaciones en relación con la endoscopia, la sedación y los productos usados en la premedicación.
Conclusiones:
La solución más efectiva como premedicación para lograr una excelente visibilidad de la mucosa digestiva correspondió a la cohorte C4 (SIM 200 + NAC 600 + H2O 100 mL). La escala TVMS propuesta es una herramienta muy completa y fácil de aplicar por más de un observador. La premedicación ingerida, con antiburbuja, mucolítico y agua hasta 100 mL, entre 15 y 30 minutos previos a endoscopia, es segura en las condiciones descritas en este estudio.
Palabras clave: Premedicación: simeticona; N-acetilcisteína; esofagogastroduodenoscopia; TVMS; concordancia interobservador
Quality parameters for upper gastrointestinal endoscopy have introduced intraprocedural indicators, including adequate mucosal visualization free of saliva, mucus, or bubbles, which may increase the possibility of early-stage injury detection. The use of mucolytics and anti-foaming agents has shown great efficiency variability depending on the type of solution, concentrations, exposure times and visibility scale applied.
Objectives:
To determine the effectiveness of different premedication solutions for cleaning the digestive mucosa; to validate, by means of an interobserver concordance test, a new scale for the adequate visualization of the mucosa (TVMS) for the esophagus, stomach, and duodenum; and to report adverse events or complications associated with the solutions used and the procedures performed.
Material and methods:
Prospective, comparative cohort study. 412 adult patients, ASA I and ASA II, were included for diagnostic endoscopy under conscious sedation. They were distributed in 6 similar cohorts and divided into two groups: non-premedication, 2 in C1 (fasting 6 to 8 hours) and C2 (water 100 mL) cohorts; premedication, 4 C3 to C6 cohorts (C3: water 100 mL + simethicone 1000 mg; C4: water 100 ml + simethicone 200 mg + N-acetylcysteine 600 mg; C5: water 100 ml + simethicone 200 mg + N-acetylcysteine 1000 mg; C6: water 100 ml + simethicone 200 mg + Hedera helix 70 mg). The solution was swallowed 15 to 30 minutes passing through the cricopharyngeus muscle. The Kappa test was performed to measure interobserver concordance of the TVMS scale.
Results:
Of 412 patients, 58 % were female; 23 % (136) were included in the C1 and C2 cohorts; and 67 % (276) were in the C3 to C6 cohorts. The average exposure time to each solution was 24.4 minutes. The wash volume for proper visualization was significantly different between the two groups. In premedicated patients, 75.6 mL of solution were used, while in patients without premedication, 124 mL were used (p = 0.000), with an excellent quality of TVMS of 88.7% versus 41.4%, respectively. The C4 cohort (water 100 mL + simethicone 200 mg + N-acetylcysteine 600 mg) was the most effective with a significant difference (p= 0.001) compared with the C1 (fasting) and C2 (placebo with water 100 mL) cohorts. It also had better efficiency compared to the C3, C5 and C6 cohorts in that order. There were no adverse events or complications associated with endoscopy, sedation, or premedication products.
Conclusions:
The most effective solution as a premedication to achieve excellent visibility of the digestive mucosa was that used in the C4 cohort (SIM 200 + NAC 600 + H2OR 100 mL). The proposed TVMS scale is a very complete and easy tool to apply by more than one observer. Premedication ingested, with anti-foam, mucolytic and water up to 100 mL, between 15 and 30 minutes before endoscopy, is safe under the conditions described in this study.
Keywords: Premedication; Simethicone; N-acetylcysteine; Esophagogastroduodenoscopy; TVMS; Interobserver agreement
INTRODUCCIÓN
La endoscopia digestiva alta actualmente tiene indicadores de calidad pre-, trans- y posprocedimiento 1-3. En el momento intraprocedimiento es fundamental mejorar la visibilidad de la mucosa digestiva alta, usualmente obstruida por saliva, moco, burbujas y líquido gástrico.
En 1964 Koga y Arakawa 4 en el tiempo preendoscópico, en pesquizaje de cáncer gástrico temprano mediante radiología con medio de contraste, eliminaron artefactos de visibilidad usando pronasa, una enzima mucolítica usada luego por Ida y colaboradores en 1991 para gastroendoscopia 5.
La efectividad de la pronasa (producto difícil de conseguir fuera de Japón, China y Corea) hizo que la premedicación se volviera una práctica rutinaria para la endoscopia digestiva alta, utilizando productos como N-acetilcisteína (NAC), que es un mucolítico ampliamente accesible, solo o combinado con simeticona-dimeticona (SIM) 6-9, que es una sustancia antiespumante 10; aunque múltiples publicaciones no dan uniformidad en cuanto a las dosificaciones y resultados.
La variabilidad de reportes depende, en parte, de la forma de medir la visibilidad de la mucosa. En 2 metaanálisis 11,12 se aprecia una gran disparidad en las escalas de visibilidad aplicadas, en ocasiones como la tasa de visibilidad mucosa (TVS; solo de la mucosa de segmentos del estómago) 6,13,14 o como la escala total de visibilidad de la mucosa (TVMS; que incluye al esófago o duodeno) 15. Las escalas tienen una especial dificultad en su expresión cuantitativa, lo que genera confusión de las cifras difíciles de recordar; por esta razón, han surgido propuestas de pasar esas cifras a escalas cualitativas fáciles de recordar y aplicar (excelente, adecuado, inadecuado) 7.
La premedicación para mejorar la calidad de la visibilidad busca detectar lesiones en la fase temprana del esófago, duodeno y estómago, lo que es de especial interés para nuestro medio en la búsqueda de cáncer gástrico temprano o incipiente, debido a que es el séptimo cáncer más común en el mundo 16: en 2018 tuvo una incidencia global de 1 033 701 casos, mientras que en Colombia fue la primera causa de muerte por cáncer en hombres y la cuarta en mujeres 17. Su detección e intervención en la fase temprana ha modificado la supervivencia en países orientales a más del 90, frente a solo 10% a 20% a 5 años para cáncer gástrico avanzado 18-20.
Se usó por varios años la SIM líquida como el único producto de premedicación, pero los resultados internacionales alentadores, aunque discordantes al combinar SIM con NAC (incluidas dos publicaciones colombianas recientes) 21,22, incentivaron los objetivos del presente estudio: comparar para determinar la mejor efectividad de diferentes soluciones de premedicación, una de las cuales incluyó un mucolítico no estudiado (Hedera hélix [HH]); validar una nueva escala adaptada de visualización de esófago, estómago y duodeno; y reportar eventos adversos y complicaciones relacionadas con las soluciones y procedimientos de la endoscopia y la sedación consciente empleados.
MATERIAL Y MÉTODOS
Selección de pacientes
El estudio consiste en 6 cohortes prospectivas, comparativas en un centro ambulatorio de segundo nivel de Bogotá, realizado del 1 de mayo al 31 de julio de 2019 en pacientes de 18 años o más, informados sobre el objetivo del estudio y quienes dieron el consentimiento informado de su participación; se llevaron a endoscopia digestiva alta diagnóstica, con sospechas clínicas principales de dispepsia, enfermedad por reflujo gastroesofágico, disfagia no estudiada, malignidad o pesquizaje de cáncer gástrico o esofágico; y se clasificaron como ASA I y II, de acuerdo con la Sociedad Americana de Anestesiología (ASA).
Los criterios de exclusión fueron las lesiones tumorales o no tumorales generadoras de estenosis infranqueables o síndrome pilórico, endoscopia terapéutica, sangrado digestivo activo o reciente, embarazo, gastroparesia y reacciones alérgicas conocidas a medicamentos de la premedicación o de sedación.
El protocolo se realizó de acuerdo con la declaración de Helsinki y fue aprobada por el comité de ética de la unidad, en especial en dos aspectos: luego de la calificación final de la premedicación, todas las preparaciones que no fueran excelentes debían ser llevadas a ese nivel mediante la limpieza de la mucosa utilizando una solución de agua con SIM al 0,1% y en el volumen requerido para lograr un excelente aclaramiento mucoso; de este modo, se le aseguraba a todos los participantes total equidad en la posibilidad de detectar lesiones tempranas o avanzadas; y después de revisada la seguridad de una sola y pequeña dosis de HH y ante los efectos benéficos vistos en la limpieza de la mucosa digestiva en algunos pacientes no controlados que la habían ingerido para cuadros pulmonares, se decidió aprobar la cohorte 6 en la que se combina HH con SIM, cuyo resultado será planteado como recomendación de uso fuera de indicación (off-label).
Diseño del estudio
El tamaño de la muestra fue de 412 pacientes en 6 cohortes (Figura 1) (tamaño de la muestra mínimo de 355 para un nivel de confianza del 97% y error máximo admitido de 5%, según la población de 1440 pacientes atendidos en los 2 años previos).
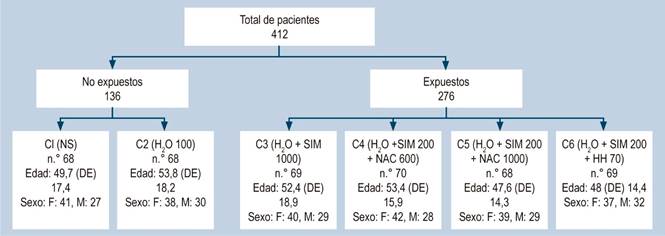
Figura 1 Características sociodemográficas de 6 cohortes. DE: desviación estándar; HH: Hedera helix; H2O: agua; NAC: N-acetilcisteína; NS: no solución; SIM: simeticona.
Todos los pacientes tuvieron una aleatorización simple (por una enfermera coordinadora) y ayuno mínimo de 8 horas. La enfermera coordinadora supervisó que la ingesta de cada solución se realizara entre 15 y 30 minutos antes del paso por el cricofaríngeo. Con la administración de anestésico local orofaríngeo, todos los procedimientos se realizaron bajo la sedación balanceada con propofol (8 mg/kg) y remifentanilo (4 µg/kg), en pacientes de ASA I y II; y se observaron como eventos adversos principales la reacción alérgica a los medicamentos, la depresión respiratoria que requiriera asistencia con presión positiva y broncoaspiración, de acuerdo con el protocolo institucional publicado 23.
Los pacientes se dividieron en dos grupos: no exposición (no premedicación) y exposición (premedicación). Al grupo de no exposición se le asignó 2 cohortes (C): C1: no solución (NS) y C2: agua (H2O) 100 mL. Al grupo exposición se le asignó 4 cohortes (C): C3: agua 100 mL + simeticona 1000 mg (H2O + SIM 1000); C4: agua 100 mL + simeticona 200 mg + N-acetilcisteína 600 mg (H2O + SIM 200 + NAC 600); C5: agua 100 mL + simeticona 200 mg + N-acetilcisteína 1000 mg (H2O + SIM 200 + NAC 1000); y C6: agua 100 mL + simeticona (SIM) 200 mg + Hedera helix (HH) 70 mg (H2O + SIM 200 + HH 70), con similitud en el número de pacientes por cohorte (Figura 1).
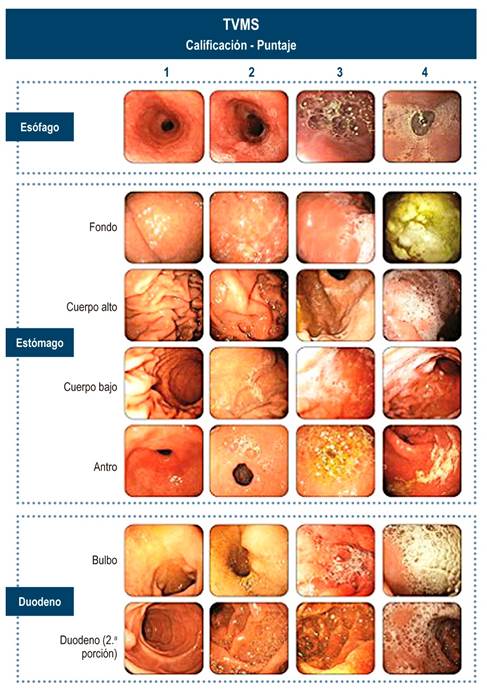
Escala de visibilidad de la mucosa
Se adoptó una escala mixta (cualitativa y cuantitativa) de visibilidad total de la mucosa (TVMS), modificada del sistema cualitativo de Elvas 7, proveniente del sistema cuantitativo de McNally 24. Se incluyeron niveles de valor de 1 a 4 según la limpieza de la mucosa, para 7 sitios del tracto digestivo alto (1 de esófago, 4 de estómago y 2 de duodeno), cuyas sumas totales (entre 7 y hasta 28) se llevaron a tres niveles cualitativos (excelente, adecuado e inadecuado), con cierta similitud, pero clara diferencia frente a otras escalas publicadas (Tabla 1) 15,25-30.
Tabla 1 Comparación entre las diferentes escalas de visibilidad de la mucosa 7
| Escala y referencia | Sitios evaluados | Calificación | ||
|---|---|---|---|---|
| Escala cuantitativa y cualitativa, Blanco y colaboradores (este artículo) |
7 sitios: esófago, 4 sitios gástricos (fondo, cuerpo proximal, cuerpo distal y antro), bulbo duodenal y D2. 4 puntajes por sitio: 1. Sin moco ni burbujas. |
Excelente: 7 a 14 puntos. Mucosa completamente limpia o máximo requiere solo aspiración. 2. Con moco flotante o no adherente o burbujas escasas, succionables, que no obstruyen la visión. |
Adecuado: 15 a 21 puntos. Requiere lavar con menos de 50 mL en máximo 3 sitios. 3. Moco adherente o burbujas abundantes, no succionables, que obstruyen la visión y requieren menos de 50 mL de agua para limpiar. |
Inadecuado: 22 a 28 puntos. Requiere lavar con más de 50 mL en 3 o más sitios. 4. Moco adherente o burbujas abundantes, no succionables, que obstruyen la visión y requieren más de 50 mL de agua para limpiar. |
| Elvas y colaboradores 7 | 3 sitios: esófago, estómago y duodeno. | Excelente moco no adherente y visión clara de la mucosa (incluida en el uso de aspiración). | Adecuado moco adherido que obstruye la visión de la mucosa y requiere lavado con agua. | Inadecuado moco grueso o residuo alimentario no susceptible de aspiración. |
| Escala A: Bhandari y colaboradores 25, Lee y colaboradores 26, Chang y colaboradores 15 | 7 sitios: esófago, 4 sitios gástricos (fondo, cuerpo proximal, cuerpo distal y antro), bulbo duodenal y D2. | Puntaje 1: sin moco adherente y visión clara de la mucosa. | Puntaje 2: fino recubrimiento del moco, sin obstruir la visión. | Puntaje 3: moco adherente que obstruye la visión. |
| Escala B: Bertoni y colaboradores 27, McNally y colaboradores 24 | 6 sitios: esófago, fondo, cuerpo, incisura, antro y duodeno (o yeyuno si hay gastroyeyunostomía). | Puntaje 1 o 2: sin o con mínima cantidad de espuma y burbujas. | Puntaje 3: cantidad moderada de espuma o burbujas. | Puntaje 4: cantidad abundante que oscurece la superficie mucosa (necesidad de lavado). |
| Escala C: Kuo y colaboradores 28, Asl y colaboradores 29, Chang y colaboradores 30 | 4 sitios gástricos: fondo, cuerpo proximal, cuerpo distal y antro. | Puntaje 1 o 2: moco no adherente o pequeña cantidad, que no obstruye la visión. | Puntaje 3: gran cantidad de moco con menos de 50 mL de agua para el aclaramiento. | Puntaje 4: gran cantidad de moco con más de 50 mL de agua para el aclaramiento. |
*Adaptado de: Elvas L et al. Endoscopy. 2017;49(2):139-145.
Se realizó el lavado de la mucosa con agua y simeticona a muy baja disolución (0,1%) solo al haber completado la visualización de los 7 sitios, aunque lavar antes podía modificar el valor dada la continuidad anatómica de los segmentos y de los tres órganos (Figura 2).
Los rangos de valor fueron de 1 a 4:
sin moco ni burbujas;
con moco flotante o no adherente o burbujas escasas, succionables, que no obstruyen la visión;
con moco adherente o burbujas abundantes, no succionables, que obstruyen la visión y requieren menos de 50 mL de agua para limpiar;
con moco adherente o burbujas abundantes, no succionables, que obstruyen la visión y requieren más de 50 mL de agua para limpiar.
El rango total de puntaje va entre 7 y 28 puntos, que se agruparon en tres grupos cualitativos: preparación excelente (7 a 14 puntos), preparación adecuada (15 a 21 puntos) y preparación inadecuada (22 a 28 puntos).
La TVMS se evaluó simultáneamente por CB (endoscopista, más de 120 000 endoscopias) y YW (enfermera, más de 32 000 endoscopias), en dos formatos iguales, privados e independientes, entregados inmediatamente terminada la endoscopia a la enfermera coordinadora. Se cuantificó el volumen necesario de lavado intraendoscopia. Dada la variabilidad en el tiempo de toma de biopsias y en la valoración de lesiones de alto riesgo o malignas, se decidió no incluir el tiempo total de la endoscopia 31.
Análisis estadístico
Se realizó un análisis univariado que se presentó de acuerdo con la naturaleza de la variable. Las pruebas de hipótesis por subgrupos de exposición se contrastaron con la prueba de Kruskall Wallis, debido al incumplimiento de la normalidad de las variables analizadas. Se llevó a cabo un análisis multivariado exploratorio con el fin de conocer el efecto de las exposiciones sobre el puntaje de visibilidad de la mucosa digestiva, a través de un modelo de regresión lineal simple; se dejaron como variables predictivas la edad, el sexo, el volumen de lavado y el tiempo de premedicación. Las variables fueron significativas en el modelo cuando el valor de p fue < 0,05 y se buscó el modelo más parsimonioso. Además, se realizó un análisis de concordancia entre los dos evaluadores de la TVMS a partir de la prueba de independencia chi cuadrado (χ²), una prueba de hipótesis de proporción de una muestra para un acuerdo superior a 70% para el puntaje de visibilidad de la mucosa; y posteriormente se estimó el índice kappa para la variable categórica (excelente, adecuada, inadecuada) 1. Los datos fueron procesados en un software R versión 3.2.0.
RESULTADOS
Se incluyeron 412 pacientes con un promedio de edad de 51 años (DE: 17), el 58% (n = 237) de sexo femenino. El 23% (n = 136) quedó asignado a las cohortes 1 y 2 de no exposición (no premedicación) y el 67% (n = 276), a las cohortes 3 a 6, de exposición (premedicación). El tiempo promedio de exposición (período entre la ingesta de la solución y el paso por el cricofaríngeo) fue de 24,3 minutos (DE: 4,4). En estas distribuciones no hay diferencias significativas según el valor de p. A su vez, el volumen del lavado requerido para lograr una excelente visibilidad muestra una diferencia significativa en las cohortes de premedicación (promedio de 75,6 mL; DE: 51,5) frente a las de no premedicación (promedio de 124,9 mL; DE: 76,5) (p = 0,000) (Tabla 2).
Tabla 2 Características sociodemográficas de la población de estudio
| Características | Premedicación | Valor de p | |
|---|---|---|---|
| No (n=136) (23 %) | Sí (n=276) (67 %) | ||
| Sexo (femenino, masculino) | 79 (33,3) 57 (32,6) | 158 (66,7) 118 (67,4) | 0,871 |
| Edad promedio (DE) | 52,1 (17,9) | 50,2 (16,1) | 0,304 |
| Tiempo total de premdeicación (n = 215) media (DE) min | 24,4 (4,3) | 24,2 (4,4) | 0,683 |
| Volumen de lavado (n = 215) media (DE) | 124,9 (76,5) | 75,6 (51,5) | 0,000 |
A su vez, en las 2 cohortes de no premedicación (C1 y C2), la media del volumen de lavado fue entre 126 y 123 mL para el 82% al 87% de los pacientes de cada cohorte (intervalo de confianza [IC] del 95%); mientras que en las de premedicación (C3, C4, C5 y C6), la media estuvo entre 59 y 84 mL, para el 32% y el 43% (IC 95%), y el grupo C4 (H2O + SIM 200 + NAC 600) fue el que requirió menos volumen (Figura 3).
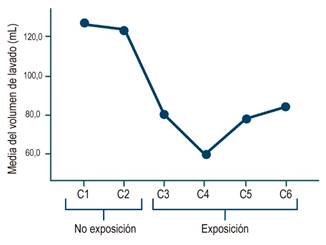
Figura 3 Asociación entre premedicación y lavado intraprocedimiento (mL de agua con simeticona al 0,1%).
Al realizar el comparativo cohorte a cohorte, se encuentran diferencias significativas entre C1 (NS) y las cohortes de premedicación C4 y C5, esto demuestra que, con el uso de estas dos soluciones, la visibilidad de la mucosa es mejor cuando se requiere menos volumen de agua adicional (Tabla 3).
Tabla 3 Comparaciones múltiples entre premedicaciones y volumen de lavado
| Cohorte (I) | Cohorte (J) | Diferencia de medias (I.J) | Valor d p | IC 95 % |
|---|---|---|---|---|
| C1 (NS) |
C2 C3 C4 C5 C6 |
2,70 45,95 66,35 48,44 42,84 |
1,000 0,066 0,001* 0,039* 0,050* |
-32,917: 38,317 -1,737: 93,643 20,793: 111,910 1,516: 95,374 ,029: 85,647 |
| C2 (H2O) |
C1 C3 C4 C5 C6 |
-2,70 43,25 63,65 45,74 40,14 |
1,000 0,104 0,001* 0,064 0,085 |
-38,317: 32,917 -4,783: 91,289 17,731: 109,572 -1,535: 93,026 -3,056: 83,332 |
| C3 (H2O+SIM 1000) |
C1 C3 C4 C5 C6 |
-45,95 -43,25 20,40 2,49 -3,11 |
0,066 0,104 0,900 1,000 1,000 |
-93,643: 1,737 -91,289: 4,783 -35,409: 76,206 -54,440: 59,424 -56,702: 50,471 |
| C4 (H2O + SIM 200 + NAC 600) |
C1 C2 C3 C5 C6 |
-66,35 -63,65 -20,40 -17,91 -23,51 |
0,001* 0,001* 0,900 0,937 0,780 |
-111,910: -20,793 -109,572: -17,731 -76,206: 35,409 -73,065: 37,252 -75,212: 28,185 |
| C5 (H2O + SIM 200 + NAC 1000) |
C1 C2 C3 C4 C6 |
-48,44 -45,74 -2,49 17,91 -5,61 |
0,039* 0,064 1,000 0,937 1,000 |
-95,374: -1,516 -93,026: 1,535 -59,424: 54,440 -37,252: 73,065 -58,517: 47,303 |
| C6 (H2O + SIM 200 + HH 70) |
C1 C2 C3 C4 C5 |
-42,84 -40,14 3,11 23,51 5,61 |
0,050 0,085 1,000 0,780 1,000 |
-85,647: -0,029 -83,332: 3,056 -50,471: 56,702 -28,185: 75,212 -47,303: 58,517 |
*Prueba HSD de Tukey. La diferencia de medias es significativa en el nivel 0,05. HSD: honestly-significant-difference.
Al realizar la conversión del puntaje cuantitativo de la TVMS a la clasificación cualitativa, incluidas todas las cohortes, se obtuvo un porcentaje de visibilidad excelente en el 72%, adecuada en el 26% e inadecuada en el 2%, para la totalidad de los pacientes. Este resultado obligó a descartar a la visibilidad inadecuada para análisis subsecuentes, pues su recuento mínimo esperado era de 33,67 pacientes (de acuerdo con las pruebas de χ² de Pearson) (Tabla 4).
Tabla 4 Distribución de calidad TVMS (global TVMS)
| Distribución cualitativa de visibilidad | n=412 (%) |
|---|---|
| Excelente (7 a 14) | 297 (72,1) |
| Adecuado (15 a 21) | 106 (25,7) |
| Inadecuado (22 a 28) | 9 (2,2) |
Hecha la anterior precisión, se evidencia que para las cohortes de premedicación (C3 a C6) se logró el 88,7% de visibilidad excelente frente al 41,4% de las dos cohortes de no premedicación (Tabla 5).
Tabla 5 Distribución de cohortes de premedicación y no premedicación frente a la calidad de visibilidad de la mucosa según la TVMS
| Cohortes | Calidad de visibilidad de TVMS | Total (%) | |
|---|---|---|---|
| Excelente (7 a 14) | Adecuada (15 a 21) | ||
| n (%) | n (%) | ||
| Premedicación (C3, C4, C5, C6) | 244 (88,7) | 31 (11,3) | 275 (100) |
| No premedicación (C1, C2) | 53 (41,4) | 75 (56,6) | 128 (100) |
| Total | 297 (73,7 | 106 (26,3) | 403 (100) |
A su vez, al realizar el comparativo de calidad cualitativa de visibilidad cohorte a cohorte, se encontró la cohorte C4 (H2O + SIM 200 + NAC 600) asociada con la mejor visibilidad (excelente en el 92,9%). La segunda mejor cohorte fue C3 (H2O+SIM 1000; 89,9%), seguida de C5 (H2O + SIM 200 + NAC 1000; 88,1%) y, finalmente, C6 (H2O 100 mL + SIM 200 mg + HH 70 mg; con 84,1%); esta última es menos eficiente que las otras soluciones, pero dos veces mejor que cuando no se da premedicación (C1) o se administra solo agua (C2) (Tabla 6).
Tabla 6 Distribución en tabla cruzada de las cohortes (C1, C2, C3, C4, C5, C6) frente a la calidad de visibilidad TVMS excelente y adecuada
| Cohortes | Calidad de visibilidad de TVMS | Total (%) | |
|---|---|---|---|
| Excelente (7 a 14) | Adecuada (15 a 21) | ||
| n (%) | n (%) | ||
| C1 (NS) | 25 (40,3) | 37 (59,7) | 62 (100,0) |
| C2 (H2O) | 28 (42,4) | 38 (57,6) | 66 (100,0) |
| C3 (H2O+SIM 1000) | 62 (89,9) | 7 (10,1) | 69 (100,0) |
| C4 (H2O + SIM 200 + NAC 600) | 65 (92,9) | 5 (7,1) | 70 (100,0) |
| C5 (H2O + SIM 200 + NAC 1000) | 59 (88,1) | 8 (11,9) | 67 (100,0) |
| C6 (H2O + SIM 200 * HH 70) | 58 (84,1) | 11 (15,9) | 69 (100,0) |
| Total | 297 (73,7) | 106 (26,3) | 403 (100,0) |
A las calificaciones dadas por los dos evaluadores de TVMS se aplicó la prueba χ² con la que no hubo evidencia suficiente para pensar que los resultados son independientes; esto fue corroborado con la prueba de hipótesis de proporciones, en la cual se obtuvo un valor de p = 0,0000 que permite rechazar la hipótesis nula que se planteó como inferior al 70%. Al realizar el análisis para la variable categórica se encontró un acuerdo de 98% con el índice kappa de 0,8952, que indica una muy buena concordancia de interobservadores (Tabla 7 y Figura 4).
Tabla 7 Concordancia interobservadores en la calificación de visibilidad con TVMS propuesta
| Calificación de la calidad con TVMS | Concordancia interobservadores (evaluadores) | Total n | |
|---|---|---|---|
| Sí | No | ||
| n (%) | n (%) | ||
| Excelente (7 a 14) | 289 (98) | 7 (2) | 296 |
| Adecuada (15 a 21) | 97 (94) | 6 (6) | 103 |
| Inadecuada (22 a 28) | 8 (62) | 5 (38) | 13 |
| Total | 394 | 18 | 412 |
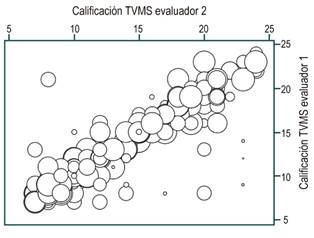
Figura 4 Concordancia de los interobservadores en la calificación de visibilidad con TVMS en una gráfica de burbujas.
Respecto a la seguridad del estudio, no se presentó ningún evento adverso en los 412 pacientes en relación con intolerancia, hipersensibilidad, broncoespasmo, angioedema, exantema, prurito, hipotensión, náuseas, vómito, diarrea o alergias asociadas con el uso de SIM, NAC y HH. Tampoco hubo reacciones alérgicas, flebitis o depresión respiratoria con propofol y remifentanilo usados en la sedación. Es de resaltar que no se presentaron eventos de broncoaspiración en relación con la sedación consiente, teniendo en cuenta que, en 5 de las 6 cohortes, los pacientes ingirieron 100 mL de líquido entre 15 a 30 minutos previos al inicio de la endoscopia (media de 24,2 minutos).
DISCUSIÓN
El presente estudio de cohortes comparativas permitió confirmar que la mayor valoración de excelente visualización de la mucosa digestiva alta se asoció con el uso de premedicación con solución de NAC 600 mg + SIM 200 mg + agua 100 mL, ingerida entre 15 y 30 minutos antes del paso del cricofaríngeo con el endoscopio. La premedicación con SIM con o sin NAC ha sido ampliamente estudiada con metaanálisis y revisiones sistemáticas. Lee, Du y Fu (12) incluyeron 5750 pacientes y la combinación de SIM con NAC mostró una mejor TVMS frente al uso de SIM sola; tanto SIM + NAC como SIM sola fueron más eficientes que el uso de agua sola (diferencias de medias [MD] = -0,14 [-0,25, -0,03]; p = 0,01), sin presencia de eventos adversos (usando SIM o dimeticona en dosis de 40 a 200 mg y NAC entre 200 y hasta 1000 mg; comparado con grupos de control con agua entre 5 mL y 100 mL). Todos reportaron TVMS, excepto uno que presentó una escala cualitativa de excelente, adecuado e inadecuado 6.
En otro metaanálisis, Sajid y colaboradores 11 incluyeron 654 pacientes, con o sin uso de SIM +/- NAC y encontraron una asociación de mejoría (Odds ratio [OR]: 0,43; IC 95% [0,28: 0,68] z = 3,65; p = 0,003) en la visibilidad mucosa cuando se utilizó premedicación. Se analizó otro grupo de 364 pacientes y se encontró que el uso de SIM +/- NAC estuvo asociado con una mejoría en el puntaje de visibilidad mucosa comparado con el grupo en el que no se usó SIM (diferencia de media estandarizada [DME]: -1,66; IC 95%: -1,93, -1,40; z = 12,12; p = 0,00001). Aunque la calidad de visualización según la TVMS fue superior con las 4 cohortes de soluciones utilizadas frente al ayuno o al uso de agua (88,7% frente a 41,4%), la mejor premedicación correspondió a la cohorte C4 (H2O + SIM 200 + NAC 600), con un volumen de lavado de 59,9 mL, inferior y significativamente diferente a las cohortes de no premedicación C1 y C2 (p > 0,001) y con un rendimiento de 92,9%, superior a los grupos C3 (89,9%), C5 (88,1%) y C6 (84,1%), aunque sin diferencia significativa entre ellas. Nuestra experiencia previa, aplicada en la cohorte C3 (H2O + SIM 1000), mostró la segunda mejor eficiencia, con visibilidad excelente en 89,9%, comparable con lo publicado por Bertoni 27 y Chang 30. Contrasta con otra publicación en la que se utilizó simeticona líquida a bajas dosis y volumen (SIM 1 mL de 100 mg, diluido a 5 mL de agua, administrado 30 minutos antes de la endoscopia), en la que reportan equivalencia de visión excelente en el 51,9% 9, cifra apenas levemente superior a lo que encontramos en ayuno o con solo agua, razón por la cual no recomendamos ese esquema. El resultado de la cohorte C5 (H2O + SIM 200 + NAC 1000), que tuvo el tercer mejor rendimiento, mostró que la mezcla de NAC + SIM no fue una dosis dependiente del aumento de NAC y que, por tanto, su concentración de 600 mg es suficiente e incluso mejor que usar 1000 mg para lograr una visualización excelente. La cohorte C6 ((H2O + SIM 200 + HH 70), con Hedera helix a baja y única dosis de 70 mg (en uso fuera de indicación como alternativo a NAC) logró un porcentaje de excelencia de 84,1%, superior a la no premedicación de C1 (40,3%) y C2 (42,4%); aunque su media de volumen de lavado (83,4 mL) no mostró una diferencia significativa frente a ellas. Deja así el campo abierto para futuras comprobaciones de su eficiencia, a otras concentraciones y en un estudio controlado, toda vez que puede ser una alternativa segura y costo-efectiva.
La endoscopia digestiva alta realizada en condición de solo ayuno de 6 a 8 horas tuvo una calidad de la visibilidad adecuada en solo el 25,7%, es decir que 1 de cada 4 pacientes va a requerir por lo menos irrigación de 3 sitios de su tracto digestivo alto (con una media volumen de 125 mL). En Chile, en las mismas condiciones, se requirió en promedio 52 mL de agua (rango entre 0 y 400 mL) valorando solo 4 sitios, todos en el estómago 14. El uso de solo agua como premedicación (cohorte C2 [H20 100 mL]) no mostró una diferencia significativa frente al ayuno, con un volumen de limpieza levemente inferior al ayuno (media de 123 mL frente a 126 mL). No confirmó otra descripción 6, en la cual el uso de 100 mL de agua empeoraba la TVMS, lo que había sugerido que el agua diseminaba el moco en un área más extensa del estómago, sin diluir moco o burbujas.
Frente al segundo objetivo del estudio, se logró aportar una nueva TVMS, escala adaptada y mejorada al tener en cuenta 7 sitios de valoración (1 del esófago, 4 del estómago, 1 del bulbo duodenal y 1 de la segunda porción del duodeno), extendiendo el concepto de la necesidad de excelente visibilidad más allá del estómago, que permitiera la detección de lesiones en la fase temprana diferentes al cáncer gástrico incipiente. La conversión cuantitativa a cualitativa de TVMS se realizó de forma sencilla: a cada uno de los 7 sitios se le asignaron puntajes de 1 a 4, para una suma total entre 7 y 28; las calificaciones 1 y 2, que significan que no había ningún residuo de burbujas, saliva o moco (1 de puntuación) o que, a lo sumo, estos residuos eran succionables (2 de puntuación). El rango de puntuación para una visibilidad excelente entonces estuvo entre 7 y 14, condición en la que solo se succionaba o la cantidad de irrigación fue mínima (menos de 50 mL). Para la visibilidad adecuada, el rango se definió entre 15 y hasta 21 puntos, condición en la cual las burbujas, el moco o la saliva no eran completamente succionables y requerían irrigación de limpieza (en un volumen menor de 50 mL, lo que cambia el puntaje de 2 a 3) en más de 4 sitios y hasta los 7 sitios. Se consideró visibilidad inadecuada cuando el rango estaba entre 22 (6 de los sitios requirieron volumen menor de 50 mL, y 1 requirió más de 50 mL) hasta 28 (7 sitios con lavado mayor de 50 mL); estos puntajes recomendarían la interrupción del procedimiento y su reprogramación.
Entendida la escala, se confirmó su aplicabilidad y validez mediante el resultado de la concordancia interobservadores, con un acuerdo de 98% cuando la visibilidad según la TVMS fue excelente y de 94% cuando la visibilidad fue adecuada. La pretensión de la escala mixta (cualitativa y cuantitativa) fue facilitar la comparabilidad del efecto de las soluciones usadas como premedicación, con la particularidad que se construyó uniendo conceptos de la escala de Chang y colaboradores 30 en relación con el volumen de lavado de más o menos de 50 mL; la escala de Lee y colaboradores 26, en cuanto a los 7 sitios de lavado, incluidos el esófago y el duodeno; la escala clásica de Kuo y colaboradores 28 y la de Asl y colaboradores 29, que usan grados de puntuación de 1 a 4, solo para los 4 sitios del estómago (con diferencia frente a nuestra escala, pues usaron un volumen de más o menos 30 mL); y la escala de Elvas y colaboradores 7, que describió los tres grados cualitativos descritos. También se constituyó en una herramienta útil para cumplir el requerimiento reciente de informar la visualización de la mucosa como un parámetro de calidad intraprocedimiento 3.
Frente al tercer objetivo, no se presentaron eventos adversos o complicaciones relacionadas con el procedimiento de endoscopia; ni relacionados con los tres productos utilizados (SIM, NAC y HH) en las soluciones de premedicación de las cohortes C2 a C6. Tampoco hubo alergias o depresión respiratoria con propofol y remifentanilo utilizados en todos los pacientes; en relación con la sedación y coincidiendo con los estudios de Koeppe y colaboradores 32 y de Da Silva y colaboradores 33, en los cuales se permitió la ingesta de agua de 200 mL a 410 mL hasta 1 hora previa a endoscopia con solo una observación subjetiva de más líquido libre en el estómago, coincidimos en no haber presentado casos de broncoaspiración. De esta forma, los resultados mostraron que la premedicación bajo las condiciones de volumen, diluciones, tiempos, condiciones fisiológicas y bajo el esquema de sedación consciente utilizada (publicada por nosotros en 2017) 23 es una práctica segura y muy útil.
Una de las limitaciones del estudio es la participación de un solo gastroenterólogo, situación no solucionable dadas las condiciones propias de la institución, compensada con el entrenamiento y conocimiento preestudio tanto de la escala TVMS como las soluciones de premedicación) con 100 pacientes y la participación de todo el equipo de trabajo, incluida la enfermera coevaluadora. Para finalizar, la baja concentración de SIM utilizada en el líquido de limpieza está en relación con publicaciones que describen la presencia de sus residuos de SIM dentro del endoscopio, a pesar del reprocesamiento de alto nivel, que podría fomentar el crecimiento bacteriano 34,35.
El estudio se adhirió a la Declaración de la Sociedad Gastroenterológica de Australia (2019), que ante la no evidencia “de eventos clínicos adversos durante décadas de su uso, nosotros creemos que el uso continuado de simeticona es apropiado y puede ser administrado a través de cualquier canal de endoscopia”. Y sus recomendaciones son las siguientes: el uso de SIM es razonable toda vez que mejora la visibilidad de la mucosa gástrica y colónica, y facilita la detección de adenomas en la colonoscopia (nivel de evidencia IA, grado de recomendación A); se debe usar la menor cantidad efectiva de simeticona para el fluido de lavado, de 2 a 3 mL de 120 mg/mL adicionados a un litro de agua estéril (nivel de evidencia IV, grado de recomendación D); SIM puede ser administrado oralmente o a través de cualquier canal de irrigación (nivel de evidencia IV, grado de recomendación D); y es esencial la estricta adherencia a los protocolos de reprocesamiento de los endoscopios, en especial la inmediata descontaminación prelimpieza al lado del paciente, que incluya irrigación posprocedimiento e inicio pronto de limpieza manual o mecánica (nivel de evidencia IIB, grado de recomendación B) 36.
CONCLUSIONES
Utilizar premedicación con SIM sola o mezclada con mucolíticos como NAC o HH (este último, recomendación de uso fuera de indicación) permite mejores tasas de visibilidad que cuando se realiza una endoscopia digestiva solo en ayunas o con solo administración de agua. De las 4 soluciones estudiadas, la de mejores resultados fue SIM 200 mg + NAC 600 mg + agua 100 mL, con lo que se logró calidad de visibilidad excelente del 92,9%; sin embargo, las otras 3 soluciones dan resultados excelentes por encima del 84,1%. La escala TVMS propuesta, que incluye 7 sitios con 4 calificaciones y convertidas a 3 calificaciones cualitativas (excelente, adecuada e inadecuada) es una herramienta fácil de aplicar y más completa frente a escalas publicadas previamente. El esquema de premedicación de hasta 100 mL, ingerida entre 15 y 30 minutos antes de la endoscopia, es una exposición segura en pacientes adultos ASA I y II, intervenidos bajo sedación consciente. El uso del mucolítico Hedera helix es una alternativa diferente y menos costosa, aunque menos eficiente que NAC.
Agradecimientos
El presente trabajo se realizó en el marco del Diplomado de Investigación Científica de la Universidad CES, en convenio y con financiación de la Asociación Colombiana de Gastroenterología, en la gestión y apoyo decidido del Dr. Fabio Gil Parada; al laboratorio Tecnoquímicas, por apoyar con el producto N-acetilcisteína (Aflux®); al laboratorio Incobra S. A., por apoyar con el producto simeticona-dimetilpolisiloxano (Siligás®); y al laboratorio Roemmers, por apoyar con el producto Hedera Helix (Abrilar®).
REFERENCIAS
1. Adams MA, Saini SD, Allen JI. Quality measures in gastrointestinal endoscopy: the current state. Curr Opin Gastroenterol. 2017;33(5):352-357. doi: 10.1097/MOG.0000000000000379 [ Links ]
2. Bisschops R, Areia M, Coron E, Dobru D, Kaskas B, Kuvaev R, Pech O, Ragunath K, Weusten B, Familiari P, Domagk D, Valori R, Kaminski MF, Spada C, Bretthauer M, Bennett C, Senore C, Dinis-Ribeiro M, Rutter MD. Performance measures for upper gastrointestinal endoscopy: A European Society of Gastrointestinal Endoscopy quality improvement initiative. United European Gastroenterol J. 2016;4(5):629-656. doi: 10.1177/2050640616664843 [ Links ]
3. Beg S, Ragunath K, Wyman A, Banks M, Trudgill N, Pritchard DM, Riley S, Anderson J, Griffiths H, Bhandari P, Kaye P, Veitch A. Quality standards in upper gastrointestinal endoscopy: a position statement of the British Society of Gastroenterology (BSG) and Association of Upper Gastrointestinal Surgeons of Great Britain and Ireland (AUGIS). Gut. 2017;66(11):1886-1899. doi: 10.1136/gutjnl-2017-314109 [ Links ]
4. Koga M, Arakawa K. [On the application of enzymatic mucinolysis in x-ray diagnosis of the stomach]. Nihon Igaku Hoshasen Gakkai Zasshi. 1964;24:1011-31. [ Links ]
5. Ida K, Okuda J, Nakazawa S, Yoshino J, Itoh M, Yokoyama Y, et al. Clinical evaluation of premedication with KPD (Pronase) in gastroendoscopy-placebo-controlled double blind study in dye scatt ering endoscopy. Clin Rep. 1991;25:1793-804. [ Links ]
6. Monrroy H, Vargas JI, Glasinovic E, Candia R, Azúa E, Gálvez C, Rojas C, Cabrera N, Vidaurre J, Álvarez N, González J, Espino A, González R, Parra-Blanco A. Use of N-acetylcysteine plus simethicone to improve mucosal visibility during upper GI endoscopy: a double-blind, randomized controlled trial. Gastrointest Endosc. 2018;87(4):986-993. doi: 10.1016/j.gie.2017.10.005 [ Links ]
7. Elvas L, Areia M, Brito D, Alves S, Saraiva S, Cadime AT. Premedication with simethicone and N-acetylcysteine in improving visibility during upper endoscopy: a double-blind randomized trial. Endoscopy. 2017;49(2):139-145. doi: 10.1055/s-0042-119034 [ Links ]
8. Callaghan JL, Neale JR, Boger PC, Sampson AP, Patel P. Variation in preparation for gastroscopy: lessons towards safer and better outcomes. Frontline Gastroenterol. 2016;7(3):187-190. doi: 10.1136/flgastro-2015-100647 [ Links ]
9. Song M, Kwek AB, Law NM, Ong JP, Tan JY, Harichander Thurairajah P, Ang DS, Ang TL. Efficacy of small-volume simethicone given at least 30 min before gastroscopy. World J Gastrointest Pharmacol Ther. 2016;7(4):572-578. doi: 10.4292/wjgpt.v7.i4.572 [ Links ]
10. Bertoni G, Gumina C, Conigliaro R, Ricci E, Staffetti J, Mortilla MG, Pacchione D. Randomized placebo-controlled trial of oral liquid simethicone prior to upper gastrointestinal endoscopy. Endoscopy. 1992;24(4):268-70. doi: 10.1055/s-2007-1010479 [ Links ]
11. Sajid MS, Rehman S, Chedgy F, Singh KK. Improving the mucosal visualization at gastroscopy: a systematic review and meta-analysis of randomized, controlled trials reporting the role of Simethicone ± N-acetylcysteine. Transl Gastroenterol Hepatol. 2018;3:29. doi: 10.21037/tgh.2018.05.02 [ Links ]
12. Li Y, Du F, Fu D. The effect of using simethicone with or without N-acetylcysteine before gastroscopy: A meta-analysis and systemic review. Saudi J Gastroenterol. 2019 Jul-;25(4):218-228. doi: 10.4103/sjg.SJG_538_18 [ Links ]
13. Zhang LY, Li WY, Ji M, Liu FK, Chen GY, Wu SS, Hao Q, Zhai HH, Zhang ST. Efficacy and safety of using premedication with simethicone/Pronase during upper gastrointestinal endoscopy examination with sedation: A single center, prospective, single blinded, randomized controlled trial. Dig Endosc. 2018;30(1):57-64. doi: 10.1111/den.12952 [ Links ]
14. Mansilla R, Uslar T, Chahuán J, Latorre G, Cruz R, Cruz R, Sirhan M, Espino A, Honold F, Huenur J, Miranda P, Riquelme A. Validez y confiabilidad de una escala de clasificación de limpieza gástrica en endoscopia digestiva. Gastroenterol Latinoam. 2016;27(1): 9-17. [ Links ]
15. Chang WK, Yeh MK, Hsu HC, Chen HW, Hu MK. Efficacy of simethicone and N-acetylcysteine as premedication in improving visibility during upper endoscopy. J Gastroenterol Hepatol. 2014;29(4):769-74. doi: 10.1111/jgh.12487 [ Links ]
16. Buxbaum JL, Hormozdi D, Dinis-Ribeiro M, Lane C, Dias-Silva D, Sahakian A, Jayaram P, Pimentel-Nunes P, Shue D, Pepper M, Cho D, Laine L. Narrow-band imaging versus white light versus mapping biopsy for gastric intestinal metaplasia: a prospective blinded trial. Gastrointest Endosc. 2017 Nov;86(5):857-865. doi: 10.1016/j.gie.2017.03.1528 [ Links ]
17. World Source: Globocan 2020 [Internet]. IARC; 2020 [citado el 5 de febrero de 2020]. Disponible en: Disponible en: https://gco.iarc.fr/today/data/factsheets/populations/900-world-fact-sheets.pdf [ Links ]
18. Wiesner Ceballos C, Henríquez Mendoza GM, Aguilera López J. Análisis de situación del cáncer en Colombia: 2015. Colombia, Ministerio de Salud, Instituto Nacional de Cancerología; 2017. Disponible en: https://www.cancer.gov.co/Situacion_del_Cancer_en_Colombia_2015.pdf [ Links ]
19. Matsuzaka M, Fukuda S, Takahashi I, Shimaya S, Oyama T, Yaegaki M, Shimoyama T, Sakamoto J, Nakaji S, Umeda T. The decreasing burden of gastric cancer in Japan. Tohoku J Exp Med. 2007;212(3):207-19. doi: 10.1620/tjem.212.207 [ Links ]
20. Kim GH, Liang PS, Bang SJ, Hwang JH. Screening and surveillance for gastric cancer in the United States: Is it needed? Gastrointest Endosc. 2016;84(1):18-28. doi: 10.1016/j.gie.2016.02.028 [ Links ]
21. Gómez-Zuleta MA, Ruíz-Morales OF, Otero-Regino W. Efectividad de la premedicación con N-acetil cisteína más dimetilpolisiloxano versus un placebo para mejorar la visibilidad en la endoscopia digestiva: estudio prospectivo, ciego, controlado aleatorizado. Medicina (Mex). 2017;39(2):98-106. [ Links ]
22. Royero Gutiérrez HA. Aplicación de una escala de visualización de la mucosa gástrica, durante la esofagogastroduodenoscopia en pacientes premedicados con N-acetilcisteína más simeticona: experiencia en Ocaña, Norte de Santander. Rev Colomb Gastroenterol. 2018;33(1):1-7. https://doi.org/10.22516/25007440.226 [ Links ]
23. Blanco Avellaneda CJ, García KR, Molano A, Chimbi DY, Forero AY. Seguridad y eficiencia de sedación balanceada con propofol y remifentanil en endoscopia digestiva alta diagnóstica. Una experiencia exitosa. Rev Colomb Gastroenterol. 2017;32(2):120-30. https://doi.org/10.22516/25007440.140 [ Links ]
24. McNally PR, Maydonovitch CL, Wong RK. The effectiveness of simethicone in improving visibility during colonoscopy: a double-blind randomized study. Gastrointest Endosc. 1988;34(3):255-8. doi: 10.1016/s0016-5107(88)71324-3 [ Links ]
25. Bhandari P, Green S, Hamanaka H, Nakajima T, Matsuda T, Saito Y, Oda I, Gotoda T. Use of Gascon and Pronase either as a pre-endoscopic drink or as targeted endoscopic flushes to improve visibility during gastroscopy: a prospective, randomized, controlled, blinded trial. Scand J Gastroenterol. 2010;45(3):357-61. doi: 10.3109/00365520903483643 [ Links ]
26. Lee GJ, Park SJ, Kim SJ, Kim HH, Park MI, Moon W. Effectiveness of Premedication with Pronase for Visualization of the Mucosa during Endoscopy: A Randomized, Controlled Trial. Clin Endosc. 2012;45(2):161-4. doi: 10.5946/ce.2012.45.2.161 [ Links ]
27. Bertoni G, Gumina C, Conigliaro R, Ricci E, Staffetti J, Mortilla MG, Pacchione D. Randomized placebo-controlled trial of oral liquid simethicone prior to upper gastrointestinal endoscopy. Endoscopy. 1992;24(4):268-70. doi: 10.1055/s-2007-1010479 [ Links ]
28. Kuo CH, Sheu BS, Kao AW, Wu CH, Chuang CH. A defoaming agent should be used with pronase premedication to improve visibility in upper gastrointestinal endoscopy. Endoscopy. 2002;34(7):531-4. doi: 10.1055/s-2002-33220 [ Links ]
29. Asl SM, Sivandzadeh GR. Efficacy of premedication with activated Dimethicone or N-acetylcysteine in improving visibility during upper endoscopy. World J Gastroenterol. 2011;17(37):4213-7. doi: 10.3748/wjg.v17.i37.4213 [ Links ]
30. Chang CC, Chen SH, Lin CP, Hsieh CR, Lou HY, Suk FM, Pan S, Wu MS, Chen JN, Chen YF. Premedication with pronase or N-acetylcysteine improves visibility during gastroendoscopy: an endoscopist-blinded, prospective, randomized study. World J Gastroenterol. 2007;13(3):444-7. doi: 10.3748/wjg.v13.i3.444 [ Links ]
31. Pimentel-Nunes P, Libânio D, Marcos-Pinto R, Areia M, Leja M, Esposito G, Garrido M, Kikuste I, Megraud F, Matysiak-Budnik T, Annibale B, Dumonceau JM, Barros R, Fléjou JF, Carneiro F, van Hooft JE, Kuipers EJ, Dinis-Ribeiro M. Management of epithelial precancerous conditions and lesions in the stomach (MAPS II): European Society of Gastrointestinal Endoscopy (ESGE), European Helicobacter and Microbiota Study Group (EHMSG), European Society of Pathology (ESP), and Sociedade Portuguesa de Endoscopia Digestiva (SPED) guideline update 2019. Endoscopy. 2019;51(4):365-388. doi: 10.1055/a-0859-1883 [ Links ]
32. Koeppe AT, Lubini M, Bonadeo NM, Moraes I Jr, Fornari F. Comfort, safety and quality of upper gastrointestinal endoscopy after 2 hours fasting: a randomized controlled trial. BMC Gastroenterol. 2013;13:158. doi: 10.1186/1471-230X-13-158 [ Links ]
33. De Silva AP, Amarasiri L, Liyanage MN, Kottachchi D, Dassanayake AS, de Silva HJ. One-hour fast for water and six-hour fast for solids prior to endoscopy provides good endoscopic vision and results in minimum patient discomfort. J Gastroenterol Hepatol. 2009;24(6):1095-7. doi: 10.1111/j.1440-1746.2009.05782.x [ Links ]
34. Ofstead CL, Wetzler HP, Johnson EA, Heymann OL, Maust TJ, Shaw MJ. Simethicone residue remains inside gastrointestinal endoscopes despite reprocessing. Am J Infect Control. 2016 Nov 1;44(11):1237-1240. doi: 10.1016/j.ajic.2016.05.016 [ Links ]
35. Sutton S, Jimenez L. A Review of Reported Recalls Involving Microbiological Control 2004-2011 with Emphasis on FDA Considerations of “Objectionable Organisms” [Internet]. American Pharmaceutical Review; 2012 [citado el 21 de febrero de 2020]. Disponible en: Disponible en: http://www.americanpharmaceuticalreview.com/Featured-Articles/38382-A-Review-of-Reported-Recalls-Involving-Microbiological-Control-2004-2011-with-Emphasis-on-FDA-Considerations-of-Objectionable-Organisms/ [ Links ]
36. Devereaux BM, Taylor ACF, Athan E, Wallis DJ, Brown RR, Greig SM, Bailey FK, Vickery K, Wardle E, Jones DM. Simethicone use during gastrointestinal endoscopy: Position statement of the Gastroenterological Society of Australia. J Gastroenterol Hepatol. 2019;34(12):2086-2089. doi: 10.1111/jgh.14757 [ Links ]
Citación: Blanco C, Barreto-Guevara MI, Walteros-Gordillo Y, Pinzón-Segura N, Rivera-Velasco MC, Bareño J. Cohortes de premedición en endoscopia alta con simeticona, N-acetilcisteína, Hedera helix y validación de la escala visual. Rev Colomb Gastroenterol. 2021;36(1):39-50. https://doi.org/10.22516/25007440.582
Recibido: 27 de Mayo de 2020; Aprobado: 28 de Octubre de 2020











 text in
text in