Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista colombiana de Gastroenterología
Print version ISSN 0120-9957On-line version ISSN 2500-7440
Rev. colomb. Gastroenterol. vol.36 no.3 Bogotá July/Sept. 2021 Epub Dec 10, 2021
https://doi.org/10.22516/25007440.646
Trabajos originales
Stents metálicos autoexpandibles para el manejo endoscópico de las fístulas esofagogástricas
1Chief of the Gastroenterology Division, Pontificia Universidad Javeriana, Hospital Universitario San Ignacio. Bogotá D. C., Colombia.
2Gastroenterology Division, Pontificia Universidad Javeriana, Hospital Universitario San Ignacio. Bogotá D. C., Colombia.
Objetivos:
mostrar la eficacia y seguridad de los stents metálicos autoexpandibles para el manejo endoscópico de las fístulas esofágicas.
Materiales y métodos:
se evalúo una serie de casos de manera retrospectiva entre el 2007 y el 2017, en los que se manejaron a 11 pacientes con un stent metálico autoexpandible para el manejo de fístula esofágica, en quienes se realizó el diagnóstico por clínica, endoscopia digestiva alta o estudios radiológicos en la unidad de gastroenterología del Hospital Universitario San Ignacio (HUSI) de Bogotá D. C., Colombia.
Resultados:
el principal síntoma inicial fue la disnea en 27,3 % de los casos, seguido por tos en un 18,2 %. El hallazgo más frecuentemente encontrado durante el seguimiento fue el derrame pleural en el 36,4 %, se realizó el diagnóstico de fístula en el 45,5 % con esofagograma y el tipo de lesión más reportada fue la fuga en la anastomosis esofagoentérica, con un 45,5 %, seguida de la esofagopleural, con un 36,4 %; y estos pacientes fueron manejados con un stent metálico autoexpandible. En el 100 % hubo éxito técnico y la resolución del defecto se evidenció en el 72,7 % de los casos. La única complicación reportada fue el desplazamiento del stent en el 27,3 %, y en un paciente se requirió el cambio del stent en 3 oportunidades. El promedio de estancia hospitalaria fue de 41,5 días.
Conclusiones:
el manejo endoscópico de las fístulas esofagogástricas con stents metálicos autoexpandibles es efectivo y seguro, con una baja tasa de complicaciones.
Palabras clave: Fístulas esofágicas; stent metálico autoexpandible; anastomosis; complicaciones; cirugía de esófago
Objective:
To demonstrate the efficacy and safety of self-expanding metal stents for endoscopic management of esophageal fistulas.
Materials and methods:
Retrospective case series between 2007 and 2017. A total of 11 patients were treated with self-expanding metal stents for esophageal fistula management, after being diagnosed based on symptoms, upper endoscopy, and/or radiological studies in the gastroenterology unit of the Hospital Universitario San Ignacio (HUSI) in Bogotá D.C, Colombia.
Results:
The most common initial symptom was dyspnea in 27.3% of cases, followed by cough in 18.2%. The most frequent finding during follow-up was pleural effusion in 36.4% of the cases, of which 45.5% received a diagnosis of fistula through esophagogram. The most reported lesion was esophagoenteric anastomotic leak with 45.5%, followed by esophagopleural injury with 36.4%; these patients were those who received self-expanding metal stent management. Technical success was achieved in 100% of the cases, and the defect was resolved in in 72.7% of them. The only complication reported was stent migration in 27.3%, requiring 3 changes in 1 patient. The average hospital stay was 41.5 days.
Conclusions:
Endoscopic management of esophagogastric fistulas with self-expanding metal stents is effective and safe, with a low complication rate.
Keywords: Esophageal fistulas; Self-expanding metal stent; Anastomosis; Complications; Esophageal surgery
Introducción
Las fugas y fístulas gastrointestinales son condiciones graves y potencialmente mortales que pueden verse como una amplia variedad de presentaciones clínicas. Las fugas están relacionadas principalmente con defectos anastomóticos posoperatorios y son responsables de una parte importante de la morbimortalidad quirúrgica. Las fugas y las colecciones posoperatorias pueden conducir al desarrollo de una fístula entre dos estructuras epiteliales. La endoscopia intervencionista con la colocación de un stent juega un papel fundamental como tratamiento de primera línea y de rescate en estas situaciones, ya que es un método eficaz y mínimamente invasivo en el que se requiere un enfoque personalizado y multidisciplinario basado en la presentación clínica, las características del defecto (tamaño, ubicación), experiencia local y la disponibilidad de dispositivos. La fuga se define como una comunicación patológica entre compartimentos intra- y extraluminales, mientas que la fístula se define como una comunicación anormal entre dos superficies epitelializadas1,2.
La mayoría de las fugas y fístulas gastrointestinales (75 %-85 %) ocurre por una complicación de la cirugía intraabdominal y es causada por una variedad de factores incluidas la ausencia o la incorrecta colocación de drenajes, desnutrición, inadecuada técnica quirúrgica, infección y dehiscencia de anastomosis. Un porcentaje menor ocurre secundariamente a enfermedad inflamatoria intestinal, diverticulitis, neoplasias, trauma y radioterapia3.
Las fístulas pueden ser difíciles de diagnosticar y demandan frecuentemente reintervenciones quirúrgicas; de este modo aumenta la morbimortalidad y los costos de la hospitalización; por tanto, los principios fundamentales del tratamiento son la identificación del sitio del defecto, el drenaje y la prevención de colecciones adicionales, ya sea mediante la desviación del flujo del contenido luminal o el cierre del defecto4,5. Aunque el manejo quirúrgico tradicional o el conservador con reposo intestinal, los antibióticos intravenosos y el soporte nutricional son los pilares del tratamiento, no siempre son efectivos6-8. El manejo endoscópico ha demostrado ser una alternativa eficaz y menos invasiva que la cirugía primaria, y los stents metálicos autoexpandibles total o parcialmente cubiertos son una alternativa mínimamente invasiva en el manejo de las fugas y fístulas gastrointestinales, cuyo objetivo es prevenir la fuga del contenido gastrointestinal por el trayecto fistuloso y, de este modo, permitir la cicatrización del defecto, lo que favorece que el paciente retome la nutrición por vía oral y mejore sus condiciones nutricionales, para que de esta manera se permita el cierre del defecto y, a futuro, mejore la calidad de vida9,10.
Una de las desventajas de los stents metálicos es que pueden causar hiperplasia de la mucosa adyacente, lo que hace difícil removerlos una vez se ha logrado el cierre de la fístula10. Los stents no cubiertos o parcialmente cubiertos están más asociados con hiperplasia epitelial y otras complicaciones, especialmente cuando su uso es transitorio, como para el manejo de condiciones benignas. Por tanto, se ha preferido el uso de stents metálicos completamente recubiertos para esta indicación, aunque pueden cursar con una mayor tasa de migración11.
Blackmon y colaboradores reportaron datos de un estudio prospectivo con seguimiento a 15 meses, que incluyó 25 pacientes, de los cuales 23 pacientes con diagnóstico de fugas anastomóticas, fístulas traqueoesofágicas y perforaciones benignas fueron manejados con stents metálicos cubiertos como primera línea de tratamiento. Se obtuvo curación en 10 pacientes manejados con stent por fuga anastomótica después de bypass gástrico o manga gástrica, un paciente con tres perforaciones iatrogénicas esofágicas tuvo control con la colocación de un stent y en 2 de 4 pacientes con fístula traqueoesofágica se logró sellar la misma con el uso de stents. Como complicación más frecuente se reportó la migración del stent en 10 pacientes12.
La serie retrospectiva de Tuebergen y colaboradores incluyó 32 pacientes, 24 con fugas posoperatorias, la mayoría luego de cirugía oncológica gastroesofágica y 8 pacientes con perforación no maligna de esófago. Lograron un sellado funcional completo después del despliegue del stent en el 78 % de los casos con el uso de stents metálicos completamente cubiertos, y se destaca que la postura se realizó en promedio entre 3 y 5 días después del diagnóstico13.
El objetivo primario de este estudio es evaluar las tasas de cierre en el manejo de las fístulas gastrointestinales con stents metálicos autoexpandibles, y como objetivo secundario está determinar las complicaciones tempranas y tardías y la estancia hospitalaria.
Materiales y métodos
Se realizó una evaluación retrospectiva de las bases de datos de los procedimientos intervencionistas de la unidad de gastroenterología, desde enero de 2007 hasta diciembre de 2017, y se encontraron 11 pacientes con diagnóstico de fístula esofágica, de los cuales 10 fueron tratados con un stent metálico autoexpandible (SMA) y 1 con SMA más OVESCO (Over The Scope Clip) en la unidad de gastroenterología del Hospital Universitario San Ignacio. Todos los datos fueron registrados en un formato diseñado para tal fin, antes y después de la colocación del stent. El seguimiento se hizo bajo la revisión de las historias clínicas o por contacto telefónico.
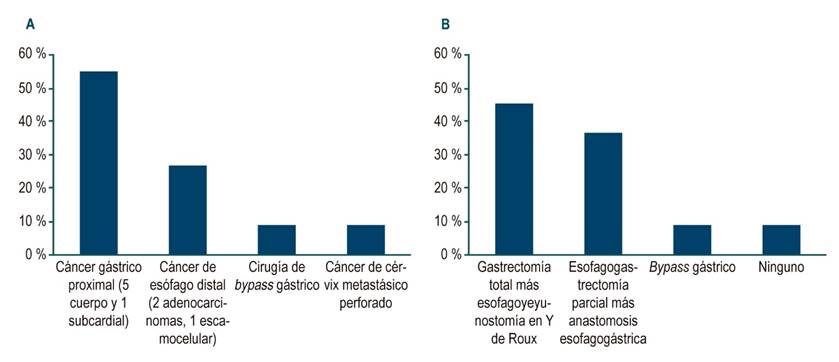
Con respecto al diagnóstico de base, en dos casos se reportó el antecedente de adenocarcinoma y un carcinoma escamocelular del tercio distal del esófago (3 casos, 27 %). En 6 casos (55 %) hubo adenocarcinomas del cardias (1 caso) o del cuerpo gástrico (5 casos), un caso de cirugía por obesidad (9 %) y uno de cáncer de cérvix metastásico perforado (9 %) (Figura 1). Derivado de las patologías de base anteriormente descritas, el manejo quirúrgico más frecuentemente realizado fue la gastrectomía total más esofagoyeyunostomía en Y de Roux (45,5 %), seguido por esofagogastrectomía más anastomosis esofagogástrica (36,4 %).
Los parámetros clínicos se registraron usando una base de datos de Microsoft Excel, que describen el éxito técnico, éxito clínico, complicaciones relacionadas con el procedimiento tales como el desplazamiento del SMA, mortalidad y la duración de la estancia hospitalaria. Los pacientes tuvieron seguimiento con estudios endoscópicos y radiológicos.
El consentimiento informado para dicho procedimiento se obtuvo de todos los pacientes o sus familiares, en caso de que el paciente no pudiese dar la autorización por la condición clínica del momento. En todos los pacientes la colocación del SMA se realizó bajo sedación suministrada por anestesiología, con estricta monitorización de los signos vitales. La localización del defecto esofágico se marcó para su identificación bajo fluoroscopia en la superficie de la piel con un identificador radiopaco. Luego, se insertó una guía semirrígida en la luz esofágica bajo visión endoscópica y se dejó in situ con retiro del gastroscopio, se introdujo sobre la guía un stent de nitinol total o parcialmente cubierto, el cual se liberó bajo visión fluoroscópica y endoscópica y se verificó que la localización de la fístula quedara en la parte media del SMA (éxito técnico) por medio de una endoscopia digestiva alta.
La extracción del SMA se realizó en promedio a las 4 semanas, en todos los pacientes que tuvieron evidencia de cicatrización del trayecto fistuloso corroborado mediante la realización de una radiografía de vías digestivas altas. El éxito clínico se definió como la ausencia de síntomas (disnea, tos, expectoración y disfagia), con la normalización de los marcadores séricos de inflamación, y evidencia endoscópica o radiológica del control del producido de la fístula.
Resultados
Se colocaron 14 SMA en 11 pacientes, que se distribuyeron en 6 mujeres (54,5 %) con una edad promedio de 58 años (desviación estándar [DE]: 16,02), con un mínimo de 36 años y un máximo de 86 años. Con respecto a las comorbilidades encontradas, la mayoría de los pacientes no presentaba ninguna (63,6 %), dos pacientes tenían hipertensión arterial (HTA) y diabetes mellitus (18,2 %), un paciente con hipertensión y otra con antecedente de cáncer de cérvix.
En cuanto a las características clínicas de los pacientes incluidos en el estudio (Tabla 1), se encontró que el principal síntoma fue la presencia de disnea en 3 casos (27,3 %), seguido por tos en 2 casos (18,2 %) y los 6 pacientes restantes presentaron cada uno síntomas diferentes, que se muestran en la Figura 2. El tiempo de evolución de los síntomas en la mayoría de casos fue subagudo (7-15 días; 63,6 %), seguido por síntomas crónicos (> 15 días; 27,3 %).
Tabla 1 Características del diagnóstico clínico
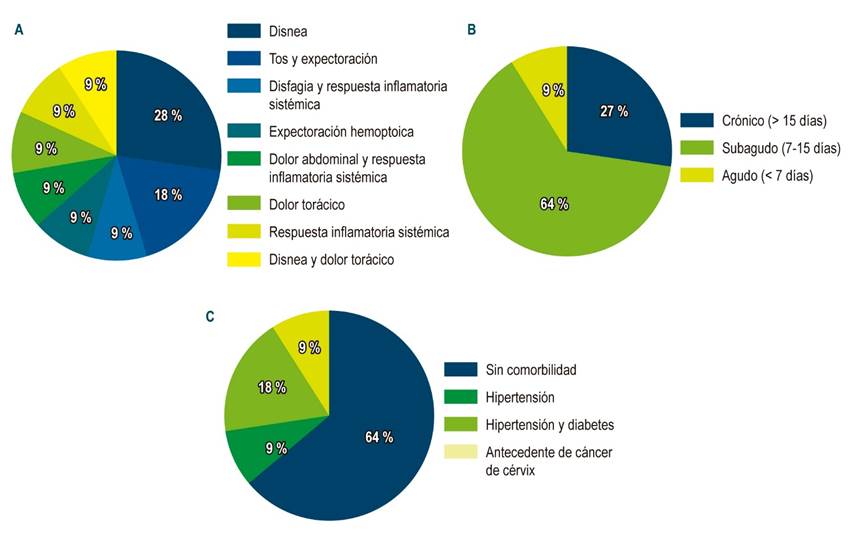
Figura 2 Características clínicas de los sujetos de estudio. A. Síntomas por los cuales consulta. B. Tiempo de evolución de los síntomas. C. Comorbilidades.
El hallazgo más frecuentemente encontrado durante el seguimiento fue el derrame pleural (36,4 %) y se realizó el diagnóstico de fístula en la mayoría de los casos (45,5 %) con esofagograma, en 2 casos con endoscopia de vías digestivas altas (EVDA) y tomografía axial computarizada (TAC) de tórax (18,2 %), y en los 4 casos restantes con esofagograma y EVDA, esofagograma y TAC Tórax, EVDA y azul de metileno, cada uno respectivamente (Tabla 1). El tipo de fístula más reportado es el relacionado con la anastomosis esofagoentérica (45,5 %), seguido de la esofagopleural (36,4 %), para lo cual dichos pacientes fueron manejados con SMA.
En relación con el manejo endoscópico de la fístula, se encontró que el tiempo promedio de inserción del SMA desde que se realizó el diagnóstico fue de 6,5 días, y el SMA totalmente recubierto fue el más utilizado (en un 54,5 % de los casos), seguido por SMA parcialmente recubierto (en un 36,4 % de los casos) y por SMA parcialmente recubierto más OVESCO (en el 9,1 % de los casos). Se utilizó el sistema de clip OVESCO para el cierre del defecto y se protegió este con un SMA.
Todos los procedimientos tuvieron éxito técnico y la resolución de síntomas se evidenció en el 72,7 % de los casos. La duración del SMA in situ tuvo en promedio 33,67 días, aunque cabe resalta que este dato no se definió en 5 pacientes dado que fallecieron con el SMA in situ. La única complicación reportada fue el desplazamiento del SMA (27,3 %) y, de estos, un paciente requirió la reposición del SMA en 3 oportunidades debido a que hubo desplazamientos (Tabla 2). El promedio de la estancia hospitalaria fue 41,5 días. La resolución de la fístula se evidenció en el 63,5 % de los casos. No se reportaron muertes relacionadas con la fístula, con fugas o con el implante del SMA.
Tabla 2 Características del procedimiento quirúrgico
De acuerdo con las características de los pacientes en los que no hubo resolución de los síntomas después del manejo endoscópico de la fístula (Tabla 3), se encontró que los 3 pacientes que no tuvieron éxito clínico fueron hombres y no tenían comorbilidades. Estos 3 pacientes no presentaron síntomas agudos, 2 tenían como diagnóstico inicial adenocarcinoma del tercio distal del esófago y el otro paciente tenía adenocarcinoma difuso del cuerpo gástrico.
Tabla 3 Características según el éxito clínico del procedimiento quirúrgico
En 2 casos se realizó gastrectomía total más esofagoyeyunostomía en Y de Roux, y en el otro caso se realizó esofagogastrectomía subtotal más anastomosis esofagogástrica; en 2 casos se presentó fístula esofagopleural y en el otro, fístula traqueoesofágica. Dos de los SMA utilizados en el fracaso clínico eran totalmente recubiertos y el otro, parcialmente recubierto. Además, dos de los casos presentaron desplazamiento como complicación.
Con respecto al tiempo de inserción del SMA desde el diagnóstico de la fístula, en promedio fue dos días menos en los casos de éxito que en los de fallos, y la media en el valor de hemoglobina fue menor en los pacientes que no tuvieron éxito clínico.
Discusión
Las fístulas esofágicas tienen un amplio espectro de presentación que varía desde síntomas inespecíficos como disnea o síndrome de respuesta inflamatoria sistémica (SRIS), hasta compromiso grave del paciente, debido a la sepsis secundaria a empiema o mediastinitis, por lo cual el tratamiento debe ser individualizado. Teniendo en cuenta los resultados desfavorables después de la reintervención quirúrgica en el caso de las fístulas anastomóticas, se ha desplazado cada vez más dicho manejo y se han considerado los manejos menos invasivos como las intervenciones endoscópicas con implante de clips, OVESCO o SMA, como la primera elección4,5,9.
Hasta el momento, no se ha realizado un consenso para un tratamiento adecuado de las fístulas esofágicas; sin embargo, se han publicado informes de casos y series pequeñas en los cuales el manejo endoscópico con SMA ha sido el pilar del tratamiento en diferentes patologías asociadas con fístula14-17. En nuestra serie de casos se describen situaciones de complejidad elevada como las fístulas esofagotraqueales y esofagobronquiales, que fueron manejadas por endoscopistas experimentados, lo cual explica la alta tasa de éxito técnico y la tasa de mortalidad fue baja en relación con el implante del SMA, en comparación con otras series publicadas (Tabla 2).
En esta serie de casos la tasa de mortalidad en relación con el SMA fue 0 %, importante en comparación con otros estudios, lo cual se puede relacionar con la no reintervención quirúrgica, que puede incrementar la mortalidad posterior al implante de un SMA debido a la condición clínica del paciente14,18-20. Además, otra de las justificaciones de la baja mortalidad y el éxito técnico y clínico evidenciado en nuestros pacientes se relaciona con el tiempo de implante de SMA desde el diagnóstico, que juega un papel fundamental, como se evidenció con éxito en los pacientes que fueron manejados con implante de SMA en los 2 primeros días de haberse realizado el diagnóstico, en comparación con los que recibieron dicho manejo después de 2 días, por lo que queda plenamente justificado que el implante de un SMA tempranamente reduce de forma importante la morbimortalidad de esta patología potencialmente letal. Por esta razón, una vez que se evidencie una evolución inadecuada en un paciente, se debe evaluar lo más pronto posible la realización de una endoscopia digestiva alta o un estudio radiológico para realizar un diagnóstico y un manejo oportunos.
Se debe tener en cuenta que el manejo endoscópico de las fístulas esofágicas es complejo desde el punto de vista técnico y con amplias implicaciones en lo económico, dado que el implante del SMA no es el único procedimiento que se realiza, teniéndose en cuenta que se requieren estudios adicionales, como las EVDA repetitivas y estudios radiológicos, hasta que se obtenga un diagnóstico preciso y se tenga claro el diagnóstico y la resolución de la fístula.
Es importante tener en cuenta el tipo de SMA a utilizar. Los SMA parcial o totalmente recubiertos se utilizan en el manejo del cáncer esofágico, fístulas anastomóticas y perforaciones esofágicas iatrogénicas, con un éxito adecuado21,22, pero se han planteado dudas sobre la eficacia a largo plazo de los SMA debido a sus complicaciones23), como el incrustamiento a la pared esofágica, por lo que el retiro endoscópico puede ser complejo23-25. En nuestra serie de casos en 6 pacientes se retiró el SMA sin complicaciones después de la confirmación de resolución de la fístula, teniéndose en cuenta que la extracción del SMA debe ser cuidadosa por el riesgo de perforación y broncoaspiración durante el procedimiento.
En nuestra serie de casos, el cierre de la fístula se presentó en el 63,3 %, ligeramente por debajo de lo que se describe en la literatura, lo cual se puede atribuir a la migración distal (que se presentó en el 27,3 % de nuestros casos) y al tiempo de implante del SMA después de la realización del diagnóstico de fístula; sin embargo, la mortalidad fue del 0 % en relación con el implante del SMA, con una media de estancia hospitalaria de 41,5 días, lo cual se relaciona con la condición clínica de cada paciente.
Vale la pena tener en cuenta técnicas endoscópicas que se pueden utilizar de forma combinada, como el uso de cianoacrilato, sutura endoscópica, técnicas de vacío (Endo-SPONGE®) y OVESCO en este tipo de fístulas; este último se usó en nuestro caso para el cierre del defecto y, posteriormente, se protegió con un SMA parcialmente cubierto. Las técnicas combinadas cada vez tienen mayor aceptación con tasas de éxito técnico y éxito clínico favorables, como lo describieron Thiruvengadam y colaboradores en su cohorte retrospectiva26.
En conclusión, con base en los resultados y lo reportado en la literatura, se puede afirmar que el manejo endoscópico de las fístulas o fugas esofágicas con SMA es una alternativa efectiva y segura, con mejoría de los síntomas, un alto cierre de las mismas y bajo riesgo de complicaciones.
REFERENCIAS
1. Bemelman WA, Baron TH. Endoscopic Management of Transmural Defects, Including Leaks, Perforations, and Fistulae. Gastroenterology. 2018;154(7):1938-1946.e1. https://doi.org/10.1053/j.gastro.2018.01.067 [ Links ]
2. Cereatti F, Grassia R, Drago A, Conti CB, Donatelli G. Endoscopic management of gastrointestinal leaks and fistulae: What option do we have? World J Gastroenterol. 2020;26(29):4198-4217. https://doi.org/10.3748/wjg.v26.i29.4198 [ Links ]
3. Falconi M, Pederzoli P. The relevance of gastrointestinal fistulae in clinical practice: a review. Gut. 2001 Dec;49 Suppl 4(Suppl 4):iv2-10. https://doi.org/10.1136/gut.49.suppl_4.iv2 [ Links ]
4. González-Pinto I, González EM. Optimising the treatment of upper gastrointestinal fistulae. Gut. 2001;49 Suppl 4(Suppl 4):iv22-31. https://doi.org/10.1136/gut.49.suppl_4.iv21 [ Links ]
5. Ge PS, Thompson CC. The Use of the Overstitch to Close Perforations and Fistulas. Gastrointest Endosc Clin N Am. 2020;30(1):147-161. https://doi.org/10.1016/j.giec.2019.08.010 [ Links ]
6. Datta V, Windsor AC. Surgical management of enterocutaneous fistula. Br J Hosp Med (Lond). 2007;68(1):28-31. https://doi.org/10.12968/hmed.2007.68.1.22652 [ Links ]
7. Kwon SH, Oh JH, Kim HJ, Park SJ, Park HC. Interventional management of gastrointestinal fistulas. Korean J Radiol. 2008;9(6):541-9. https://doi.org/10.3348/kjr.2008.9.6.541 [ Links ]
8. Schecter WP. Management of enterocutaneous fistulas. Surg Clin North Am. 2011;91(3):481-91. https://doi.org/10.1016/j.suc.2011.02.004 [ Links ]
9. Dasari BV, Neely D, Kennedy A, Spence G, Rice P, Mackle E, Epanomeritakis E. The role of esophageal stents in the management of esophageal anastomotic leaks and benign esophageal perforations. Ann Surg. 2014;259(5):852-60. https://doi.org/10.1097/SLA.0000000000000564 [ Links ]
10. Rodrigues-Pinto E, Repici A, Donatelli G, Macedo G, Devière J, van Hooft JE, Campos JM, Galvao Neto M, Silva M, Eisendrath P, Kumbhari V, Khashab MA. International multicenter expert survey on endoscopic treatment of upper gastrointestinal anastomotic leaks. Endosc Int Open. 2019;7(12):E1671-E1682. https://doi.org/10.1055/a-1005-6632 [ Links ]
11. Ross WA, Alkassab F, Lynch PM, Ayers GD, Ajani J, Lee JH, Bismar M. Evolving role of self-expanding metal stents in the treatment of malignant dysphagia and fistulas. Gastrointest Endosc. 2007;65(1):70-6. https://doi.org/10.1016/j.gie.2006.04.040 [ Links ]
12. Blackmon SH, Santora R, Schwarz P, Barroso A, Dunkin BJ. Utility of removable esophageal covered self-expanding metal stents for leak and fistula management. Ann Thorac Surg. 2010;89(3):931-6; discussion 936-7. https://doi.org/10.1016/j.athoracsur.2009.10.061 [ Links ]
13. Tuebergen D, Rijcken E, Mennigen R, Hopkins AM, Senninger N, Bruewer M. Treatment of thoracic esophageal anastomotic leaks and esophageal perforations with endoluminal stents: efficacy and current limitations. J Gastrointest Surg. 2008;12(7):1168-76. https://doi.org/10.1007/s11605-008-0500-4 [ Links ]
14. Doniec JM, Schniewind B, Kahlke V, Kremer B, Grimm H. Therapy of anastomotic leaks by means of covered self-expanding metallic stents after esophagogastrectomy. Endoscopy. 2003;35(8):652-8. https://doi.org/10.1055/s-2003-41509 [ Links ]
15. Roy-Choudhury SH, Nicholson AA, Wedgwood KR, Mannion RA, Sedman PC, Royston CM, Breen DJ. Symptomatic malignant gastroesophageal anastomotic leak: management with covered metallic esophageal stents. AJR Am J Roentgenol. 2001;176(1):161-5. https://doi.org/10.2214/ajr.176.1.1760161 [ Links ]
16. Siersema PD, Homs MY, Haringsma J, Tilanus HW, Kuipers EJ. Use of large-diameter metallic stents to seal traumatic nonmalignant perforations of the esophagus. Gastrointest Endosc. 2003;58(3):356-61. https://doi.org/10.1067/s0016-5107(03)00008-7 [ Links ]
17. Kauer WK, Stein HJ, Dittler HJ, Siewert JR. Stent implantation as a treatment option in patients with thoracic anastomotic leaks after esophagectomy. Surg Endosc. 2008;22(1):50-3. https://doi.org/10.1007/s00464-007-9504-5 [ Links ]
18. Urschel JD. Esophagogastrostomy anastomotic leaks complicating esophagectomy: a review. Am J Surg. 1995;169(6):634-40. https://doi.org/10.1016/s0002-9610(99)80238-4 [ Links ]
19. Gelbmann CM, Ratiu NL, Rath HC, Rogler G, Lock G, Schölmerich J, Kullmann F. Use of self-expandable plastic stents for the treatment of esophageal perforations and symptomatic anastomotic leaks. Endoscopy. 2004;36(8):695-9. https://doi.org/10.1055/s-2004-825656 [ Links ]
20. Johnsson E, Lundell L, Liedman B. Sealing of esophageal perforation or ruptures with expandable metallic stents: a prospective controlled study on treatment efficacy and limitations. Dis Esophagus. 2005;18(4):262-6. https://doi.org/10.1111/j.1442-2050.2005.00476.x [ Links ]
21. Raijman I. Endoscopic management of esophagorespiratory fistulas: expanding our options with expandable stents. Am J Gastroenterol. 1998;93(4):496-9. https://doi.org/10.1111/j.1572-0241.1998.496_b.x [ Links ]
22. Ramirez FC, Dennert B, Zierer ST, Sanowski RA. Esophageal self-expandable metallic stents--indications, practice, techniques, and complications: results of a national survey. Gastrointest Endosc. 1997;45(5):360-4. https://doi.org/10.1016/s0016-5107(97)70144-5 [ Links ]
23. Song HY, Park SI, Jung HY, Kim SB, Kim JH, Huh SJ, Kim TH, Kim YK, Park S, Yoon HK, Sung KB, Min YI. Benign and malignant esophageal strictures: treatment with a polyurethane-covered retrievable expandable metallic stent. Radiology. 1997;203(3):747-52. https://doi.org/10.1148/radiology.203.3.9169699 [ Links ]
24. Wadhwa RP, Kozarek RA, France RE, Brandabur JJ, Gluck M, Low DE, Traverso LW, Moonka R. Use of self-expandable metallic stents in benign GI diseases. Gastrointest Endosc. 2003;58(2):207-12. https://doi.org/10.1067/mge.2003.343 [ Links ]
25. Lee SH. The role of oesophageal stenting in the non-surgical management of oesophageal strictures. Br J Radiol. 2001;74(886):891-900. https://doi.org/10.1259/bjr.74.886.740891 [ Links ]
26. Thiruvengadam NR, Hamerski C, Nett A, Bhat Y, Shah J, Bernabe J, Kane S, Binmoeller K, Watson RR. Combination Endoscopic Therapy is Effective for Treatment of Nonbariatric Postoperative Gastroenteric Leaks. Techniques and Innovations in Gastrointestinal Endoscopy. 2021;23(2):122-8. https://doi.org/10.1016/j.tige.2020.11.003 [ Links ]
Citación:
Vargas R, Costa V, Ovalle FA. Stents metálicos autoexpandibles para el manejo endoscópico de las fístulas esofagogástricas. Rev Colomb Gastroenterol. 2021;36(3):313-321. https://doi.org/10.22516/25007440.646
Recibido: 17 de Agosto de 2020; Aprobado: 31 de Mayo de 2021











 text in
text in