Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista colombiana de Gastroenterología
versión impresa ISSN 0120-9957versión On-line ISSN 2500-7440
Rev. colomb. Gastroenterol. vol.36 no.3 Bogotá jul./set. 2021 Epub 25-Ene-2022
https://doi.org/10.22516/25007440.528
Reporte de caso
Síndrome de Sweet por tuberculosis peritoneal: reporte de caso
1General practitioner, resident of internal medicine, Universidad del Rosario. Bogotá Colombia.
2General practitioner, Clínica Uros. Neiva, Colombia.
3General practitioner. Surcolombiana University. Neiva, Colombia.
4General Practitioner, University of Manizales. Manizales, Colombia.
5General Practitioner, Latin American School of Medicine (ELAM). Havana Cuba.
6General practitioner, Hospital Federico Lleras Acosta. Ibagué, Colombia.
7General practitioner, Cooperative University of Colombia. Popayan, Colombia.
La tuberculosis (TBC) peritoneal es una entidad poco frecuente y representa un 25 %-50 % de los casos de tuberculosis abdominal, y 0,1 %-0,7 % de todos los casos de tuberculosis. La mortalidad alcanza un 35 % cuando hay un retraso en el tratamiento, y un 73 % en pacientes con cirrosis. Además, tiene un gran espectro clínico, por lo que su diagnóstico diferencial abarca a nivel clínico patologías como cirrosis, malignidad, síndrome nefrótico, desnutrición; a nivel imagenológico enfermedad metastásica peritoneal, carcinomatosis de origen gástrico, pancreático, vesical, ovárico, colónico y enfermedades infecciosas como actinomicosis, coccidioidomicosis, histoplasmosis o micobacterias no tuberculosas. El diagnóstico se apoya inicialmente con química sanguínea, función hepática y renal, ultrasonido, tomografía computarizada (TC), paracentesis con citoquímico de líquido peritoneal, medición de adenosina-desaminasa (ADA) y reacción en cadena de polimerasa (PCR); no obstante, la laparoscopia con biopsia peritoneal y confirmación patológica o microbiológica siguen siendo el estándar de oro. Se han descrito casos de falsos negativos de la prueba ADA en situaciones de inmunosupresión o uso de antituberculosos. Se ha planteado el seguimiento de la actividad de la enfermedad midiendo los niveles de antígeno del cáncer 125 (CA-125). A continuación, presentamos un caso inusual de un paciente con TBC peritoneal con un síndrome de Sweet secundario, en quien inicialmente el reporte para ADA fue negativo, posiblemente debido a la administración de meropenem y en quien, además, se hizo el seguimiento de la actividad de la enfermedad con CA-125. Son muy excepcionales los reportes de falsos negativos de ADA y Sweet secundario a tuberculosis, por lo cual aportamos a la literatura con el reporte de nuestro caso.
Palabras claves: Tuberculosis peritoneal; síndrome de Sweet; ADA; CA-125
Peritoneal tuberculosis is a rare disease that accounts for 25-50% of abdominal tuberculosis cases and 0.1-0.7% of all cases of tuberculosis. Mortality is 35% when treatment is delayed, and 73% in patients with cirrhosis. It also has a wide clinical spectrum, so its differential diagnosis covers conditions such as cirrhosis, malignancy, nephrotic syndrome, and malnutrition. Moreover, imaging studies may reveal peritoneal metastases; carcinomatosis of gastric, pancreatic, bladder, ovarian, colonic origin; and infectious diseases such as actinomycosis, coccidioidomycosis, histoplasmosis or non-tuberculous mycobacteria. Diagnosis is initially supported by blood chemistry, liver and renal function tests, ultrasound, CT scans, paracentesis with peritoneal fluid cytochemistry, and ADA and PCR measurement. The gold standard is laparoscopy with peritoneal biopsy and pathological or microbiological confirmation. Cases of false negatives of the ADA test have been described in immunosuppression or use of antituberculosis drugs. Monitoring of disease activity by measuring CA-125 levels has been considered. The following is the report of an unusual case of peritoneal TB with secondary Sweet’s syndrome, in which the ADA report was initially negative, possibly due to meropenem administration, and in whom disease activity was monitored through Ca125. False negative reports of ADA and Sweet’s secondary to TB are very rare, so this case contributes to the literature on these conditions.
Keywords: Tuberculosis; Peritoneal; Sweet’s syndrome; ADA; CA-125
Introducción
La tuberculosis (TBC) es una enfermedad con alta morbilidad y mortalidad mundial, cuya principal manifestación es la forma pulmonar; sin embargo, las formas extrapulmonares ocurren en un 10 %-42 % de los casos, de los que el 25 %-50 % corresponden a localización abdominal1-3.
La TBC peritoneal se desarrolla a partir de una TBC pulmonar latente por diseminación hematógena, ingestión directa del bacilo, el consumo de leche pasteurizada, etc.2,4. Los principales grupos de riesgo son individuos con infección por el virus de la inmunodeficiencia humana (VIH), estados de inmunosupresión, contactos estrechos con personas infectadas, extremos de la vida, prisioneros, usuarios de drogas ilícitas, personal de salud, pacientes con diabetes, insuficiencia renal crónica (IRC), hepatopatía alcohólica y bajo nivel socioeconómico2,5. Los principales síntomas son dolor abdominal, fiebre, ascitis, pérdida de peso, sensibilidad abdominal y masa abdominal; el síndrome de Sweet se ha descrito como una manifestación poco usual6, el cual es una dermatosis reactiva neutrofílica febril aguda y rara caracterizada por la aparición súbita de placas, pápulas, pústulas, vesículas o nódulos dolorosos eritematosos brillantes ubicados en la cara, el cuello y los miembros superiores que puede acompañarse de fiebre o febrícula, artralgia migratoria, leucocitosis, neutrofilia y velocidad de sedimentación globular (VSG) elevada; generalmente mejora con el tratamiento con corticoides sistémicos7,8.
En cuanto al enfoque clínico, la tomografía computarizada (TC) de abdomen ofrece un hallazgo importante denominado omental cake, que obliga a hacer un diagnóstico diferencial con la carcinomatosis peritoneal9. El estudio de líquido ascítico por paracentesis en pacientes con TBC peritoneal muestra característicamente un recuento de leucocitos >500/uL, deshidrogenasa láctica (LDH) >90 u/L, un gradiente de albúmina ascítica/albúmina sérica (GASA) <1,1 g/dL y niveles de adenosina-desaminasa (ADA) >39 UI/L2,10-12. El estándar de oro para el diagnóstico de TBC peritoneal es la laparoscopia con biopsia peritoneal y con posterior confirmación patológica o microbiológica2,13. El tratamiento farmacológico consiste en el mismo esquema usado para la TBC pulmonar14. Se ha reportado un aumento en los niveles del marcador tumoral CA-125 >35 U/mL en casos de TBC peritoneal activa, cuyo descenso se ha relacionado con una buena respuesta al tratamiento anti-TBC, mostrándose como un marcador de seguimiento en la actividad de la enfermedad15,16.
A continuación, presentamos el caso clínico de un paciente con TBC peritoneal asociada con un síndrome de Sweet secundario, en quien se tomaron estudios de líquido ascítico sugestivos de malignidad, con un falso negativo del ADA, posiblemente dado por la administración de un carbapenémico, y en quien se hizo el seguimiento del tratamiento con antígeno del cáncer 125 (CA-125). Son muy excepcionales los reportes de falsos negativos de ADA y síndrome Sweet secundario a TBC, por lo cual aportamos a la literatura con el reporte de nuestro caso.
Reporte de caso
Un hombre de 46 años de edad, con antecedentes médicos de insuficiencia renal crónica (IRC) estadio V de etiología hipertensiva, quien se encuentra en manejo con terapia de reemplazo renal tipo hemodiálisis interdiaria desde hace 2 años, hipertensión arterial desde los 16 años de edad, en manejo farmacológico con enalapril y espironolactona, es expresidiario desde hace 9 años con egreso hace 3 meses. Ingresa remitido desde un nivel de menor complejidad por un cuadro clínico de aproximadamente 15 días de evolución consistente en distensión y dolor abdominal difuso, fiebre, astenia, adinamia e hiporexia; adicionalmente, refiere una pérdida involuntaria de peso de aproximadamente 7 kg en los últimos 2 meses. A su ingreso se encuentra con signos vitales dentro de los rangos normales, con hallazgos de disminución de ruidos respiratorios en la base pulmonar izquierda y distensión abdominal con onda ascítica positiva sin presencia de signos de irritación peritoneal. Se tomaron paraclínicos, los cuales evidenciaron trombocitosis en el hemograma, anemia de volúmenes normales en el rango transfusional, ferritina elevada, azoados elevados, hiperpotasemia, hiponatremia e hipoalbuminemia, VIH negativo, antígeno de superficie para hepatitis B negativo, anticuerpo para hepatitis C negativo, procalcitonina positiva y hormona estimulante de la tiroides (TSH) normal. Se inició soporte transfusional con dos unidades de glóbulos sin complicaciones.
El ecocardiograma transtorácico mostró una hipertrofia del ventrículo izquierdo, fracción de eyección ventricular izquierda (FEVI) 62 % y un derrame pericárdico leve. La ecografía abdominal no mostró evidencia de anormalidades estructurales hepáticas ni biliares, con una cantidad moderada de líquido ascítico. La endoscopia de las vías digestivas altas no mostró várices esofágicas, con lo cual se descarta una patología cardíaca o hepática crónica como causa de la ascitis. Por último, la radiografía de tórax mostró hallazgos de consolidación a nivel de la língula y derrame pleural izquierdo (Figura 1).
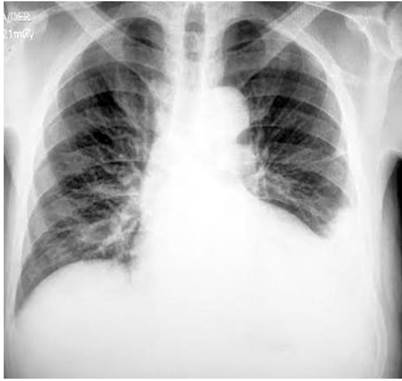
Figura 1 Radiografía de tórax en proyección anteroposterior con hallazgos de cardiomegalia, ateromatosis aórtica y obliteración del ángulo costofrénico izquierdo.
Por los hallazgos radiológicos mencionados se amplía el estudio con TC de tórax, donde se documentó un derrame pleural izquierdo moderado con atelectasia pasiva del parénquima pulmonar adyacente y consolidación en língula (Figura 2). En el contexto de síndrome febril con hallazgos en el parénquima pulmonar, se consideró una neumonía adquirida en la comunidad y se inició tratamiento con meropenem en su día hospitalario 2, dado que el paciente refiere antibioticoterapia previa desconocida extrainstitucional. Luego se realiza un estudio de líquido pleural, el cual documenta un derrame tipo exudado, con ADA negativo, hidróxido de potasio (KOH) negativo, cultivos negativos y PCR negativa para Mycobacterium tuberculosis. El bloque celular reportó abundantes linfocitos, células mesoteliales reactivas y presencia de células con núcleo grande y citoplasma abundante, con Ziehl-Nielsen (ZN) negativos (Tabla 1).
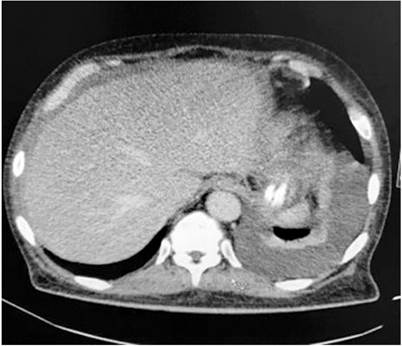
Figura 2 Tomografía de tórax simple en la ventana del mediastino con hallazgos de derrame pleural izquierdo con atelectasia pasiva pulmonar adyacente y consolidación de la língula.
Tabla 1 Estudio de líquido pleural
| Estudio de líquido pleural | |
|---|---|
| Color | Amarillo |
| Aspecto | Ligeramente turbio |
| Celularidad | No |
| pH | 8 |
| Glucosa | 101 mg/dL |
| LDH | 154 UI/mL |
| Proteínas totales | 3,8 g/dL |
| ADA | 19,67 U/L |
| KOH | Negativo |
| Cultivo | Negativo |
Por otra parte, para el estudio del síndrome ascítico se realiza una TC de abdomen donde se observaron lesiones de tipo omental cake. Se solicitan marcadores tumorales con reporte de CA-125 de 210 U/mL (positivo). Se realiza una paracentesis diagnóstica, cuyo líquido peritoneal mostró un patrón no hipertensivo GASA 0,7, con ADA 19,92 (negativo), cultivo y PCR para Mycobacterium tuberculosis negativos (Tabla 2). El bloque celular de líquido peritoneal reportó linfocitos con células mesoteliales reactivas y presencia de células con núcleo grande y citoplasma abundante. Todo lo anterior sugiere un proceso maligno subyacente como primera posibilidad.
Tabla 2 Estudio de líquido peritoneal
Durante su estadía hospitalaria el paciente se encontraba sin acompañante; sin embargo, al día 6 de hospitalización se presenta la exesposa, quien suministra la historia clínica de la institución desde donde lo remitieron. En esta se encuentra información que había sido obviada por el paciente y aporta información acerca de lesiones cutáneas pustulosas generalizadas, las cuales el paciente drenaba con objetos puntiagudos, asociadas con episodios febriles. De esta manera, se evidencian lesiones eritematosas cutáneas dadas por pápulas, nódulos y placas en las extremidades superiores e inferiores y en el tronco de distribución simétrica, además con nódulos eritematosos violáceos dolorosos a la palpación y con un aumento local de la temperatura; todo lo anterior es característico del síndrome de Sweet.
Ante los hallazgos de líquido ascítico, omental cake documentado en la TC de abdomen, CA-125 positivo y síndrome de Sweet como posible manifestación paraneoplásica, con alta sospecha de malignidad, se decide iniciar la administración de un esteroide y se suspende el tratamiento con meropenem, con lo cual se obtiene una mejoría clínica de las lesiones cutáneas.
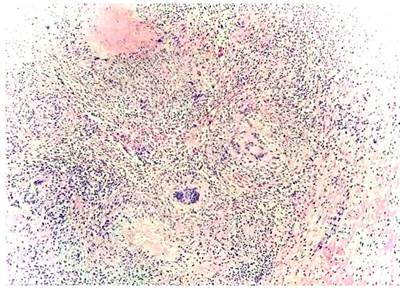
Se revisó la historia clínica de la hospitalización anterior del paciente, donde habían realizado paracentesis diagnóstica, con un reporte de ADA de líquido peritoneal de 36 U/L (positivo). Ante la no claridad del cuadro clínico actual, se decide realizar una biopsia de epiplón, peritoneo y ligamento redondo por medio de laparoscopia, cuyo reporte confirma la presencia del proceso inflamatorio crónico, granulomatoso necrotizante de etiología infecciosa, negativo para malignidad (Figura 3). De esta manera, se concluye que el diagnóstico es TBC peritoneal, por lo que se suspendió el manejo con esteroide y se inició el manejo antituberculoso; esto dio como resultado la mejoría clínica del paciente. Se hizo seguimiento con niveles de CA-125, comprobando la negativización de dichos niveles a los 10 días de iniciado el tratamiento antituberculoso (CA-125 inicial 210, control de 115). Por esta razón, se consideró el síndrome de Sweet como manifestación de la TBC peritoneal, con falso negativo del ADA posiblemente debido a la administración previa del carbapenémico, con negativización de CA-125 como marcador de buena respuesta al tratamiento anti-TBC.
Discusión
La TBC es una enfermedad con una alta carga de morbilidad y mortalidad. Se estima que, en 2017, 10 millones de personas se enfermaron por TBC y 1,6 millones murieron por esta enfermedad. La principal manifestación es la forma pulmonar; sin embargo, las formas extrapulmonares ocurren en un 10 %-42 %. En su forma extrapulmonar, el 25 %-50 % de los casos son de presentación abdominal, con datos de mortalidad que alcanza un 35 % cuando no hay un tratamiento adecuado y hasta un 73 % en pacientes con cirrosis2,3. Los principales grupos de riesgo para la adquisición de la enfermedad son individuos con VIH, estados de inmunosupresión, contactos estrechos con personas infectadas, niños menores de 5 años, edad avanzada, prisioneros, usuarios de drogas ilícitas, personal de salud, pacientes con diabetes, IRC, enfermedad hepática alcohólica y bajo estrato socioeconómico2,5. Los principales síntomas presentados son dolor abdominal (75 %), fiebre (69 %), ascitis (62 %), distensión abdominal (60 %), pérdida de peso (53 %), sensibilidad abdominal (49 %) y masa abdominal (34 %). Debido a los síntomas de carácter inespecífico, su diagnóstico se torna tortuoso, siendo tardío con datos desde semanas a meses2,3.
El síndrome de Sweet se ha descrito como una manifestación poco común de la TBC peritoneal6; es una dermatosis reactiva neutrofílica febril aguda y rara que se caracteriza por la aparición súbita de placas o nódulos dolorosos eritematosos brillantes, que presentarse en forma de pápulas, pústulas o vesículas ubicadas en cara, cuello y miembros superiores. Su forma paraneoplásica es más grave y puede afectar el tronco y los miembros inferiores. Puede presentarse con otros síntomas como fiebre o febrícula, artralgia migratoria de grandes articulaciones, leucocitosis, neutrofilia y VSG elevada, que mejora con corticoides sistémicos. La mayoría de las causas son benignas y entre ellas se encuentran las enfermedades autoinmunitarias, medicamentos e infecciones, dentro de las que se describen aquellas causadas por micobacterias7,8.
Generalmente la TBC peritoneal se desarrolla a partir de una TBC latente, cuyo mecanismo involucra la activación de un foco tuberculoso localizado en el peritoneo, el cual se origina durante la infección primaria a través de la diseminación hematógena desde el foco pulmonar primario hacia los nódulos linfoides mesentéricos. Otros mecanismos son la ingestión del bacilo, con el paso de éste a los nódulos linfoides mesentéricos a través de placas de Peyer en la mucosa intestinal. Se ha observado la adquisición de la infección a través del consumo de leche pasteurizada más comúnmente por Mycobacterium bovis2,4.
El diagnóstico de TBC peritoneal suele ser difícil. Se observan hallazgos paraclínicos a nivel hematológico como anemia normocítica, normocrómica, trombocitosis y conteo normal de leucocitos. El método imagenológico de primera línea es la ecografía abdominal que evidencia la presencia de líquido ascítico y descarta la etiología portal como causa de ascitis, lo que ofrece adicionalmente una guía para el drenaje de líquido peritoneal2,17. Otra ayuda imagenológica es la TC, que en el caso de TBC peritoneal ofrece algunos hallazgos como ascitis, linfadenopatías, engrosamientos intestinales, nódulos peritoneales, adherencias, tabiques fibrinosos y un hallazgo llamado omental cake, que obliga a hacer un diagnóstico diferencial con carcinomatosis peritoneal9.
En nuestro caso se documentó el hallazgo de omental cake, condición que debido a enfermedades infecciosas es raro. Generalmente estas enfermedades resultan de diseminación hematógena, linfática o directa de microorganismos infecciosos hacia el peritoneo. Usualmente la TBC peritoneal exhibe estas manifestaciones, y la apariencia es similar a la de una carcinomatosis peritoneal. Los hallazgos que pueden ayudar a distinguirlo de una carcinomatosis peritoneal incluyen macronódulos mesentéricos, irregularidad en el infiltrado del epiplón, pared fibrosa recubriendo el epiplón infiltrado, esplenomegalia o calcificación esplénica9.
En el estudio del líquido ascítico en sospecha de TBC peritoneal, las tinciones para bacilos resistentes al alcohol ácido (BAAR) y ZN tienen muy baja sensibilidad17, los cultivos tienen una sensibilidad de 21 %-35 %18. Generalmente el recuento de leucocitos en líquido ascítico es mayor a 500 uL2. La LDH es una de las pruebas que más reúne sensibilidad ya que alcanza un 77 %; sin embargo, esta tiene una sensibilidad similar para otras enfermedades como ascitis pancreática y carcinomatosis peritoneal, lo que no permite discriminar entre estas patologías. Algunos autores proponen un punto de corte mayor a 90 U/L2,10. El índice de GASA <1,1 g/dL orienta a etiología no portal como malignidad, pancreatitis o infecciones como tuberculosis peritoneal. No obstante, en casos donde el diagnóstico de TBC peritoneal se acompaña de enfermedad hepática crónica, la sensibilidad disminuye a 28 %-88 %11,17. El incremento en los niveles de marcadores tumorales como el CA-125 también ha sido reportado en la TBC peritoneal; se han propuesto puntos de corte de 35 U/mL con una sensibilidad de 83,33 % y una especificidad del 50 % para la TBC peritoneal activa, y estudios han relacionado el descenso de dichos niveles con una buena respuesta al tratamiento anti-TBC4,6,9,15-18.
Dentro de los otros hallazgos inusuales de nuestro caso están las anormalidades del líquido peritoneal, con un falso negativo del ADA. ADA es una enzima del metabolismo de las purinas y un potente modulador de la diferenciación de células T, que muestra alta sensibilidad (100 %) y especificidad (97 %) para el diagnóstico de TBC usando puntos de corte de 36-40 UI/L, con corte óptimo >39 UI/L2,12. Las técnicas de amplificación genómica como la PCR ha demostrado sensibilidad y especificidad tan altas como 93,7 % y 91,7 %, respectivamente, en los casos de TBC pulmonar; tiene ventajas como una mayor rapidez que las técnicas de cultivo para Mycobacterium. Algunos estudios han estimado una sensibilidad para TBC extrapulmonar hasta 94,5 %19,20. El estudio de citología de líquido ascítico muestra una sensibilidad hasta de 97 % cuando se realizan paracentesis con 3 muestras separadas para diagnósticos de malignidad con alta especificidad; sin embargo, se observa una baja sensibilidad en tinciones para TBC21. El estándar de oro para el diagnóstico de TBC peritoneal es la laparoscopia con biopsia peritoneal y posterior confirmación patológica o microbiológica2,13.
El tratamiento farmacológico para TBC peritoneal consiste en el mismo esquema usado para la TBC pulmonar. Generalmente se observa una respuesta dentro de los 3 primeros meses con resolución de síntomas y normalización de los paraclínicos22. La intervención quirúrgica se reserva para casos que muestran signos de perforación intestinal, obstrucción intestinal, fístulas, abscesos y hemorragia4,9,12,13,16,18-23. Como se observó, nuestro paciente recibió previamente un carbapenémico, con una alteración en los reportes de ADA; como se conoce, estos fármacos se usan para el tratamiento de Mycobacterium tuberculosis farmacorresistente14, y esta fue la causa de la alteración del reporte de ADA en el líquido ascítico.
Conclusiones
Presentamos un caso clínico de una TBC peritoneal asociada con un síndrome de Sweet secundario, en quien se tomaron estudios de líquido ascítico sugestivos de malignidad con un falso negativo del ADA, posiblemente dado por la administración de un carbapenémico, y en quien se hizo el seguimiento del tratamiento con CA-125. Son muy excepcionales los reportes de falsos negativos de ADA y Sweet secundario a TBC, por lo cual aportamos a la literatura con el reporte de nuestro caso.
REFERENCIAS
1. Organización Mundial de la Salud. [Internet]. Informe mundial sobre la tuberculosis (Sinopsis); 2019. p. 1-8. Disponible en: https://www.who.int/tb/publications/global_report/gtbr2019_ExecutiveSummary_es.pdf [ Links ]
2. Wu DC, Averbukh LD, Wu GY. Diagnostic and Therapeutic Strategies for Peritoneal Tuberculosis: A Review. J Clin Transl Hepatol. 2019;7(2):140-148. https://doi.org/10.14218/JCTH.2018.00062. [ Links ]
3. Zumla A, Raviglione M, Hafner R, von Reyn CF. Tuberculosis. N Engl J Med. 2013;368(8):745-55. https://doi.org/10.1056/NEJMra1200894 [ Links ]
4. Tang LC, Cho HK, Wong Taam VC. Atypical presentation of female genital tract tuberculosis. Eur J Obstet Gynecol Reprod Biol. 1984;17(5):355-63. https://doi.org/10.1016/0028-2243(84)90115-1 [ Links ]
5. Getahun H, Matteelli A, Chaisson RE, Raviglione M. Latent Mycobacterium tuberculosis infection. N Engl J Med. 2015;372(22):2127-35. https://doi.org/10.1056/NEJMra1405427 [ Links ]
6. Karmakar PS, Sherpa PL, Ray AN, Saha BK, Santra T, Saha S, Chakrabarti I. Sweet’s syndrome: a very rare association with pulmonary tuberculosis. J Infect Dev Ctries. 2013;7(5):417-20. https://doi.org/10.3855/jidc.2606 [ Links ]
7. Rodríguez L, Yurgaky J, Otero W, Faizal M. Síndromes paraneoplásicos en tumores gastrointestinales. Revisión de tema. Rev Colomb Gast. 2017;32(3):230-44. https://doi.org/10.22516/25007440.155 [ Links ]
8. Baquero J, Garlatti L, Torre A. Síndrome de Sweet asociado a síndrome mielodisplasico. Rev. Hosp Ital B. Aires. 2015;35(2):62-65. [ Links ]
9. Mamlouk M, vanSonnenberg E, Shankar S, Silverman S. Omental Cakes: unusual aetiologies and CT appearances. Insights Imaging. 2011;2(4):399-408. https://doi.org/10.1007/s13244-011-0105-4 [ Links ]
10. Balteiro A, Carrión E. Diagnóstico de la Ascitis. Gastroenterología y Hepatología continuada. 2008;7(1):6-10. https://doi.org/10.1016/S1578-1550(08)72976-0 [ Links ]
11. Boyer TD. Diagnosis and management of cirrhotic ascites. En: Zakim, Boyer DT. (editores). Hepatology: A Textbook of Liver Disease. 4.a edición. Filadelfia: Saunders; 2003. p. 1227-1232. [ Links ]
12. Riquelme A, Calvo M, Salech F, Valderrama S, Pattillo A, Arellano M, Arrese M, Soza A, Viviani P, Letelier LM. Value of adenosine deaminase (ADA) in ascitic fluid for the diagnosis of tuberculous peritonitis: a meta-analysis. J Clin Gastroenterol. 2006;40(8):705-10. https://doi.org/10.1097/00004836-200609000-00009 [ Links ]
13. Yoon YJ, Ahn SH, Park JY, Chon CY, Kim DY, Park YN, Han KH. What is the role of diagnostic laparoscopy in a gastroenterology unit? J Gastroenterol. 2007;42(11):881-6. https://doi.org/10.1007/s00535-007-2106-0 [ Links ]
14. van Rijn SP, Zuur MA, Anthony R, Wilffert B, van Altena R, Akkerman OW, de Lange WCM, van der Werf TS, Kosterink JGW, Alffenaar JC. Evaluation of Carbapenems for Treatment of Multi- and Extensively Drug-Resistant Mycobacterium tuberculosis. Antimicrob Agents Chemother. 2019;63(2):e01489-18. https://doi.org/10.1128/AAC.01489-18 [ Links ]
15. Yilmaz A, Ece F, Bayramgürler B, Akkaya E, Baran R. The value of CA-125 in the evaluation of the tuberculosis activity. Respir Med. 2001;95(8):666-69. https://doi.org/10.1053/rmed.2001.1121 [ Links ]
16. Gómez AA. Tuberculosis peritoneal con niveles elevados de CA-125. Rev Fac Med U Jav Colomb. 2013;61(3):311-14. [ Links ]
17. Oey RC, van Buuren HR, de Man RA. The diagnostic work-up in patients with ascites: current guidelines and future prospects. Neth J Med. 2016;74(8):330-35. [ Links ]
18. Fei GJ, Zhang LF, Shu HJ. Values of different laboratory diagnostic approaches for tuberculous peritonitis. Zhongguo Yi Xue Ke Xue Yuan Xue Bao. 2018;40(4):534-38. [ Links ]
19. Pimkina E, Zablockis R, Nikolayevskyy V, Danila E, Davidaviciene E. The Xpert MTB/RIF assay in routine diagnosis of pulmonary tuberculosis: A multicentre study in Lithuania. Respir Med. 2015;109(11):1484-89. https://doi.org/10.1016/j.rmed.2015.07.006 [ Links ]
20. Raj A, Singh N, Gupta KB, Chaudhary D, Yadav A, Chaudhary A, Agarwal K, Varma-Basil M, Prasad R, Khuller GK, Mehta PK. Comparative Evaluation of Several Gene Targets for Designing a Multiplex-PCR for an Early Diagnosis of Extrapulmonary Tuberculosis. Yonsei Med J. 2016;57(1):88-96. https://doi.org/10.3349/ymj.2016.57.1.88 [ Links ]
21. Runyon BA, Hoefs JC, Morgan TR. Ascitic fluid analysis in malignancyrelated ascites. Hepatology. 1988;8(5):1104-9. https://doi.org/10.1002/hep.1840080521 [ Links ]
22. Sanai FM, Bzeizi KI. Systematic review: tuberculous peritonitis-presenting features, diagnostic strategies and treatment. Aliment Pharmacol Ther. 2005;22(8):685-700. https://doi.org/10.1111/j.1365-2036.2005.02645.x [ Links ]
23. Ramappa V, Aithal GP. Hepatotoxicity related to anti-tuberculosis drugs: Mechanisms and management. J Clin Exp Hepato. 2013;3(1):37-49. https://doi.org/10.1016/j.jceh.2012.12.001 [ Links ]
Citación:
Martínez-Montalvo CM, Caviedes-Cleves M, Gómez Y, Herrera-Ortega LM, Guerrero-Becerra ME, Pérez-Martínez NV, Esguerra-Sánchez DC. Síndrome de Sweet por tuberculosis peritoneal: reporte de caso. Rev Colomb Gastroenterol. 2021;36(3):384-390. https://doi.org/10.22516/25007440.528
Recibido: 26 de Marzo de 2020; Aprobado: 11 de Mayo de 2020











 texto en
texto en