Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista colombiana de Gastroenterología
versión impresa ISSN 0120-9957versión On-line ISSN 2500-7440
Rev. colomb. Gastroenterol. vol.37 no.1 Bogotá ene./mar. 2022 Epub 02-Jun-2022
https://doi.org/10.22516/25007440.644
Trabajos originales
Utilidad del índice de fibrosis hepática (IFH) medido durante la ultrasonografía endoscópica en la evaluación del parénquima pancreático
1MD, Internist, Gastroenterologist, Lecturer of Gastroenterology, Universidad Nacional de Colombia. Gastroenterology Service. Hospital Universitario Nacional de Colombia. Bogotá, Colombia.
2MD, Internist, Gastroenterologist. Gastroenterology Service, Hospital Universitario Nacional de Colombia, Colombia.
3Internist, Gastroenterology fellow, Universidad Nacional de Colombia, Hospital Universitario Nacional de Colombia. Bogotá, Colombia.
El ultrasonido endoscópico ha cambiado la evaluación de las enfermedades pancreáticas y ha logrado un diagnóstico histopatológico (cuando se asocia con la punción); sin embargo, este procedimiento requiere de entrenamiento, no está libre de complicaciones y alrededor de 25% de los pacientes puede tener falsos negativos. Por esto se ha implementado el uso de la elastografía cuantitativa con el strain ratio, el cual permite diferenciar las masas benignas de las malignas. Existe evidencia creciente, pero aún no conclusiva, dada la heterogeneidad de los resultados (sin consenso para su realización), por lo que es necesario desarrollar otros métodos, que permitan una mayor certeza diagnóstica, como el índice de fibrosis hepática (IFH) medido por ultrasonografía endoscópica, el cual tienen como base la inteligencia artificial, validado para el diagnóstico y el seguimiento de la fibrosis hepática. Nuestro grupo considera que se podría usar de la misma forma para valorar el parénquima pancreático.
Objetivo:
evaluar si el IFH puede diferenciar tres tipos diferentes de tejidos pancreáticos: páncreas normal, páncreas graso y cáncer de páncreas.
Metodología:
estudio prospectivo de corte transversal en un solo centro. Se incluyeron 66 pacientes mayores de 18 años, con indicación de ultrasonografía endoscópica. El grupo 1 fue de pacientes con indicación diferente a la enfermedad biliopancreática (55 pacientes). En este grupo se aplicó la escala de clasificación de páncreas graso por ultrasonografía endoscópica (USE), utilizando como referencia la ecogenicidad del bazo (previamente validada); este grupo se subdividió en uno con parénquima pancreático normal y en otro con páncreas graso. En el grupo 2 (11 pacientes) se incluyeron los pacientes llevados para el estudio de lesión sólida pancreática, con diagnóstico citológico positivo para carcinoma de páncreas. Como herramienta de recolección de datos se utilizó un formulario virtual de Google Drive, disponible con dirección acortada: shorturl.at/pIMWX, diligenciado antes y después del procedimiento por fellows de Gastroenterología, previamente entrenados para este fin. El IFH se tomó en el páncreas en tiempo real mediante un software suministrado por el fabricante (Hitachi-Noblus), en un período comprendido entre enero de 2019 y enero 2020. A todos los pacientes se les realizó una ecoendoscopia biliopancreática completa, con un ecoendoscopio Pentax lineal y procesador Hitachi-Noblus; luego se efectuó una elastografía cualitativa y una cuantitativa, la cual incluyó la medición del IFH.
Resultados:
en total se incluyeron 66 pacientes: 11 pacientes con diagnóstico confirmado por citología de cáncer de páncreas y 55 pacientes que se enviaron para ecoendoscopia por evaluación de otras patologías diferentes a la biliopancreática. El rango de edad fue de 23-89, media de 56,75 años. El antecedente más frecuente fue la esteatosis o esteatohepatitis (n = 14) (25,45 %). La indicación para la realización del procedimiento más frecuente fue la lesión subepitelial (n = 29) (52,73 %). Los porcentajes de pacientes según los grados de ecogenicidad del páncreas fueron de grado I (n = 29) (52,73 %); grado II (n = 5) (9,09 %); grado III (n = 18) (32,73 %); grado IV (n = 3) (5,45 %). Se tomaron los grados I y II como páncreas normal, y los grado III y IV como páncreas graso. Estos se dividieron en n = 34 pacientes (61,82 %) para páncreas normal y n = 21 (38 %) para páncreas graso; es decir, que de acuerdo con la escala utilizada hay una prevalencia para páncreas graso de 38,18 %. Se realizó el IFH en los tres subgrupos diferentes: los considerados como ecoendoscópicamente normales, los clasificados como páncreas graso y los pacientes con diagnóstico de cáncer de páncreas confirmado por citología, tomado en el páncreas. El IFH para los tres diferentes grupos fueron, respectivamente, normal: IFH 2,60, rango 0,97-3,47 (IC 95 % 2,17-3,02); páncreas graso: IFH 3,87, rango 2-5,5 (IC 95 % 3,44-4,29); cáncer de páncreas: IFH 6,35, rango 5,8-7,8 (IC 95 % 5,92-6,77).
Conclusiones:
este es el primer estudio piloto que usa el IFH aplicado al parénquima pancreático, y se sugiere su utilidad para diferenciar, de manera no invasiva, el páncreas normal, el graso y el carcinoma de páncreas. Este hallazgo se debe confirmar en poblaciones más amplias y heterogéneas, con el fin de ser validado.
Palabras clave: Ultrasonografía endoscópica; elastografía; índice de fibrosis hepática; páncreas graso; esteatosis pancreática; cáncer de páncreas
Endoscopic ultrasound has changed the evaluation of pancreatic diseases and has achieved a histopathological diagnosis (when associated with a puncture); however, this procedure requires training, is not free of complications, and around 25 % of patients may have false negatives. Therefore, quantitative elastography with the strain ratio has been implemented to differentiate benign masses from malignant ones. There is growing but not yet conclusive evidence, given the heterogeneity of the results (without consensus on its performance). It is necessary to develop other methods that allow for greater diagnostic certainty, such as the liver fibrosis index (LFI) measured by endoscopic ultrasonography. This method is based on artificial intelligence and validated for diagnosing and monitoring liver fibrosis. Our group considers that it could also be used to assess the pancreatic parenchyma.
Aim:
To evaluate whether the LFI can differentiate three types of pancreatic tissues: normal pancreas, fatty pancreas, and pancreatic cancer.
Materials and methods:
Prospective cross-sectional single-center study. We included sixty-six patients over 18 years of age with an indication for endoscopic ultrasonography. Group 1 consisted of patients with an indication other than the biliopancreatic disease (55 patients). The endoscopic ultrasonography (EUS) fatty pancreas classification scale was applied to this group, taking the echogenicity of the spleen (previously validated) as a reference; this group was subdivided into normal pancreatic parenchyma and fatty pancreas. Group 2 (11 patients) included those examined for solid pancreatic lesions with a positive cytological diagnosis of pancreatic carcinoma. We used a Google Form as a data collection tool, available with a shortened address (shorturl.at/pIMWX). It was filled out before and after the procedure by Gastroenterology fellows, previously trained for this purpose. The LFI was measured in the pancreas in real-time using software supplied by the manufacturer (Hitachi Noblus) between January 2019 and January 2020. All patients underwent a complete biliopancreatic echoendoscopy, with a linear Pentax echoendoscope and Hitachi Noblus processor. Then, qualitative and quantitative elastography was performed, including LFI measurement.
Results:
We included a total of 66 patients: 11 with a diagnosis of pancreatic cancer confirmed by cytology and 55 sent for ultrasound endoscopy due to pathologies other than the biliopancreatic disease. The age range was 23-89, with a mean of 56.75 years. The most frequent history was steatosis or steatohepatitis (n = 14) (25.45 %). The most frequent indication for performing the procedure was subepithelial lesion (n = 29) (52.73 %). The percentages of patients according to pancreatic echogenicity were Grade I (n = 29) (52.73 %); Grade II (n = 5) (9.09 %); Grade III (n = 18) (32.73 %); Grade IV (n = 3) (5.45 %). Grades I and II were taken as a normal pancreas and Grades III and IV as a fatty pancreas, divided into n = 34 patients (61.82 %) for a normal pancreas and n = 21 (38 %) for a fatty pancreas. According to the scale used, there is a fatty pancreas prevalence of 38.18 %. The LFI was measured in three subgroups: those considered endoscopically normal, those classified as fatty pancreas, and patients diagnosed with pancreatic cancer confirmed by cytology taken from the pancreas. The LFI for these groups were, respectively, normal pancreas: LFI 2.60, range 0.97-3.47 (95 % CI 2.17-3.02); fatty pancreas: LFI 3.87, range 2-5.5 (95 % CI 3.44-4.29); pancreatic cancer: LFI 6.35, range 5.8-7.8 (95 % CI 5.92-6.77).
Conclusions:
This is the first pilot study that applies the LFI to the pancreatic parenchyma. It is useful in differentiating a normal pancreas, a fatty pancreas, and pancreatic carcinoma non-invasively. This finding must be validated in larger and more heterogeneous populations.
Keywords: Endoscopic ultrasonography; elastography; liver fibrosis index; fatty pancreas; pancreatic steatosis; pancreatic cancer
Introducción
A pesar del crecimiento exponencial del conocimiento médico y del avance tecnológico y científico en diferentes métodos diagnósticos y tratamientos, las enfermedades pancreáticas siguen siendo poco entendidas, esto genera un reto diagnóstico. La sintomatología suele ser inespecífica o inexistente (hasta las etapas avanzadas). Esto se asocia con que la ubicación retroperitoneal del páncreas dificulta su exploración por técnicas de imágenes diagnósticas tradicionales. Al considerar que patologías como la pancreatitis crónica, el cáncer de páncreas y, más recientemente, el páncreas graso, vienen aumentando en incidencia y morbimortalidad1,2 se requieren nuevos métodos diagnósticos, que permitan diagnosticarlas de forma más certera y tempranamente, para poder brindar un tratamiento oportuno.
En 1980, DiMagno y colaboradores e Hisanaga y colaboradores desarrollaron la ultrasonografía endoscópica (USE)3,4. Desde entonces, esta se ha convertido en una herramienta diagnóstica y terapéutica en las enfermedades pancreáticas, lo que ha permitido una mejor evaluación de todo el parénquima, con sensibilidades reportadas entre 87 %-100 %5,6. Esta ha logrado un mejor desempeño, cuando se compara con la tomografía axial computarizada y la resonancia magnética6-8. Adicionalmente, la utilización de la USE más biopsia por aguja fina (USE-BAF) se ha convertido en el método de elección para el diagnóstico de lesiones sólidas en páncreas, incluida el cáncer de páncreas, especialmente en lesiones menores de 30 mm, donde alcanza una sensibilidad hasta del 93 %6,9,10. A pesar de esto, hasta 25 % de los pacientes puede tener falsos negativos, lo cual depende de distintos factores (tipo de aguja, la técnica, la experiencia, la disponibilidad de un patólogo en sala, entre otros), esto asociado con que no es un procedimiento libre de complicaciones (como pancreatitis y sangrado) y a su alto costo (agujas entre 500-800 dólares), lo que obliga a la exploración de nuevos métodos diagnósticos, que permitan un mayor rendimiento, más costo-efectivo y menos invasivo, por lo que se ha explorado la USE más la elastografía como método complementario.
La elastografía permite evaluar la elasticidad de un tejido. Esta se puede usar por ultrasonografía, resonancia magnética o tomografía de coherencia óptica11. Ha demostrado su utilidad en las mamas12, la próstata13 y la tiroides14,15, así como para guiar o evitar biopsias de los diferentes tejidos, especialmente del hígado. A pesar de que la biopsia se ha considerado el método de referencia para determinar el índice de fibrosis, su uso es limitado por lo invasivo del método (con una morbilidad y mortalidad significativa), los costos, el error al tomar la muestra y lo que dificulta monitorizar la progresión de la fibrosis16.
Actualmente, la elastografía transitoria (FibroScanTM) ha permitido establecer el grado de fibrosis de una forma no invasiva, lo que lo convierte en un método ampliamente utilizado16,17; siendo menos sensible en pacientes con ascitis, abundante panículo adiposo, espacios intercostales estrechos y atrofia hepática18,19. Con una importante variabilidad intra e interobservador en función del grado de la compresión de la sonda, junto con una menor precisión en el diagnóstico de la fibrosis moderada17,19,20. Esto ha impulsado a que el desarrollo de la elastografía en tiempo real (ETR) surja como una evolución de la elastografía transitoria, la cual puede ser más sensible en el diagnóstico del grado de fibrosis hepática, lo que permite determinar que el índice de fibrosis hepática (IFH) mayor de 2,56 se correlaciona con puntajes METAVIR de F421,22, reflejándolo de forma exacta, aún en presencia de inflamación23-27.
En el páncreas, el uso de la ETR-USE permite caracterizar mejor diferentes patologías, como la pancreatitis crónica, el páncreas graso y el cáncer de páncreas, al evaluar la rigidez del tejido pancreático con una escala de colores (elastografía cualitativa)28,29. En este campo, la esteatosis pancreática, una entidad descrita en 1926 en cadáveres y 40 años después documentada en relación con la edad y la obesidad30,31, se ha clasificado como congénita y adquirida. Esta última se encuentra asociada con la obesidad y el síndrome metabólico, denominándose esteatosis pancreática o enfermedad de páncreas graso no alcohólico32,33. Las consecuencias de esta aún se encuentran en estudio; sin embargo, se ha encontrado relación con el desarrollo de cáncer de páncreas, por lo que su relevancia es cada vez mayor34,35.
Nuestro grupo considera que se podría usar de la misma forma, pero para valorar el parénquima pancreático, por lo cual en este estudio piloto, nuestro objetivo es evaluar si el IFH medido a través de la ETR-USE es útil para diferenciar el tejido pancreático normal, graso o con cáncer en una cohorte de pacientes evaluados por USE.
Materiales y métodos
Diseño y población del estudio
Estudio prospectivo de corte transversal realizado en el Hospital Universitario, centro de referencia de Gastroenterología y Ecoendoscopia, en Bogotá, Colombia, entre enero de 2019 y enero de 2020. Se realizaron 682 ecoendoscopias durante este período en los pacientes a los que se les aplicó los siguientes criterios.
Criterios de inclusión
Edad igual o mayor de 18 años (para los dos grupos)
Pacientes enviados para ecoendoscopia diagnóstica, sin antecedentes de enfermedad biliopancreática (lesiones subepiteliales o de mucosas, entre otras) (grupo 1)
Pacientes enviados para la toma de biopsia de lesiones sólidas del páncreas, sospechosas para cáncer, cuya citología fuera confirmatoria de adenocarcinoma del páncreas (grupo 2)
Firma de consentimiento informado.
Criterios de exclusión
Pacientes con antecedente de pancreatitis aguda o crónica
Pacientes a los cuales se les tomó biopsia por ultrasonido endoscópico, pero la patología no confirmo el tumor
Pacientes con patología biliopancreática diferente al cáncer
Pacientes con hipertensión portal de cualquier etiología
Pacientes con ausencia de bazo
Pacientes con alteración anatómica biliopancreática
Pacientes con funcionalidad disminuida mayor de 4 en la escala del Grupo Cooperativo Oncológico del Este (ECOG)36
Pacientes con riesgo de hemorragia, con índice internacional normalizado(INR) > 1,5 o con recuento de plaquetas < 50 000/mm2
Mujer embarazada
Pacientes menores de 18 años
Pacientes que no autorizaban la inclusión de sus datos al estudio
Luego de la aplicación de los criterios se incluyeron 66 pacientes para el análisis (Figura 1).
Intervención
Los pacientes que asistieron para la realización de una ultrasonografía endoscópica indicada por su médico tratante, tanto hospitalizado como ambulatorio, y que no cumplían con alguno de los criterios de exclusión, se interrogaron antes del procedimiento, siguiendo una herramienta de recolección de datos tipo formulario virtual, en donde se consignan los datos demográficos, indicación del estudio y antecedentes positivos. Los datos obtenidos durante el estudio se consignaron simultáneamente por un médico especialista en Medicina Interna, fellow de Gastroenterología, previamente entrenado para diligenciar el formulario virtual. Estos datos se descargaron, corrigieron e ingresaron en el software SPSS (versión 12.0; SPSS Inc).
En todos los pacientes, la ultrasonografía endoscópica se realizó siguiendo los indicadores de calidad de la American Society for Gastrointestinal Endoscopy y la American College of Gastroenterology37. Se llevaron a cabo en la sala de Gastroenterología de una unidad de referencia para la realización de procedimientos endoscópicos diagnósticos, bajo sedación guiado por un anestesiólogo, con una combinación de propofol más remifentanilo, titulada según las características de cada paciente, previa valoración por parte del servicio de Anestesiología.
Todos los procedimientos se realizaron con un ecoendoscopio Pentax lineal (EG3870UTK; Pentax, Tokio, Japón), combinado con un sistema de ultrasonido portátil Doppler color, modelo Noblus (Hitachi Aloka Medical, Tokio, Japón), que incluye el módulo de elastografía y otro módulo de IFH suministrados por el fabricante. Todas las USE se realizaron por un endoscopista experimentado en procedimientos intervencionistas, con más de 2000 USE diagnósticas y terapéuticas realizadas.
Durante el examen se evaluó el parénquima pancreático, mientras que la ecogenicidad se clasificó por grados de I a IV. El sistema de clasificación se adaptó de Sepe y colaboradores35, donde adicional a la ecogenicidad se evaluó el patrón de sal y pimienta del parénquima pancreático y la claridad con que se delimitó el conducto pancreático. El grado I se definió como un páncreas en el cual más del 80% del parénquima era hipoecoico o isoecoico al compararlo con el bazo, el conducto pancreático principal estaba claramente delimitado y el patrón de sal y pimienta se observó claramente. El grado II se definió como un páncreas en el cual más del 80% era hiperecoico al compararlo con el bazo, el conducto pancreático principal estaba claramente delimitado y el patrón de sal y pimienta se observó claramente. El grado III se definió como un páncreas en el cual más del 80% era moderadamente hiperecoico al compararlo con el bazo, el conducto pancreático principal estaba moderadamente obscurecido y el patrón de sal y pimienta fue moderadamente borroso. El grado IV se definió como un páncreas en el cual más del 80% estaba severamente hiperecoico al compararlo con el bazo, los márgenes del conducto pancreático principal estaban severamente oscurecidos y el patrón de sal y pimienta fue severamente borroso. Los grados I y II se consideraron como normales, mientras que los grado III y IV se estimaron como páncreas graso (Tabla 1)35.
Tabla 1 Escala de clasificación de páncreas graso. Tomado de35
| Grado | |
|---|---|
| I | Páncreas en el cual más del 80% del parénquima es hipoecoico o isoecoico al compararlo con el bazo. El conducto pancreático principal está claramente delimitado y el patrón de sal y pimienta fue claramente visto |
| II | Páncreas en el cual más del 80% es hiperecoico al compararlo con el bazo. El conducto pancreático principal está claramente delimitado y el patrón de sal y pimienta fue claramente visto |
| III | Páncreas en el cual más del 80% es moderadamente hiperecoico al compararlo con el bazo. El conducto pancreático principal está moderadamente obscurecido y el patrón de sal y pimienta fue moderadamente borroso |
| IV | Páncreas en el cual más del 80% es severamente hiperecoico al compararlo con el bazo. Los márgenes del conducto pancreático principal están severamente oscurecidos y el patrón de sal y pimienta fue severamente borroso |
Para limitar el sesgo de selección, durante la ultrasonografía endoscópica se estimó tres veces, en todos los pacientes, el IFH tomado para el páncreas. El valor medio de las tres medidas se consideró el resultado final del análisis. Como ya se describió previamente, el IFH tiene en cuenta 11 parámetros que se utilizan para encontrar patrones de imágenes que evalúen la rigidez del parénquima hepático. Esto se logra con solo ubicar el cursor en el sitio donde queremos medir el IFH, al oprimir el botón “Enter” la computadora calcula inmediatamente este índice. Desde hace aproximadamente una década se usa en ecografía abdominal para la estatificación de la fibrosis hepática, usando imágenes de elastografía (RTE).
El IFH secuencial se logra de la siguiente manera:
Se convierte el área de análisis seleccionado de la imagen RTE en una imagen en escala de colores de 256 cuadros
Se traza el histograma de tensión
Se calcula la media de la tensión relativa (media), la desviación estándar de la tensión relativa (DE), la asimetría del histograma de deformación (SKEW) y la curtosis del histograma de deformación (KURT)
Se binariza la imagen RTE en regiones de blanco y negro: las blancas como de baja tensión (azul) y las negras como todas las demás regiones
Para caracterizar las regiones de baja tensión (azul) se calcula la proporción de regiones de baja tensión dentro del área de análisis seleccionada (% área), y la complejidad de la región de baja tensión (COMP)
Se calcula la entropía (ENT)
Se calcula el momento de diferencia inversa (IDM) y angular del segundo momento (ASM) para evaluar la textura de la imagen RTE
Se realiza un análisis de regresión múltiple para mejorar la precisión del diagnóstico, utilizando todas estas características de imagen, en lugar de diagnosticar con características de imagen individuales, como se muestra en la siguiente ecuación de regresión múltiple23:
IFH = -0,009 x MEAN - 0,005 x SD + 0,023 x % área + 0,025 x COMP + 0,775 x SKEW - 0,281 x KURT + 2,083 x ENT + 3,042 x IDM + 39,979 x ASM - 5,542
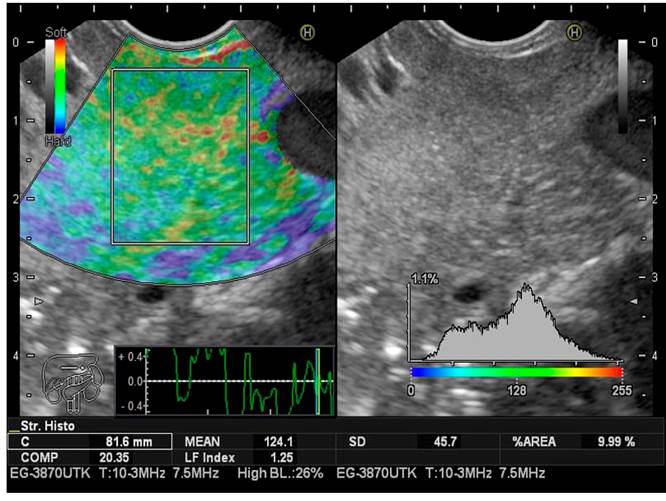
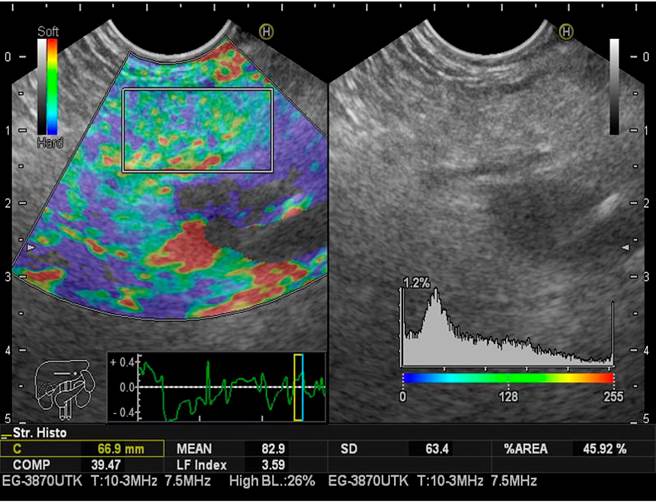
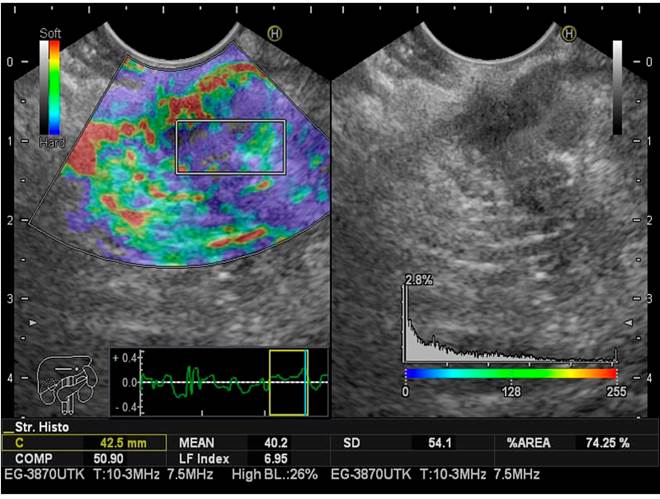
Este cálculo se realiza en milisegundos con el software, lo cual no aumenta significativamente el tiempo del procedimiento (Figuras 2,3y4).
Variables del estudio y definición de variables
En la Tabla 2 se muestran las variables del estudio y sus respectivas definiciones.
Tabla 2 Variables del estudio y definiciones
| Variable | Naturaleza | Escala | Categoría |
|---|---|---|---|
| Edad | Cuantitativa | Razón Discreta |
|
| Sexo | Cualitativa | Nominal Dicotómica |
|
| Antecedentes | Cualitativa | Nominal Policotómica |
|
| Indicación de la USE | Cualitativa | Nominal Policotómica |
|
| Clasificación de páncreas graso por ecoendoscopia | Cualitativa | Nominal Policotómica |
|
| Índice de fibrosis pancreático | Cuantitativa | Continua |
|
IMC: índice de masa muscular; USE: ultrasonografía endoscópica.
Análisis estadístico
La base de datos se registró en un formulario virtual (disponible en Google Drive con dirección acortada shorturl.at/pIMWX). Luego, esta información se descargó en tablas de datos de Excel, versión 2013. Se corrigieron datos, se tabularon y se analizaron en el paquete estadístico SPSS, versión 2.1. Las variables cuantitativas de distribución normal se presentan como media y las de distribución anormal como mediana.
El análisis univariado se realizó por medio de un estadístico descriptivo, para determinar las frecuencias absolutas y relativas en las variables cualitativas. En el caso de las variables cuantitativas se realizaron medidas de tendencia central, de dispersión o de posición (utilizando media y desviación estándar, cuando la variable numérica sigue la distribución normal o mediana).
Se calculó el intervalo de confianza para el grupo de datos basados en la media, la desviación estándar y el tamaño de la muestra para la unidad de datos, con un valor de P igual a 0,05. Para determinar la distribución normal de las variables numéricas se utilizó el estadístico de Kolmogorov-Smirnov (estadístico KS), entendiendo que un valor p igual a 0.05 sigue la curva de distribución normal. Se realizó el análisis de varianza (ANOVA de una vía), para determinar si existen diferencias estadísticamente significativas entre las medias de estos tres grupos (páncreas normal, páncreas graso, cáncer de páncreas), siendo mayor de 0,05. La prevalencia se expresará como porcentaje. Se buscó determinar si el IFH tiene una diferencia en los grupos de páncreas normal, páncreas graso y carcinoma de páncreas.
Resultados
En total se incluyeron 66 pacientes. En el grupo 1 se incluyeron 55 pacientes enviados para ecoendoscopia por evaluación de otras patologías diferentes a la biliopancreática, de los cuales 32 fueron mujeres, con un rango de edad de 23-89, media 56,75 años. En el grupo 2, 11 pacientes con diagnóstico confirmado por citología de cáncer de páncreas, 6 mujeres y 5 hombres, con un rango de edad de 54-89, media 69,56 años. Los antecedentes personales presentes en esta población fueron hipertensión arterial, diabetes mellitus, obesidad (definida como IMC mayor de 30), hipotiroidismo, dislipidemia, entre otros, siendo el más frecuente la esteatosis o esteatohepatitis (n = 14), media 25,45. La indicación para realizar el procedimiento más frecuente fue la lesión subepitelial (n = 29). Los porcentajes de pacientes según los grados de ecogenicidad del páncreas fueron de grado I (n = 29); grado II (n = 5); grado III (n = 18); grado IV (n = 3) (Tabla 3).
Tabla 3 Características demografías de la población estudio
| Grupo 1 | Grupo 2 | |||
|---|---|---|---|---|
| Páncreas normal | Páncreas graso | Total | Cáncer de páncreas | |
| Edad | n = promedio (rango en años) 57,26 (25-72) | n = promedio (rango en años) 55,90 (23-78) | n = promedio (rango en años) 56,58 (23-78) | n = promedio (rango en años) 69,56 (54-89) |
| Género | Normal (n = 34); n = (%) | Graso (n = 21); n = (%) | Total (n = 55); n = (%) | Total (n = 11); n = (%) |
|
|
23 (67,65) | 9 (42,86) | 32 (58,18) | 6 (54,55) |
|
|
11 (32,35) | 12 (57,14) | 23 (41,82) | 5 (45,45) |
| Antecedentes | ||||
|
|
6 (17,65) | 8 (38,09) | 14 (25,45) | |
|
|
5 (14,71) | 3 (14,29) | 8 (14,54) | 2 (18,18) |
|
|
4 (11,76) | 4 (19,05) | 8 (14,54) | 5 (45,45) |
|
|
4 (11,76) | 3 (14,29) | 7 (12,73) | |
|
|
2 (5,88) | 2 (9,52) | 4 (7,27) | 3 (27,27) |
|
|
1 (2,94) | 1 (1,82) | ||
|
|
1 (2,94) | 1 (4,76) | 2 (3,64) | 1 (9,09) |
|
|
1 (2,94) | 1 (1,82) | ||
|
|
1 (2,94) | 8 (14,54) | ||
|
|
1 (2,94) | 2 (9,52) | 3 (5,45) | 5 (45,45) |
|
|
1 (2,94) | 1 (4,76) | 1 (1,82) | |
|
|
1 (2,94) | 1 (1,82) | ||
|
|
6 (17,65) | 2 (9,52) | 8 (14,54) | |
| Clasificación del IMC. Tomado de38 | ||||
|
|
5 (14,71) | 1 (4,76) | 6 (10,91) | 5 (45,45) |
|
|
18 (52,94) | 5 (23,81) | 23 (41,82) | 6 (54,55) |
|
|
8 (23,53) | 10 (47,62) | 18 (32,73) | |
|
|
2 (5,88) | 4 (19,05) | 6 (10,91) | |
|
|
1 (2,94) | 3 (14,29) | 4 (7,27) | |
|
|
1 (2,94) | 1 (1,82) | ||
|
|
1 (4,76) | 1 (1,82) | ||
| Indicación del procedimiento | ||||
|
|
5 (14,71) | 3 (14,29) | 8 (14,54) | |
|
|
11 (32,35) | |||
|
|
1 (4,76) | 1 (1,82) | ||
|
|
1 (2,94) | 1 (1,82) | ||
|
|
20 (58,82) | 9 (42,86) | 29 (52,73) | |
|
|
2 (5,88) | 2 (3,64) | ||
|
|
3 (8,82) | 2 (9,52) | 5 (9,09) | |
|
|
1 (4,76) | 1 (1,82) | ||
|
|
2 (5,88) | 4 (19,05) | 6 (10,91) | |
|
|
1 (2,94) | 1 (4,76) | 2 (3,64) | |
El IFH para el páncreas (valor medio de las tres medidas), tomando los grados I y II como normales, y los grado III y IV como páncreas graso, fueron, respectivamente: normal (n = 34), IFH 2,60, rango de 0,97-3,47; páncreas graso (n = 21), IFH 3,87, rango 2-5,5. Con una prevalencia para páncreas graso de 38,18 %, cuando se realiza el IFH en tres subgrupos diferentes, considerados como ecoendoscópicamente normales, páncreas graso, pacientes con diagnóstico previo de cáncer de páncreas confirmado por histología. El IFH tomado en el páncreas fue para los tres grupos, respectivamente: normal (grado I y II): IFH 2,60, rango 0,97-3,47 (IC 95 % 2,17-3,02); páncreas graso (grado III y IV): IFH 3,87, rango 2-5,5 (IC 95% 3,44-4,29); cáncer de páncreas: IFH 6.35, rango 5,8-7,8 (IC 95% 5,92-6,77) (Tabla 4).
Discusión
El páncreas graso es una afección recientemente reconocida, que ha sido poco investigada hasta el día de hoy39. Se han utilizado diferentes nombres para describir estos cambios: páncreas graso, infiltración grasa, reemplazo graso y lipomatosis pancreática. Para efectos de este artículo, lo hemos denominado como páncreas graso. El espectro de este abarca desde la acumulación de grasa interlobular (macrovesículas) hasta la esteatopancreatitis no alcohólica40. Es por esto por lo que su epidemiología aún no está bien definida, dada la falta de parámetros para un diagnóstico claro y, como ya anotamos, las claras diferencias en la terminología para referirse a una misma entidad.
Por lo general, el páncreas graso se considera un hallazgo aleatorio durante las pruebas de imagen abdominal realizadas por otras razones (sin que aún exista una prueba de detección estandarizada). Los datos epidemiológicos son limitados a la población asiática, y se calcula que su prevalencia puede estar entre 16 % y 35 %41. El páncreas graso se ha asociado con un desarrollo ulterior de las complicaciones pancreáticas y metabólicas. Se ha encontrado una asociación con la diabetes mellitus tipo 2, la pancreatitis aguda (aparición y severidad), la insuficiencia pancreática exocrina, la pancreatitis crónica, la fibrosis pancreática e, incluso, con el carcinoma pancreático35,39-42.
Su patogénesis aún se encuentra en investigación y los datos son escasos, pero se ha propuesto una hipótesis emergente, en donde existe una mayor infiltración de macrófagos en el tejido graso pancreático, debido a la alteración del microambiente hormonal, que conduce a un estado inflamatorio crónico, caracterizado por la secreción de citocinas proinflamatorias (TNF-α e IL-1β)42. Otras hipótesis alternativas sugieren que la lipotoxicidad resultante de la acumulación de triglicéridos en las células β causa alteración del metabolismo de la glucosa, lo que conduce a la apoptosis celular y al reemplazo de grasas. A esto se le adiciona la señalización paracrina por los adipocitos en el páncreas, que regula negativamente las células β. Todo esto genera una alteración en el metabolismo de la glucosa, lo que predispone a la aparición de diabetes mellitus tipo 241,42.
Las vías afectadas en el contexto de la pancreatitis aguda implican la producción aumentada de radicales libres, lo que conduce a la lesión y muerte de las células acinares, que se pueden reemplazar por tejido graso, esto predispone a los pacientes a desarrollar una pancreatitis aguda más grave32-35,39-42. Finalmente, con respecto al cáncer de páncreas, el páncreas graso predispone de forma independiente a los individuos a desarrollar una neoplasia maligna pancreática. Aunque el mecanismo aún no está claro, esta asociación puede derivar de la inflamación lipogénica crónica, al mismo tiempo que altera el microambiente de forma protumoral32,34,42.
La evaluación del páncreas graso incluye el examen histológico, en donde se encuentra que la infiltración grasa del páncreas evita los acinos (función exocrina) y los islotes de Langerhans (función endocrina), y se acumula preferentemente dentro de los tabiques intersticiales pancreáticos por razones desconocidas. Por lo general, todo el páncreas está afectado de manera difusa. Rara vez el depósito de grasa ectópica puede ser desigual, que ocurre preferentemente en la cabeza del páncreas anterior, con preservación del proceso uncinado, en probable relación con su origen embriológico43.
Dada la ubicación retroperitoneal del páncreas, la distribución heterogénea de la grasa y los bordes mal definidos hacen que la evaluación del páncreas graso sea un desafío40-43; por lo que el USE desempeña un papel preponderante en esta y otras enfermedades pancreáticas, ya que este ha cambiado significativamente el diagnóstico y el manejo de 25 % a 50 % de los casos44-48. Sin embargo, no siempre se puede determinar un diagnóstico preciso utilizando solo las imágenes del USE de forma convencional. Por ejemplo, en el cáncer de páncreas, la exactitud de la USE (sin elastografía) para diferenciar el cáncer de lesiones benignas es aproximadamente del 75 %39-43,49, siendo necesaria la USE-BAF, que alcanza una sensibilidad del 89 %, especificidad del 96 % y exactitud diagnóstica del 97 %37,50-52.
A pesar de esto, una de las dificultades en la punción guiada por USE es que la toma del tejido es técnicamente exigente y se pueden necesitar múltiples punciones para obtener una cantidad suficiente de tejido47,48. En ocasiones, a pesar del muestreo repetido, la evaluación citohistológica puede ser falsamente negativa, y puede asociarse con tasas de morbilidad pequeñas, pero no insignificantes53. Por tanto, es necesario explorar nuevos métodos que permitan una caracterización más precisa, pero no invasiva, de las lesiones, lo que limita la necesidad de la toma de biopsia en las áreas con la mayor sospecha de malignidad. Uno de estos métodos es la elastografía guiada por USE, la cual surgió del desarrollo de la técnica de la vibración en la ultrasonografía de mama53,54.
La elastografía se basa en el conocimiento de que muchos procesos patológicos diferentes, como la fibrosis, la inflamación y el cáncer, inducen alteraciones en la rigidez de los tejidos12,55,56. Esta técnica evalúa la rigidez mediante la aplicación de una ligera compresión. Al usar un transductor de ultrasonido al tejido objetivo y al registrar el desplazamiento de la región evaluada, las pulsaciones vasculares fisiológicas y las respiratorias proporcionan las vibraciones (compresiones) necesarias para el estudio57-59.
Existen diferentes generaciones de elastografía inicialmente cualitativa (colores), que sirvieron como base para que recientemente se describa la elastografía de segunda generación por USE, la cual permite la evaluación cuantitativa de la rigidez de los tejidos con dos enfoques diferentes: la relación de deformación, o strain ratio (SR), y el histograma de tensión, o strain histograma (SH). Esta ETR-USE puede mejorar el rendimiento diagnóstico de una manera no invasiva44-48,50-56,60-69.
El más estudiado de estos métodos es el SR, por Itokawa y colaboradores, siendo una técnica de elastografía cuantitativa, que permite diferenciar una lesión altamente sugestiva de cáncer, con un SR promedio de 39,08 o más, de una masa inflamatoria, con un SR promedio de 23,66, o menos (p < 0,05)61. Desafortunadamente, los estudios ulteriores no han sido consistentes ni reproducibles, definiendo diferentes valores de corte, que pueden ir desde SR 3,7 a 24, con rangos de sensibilidad que van desde 67 % al 98 % y con niveles más bajos de especificidad del 45 % al 71 %, por lo que es difícil su aplicación en la práctica clínica rutinaria56,61,62,67. En consecuencia, surge la necesidad de evaluar otros métodos que tengan resultados más precisos y reproducibles. La respuesta podría estar en el IFH, que como se explicó previamente, ya se ha validado, y su utilidad se ha demostrado en el diagnóstico no invasivo de enfermedades hepáticas, con una excelente correlación en medir la rigidez del parénquima hepático y detectar la fibrosis y el hígado graso de manera no invasiva23,25.
Como se explicó anteriormente, el IFH se calcula automáticamente utilizando un software, que usa las imágenes de elastografía en tiempo real; para su cálculo se incluyen 11 variables. Un hallazgo inicial de nuestro trabajo es que un tercio (38 %) de los pacientes evaluados por el USE tiene un hallazgo compatible con páncreas graso. Aunque esto es similar a lo reportado en la literatura, donde la prevalencia en los países asiáticos y Estados Unidos oscila entre el 16 % y 35 %55,65. Esto puede relacionarse con que el 19 % tenía obesidad (IMC mayor de 30) y 38 % presentaba hígado graso, documentado por imagen previa. De los que presentaron páncreas graso, más del 30 % tenía algún síntoma de insuficiencia pancreática; sin embargo, a partir de este estudio no es posible establecer asociaciones, a pesar de que se ha encontrado una clara asociación entre la infiltración grasa pancreática no alcohólica (NAFPD) con la obesidad y el síndrome metabólico, encontrado, además, que la degeneración grasa y fibrosis en el tejido pancreático que rodea a la mayoría de los casos de adenocarcinoma pancreático33,70-72.
Es por esto por lo que la detección de páncreas graso, en especial, la detección temprana del cáncer de páncreas, es un desafío permanente en la práctica clínica, por lo que es crucial contar con una herramienta precisa para la detección temprana de estas afecciones, que permita una intervención médica oportuna. La propuesta es el uso del IFH medido por elastografía mediante la USE.
Es por ello por lo que realizamos este estudio piloto, para evaluar su utilidad en el páncreas. En este se encontró que, al igual que en el hígado, se muestra una asociación entre el aumento del IFH y la rigidez del tejido en los tres grupos de pacientes evaluados: páncreas normal, páncreas graso y carcinoma de páncreas. Consideramos que podría ser una herramienta útil y más objetiva que el SR, si se logran reproducir estos resultados en estudios con una población más amplia y heterogénea, que permita evaluar su rendimiento en diferentes escenarios del páncreas graso en estudios controlados.
Como principales limitantes encontramos el tamaño de la muestra, por ser un estudio de un solo centro, con un observador, lo cual, al tratarse de un estudio piloto con hallazgos prometedores, que permiten la innovación en un campo del conocimiento médico aún en desarrollo, abre la puerta para nuevos estudios, que permitan definir más claramente la utilidad de este método diagnóstico y de seguimiento en este y en otros escenarios.
Conclusión
Este estudio piloto es el primero en el mundo que utiliza el IFH aplicado al parénquima pancreático. Se mostró una utilidad en diferenciar de manera no invasiva el páncreas normal, graso y carcinoma de páncreas; sin embargo, este hallazgo debe ser confirmado en poblaciones más amplias y heterogéneas, con el fin de ser validado.
REFERENCIAS
1. Gordon-Dseagu VL, Devesa SS, Goggins M, Stolzenberg-Solomon R. Pancreatic cancer incidence trends: Evidence from the surveillance, epidemiology and end results (SEER) population-based data. Int J Epidemiol. 2018;47(2):427-39. https://doi.org/10.1093/ije/dyx232 [ Links ]
2. Petrov MS, Yadav D. Global epidemiology and holistic prevention of pancreatitis. Nat Rev Gastroenterol Hepatol. 2019;16(3):175-84. https://doi.org/10.1038/s41575-018-0087-5 [ Links ]
3. Hisanaga K, Hisanaga A, Nagata K, Ichie Y. High speed rotating scanner for transgastric sonography. Am J Roentgenol. 1980;135(3):627-9. https://doi.org/10.2214/ajr.135.3.627 [ Links ]
4. Dimagno EP, Regan PT, Clain JE, James EM, Buxton JL. Human endoscopic ultrasonography. Gastroenterology. 1982;83(4):824-9. https://doi.org/10.1016/S0016-5085(82)80012-7 [ Links ]
5. Yamashita Y, Kato J, Ueda K, Nakamura Y, Kawaji Y, Abe H, et al. Contrast-enhanced endoscopic ultrasonography for pancreatic tumors. Biomed Res Int. 2015;2015:491782. https://doi.org/10.1155/2015/491782 [ Links ]
6. Moutinho-Ribeiro P, Iglesias-García J, Gaspar R, Macedo G. Early pancreatic cancer - The role of endoscopic ultrasound with or without tissue acquisition in diagnosis and staging. Dig Liver Dis. 2019;51(1):4-9. https://doi.org/10.1016/j.dld.2018.09.027 [ Links ]
7. DeWitt J, Devereaux BM, Lehman GA, Sherman S, Imperiale TF. Comparison of endoscopic ultrasound and computed tomography for the preoperative evaluation of pancreatic cancer: A systematic review. Clin Gastroenterol Hepatol. 2006;4(6):717-25. https://doi.org/10.1016/j.cgh.2006.02.020 [ Links ]
8. DeWitt J, Devereaux B, Chriswell M, McGreevy K, Howard T, Imperiale TF, et al. Comparison of endoscopic ultrasonography and multidetector computed tomography for detecting and staging pancreatic cancer. Ann Intern Med. 2004;141(10):753-63. https://doi.org/10.7326/0003-4819-141-10-200411160-00006 [ Links ]
9. Luz LP, Al-Haddad MA, Sey MSL, Dewitt JM. Applications of endoscopic ultrasound in pancreatic cancer. World J Gastroenterol. 2014;20(24):7808-18. https://doi.org/10.3748/wjg.v20.i24.7808 [ Links ]
10. Wang W, Shpaner A, Krishna SG, Ross WA, Bhutani MS, Tamm EP, et al. Use of EUS-FNA in diagnosing pancreatic neoplasm without a definitive mass on CT. Gastrointest Endosc. 2013;78(1):73-80. https://doi.org/10.1016/j.gie.2013.01.040 [ Links ]
11. Shi Y, Glaser KJ, Venkatesh SK, Ben-Abraham EI, Ehman RL. Feasibility of using 3D MR elastography to determine pancreatic stiffness in healthy volunteers. J Magn Reson Imaging. 2015;41(2):369-75. https://doi.org/10.1002/jmri.24572 [ Links ]
12. Itoh A, Ueno E, Tohno E, Kamma H, Takahashi H, Shiina T, et al. Breast disease: Clinical application of US elastography for diagnosis. Radiology. 2006;239(2):341-50. https://doi.org/10.1148/radiol.2391041676. [ Links ]
13. Correas JM, Tissier AM, Khairoune A, Khoury G, Eiss D, Hélénon O. Ultrasound elastography of the prostate: State of the art. Diagn Interv Imaging. 2013;94(5):551-60. https://doi.org/10.1016/j.diii.2013.01.017 [ Links ]
14. Lyshchik A, Higashi T, Asato R, Tanaka S, Ito J, Mai JJ, et al. Thyroid gland tumor diagnosis at US elastography. Radiology. 2005;237(1):202-11. https://doi.org/10.1148/radiol.2363041248 [ Links ]
15. Dighe M, Luo S, Cuevas C, Kim Y. Efficacy of thyroid ultrasound elastography in differential diagnosis of small thyroid nodules. Eur J Radiol. 2013;82(6):e274-80. https://doi.org/10.1016/j.ejrad.2013.01.009 [ Links ]
16. Schulman AR, Lin MV, Rutherford A, Chan WW, Ryou M. A prospective blinded study of endoscopic ultrasound elastography in liver disease: Towards a virtual biopsy. Clin Endosc. 2018;51(2):181-5. https://doi.org/10.5946/ce.2017.095 [ Links ]
17. Pang JX, Zimmer S, Niu S, Crotty P, Tracey J, Pradhan F, et al. Liver stiffness by transient elastography predicts liver-related complications and mortality in patients with chronic liver disease. PLoS One. 2014;9(4):e95776. https://doi.org/10.1371/journal.pone.0095776 [ Links ]
18. Castéra L, Foucher J, Bernard PH, Carvalho F, Allaix D, Merrouche W, et al. Pitfalls of liver stiffness measurement: A 5-year prospective study of 13,369 examinations. Hepatology. 2010;51(3):828-35. https://doi.org/10.1002/hep.23425 [ Links ]
19. Wong GLH, Wong VWS, Chim AML, Yiu KK, Chu SH, Li MK, et al. Factors associated with unreliable liver stiffness measurement and its failure with transient elastography in the Chinese population. J Gastroenterol Hepatol. 2011;26(2):300-5. https://doi.org/10.1111/j.1440-1746.2010.06510.x [ Links ]
20. Lucidarme D, Foucher J, Le Bail B, Vergniol J, Castera L, Duburque C, et al. Factors of accuracy of transient elastography (fibroscan) for the diagnosis of liver fibrosis in chronic hepatitis C. Hepatology. 2009;49(4):1083-9. https://doi.org/10.1002/hep.22748 [ Links ]
21. Tatsumi C, Kudo M, Ueshima K, Kitai S, Ishikawa E, Yada N, et al. Non-invasive evaluation of hepatic fibrosis for type C chronic hepatitis. Intervirology. 2010;53(1):76-81. https://doi.org/10.1159/000252789 [ Links ]
22. Fujimoto K, Kato M, Tonomura A, Yada N. Non-invasive evaluation method of the liver fibrosis using real-time tissue elastography. Usefulness of judgment liver fibrosis stage by liver fibrosis index (LF index). Kanzo. 2010;51(9):539-41. https://doi.org/10.2957/kanzo.51.539 [ Links ]
23. Fujimoto K, Kato M, Kudo M, Yada N, Shiina T, Ueshima K, et al. Novel image analysis method using ultrasound elastography for noninvasive evaluation of hepatic fibrosis in patients with chronic hepatitis C. Oncology. 2013;84(1):3-12. https://doi.org/10.1159/000345883 [ Links ]
24. Tatsumi C, Kudo M, Ueshima K, Kitai S, Takahashi S, Inoue T, et al. Noninvasive evaluation of hepatic fibrosis using serum fibrotic markers, transient elastography (FibroScan) and real-time tissue elastography. Intervirology. 2008;51(1):27-33. https://doi.org/10.1159/000122602 [ Links ]
25. Benedict M, Zhang X. Non-alcoholic fatty liver disease: An expanded review. World J Hepatol. 2017;9(16):715-32. https://doi.org/10.4254/wjh.v9.i16.715 [ Links ]
26. Sayiner M, Koenig A, Henry L, Younossi ZM. Epidemiology of nonalcoholic fatty liver disease and nonalcoholic steatohepatitis in the United States and the rest of the world. Clin Liver Dis. 2016;20(2):205-14. https://doi.org/10.1016/j.cld.2015.10.001 [ Links ]
27. Kanwar P, Kowdley KV. The metabolic syndrome and its influence on nonalcoholic steatohepatitis. Clin Liver Dis. 2016;20(2):225-43. https://doi.org/10.1016/j.cld.2015.10.002. [ Links ]
28. Hirooka Y, Kuwahara T, Irisawa A, Itokawa F, Uchida H, Sasahira N, et al. JSUM ultrasound elastography practice guidelines: Pancreas. J Med Ultrason. 2015;42(2):151-74. https://doi.org/10.1007/s10396-014-0571-7 [ Links ]
29. Giovannini M, Hookey L, Bories E, Pesenti C, Monges G, Delpero JR. Endoscopic ultrasound elastography: The first step towards virtual biopsy? Preliminary results in 49 patients. Endoscopy. 2006;38(4):344-8. https://doi.org/10.1055/s-2006-925158 [ Links ]
30. Schaefer J. The normal weight of the pancreas in the adult human being: A biometric study. Anat Tec. 1926;32(2):119-32. https://doi.org/10.1002/ar.1090320204 [ Links ]
31. Olsen TS. Lipomatosis of the pancreas in autopsy material and its relation to age and overweight. Acta Pathol Microbiol Scand A. 1978;86A(5):367-73. https://doi.org/10.1111/j.1699-0463.1978.tb02058.x [ Links ]
32. Ramkissoon R, Gardner TB. Pancreatic steatosis: An emerging clinical entity. Am J Gastroenterol. 2019;114(11):1726-34. https://doi.org/10.14309/ajg.0000000000000262 [ Links ]
33. Prachayakul V, Aswakul P. Pancreatic steatosis: What should gastroenterologists know? J Pancreas. 2015;16(3):227-31. https://doi.org/10.6092/1590-8577/2987 [ Links ]
34. Alempijevic T, Dragasevic S, Zec S, Popovic D, Milosavljevic T. Non-alcoholic fatty pancreas disease. Postgrad Med J. 2017;93(1098):226-30. https://doi.org/10.1136/postgradmedj-2016-134546 [ Links ]
35. Sepe PS, Ohri A, Sanaka S, Berzin TM, Sekhon S, Bennett G, et al. A prospective evaluation of fatty pancreas by using EUS. Gastrointest Endosc. 2011;73(5):987-93. https://doi.org/10.1016/j.gie.2011.01.015 [ Links ]
36. Othman MO, Wallace MB. The role of endoscopic ultrasonography in the diagnosis and management of pancreatic cancer. Gastroenterol Clin North Am. 2012;41(1):179-88. https://doi.org/10.1016/j.gtc.2011.12.014 [ Links ]
37. Chen G, Liu S, Zhao Y, Dai M, Zhang T. Diagnostic accuracy of endoscopic ultrasound-guided fine-needle aspiration for pancreatic cancer: A meta-analysis. Pancreatology. 2013;13(3):298-304. https://doi.org/10.1016/j.pan.2013.01.013 [ Links ]
38. Datos sobre la obesidad [Internet]. Organización Mundial de la Salud (consultado el 20 de enero de 2020). Disponible en: Disponible en: https://www.who.int/health-topics/obesity#tab=tab_1 [ Links ]
39. Shah N, Rocha JP, Bhutiani N, Endashaw O. Nonalcoholic fatty pancreas disease. Nutr Clin Pract. 2019;34(Suppl 1):S49-S56. https://doi.org/10.1002/ncp.10397 [ Links ]
40. Tariq H, Nayudu S, Akella S, Glandt M, Chilimuri S. Non-alcoholic fatty pancreatic disease: A review of literature. Gastroenterology Res. 2016;9(6):87-91. https://doi.org/10.14740/gr731w [ Links ]
41. Khoury T, Asombang AW, Berzin TM, Cohen J, Pleskow DK, Mizrahi M. The clinical implications of fatty pancreas: A concise review. Dig Dis Sci. 2017;62(10):2658-67. https://doi.org/10.1007/s10620-017-4700-1 [ Links ]
42. Acharya C, Navina S, Singh VP. Role of pancreatic fat in the outcomes of pancreatitis. Pancreatology. 2014;14(5):403-8. https://doi.org/10.1016/j.pan.2014.06.004 [ Links ]
43. Singh RG, Yoon HD, Wu LM, Lu J, Plank LD, Petrov MS. Ectopic fat accumulation in the pancreas and its clinical relevance: A systematic review, meta-analysis, and metaregression. Metabolism. 2017;69:1-13. https://doi.org/10.1016/j.metabol.2016.12.012 [ Links ]
44. Mittal D, Kumar V, Saxena SC, Khandelwal N, Kalra N. Neural network based focal liver lesion diagnosis using ultrasound images. Comput Med Imaging Graph. 2011;35(4):315-23. https://doi.org/10.1016/j.compmedimag.2011.01.007. [ Links ]
45. Lightdale CJ. Endoscopic ultrasound. Gastrointest Endosc Clin N Am. 2005;15(1):863-79. https://doi.org/10.1016/j.giec.2004.08.001 [ Links ]
46. Tamerisa R, Irisawa A, Bhutani MS. Endoscopic ultrasound in the diagnosis, staging, and management of gastrointestinal and adjacent malignancies. Med Clin North Am. 2005;89(1):139-58. https://doi.org/10.1016/j.mcna.2004.08.010 [ Links ]
47. Luthra AK, Evans JA. Review of current and evolving clinical indications for endoscopic ultrasound. World J Gastrointest Endosc. 2016;8(3):157-64. https://doi.org/10.4253/wjge.v8.i3.157 [ Links ]
48. Iglesias-García J, Lindkvist B, Lariño-Noia J, Domínguez-Muñoz JE. The role of EUS in relation to other imaging modalities in the differential diagnosis between mass forming chronic pancreatitis, autoimmune pancreatitis and ductal pancreatic adenocarcinoma. Rev Esp Enferm Dig. 2012;104(6):315-21. https://doi.org/10.4321/S1130-01082012000600006 [ Links ]
49. Lee LS, Andersen DK, Ashida R, Brugge WR, Canto MI, Chang KJ, et al. Endoscopic ultrasound and related technologies for the diagnosis and treatment of pancreatic disease - Research gaps and opportunities: Summary of a National Institute of Diabetes and Digestive and Kidney Diseases Workshop. Pancreas. 2017;46(10):1242-50. https://doi.org/10.1097/MPA.0000000000000936 [ Links ]
50. Bhatia V, Varadarajulu S. Endoscopic ultrasonography-guided tissue acquisition: How to achieve excellence. Dig Endosc. 2017;29(4):417-30. https://doi.org/10.1111/den.12823 [ Links ]
51. Huang JYL, Chang KJ. Improvements and innovations in endoscopic ultrasound guided fine needle aspiration. J Hepatobiliary Pancreat Sci. 2015;22(7):E37-E46. https://doi.org/10.1002/jhbp.232 [ Links ]
52. Dumonceau JM, Koessler T, van Hooft Jeanin E, Fockens P. Endoscopic ultrasonography-guided fine needle aspiration: Relatively low sensitivity in the endosonographer population. World J Gastroenterol. 2012;18(19):2357-63. https://doi.org/10.3748/wjg.v18.i19.2357 [ Links ]
53. Jhala NC, Jhala DN, Chhieng DC, Eloubeidi MA, Eltoum IA. Endoscopic ultrasound-guided fine-needle aspiration: A cytopathologist’s perspective. Am J Clin Pathol. 2003;120(3):351-67. https://doi.org/ 10.1309/MFRF-J0XY-JLN8-NVDP [ Links ]
54. Dumonceau JM, Deprez PH, Jenssen C, Iglesias-García J, Larghi A, Vanbiervliet G, et al. Indications, results, and clinical impact of endoscopic ultrasound (EUS)-guided sampling in gastroenterology: European Society of Gastrointestinal Endoscopy (ESGE) Clinical Guideline - Updated January 2017. Endoscopy. 2017;49(7):695-714. https://doi.org/10.1055/s-0043-109021 [ Links ]
55. Polkowski M, Larghi A, Weynand B, Boustière C, Giovannini M, Pujol B, et al. Learning, techniques, and complications of endoscopic ultrasound (EUS)-guided sampling in gastroenterology: European Society of Gastrointestinal Endoscopy (ESGE) technical guideline. Endoscopy. 2012;44(2):190-205. https://doi.org/10.1055/s-0031-1291543 [ Links ]
56. Iglesias-García J, Lindkvist B, Lariño-Noia J, Domínguez-Muñoz JE. Endoscopic ultrasound elastography. Endosc Ultrasound. 2012;1(1):8-16. https://doi.org/10.7178/eus.01.003 [ Links ]
57. GBD 2017 Pancreatic Cancer Collaborators. The global, regional, and national burden of pancreatic cancer and its attributable risk factors in 195 countries and territories, 1990-2017: A systematic analysis for the Global Burden of Disease Study 2017. Lancet Gastroenterol Hepatol. 2019;4(12):934-47. https://doi.org/10.1016/S2468-1253(19)30347-4 [ Links ]
58. Siegel RL, Miller KD, Jemal A. Cancer statistics, 2020. CA Cancer J Clin. 2020;70(1):7-30. https://doi.org/10.3322/caac.21590 [ Links ]
59. Pardo C, Cendales R. Cancer incidence estimates and mortality for the top five cancer in Colombia, 2007-2011. Colomb Med (Cali). 2018;49(1):16-22. https://doi.org/10.25100/cm.v49i1.3596 [ Links ]
60. Mondal U, Henkes N, Patel S, Rosenkranz L. Endoscopic ultrasound elastography: Current clinical use in pancreas. Pancreas. 2016;45(7):929-33. https://doi.org/10.1097/MPA.0000000000000595 [ Links ]
61. Itokawa F, Itoi T, Sofuni A, Kurihara T, Tsuchiya T, Ishii K, et al. EUS elastography combined with the strain ratio of tissue elasticity for diagnosis of solid pancreatic masses. J Gastroenterol. 2011;46(6):843-53. https://doi.org/10.1007/s00535-011-0399-5 [ Links ]
62. Okasha HH, Mahdy RE, Elkholy S, Hassan MS, El-Mazny AN, Hadad KEE, et al. Endoscopic ultrasound (EUS) elastography and strain ratio, could it help in differentiating malignant from benign pancreatic lesions? Medicine. 2018;97(36):e11689. https://doi.org/10.1097/MD.0000000000011689 [ Links ]
63. Pérez-Cruz PE, Acevedo F. Escalas de estado funcional (o performance status) en cáncer. Gastroenterol Latinoam. 2014;25(3):219-26. [ Links ]
64. Wani S, Wallace MB, Cohen J, Pike IM, Adler DG, Kochman ML, et al. Quality indicators for EUS. Gastrointest Endosc. 2015;81(1):67-80. https://doi.org/10.1016/j.gie.2014.07.054 [ Links ]
65. Cui XW, Chang JM, Kan QC, Chiorean L, Ignee A, Dietrich CF. Endoscopic ultrasound elastography: Current status and future perspectives. World J Gastroenterol. 2015;21(47):13212-24. https://doi.org/10.3748/wjg.v21.i47.13212 [ Links ]
66. Dietrich CF. Elastography, the new dimension in ultrasonography. Praxis (Bern 1994). 2011;100(25):1533-42. https://doi.org/10.1024/1661-8157/a000735 [ Links ]
67. Krouskop TA, Wheeler TM, Kallel F, Garra BS, Hall T. Elastic moduli of breast and prostate tissues under compression. Ultrason Imaging. 1998;20(4):260-74. https://doi.org/10.1177/016173469802000403 [ Links ]
68. Wang D, Yu X, Xiao W, Jiao X, Wu J, Teng D, et al. Prevalence and clinical characteristics of fatty pancreas in Yangzhou, China: A cross-sectional study. Pancreatology. 2018;18(3):263-8. https://doi.org/10.1016/j.pan.2018.02.004 [ Links ]
69. Lesmana CRA, Pakasi LS, Inggriani S, Aidawati ML, Lesmana LA. Prevalence of non-alcoholic fatty pancreas disease (NAFPD) and its risk factors among adult medical check-up patients in a private hospital: A large cross sectional study. BMC Gastroenterol. 2015;15(1):174. https://doi.org/10.1186/s12876-015-0404-1 [ Links ]
70. Lee JS, Kim SH, Jun DW, Han JH, Jang EC, Park JY, et al. Clinical implications of fatty pancreas: Correlations between fatty pancreas and metabolic syndrome. World J Gastroenterol. 2009;15(15):1869-75. https://doi.org/10.3748/wjg.15.1869 [ Links ]
71. Liles JS, Katz MH. Pancreaticoduodenectomy with vascular resection for pancreatic head adenocarcinoma. Expert Rev Anticancer Ther. 2014;14(8):919-29. https://doi.org/10.1586/14737140.2014.919860 [ Links ]
72. Lesmana CRA, Gani RA, Lesmana LA. Non-alcoholic fatty pancreas disease as a risk factor for pancreatic cancer based on endoscopic ultrasound examination among pancreatic cancer patients: A single-center experience. JGH Open. 2017;2(1):4-7. https://doi.org/10.1002/jgh3.12032 [ Links ]
Citación: Gómez-Zuleta MA, Ruiz-Morales OF, Buitrago-Laguado EJ. Utilidad del índice de fibrosis hepática (IFH) medido durante la ultrasonografía endoscópica en la evaluación del parénquima pancreático. Rev Colomb Gastroenterol. 2022;37(1):10-23. https://doi.org/10.22516/25007440.644
Consideraciones éticas Este protocolo se diseñó de acuerdo con la reglamentación ética vigente (Declaración de Helsinki, reporte Belmont, pautas CIOMS, guías de la buena práctica clínica/conferencia internacional de armonización GPC/ICH, y a nivel local por la Resolución 8430 de 1993). Se clasifica como una investigación con riesgo mínimo de acuerdo con la Resolución 8430 de 1993, del Ministerio de Salud de Colombia. Teniendo en cuenta que la recolección de la información se basa en una revisión de los videos grabados durante el procedimiento diagnóstico necesario, como parte de la evaluación diagnóstica, o la intervención terapéutica dada por la condición clínica de base del paciente, en donde no se realiza ninguna intervención médica, tampoco se tomarán datos de contacto del paciente. Se utilizó el consentimiento informado institucional, que el paciente previo al procedimiento firmó. La recolección de la información la realizó el investigador principal del presente proyecto y se codificaron todos los datos de identidad de los pacientes. Este documento se aprobó por el comité de ética médica institucional
Recibido: 18 de Agosto de 2020; Aprobado: 10 de Noviembre de 2021











 texto en
texto en