Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista colombiana de Gastroenterología
Print version ISSN 0120-9957On-line version ISSN 2500-7440
Rev. colomb. Gastroenterol. vol.37 no.1 Bogotá Jan./Mar. 2022 Epub May 23, 2022
https://doi.org/10.22516/25007440.828
Artículo de revisión
Cáncer de recto: tendencias y cambios en el manejo. Conceptos para el gastroenterólogo y el cirujano
1 Colorectal surgeon. Assistant Professor, Pontificia Universidad Javeriana. Head of the Colorectal Unit, Hospital Universitario San Ignacio. Bogotá, Colombia.
2Gastroenterologist. Instructing Professor, Pontificia Universidad Javeriana. Head of the Gastroenterology Unit, Hospital Universitario San Ignacio. Bogotá, Colombia.
3General Surgeon. Instructor Professor, Pontificia Universidad Javeriana. Hospital Universitario San Ignacio. Bogotá, Colombia.
4 Gastrointestinal Surgeon. Full Professor, Pontificia Universidad Javeriana. Head of the Metabolic and Nutritional Support Group, Hospital Universitario San Ignacio. Bogotá, Colombia.
El cáncer de recto es el tercer cáncer en frecuencia en Colombia, y constituye un reto diagnóstico y terapéutico para gastroenterólogos, cirujanos y oncólogos. La evaluación diagnóstica y el estudio de su extensión locorregional y sistémica se han modificado por nuevos métodos de imagen, que permiten una visualización precisa de estructuras anatómicas que antes no se podían evaluar fácilmente. La disponibilidad de estas nuevas herramientas en la estadificación de la enfermedad ha tenido un gran impacto en las decisiones terapéuticas y en la escogencia de una ruta de tratamiento específica para cada paciente, lo que ha racionalizado el uso de terapias neoadyuvantes y la realización de cirugía con criterios anatómicos correctos. Esto ha sido fundamental en el objetivo de lograr los mejores desenlaces con la menor morbilidad posoperatoria asociada. En este artículo se revisarán y explicarán en detalle cuáles han sido los cambios más recientes y las recomendaciones más actualizadas para el manejo del cáncer de recto.
Palabras clave: Recto; neoplasias del recto; proctectomía; estadificación de neoplasias; quimioterapia; radioterapia
Rectal cancer is the third most frequent cancer in Colombia and constitutes a diagnostic and therapeutic challenge for gastroenterologists, surgeons, and oncologists. Diagnostic evaluation and the study of its locoregional and systemic extension have been modified by new imaging methods, enabling an accurate view of anatomical structures that could not be easily examined before. The availability of these new tools in disease staging has significantly impacted therapeutic decisions and the choice of a specific treatment path for each patient, rationalizing the use of neoadjuvant therapies and the performance of surgery with correct anatomical criteria. The preceding has been essential to achieving the best outcomes with the least associated postoperative morbidity. This article will review and explain in detail the most recent changes and up-to-date recommendations for managing rectal cancer.
Keywords: Rectum; neoplasms of the rectum; proctectomy; staging of neoplasms; chemotherapy; radiotherapy
Introducción
El cáncer de colon y recto es el tercer tipo de cáncer más frecuente en Colombia. En el 2018 se diagnosticaron 19 258 nuevos casos, de los cuales solo el 13 % correspondía al estadio I, mientras que el 40 % se encontraba en los estadios III o IV. El 26 % no tuvo un correcto estadiaje1. La oportunidad en el diagnóstico y manejo ha mejorado, pero aún existen muchos pacientes sin un adecuado tratamiento oncológico. El cáncer de recto es una enfermedad compleja, con una historia natural propia y una localización anatómica difícil, que hace que la evaluación imagenológica no sea tan precisa y que la disección quirúrgica sea exigente. Estos atributos producen subestadiajes, tratamientos de neoadyuvancia y adyuvancia no adecuados, y cirugías con márgenes de resección que, si llegan a ser positivos, disminuirán la probabilidad de curación y la sobrevida a largo plazo con una adecuada calidad de vida.
Es por esto por lo que es pertinente revisar los cambios recientes que han ocurrido en las imágenes de evaluación, el estadiaje, la técnica quirúrgica y los tratamientos complementarios, para escoger aquellos que brinden mejores resultados para el paciente, y así poder implementarlos en la práctica clínica de forma rutinaria.
Cambios en la nomenclatura oncológica
Con las nuevas herramientas en los estudios de imágenes, y los nuevos conceptos anatómicos, surge una nueva terminología, que se debe estandarizar y manejar por todos los especialistas que intervienen en el manejo2. Nótese especialmente las diferentes posibilidades de estadiaje de acuerdo con la resonancia magnética (RM) en el preoperatorio. En la Tabla 1 se describen los términos actuales y sus abreviaturas, las cuales se utilizarán en esta revisión.
Tabla 1 Nomenclatura oncológica
| CRM: margen radial circunferencial |
| cTNM: estadiaje clínico según la AJCC |
| EMVI: invasión vascular extramural |
| FMR: fascia mesorrectal |
| IMS: inestabilidad microsatelital |
| mrTNM: estadiaje por RM |
| pTNM: estadiaje patológico definitivo |
| RC: respuesta completa |
| RL: recurrencia local. Reaparición del tumor dentro de los 5 años de seguimiento en la pelvis |
| SG: supervivencia global. Pacientes vivos a los 5 años de seguimiento |
| SLP: supervivencia libre de progresión |
| TME: escisión total del mesorrecto |
| TNT: terapia neoadyuvante total |
| ypTNM: estadiaje patológico definitivo en pieza irradiada |
| yTNM: estadiaje por imágenes después de la neoadyuvancia |
AJCC: American Joint Committe on Cancer; RM: resonancia magnética. Fuente: tabla realizada por autores
Cambios en las guías de orientación clínica
Las guías de referencia en cáncer han tenido cambios en sus actualizaciones. Existen dos principales, la del National Comprehensive Cancer Network (NCCN)3 y las guías de la European Society for Medical Oncology (ESMO)4. Al compararlas hay diferencias fundamentales en ambas. Las guías ESMO están teniendo mayor adherencia en los cirujanos recientemente, sin embargo, la mayoría de grupos en oncología sigue las pautas definidas en las guías NCCN.
Diferencias entre las recomendaciones de las guías del NCCN y las guías ESMO
Por años, en las guías NCCN (Figura 1), el estudio preoperatorio se basó en la ultrasonografía rectal (2004-2012), definido por el estudio de Sauer, en donde se indicó la ultrasonografía en todos los pacientes5. En la actualización del 2017 se sugirió la RM como el estudio preferible, y en la actualización de mayo del 2020, la RM simple de recto es el estudio de elección. La ultrasonografía rectal es solo para casos selectivos tempranos. En esta última actualización se tuvo en cuenta el CRM como un factor fundamental en la toma de decisiones para definir el manejo quirúrgico, la indicación y el tipo de neoadyuvancia, y como determinador de diferentes esquemas de quimioterapia2. La toma de decisiones se sigue basando en el TNM clásico, en donde el T3 sin subclasificar, el T4 y los ganglios positivos son la indicación principal de la quimiorradioterapia (QMRT) neoadyuvante.
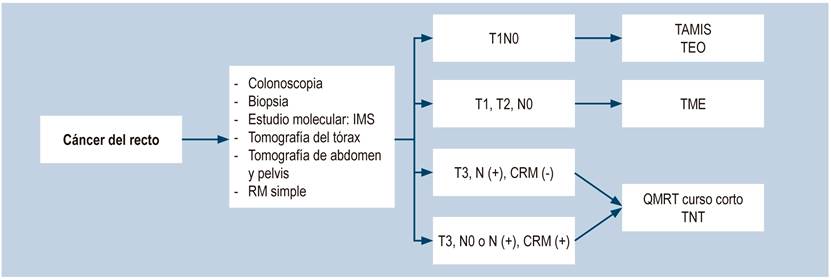
Figura 1 Recomendaciones del manejo de cáncer de recto según las guías del NCCN. CRM: margen radial circunferencial; IMS: inestabilidad microsatelital; N: estado ganglionar; QMRT: quimiorradioterapia; RM: resonancia magnética; T: tamaño tumor primario, TAMIS: cirugía transanal mínimamente invasiva; TEO: operación endoscópica transanal; TME: escisión total del mesorrecto; TNT: terapia neoadyuvante total. Tomado de3.
Las guías europeas ESMO (Figura 2) cambiaron los parámetros de la toma de decisiones, basados en los estudios Mercury6. El tamaño tumor primario (T) se subclasifica de acuerdo con la penetrancia en la grasa del mesorrecto anterior o posterior en T3a (< 1 mm), T3b (2-5 mm) T3c (> 5 mm), T3d (> 15 mm), y el CRM positivo o negativo determina la toma de decisiones; es decir, el estado nodal es importante, pero no lo primordial. El estadiaje se basa más en la subclasificación del T3 y del estado del CRM6,7. Los pacientes con T1, T2, T3a,b CRM (-) se pueden llevar directamente a cirugía, de acuerdo con estas guías.
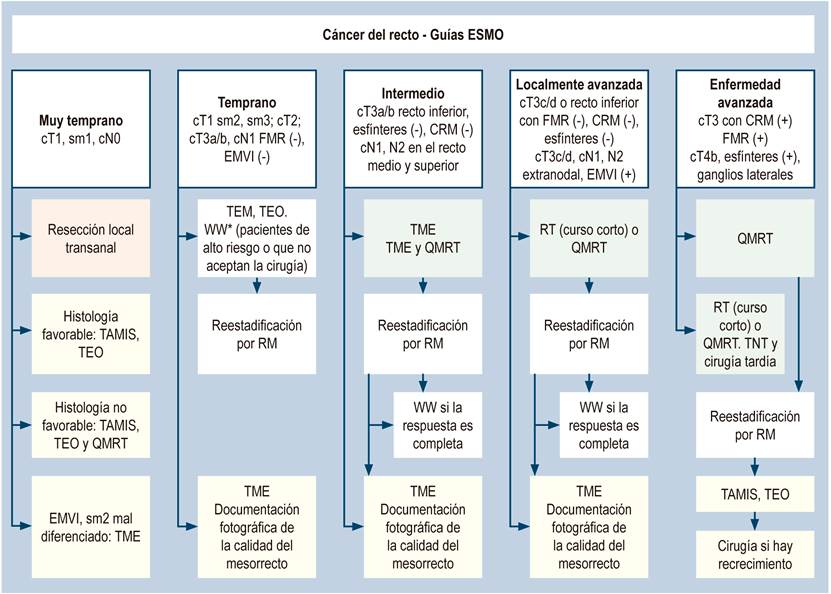
Figura 2 Recomendaciones para el manejo de cáncer de recto según la ESMO. cN: estado ganglionar clínico; CRM: margen radial circunferencial; cT: tamaño del tumor primario cínico; EMVI: invasión vascular extramural; FMR: fascia mesorrectal; QMRT: quimiorradioterapia; RM: resonancia magnética; sm: submucosa; TAMIS: cirugía transanal mínimamente invasiva; TEM: microcirugía endoscópica transanal; TME: escisión total del mesorrecto; TEO: operación endoscópica transanal; TNT: terapia neoadyuvante total; WW: observar y esperar. Fuente: ESMO rectal cancer guidelines.
En las guías ESMO, la neoadyuvancia se recomienda en T3c, T3d, T4 y CRM positivo o con riesgo de compromiso. Una buena técnica quirúrgica garantiza la resección de todos los ganglios bajo la TME, la cual se definió y estandarizó por Heald en 1986; y los ganglios positivos no son un factor absoluto para tomar las decisiones antes de operar8. El compromiso nodal positivo es importante en la toma de decisiones de neoadyuvancia, si es parte de un CRM positivo. Si el paciente tiene ganglios positivos en la RM, pero la FMR y el CRM son libres, esto no implica necesariamente enviar a QMRT al paciente. Esta es una diferencia fundamental en la guía ESMO.
Las guías ESMO y NCCN consideran las estrategias de preservación de órgano, en las que se pueden incluir pacientes con tumores clasificados como cT2N0M0 o cT3a y b de recto inferior para neoadyuvancia. La guía ESMO reconoce el protocolo “observar y esperar” (WW), reportado en Brasil hace más de 14 años por Habr-Gama y colaboradores, no solo como un protocolo que se sigue en grupos experimentales8, sino como una realidad a seguir, en donde se obtiene una respuesta clínica completa en 37 % a 50 % de los pacientes9,10.
Cambios en el diagnóstico anatómico
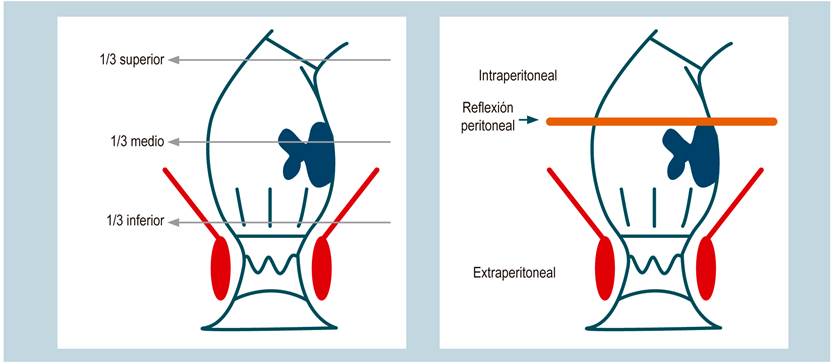
Ante un cáncer de recto se debe hacer un diagnóstico anatómico, que tradicionalmente se ha definido por el tercio en el que se localiza el tumor. El recto se divide en el tercio superior, medio e inferior. El tercio inferior va de 0 a 5 cm, el medio de 5 a 10 cm y el superior de 10 a 15 cm, desde el reborde anal. Es importante describir si el tumor se palpa al tacto rectal y si se siente fijo. Semiológicamente, la distancia en centímetros puede variar cuando se toma el colonoscopio, que es flexible, como instrumento de medida. Se ha descrito el uso de la rectosigmoidoscopia rígida para medir esa distancia, pero esta es una recomendación con poca adherencia. Es aconsejable, como herramienta, no solo definir la altura del tumor en centímetros, y su relación con las válvulas de Houston del recto durante la colonoscopia, sino establecer, por medio de la RM, la localización de la reflexión peritoneal y definir simplemente si el tumor es intraperitoneal o extraperitoneal, y si la reflexión peritoneal está comprometida.
El tercio inferior comprenderá el recto extraperitoneal, donde se evalúa el CRM; en el tercio medio, su cara anterior es intraperitoneal, y sus caras laterales y posterior son extraperitoneales, en este lugar se evaluará la FMR; mientras que el tercio superior es intraperitoneal. La distancia desde el reborde anal al tumor en centímetros, la localización y fijación del tumor por el tacto, la descripción colonoscópica y la RM con la valoración de la reflexión peritoneal determinarán el diagnóstico anatómico (Figura 3)11. Sin embargo, los tumores localizados en el tercio medio podrían tener un componente intraperitoneal y extraperitoneal. Este aspecto en particular será definitivo para determinar la decisión de neoadyuvancia y la técnica quirúrgica a desarrollar, es decir, una escisión total o parcial del mesorrecto.
Cambios en el manejo farmacológico por parte del oncólogo
El manejo se determina por el grado de invasión tisular del tumor (T3, T4), el número de ganglios y los bordes de sección negativos. Encontrar más de 12 ganglios era el medidor de calidad de una cirugía en cáncer de recto, mientras que menos de 12 ganglios se consideraba una cirugía incompleta, candidata a adyuvancia. En la actualidad, el oncólogo debe analizar los mismos factores que el radiólogo, el cirujano y el patólogo (el CRM, la calidad de la TME, y la presencia de EMVI). Desde el punto de vista de RL y SG, estos factores adicionales son los que más tienen impacto. Lo más interesante es que se pueden evaluar con la RM simple sin contraste desde el inicio del estudio del paciente, en la RM de seguimiento luego de la neoadyuvancia y confirmados en la patología definitiva12.
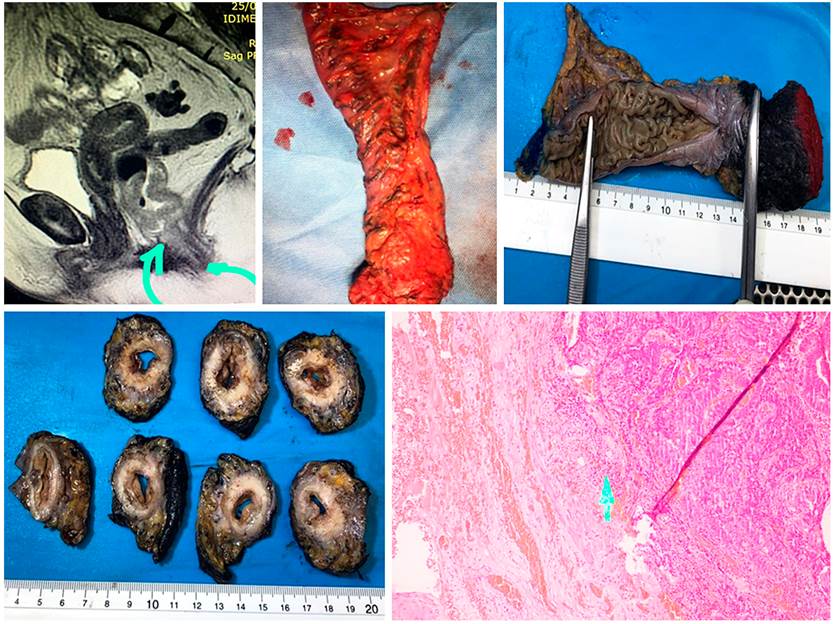
El margen radial, o rectal circunferencial (ambas definiciones son válidas), positivo es la presencia de tumor, de ganglio o de EMVI a menos de 1 mm del margen circunferencial en el recto inferior extraperitoneal. Ese borde se determina al revisar la FMR en la RM o en la tinta china en la patología. Si la medición es en el recto alto, esta corresponderá a FMR, si la medición es en el recto extraperitoneal, esta corresponderá a CRM. De estos factores, el que tiene valor pronóstico y afecta la RL y la SG es el CRM positivo dado por tumor (Figura 4)13,14.
Cambios en las imágenes de estadificación
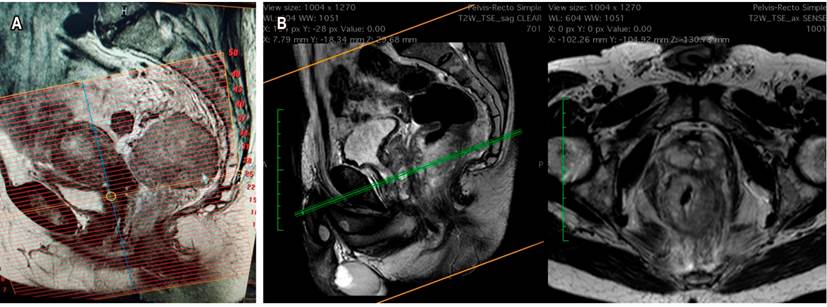
La RM simple con protocolo de recto es el examen principal para el estadiaje y para definir la subclasificación del T, el CRM y la presencia de EMVI. El recto inferior aporta otros parámetros, como la relación del tumor con el mecanismo esfinteriano externo y el surco interesfintérico. Reportar adecuadamente el CRM implica la descripción perfecta de la FMR. Reconocerla en las imágenes es lo que, en últimas, contribuye a establecer un estadiaje adecuado, a tomar las decisiones del manejo oncológico y a planear la técnica quirúrgica.
Si se tomó la decisión de neoadyuvancia por CRM positiva, o por riesgo de estarlo, la reestadificación se hace con una RM simple adicional, con evaluación de las secuencias de T2, de restricción a la difusión y el índice de regresión tumoral. Esta evaluación se hará dependiendo del tipo de neoadyuvancia que se realice: si es convencional, a las 6 semanas de haber terminado la radioterapia, pero si fue TNT (nuevo concepto), la medición se hará al terminar la quimioterapia de consolidación. Una de las dificultades frecuentemente encontradas en el estudio es que habitualmente se solicita como RM de pelvis. Si no se especifica y se solicita la RM con protocolo de recto, el técnico hará la alineación y la reconstrucción de las imágenes en forma inadecuada, y estas no serán perpendiculares al eje del recto y el tumor, lo que no permite evaluar correctamente la subclasificación del T. Es recomendable establecer, con su grupo de trabajo, la revisión de la técnica de reconstrucción de imágenes (Figura 5)14,15.
Cambios relacionados con la indicación de cirugía como tratamiento inicial
Los pacientes con estadificación preoperatoria que reportan T1N0M0 serían candidatos a TME o a una cirugía transanal mínimamente invasiva por alguna de las plataformas existentes: cirugía transanal mínimamente invasiva (TAMIS), operación endoscópica transanal (TEO) o microcirugía endoscópica transanal (TEM).
Los pacientes T2N0M0 del tercio inferior se pueden llevar a cirugía inicial, o ser candidatos para un protocolo de preservación de órgano, decisión que debe surgir en una junta multidisciplinaria, como parte de un programa de QMRT neoadyuvante más quimioterapia de consolidación (esto es el protocolo WW). Todos los pacientes con cáncer de tercio superior son candidatos a una cirugía inmediata, siempre y cuando en la RM no se describa compromiso de la reflexión peritoneal o riesgo de compromiso de la FMR. Asimismo, los pacientes con cáncer del tercio inferior, medio o tercio superior clasificados como T2 o T3a/b, CRM negativa, con FMR intacta y que el cirujano crea que es factible realizar una TME o una resección parcial del mesorrecto con 5 cm de margen distal, pueden ir a cirugía directamente.
La neoadyuvancia se reserva para los pacientes T3c/d y T4, aquellos con tumores con CRM positivo o en riesgo de compromiso del margen circunferencial y con extensión al surco interesfintérico, así como pacientes con ganglios positivos N1 seleccionados, N2 o laterales. Esto ha representado un cambio fundamental en el algoritmo de manejo; el estado nodal no es necesariamente quien determina la necesidad de la neoadyuvancia. Según las guías ESMO, la presencia de ganglios positivos en el tercio medio o superior, con la FMR libre, pueden llevarse a cirugía, lo que constituye una gran diferencia con las recomendaciones de las guías del NCCN, que envían a los pacientes a quimio y radioterapia primero. Los pacientes con cáncer de recto inferior, en los que su cirugía pueda implicar la realización de una resección abdomino perineal (RAP), o una resección coloanal interesfintérica, pueden tratarse con estrategia de preservación de órgano desde T2N0 en adelante, en la cual los nuevos esquemas de radiación y quimioterapia de consolidación pueden generar un porcentaje mayor de respuesta clínica completa o casi completa.
En la estrategia de preservación de órgano, la neoadyuvancia permite una respuesta clínica completa, que constituye el fundamento del WW; sin embargo, en ciertos casos podría dar una respuesta casi completa o una disminución del estadiaje en la T, escenario que se puede manejar con resección local, con abordaje de TAMIS o TEO, y que solo se debe realizar por grupos expertos en el manejo de cáncer de recto16,17. Este último abordaje en la respuesta casi completa luego de la neoadyuvancia aún se encuentra en discusión.
La respuesta clínica completa que observamos en nuestro medio está entre el 11 %-20 % al usar QMRT estándar. Los esquemas usados en Brasil son la QMRT extendida con 5400 centigray (cGY) y quimioterapia de consolidación a base de 5-fluoracilo o capecitabina oral18. Este esquema se indica en pacientes con estadificación preoperatoria desde T2N0M0 en adelante, quienes obtienen una RC de 50 %. La respuesta clínica completa luego de la TNT se ha reportado entre 50 % a 65 % de los pacientes en ciertos trabajos, como el estudio OPRA19; estos resultados no se veían con los algoritmos anteriores. Otros reportes informan una tasa global de 37 % de RC cuando se incluyen pacientes con estadios tempranos y localmente avanzados.
Cambios en la neoadyuvancia
La neoadyuvancia se indica en pacientes con cáncer de recto tercio superior con compromiso de la reflexión peritoneal, en pacientes con cáncer de recto tercio medio e inferior T3c/d, y T4, CRM y EMVI positivas, y en estrategia de preservación de órgano en el recto inferior en pacientes ≥ T2N0M020.
Existen varias definiciones que se deben aclarar en quimioterapia. La quimioterapia que se aplica como parte de la QMRT estándar se llama quimioterapia de sensibilización a base de 5-fluoracilo o capecitabina. Si se aplica un esquema completo antes de la radioterapia, esta se llama quimioterapia de inducción; si se aplica concomitante o después de la QMRT estándar se llama quimioterapia de consolidación. La quimioterapia de consolidación con 5- fluoracilo o capecitabina se usa en el protocolo de WW. El esquema con adición de oxaliplatino de 16 semanas usualmente se aplica cuando el estadiaje incluye n y CRM positivos, o T4 adicionalmente. La TNT agrupa todos los esquemas en donde la quimioterapia sistémica, que antes se aplicaba después de la cirugía, ahora se recibe antes de operar.
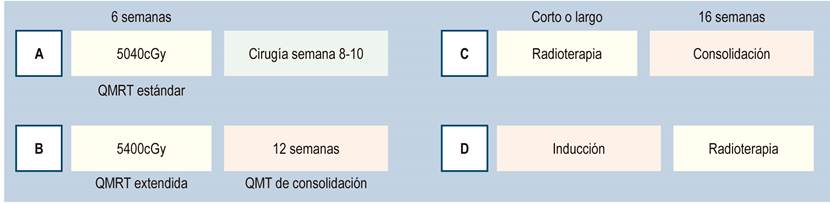
Los esquemas de radioterapia pueden ser de curso corto, en donde el paciente recibe 500 cGY por 5 días, para un total de 2500 cGY. Si se esperan 4 a 6 semanas se obtiene el mismo efecto biológico que el esquema largo convencional, siempre y cuando se aguarde al menos 6 a 8 semanas para llevar a cirugía. Si se usa como parte de la TNT, el paciente recibe la terapia de consolidación 15 días después de terminado el ciclo corto. El esquema largo de radioterapia estándar son 5040 cGY en 25 sesiones de 200 cGY por día, aplicado en 6 semanas. El esquema de Brasil aplica 5400 cGY, correspondientes a 4500 cGY de radioterapia externa y un refuerzo adicional (boost) de 900 cGY enfocados en el tumor. En términos prácticos son 2 días más de radioterapia, seguido de una quimioterapia de consolidación (Figura 6)18.
Cambios en el momento de operar
Los tumores T1 se tratan con TME o resección local vía transanal. Las lesiones T2, T3a/b del tercio medio e inferior deben ir a cirugía solo si es factible una TME. Si la lesión está en el recto inferior, y se considera esquema de preservación de órgano, se da QMRT extendida más consolidación. Se reevalúa al terminar la quimioterapia y, según los resultados, se toma la decisión de operar o de observar si se obtuvo una respuesta clínica completa. Si la respuesta es casi completa (concepto nuevo que debe discutirse), se puede extender la observación a 6 semanas para lograr una RC y hacer un salvamento de órgano21.
Uniendo los clásicos y nuevos conceptos ante un T3c/d, T4 de tercio medio e inferior tenemos las siguientes alternativas:
Esquema tradicional: QMRT de curso largo, se esperan 6 semanas y se reevalúa con RM. La cirugía se realiza entre la semana 8 a 12. Luego de esta se decide si hay quimioterapia adyuvante. Este es el esquema más usado de neoadyuvancia, cirugía y adyuvancia, que ya estamos abandonando.
Ante un tumor con alto riesgo de pérdida de esfínter es posible optar por un esquema de TNT con quimioterapia de consolidación de 4 meses, reevaluación con RM y cirugía que se realiza a los 6 meses. El esquema de la TNT se puede realizar con radioterapia de esquema corto o largo y con quimioterapia de inducción o de consolidación. En caso de RC se puede aplicar el protocolo WW para salvar el recto. Si la respuesta es casi completa se puede optar por una TME o por un abordaje transanal mínimamente invasivo, para lograr el objetivo de preservación.
Hay estudios que soportan cada una de estas opciones y otros en curso para definir la mejor estrategia con impacto en la RL y SG (estudios RAPIDO y OPRA). Reportes preliminares dan respuesta clínica completa entre el 50 % y 64 % de los casos22,23.
¿Qué cambió en la cirugía?
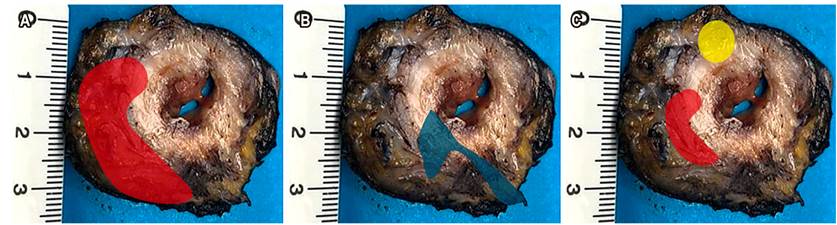
La cirugía ya no se define en términos de resección anterior, resección anterior baja o resección anterior ultrabaja. Actualmente se describe en términos de TME para tumores del tercio inferior, algunos del tercio medio con compromiso extraperitoneal y escisión mesorrectal específica o escisión parcial del mesorrecto (pME) para tumores del tercio superior o medio (intraperitoneales); en estos casos, el margen distal debe ser de 5 cm. El concepto de 2 cm de margen en el recto no irradiado, o de 1 cm de margen distal en rectos irradiados, es un concepto que hace referencia al margen de sección de la mucosa para los pacientes a quienes se les realiza TME (Figura 7)24. La TME se puede hacer por cirugía abierta, laparoscópica o robótica, dependiendo de la experticia del cirujano.
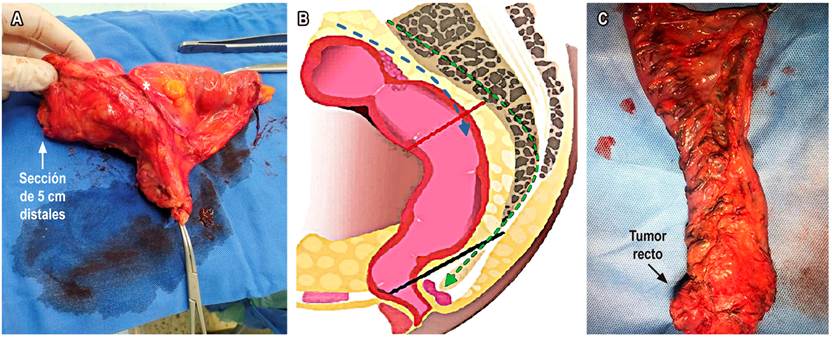
Figura 7 A. Escisión parcial o mesorrectal específica (*localización del tumor). B. Esquema de escisión mesorrectal. TME: líneas punteadas verdes hasta plano del elevador del ano (línea negra). pME específica: líneas punteadas azul hasta el borde de la sección distal (línea roja). C. TME. Fuente: archivo de los autores.
¿Cómo se define la TME?
En la TME se debe resecar completamente el meso del recto hasta el elevador del ano, por las fascias de fusión embriológicas de Waldeyer y Denonnvilier. La calidad de esta resección se debe evaluar por el cirujano y el patólogo. El informe histopatológico debe describir si la resección que se conoce como el plano mesocólico es completa, incompleta o intramuscular. Esta característica se ha definido como un factor pronóstico de recurrencia y SG.
En la última década se ha descrito una técnica de abordaje del mesorrecto por dos vías: abdominal y perineal en simultáneo. El abordaje transanal directo y transabdominal se conoce como TATA. Si el abordaje transanal se hace con una plataforma o dispositivo perianal de laparoscopia y se realiza la disección del mesorrecto del tercio inferior y se encuentra con el cirujano abdominal, la técnica se conoce como transanal total mesorrectal excision (TaTME)25. Es una opción quirúrgica en desarrollo para pacientes hombres obesos, donde hacer la TME hasta el elevador del ano no es fácil; además, esta técnica asegura el borde de sección distal26. Tiene defensores y detractores, y aún sus desenlaces oncológicos están en discusión15,27.
La evaluación de la presencia de adenopatías laterales es un concepto diferente en desarrollo y detectable solo por la RM. Estos ganglios externos a los vasos ilíacos actualmente se consideran como una enfermedad locorregional, y no hacen parte del vaciamiento convencional de una TME. Son de especial interés porque si se detectan por RM, y persisten aumentados de tamaño después de la radioterapia, tienen la indicación de una nueva cirugía, que se conoce como disección pélvica lateral (PLND). Los ganglios laterales son responsables de la recurrencia pélvica, si esta cirugía no se lleva a cabo28.
¿Qué cambió en la patología?
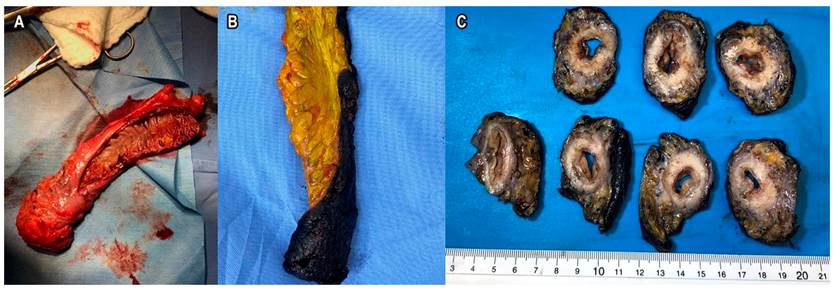
El procesamiento de la pieza quirúrgica en macro es tan importante como los hallazgos del estudio microscópico. Los cirujanos tienen la tendencia de abrir la pieza quirúrgica para verificar los bordes de sección seguros, sin embargo, esto dificulta técnicamente la evaluación del CRM por parte del patólogo. El escenario ideal es preservar la pieza en la zona del tumor, solo abrirla parcialmente para que el formol ingrese y que se puedan procesar los bordes correctamente. Esto permite medir la distancia en milímetros del T, el CRM, la distancia a la FMR, la invasión venosa extramural y la calidad del mesorrecto, todo esto, adicional a los ganglios, su número, el grado de diferenciación tumoral, el tamaño tumoral y el subtipo histológico. El informe de patología debe incluir, de forma detallada, la información previamente descrita (Figura 8)29.
Cambio en la biología molecular
Conocer la biología tumoral ayuda a determinar el pronóstico y el tratamiento. Hay dos maneras de estudiar las mutaciones: sobre la pieza y las biopsias, o en sangre, lo que se conoce como biopsias líquidas. En la biopsia y la pieza se determina si hay inestabilidad IMS, se miden la mutación en MSH, MLH y PMS2, y se mide el estado del KRAS: mutado o nativo.
Estos factores de importancia en el pronóstico direccionan al oncólogo sobre el uso o no de los quimioterapéuticos. La IMS se relaciona con una mala respuesta a las fluoropirimidinas, pero a un mejor pronóstico, y su presencia apoya el uso de la inmunoterapia. El perfil del ras permite saber si los biológicos, como los inhibidores del factor de crecimiento epidérmico (EGFR) se deben o no usar. En sangre, la medición de las nuevas vías de carcinogénesis, como BRAF, darán lineamientos de tratamiento. El estadiaje molecular ya es un estándar en el estudio de un paciente con cáncer de recto30.
Cambio en la toma de decisiones: junta multidisciplinaria
Es ideal que las decisiones se tomen por un equipo interdisciplinario1, el cual debe estar integrado por gastroenterología, cirugía colorrectal o gastrointestinal, radiología, oncología, radioterapia y patología. La existencia de esta junta ayudará a definir, desde el inicio, el manejo y la ruta para cada paciente (Figura 9).
Conclusiones
La evidencia reciente hace que el diagnóstico, el estadiaje locorregional y sistémico, y el tratamiento del cáncer de recto sean conocidos por todas las especialidades involucradas en su manejo. Se deben sumar esfuerzos desde las diferentes instituciones públicas y privadas, y los grupos de investigación y clínicos, para implementar las estrategias de abordaje diagnóstico y terapéutico aquí presentadas. Los cambios expuestos se encuentran en la Figura 10.
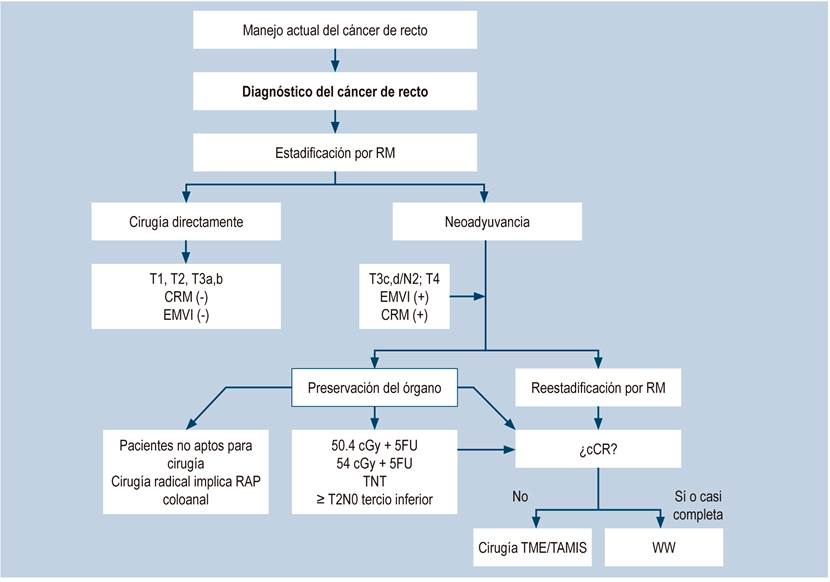
Figura 10 Diagrama de flujo para el manejo actual del cáncer de recto. 5FU: 5-fluoracilo; cCR: respuesta clínica completa; cGy: centigray; CRM: margen radial circunferencial; EMVI: invasión vascular extramural; RM: resonancia magnética; TAMIS: cirugía transanal mínimamente invasiva; TME: escisión total del mesorrecto; TNT: terapia neoadyuvante total; WW: observar y esperar. Fuente: diagrama realizado por autores.
REFERENCIAS
1. Situación del cáncer de colon y recto en Colombia 2018 [Internet]. Fondo Colombiano de Enfermedades de Alto Costo [consultado el 17 de agosto de 2020]. Disponible en: Disponible en: https://cuentadealtocosto.org/site/publicaciones/fact-sheet-situacion-del-cancer-de-colon-y-recto-en-colombia-2018/ [ Links ]
2. Dekker E, Tanis PJ, Vleugels JL, Kasi PM, Wallace MB. Colorectal cancer. Lancet. 2019;394(10207):1467-80. https://doi.org/10.1016/S0140-6736(19)32319-0 [ Links ]
3. Rectal cancer version 1 [Internet]. National Comprehensive Cancer Network; 2021 [consultado el 1 de agosto de 2021]. Disponible en: Disponible en: https://www.nccn.org/patients/guidelines/content/PDF/rectal-patient.pdf [ Links ]
4. Glynne-Jones R, Wyrwicz L, Tiret E, Brown G, Rödel C, Cervantes A, et al. Rectal cancer: ESMO clinical practice guidelines. Ann Oncol. 2017;28(4):iv22-iv40. https://doi.org/10.1093/annonc/mdx224 [ Links ]
5. Sauer R, Becker H, Hohenberger W, Rödel C, Wittekind C, Fietkau R, et al. Preoperative versus postoperative chemoradiotherapy for rectal cancer. N Engl J Med. 2004;351(17):1731-40. https://doi.org/10.1056/NEJMoa040694 [ Links ]
6. MERCURY Study Group. Extramural depth of tumor invasion at thin-section MR in patients with rectal cancer: results of the MERCURY study. Radiology. 2007;243(1):132-9. https://doi.org/10.1148/radiol.2431051825 [ Links ]
7. Patel A, Green N, Sarmah P, Langman G, Chandrakumaran K, Youssef H. The clinical significance of a pathologically positive lymph node at the circumferential resection margin in rectal cancer. Tech Coloproctol. 2019;23(2):151-9. https://doi.org/10.1007/s10151-019-01947-6 [ Links ]
8. Habr-Gama A, Pérez RO, Wynn G, Marks J, Kessler H, Gama-Rodrigues J. Complete clinical response after neoadjuvant chemoradiation therapy for distal rectal cancer: Characterization of clinical and endoscopic findings for standardization. Dis Colon Rectum. 2010;53(12):1692-8. https://doi.org/10.1007/DCR.0b013e3181f42b89 [ Links ]
9. Perez RO, Habr-Gama A, São Julião GP, Lynn PB, Sabbagh C, Proscurshim I, et al. Predicting complete response to neoadjuvant CRT for distal rectal cancer using sequential PET/CT imaging. Tech Coloproctol. 2014;18(8):699-708. https://doi.org/10.1007/s10151-013-1113-9. [ Links ]
10. Habr-Gama A, São Julião GP, Fernandez LM, Vailati BB, Andrade A, Araújo SE, et al. Achieving a complete clinical response after neoadjuvant chemoradiation that does not require surgical resection: It may take longer than you think! Dis Colon Rectum. 2019;62(7):802-8. https://doi.org/10.1097/DCR.0000000000001338 [ Links ]
11. D’Souza N, de Neree tot Babberich MP, d’Hoore A, Tiret E, Xynos E, Beets-Tan RG, et al. Definition of the rectum. Ann Surg. 2019;270(6):955-9. https://doi.org/10.1097/SLA.0000000000003251 [ Links ]
12. Horvat N, Carlos Tavares Rocha C, Clemente Oliveira B, Petkovska I, Gollub MJ. MRI of rectal cancer: Tumor staging, imaging techniques, and management. RadioGraphics. 2019;39(2):367-87. https://doi.org/10.1148/rg.2019180114 [ Links ]
13. Perez RO, Habr-Gama A, São Julião GP, Gama-Rodrigues J, Sousa AHS, Campos FG, et al. Optimal timing for assessment of tumor response to neoadjuvant chemoradiation in patients with rectal cancer: Do all patients benefit from waiting longer than 6 weeks? Int J Radiat Oncol Biol Phys. 2012;84(5):1159-65. https://doi.org/10.1016/j.ijrobp.2012.01.096 [ Links ]
14. Ortega CD, Pérez RO. Role of magnetic resonance imaging in organ-preserving strategies for the management of patients with rectal cancer. Insights Imaging. 2019;10(1):59. https://doi.org/10.1186/s13244-019-0742-6 [ Links ]
15. Perez RO, Habr-Gama A, São Julião GP, Proscurshim I, Neto AS, Gama-Rodrigues J. Transanal endoscopic microsurgery for residual rectal cancer after neoadjuvant chemoradiation therapy is associated with significant immediate pain and hospital readmission rates. Dis Colon Rectum. 2011;54(5):545-51. https://doi.org/10.1007/DCR.0b013e3182083b84 [ Links ]
16. Perez RO, Habr-Gama A, São Julião GP, Proscurshim I, Fernandez LM, de Azevedo RU, et al. Transanal endoscopic microsurgery (TEM) following neoadjuvant chemoradiation for rectal cancer: Outcomes of salvage resection for local recurrence. Ann Surg Oncol. 2015;23(4):1143-8. https://doi.org/10.1245/s10434-015-4977-2 [ Links ]
17. Habr-Gama A, Sabbaga J, Gama-Rodrigues J, São Julião GP, Proscurshim I, Bailão Aguilar P, et al. Watch and wait approach following extended neoadjuvant chemoradiation for distal rectal cancer. Dis Colon Rectum. 2013;56(10):1109-17. https://doi.org/10.1097/DCR.0b013e3182a25c4e [ Links ]
18. Habr-Gama A, Perez RO, São Julião GP, Proscurshim I, Fernandez LM, Figueiredo MN, et al. Consolidation chemotherapy during neoadjuvant chemoradiation (CRT) for distal rectal cancer leads to sustained decrease in tumor metabolism when compared to standard CRT regimen. Radiat Oncol. 2016;11:24. https://doi.org/10.1186/s13014-016-0598-6 [ Links ]
19. Garcia-Aguilar J, Patil S, Kim JK, Yuval JB, Thompson H, Verheij F, et al. Preliminary results of the organ preservation of rectal adenocarcinoma (OPRA) trial. J Clin Oncol. 2020;38(15):4008. https://doi.org/10.1200/jco.2020.38.15_suppl.4008 [ Links ]
20. Habr-Gama A, São Julião GP, Vailati BB, Sabbaga J, Aguilar PB, Fernandez LM, et al. Organ preservation in CT2N0 rectal cancer after neoadjuvant chemoradiation therapy. Ann Surg. 2019;269(1):102-7. https://doi.org/10.1097/SLA.0000000000002447 [ Links ]
21. Smith FML, Ahad A, Perez RO, Marks J, Bujko K, Heald RJ. Local excision techniques for rectal cancer after Neoadjuvant chemoradiotherapy: What are we doing? Dis Colon Rectum. 2017;60(2):228-39. https://doi.org/10.1097/DCR.0000000000000749 [ Links ]
22. van der Valk MJM, Marijnen CAM, van Etten B, Dijkstra EA, Hilling DE, Kranenbarg EMK, et al. Compliance and tolerability of short-course radiotherapy followed by preoperative chemotherapy and surgery for high-risk rectal cancer - Results of the international randomized RAPIDO-trial. Radiother Oncol. 2020;147:75-83. https://doi.org/10.1016/j.radonc.2020.03.011 [ Links ]
23. Yuval JB, Thompson HM, Garcia-Aguilar J. Organ preservation in rectal cancer. J Gastrointest Surg. 2020;24(8):1880-8. https://doi.org/10.1007/s11605-020-04583-w [ Links ]
24. Knol J, Keller DS. Total mesorectal excision technique - Past, present, and future. Clin Colon Rectal Surg. 2020;33(3):134-43. https://doi.org/10.1055/s-0039-3402776 [ Links ]
25. Sands D, Wexner SD. Transanal total mesorectal excision. Clin Colon Rectal Surg. 2020;33(3):111-2. https://doi.org/10.1055/s-0039-3402775 [ Links ]
26. Penna M, Hompes R, Arnold S, Wynn G, Austin R, Warusavitarne J, et al. Incidence and risk factors for anastomotic failure in 1594 patients treated BY transanal total mesorectal excision. Ann Surg. 2019;269(4):700-11. https://doi.org/10.1097/SLA.0000000000002653 [ Links ]
27. Oostendorp SE, Belgers HJ, Bootsma BT, Hol JC, Belt EJ, Bleeker W, et al. Locoregional recurrences after transanal total mesorectal excision of rectal cancer during implementation. Br J Surg. 2020;107(9):1211-20. https://doi.org/10.1002/bjs.11525 [ Links ]
28. Ogura A, Konishi T, Cunningham C, Garcia-Aguilar J, Iversen H, Toda S, et al. Neoadjuvant (chemo)radiotherapy with total mesorectal excision only is not sufficient to prevent lateral local recurrence in enlarged nodes: Results of the multicenter lateral node study of patients with low Ct3/4 rectal cancer. J Clin Oncol. 2019;37(1):33-43. https://doi.org/10.1200/JCO.18.00032 [ Links ]
29. Protocol for the examination of excisional biopsy specimens from patients with primary carcinoma of the colon and rectum [Internet]. College of American Pathologists [consultado el 22 de agosto de 2021]. Disponible en: Disponible en: https://documents.cap.org/protocols/cp-gilower-colonrectum-biopsy-20-4100.pdf [ Links ]
30. Salem ME, Puccini A, Tie J. Redefining colorectal cancer by tumor biology. Am Soc Clin Oncol Educ Book. 2020;(40):147-59. https://doi.org/10.1200/EDBK_279867 [ Links ]
Citación: Lombana LJ, Vargas-Rubio RD, Ariza A, Rúgeles-Quintero SJ. Cáncer de recto: tendencias y cambios en el manejo. Conceptos para el gastroenterólogo y el cirujano. Rev Colomb Gastroenterol. 2022;37(1):66-77. https://doi.org/10.22516/25007440.828
Recibido: 15 de Septiembre de 2021; Aprobado: 09 de Diciembre de 2021











 text in
text in