Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista colombiana de Gastroenterología
versión impresa ISSN 0120-9957versión On-line ISSN 2500-7440
Rev. colomb. Gastroenterol. vol.37 no.2 Bogotá ene./jun. 2022 Epub 23-Ago-2022
https://doi.org/10.22516/25007440.823
Trabajos originales
Hepatocarcinoma: experiencia de la vida real en un centro especializado de Bogotá, Colombia
1MD Specialist in Internal Medicine, Gastroenterology and Hepatology. Centro de enfermedades hepáticas y digestivas (CEHYD) - Center for Liver and Digestive Diseases Bogotá, Colombia.
2ND, MSc in Clinical Epidemiology. Researcher associated with the Equity in Health group of the Faculty of Medicine. Universidad Nacional de Colombia. Hospital Universitario Nacional de Colombia. Bogotá, Colombia.
3MD Specialist in Internal Medicine, Fellow Infectious Diseases Universidad Javeriana. Bogotá, Colombia.
4MD Specialist in General Surgery and Gastroenterology (CEHYD). Hospital Central de la Policía (HOCEN). Bogotá, Colombia.
5MD, MSc, PhD in Public Health. Leader of the Health Equity Group, School of Medicine, Universidad Nacional de Colombia. Hospital Universitario Nacional de Colombia. Bogotá, Colombia.
Introducción:
el hepatocarcinoma (HCC) es el tumor hepático primario maligno más frecuente en el mundo: en 2018 ocupó la sexta posición y representó la cuarta causa de muerte por cáncer; la supervivencia global a 5 años es del 18 %. La mayoría de los casos de HCC se desarrolla en pacientes con cirrosis de cualquier etiología, especialmente por virus de la hepatitis B y C, alcohol y, recientemente, por la esteatohepatitis no alcohólica (NASH).
Objetivo:
analizar las características clínicas, métodos de diagnóstico, tratamientos, variables pronósticas y supervivencia.
Metodología:
estudio descriptivo retrospectivo de una cohorte de pacientes con diagnóstico de cirrosis atendidos entre enero de 2011 y diciembre de 2020 en un centro de atención médica de Bogotá, con diagnóstico de HCC confirmado radiológicamente o por biopsia. La información se analizó de forma descriptiva con medidas de frecuencia absoluta en el caso de las variables categóricas; para las variables continuas se resumió la información con medidas de tendencia central (media o medianas) y su respectiva medida de dispersión.
Resultados:
se incluyeron 152 pacientes diagnosticados con HCC, con edad promedio de 69,4 años, 51,3 % eran hombres. La principal causa de HCC fue el hígado graso no alcohólico (NAFLD), que representó casi una tercera parte de los casos (32 %); otras causas fueron el alcohol (15 %) y el virus de la hepatitis C (14 %). La mediana de presentación del tumor fue de 2 nódulos con un tamaño cercano a 4 cm. El 35 % de los pacientes tenía un estadio BCLC (Barcelona Clinic Liver Cancer) con opciones curativas y el 25 % de los pacientes recibió opciones curativas de tratamiento. La terapia sistémica de primera línea utilizada en esta cohorte fue el sorafenib®, que se utilizó en 35 pacientes (33,7 %). Las curvas de supervivencia mostraron que las mujeres, el estadio Child-Pugh A y el estadio BCLC 0 presentaron mayores medianas de supervivencia. El análisis multivariado evidenció un mayor riesgo de muerte al ser hombre (Hazard ratio [HR]: 2,16; intervalo de confianza [IC]: 1,24 a 3,76), estar en los estadios Child-Pugh B (HR: 2,14; IC: 1,16 a 3,95) y Child-Pugh C (HR: 7,52; IC: 2,88 a 19,57).
Conclusiones:
el NAFLD es la principal causa de HCC en la presente cohorte, una tercera parte de los pacientes se diagnostica en estadios BCLC tempranos con opción curativa de tratamiento, y un 25 % se trata con terapias curativas. El sorafenib fue la terapia de primera línea en HCC avanzado. La supervivencia global luego del diagnóstico de HCC sigue siendo baja, y es necesario aunar esfuerzos en el seguimiento de los pacientes con cirrosis para mejorar estos resultados.
Palabras clave: Hepatocarcinoma; vida real; supervivencia; sorafenib
Introduction:
Hepatocellular carcinoma (HCC) is the most frequent malignant primary liver tumor globally. In 2018, it ranked sixth and represented the fourth cause of death from cancer; the five-year overall survival is 18 %. Most cases of HCC develop in patients with cirrhosis of any etiology, especially because of hepatitis B and C viruses, alcohol, and recently nonalcoholic steatohepatitis (NASH).
Aim:
To analyze the clinical characteristics, diagnostic methods, treatments, prognostic variables, and survival.
Materials and methods:
This retrospective descriptive study was conducted on a cohort of patients diagnosed with cirrhosis and treated between January 2011 and December 2020 at a health care center in Bogotá. The diagnosis of HCC was confirmed radiologically or by biopsy. We analyzed the information descriptively with absolute frequency measures in the case of categorical variables. For continuous variables, the information was summarized with measures of central tendency (mean or median) and their relevant measures of dispersion.
Results:
We included 152 patients diagnosed with HCC, with a mean age of 69.4 years; 51.3 % were men. The leading cause of HCC was nonalcoholic fatty liver disease (NAFLD), which accounted for almost a third of cases (32 %); other causes were alcohol (15 %) and hepatitis C virus (14 %). The median manifestation of the tumor was two nodules with a size close to 4 cm. Besides, 35 % of patients had a BCLC (Barcelona Clinic Liver Cancer) stage with curative options, and 25 % received curative treatment options. The first-line systemic therapy used in this cohort was sorafenib®, used in 35 patients (33.7 %). Survival curves showed that women, Child-Pugh class A, and BCLC stage 0 had higher median survival. Multivariate analysis showed a higher risk of death for males (hazard ratio [HR]: 2.16; confidence interval [CI]: 1.24-3.76), Child-Pugh class B (HR: 2.14; CI 1.16-3.95), and Child-Pugh class C (HR: 7.52; CI 2.88-19.57).
Conclusions:
NAFLD is the leading cause of HCC in this cohort. A third of patients are diagnosed in early BCLC stages with a curative treatment option, and 25 % are treated with curative therapies. Sorafenib was the first-line therapy in advanced HCC. Overall survival after diagnosis of HCC remains low, being necessary to join forces in the follow-up of patients with cirrhosis to improve these outcomes.
Keywords: Hepatocellular carcinoma; real life; survival; sorafenib
Introducción
El carcinoma hepatocelular (CHC) o hepatocarcinoma (HCC) es el tumor hepático primario maligno más frecuente en el mundo: en 2018 fue el sexto cáncer más diagnosticado y representó la cuarta causa de muerte por cáncer, 841 000 casos nuevos y 782 000 muertes, respectivamente1. En los hombres, la incidencia y la mortalidad son 2 a 3 veces más altas en la mayoría de las regiones del mundo, y representa el quinto lugar en cuanto a casos globales y la segunda causa de muerte1,2. La supervivencia global a 5 años es del 18 %3. El 72 % de los casos de HCC se presenta en Asia, 10 % en Europa, 8 % en África y 5 % en Norteamérica y Latinoamérica; estas diferencias en prevalencia se explican por diferencias etiológicas zonales1,4. En Colombia, entre 2007 y 2013 ocupó el séptimo lugar de mortalidad con una prevalencia de 2,8 a 3,2/100 000 habitantes, y dentro de 234 763 muertes por cáncer fue responsable de más de 10 000 de ellas5.
La cirrosis de cualquier etiología tiene una prevalencia de 85 % a 95 % en los pacientes con HCC6,7, y representa un importante factor de riesgo en la aparición del tumor. Se estima una tasa de incidencia de HCC en pacientes con cirrosis de 2 % a 4 % por año8 y se considera que cerca de un tercio de los pacientes con cirrosis desarrollará HCC en algún momento de la vida9. A nivel mundial, aproximadamente el 90 % de los HCC se asocia con una etiología conocida2,10, 54 % de los casos se atribuye a la infección crónica por virus de la hepatitis B (VHB), 31 % a la infección por el virus de la hepatitis C (VHC) y el 15 % a otras causas como ingesta de alcohol y exposición a aflatoxinas; sin embargo, estos cálculos son estimaciones aproximadas que no reflejan comorbilidades y es probable que subestimen el impacto de la esteatohepatitis no alcohólica (NASH)/síndrome metabólico10. Datos recientes de Estados Unidos muestran que el hígado graso no alcohólico (NAFLD) en su forma de NASH y el síndrome metabólico contribuyen más a la carga del HCC que cualquier otro factor de riesgo, incluso la infección por el VHC11, debido principalmente a la alta prevalencia de NAFLD en la población en general.
Los estudios radiológicos son esenciales para el diagnóstico de los tumores hepáticos y contribuyen a su tipificación y estadificación. El diagnóstico por radiología no invasiva de HCC en el contexto de un paciente con cirrosis se aceptó en 2001, cuando las imágenes dinámicas demostraron el patrón típico12, que se actualizo en 200513, y que es el resultado del trastorno vascular característico que se produce durante la carcinogénesis hepática14, más una alta probabilidad pretest de HCC previa a la prueba en el contexto de la cirrosis. Los hallazgos típicos son la combinación de hipervascularidad en la fase arterial tardía, definida como hiperrealce de la fase arterial (APHE), según la clasificación LI-RADS (Liver Imaging Reporting and Data System), y lavado en las fases venosa portal o retardada14-16.
En pacientes con alto riesgo de desarrollar HCC (cirrosis más VHB o VHC, entre otros) y presencia de una o más lesiones, el diagnóstico se puede hacer con tomografía axial computarizada (TAC) contrastada y dinámica o imágenes por resonancia nuclear magnética (RNM) con protocolos de lesión hepática, si la lesión muestra criterios imagenológicos y es leída como LI-RADS 5 (LR 5) conclusiva de HCC. La ecografía abdominal con contraste también se puede utilizar para lesiones solitarias si la modalidad está disponible, aunque es más utilizada en Europa, en centros especializados15,16. Los pacientes de alto riesgo que no presentan lesiones hepáticas pueden ser seguidos periódicamente mediante ecografía con o sin niveles de alfafetoproteína (AFP) cada 6 meses15-17.
El sistema de estadificación Barcelona Clinic Liver Cancer (BCLC) ha sido es más utilizado para el enfoque del HCC18, y clasifica a los pacientes en 5 categorías o estadios (0, A, B, C y D) de acuerdo con las recomendaciones de tratamiento y supervivencia. Los estadios 0 y A tienen opciones de tratamiento curativas, con supervivencias mayores de 5 años. En los estadios B y C (intermedio y avanzado), las posibilidades terapéuticas están enfocadas en frenar la progresión de la enfermedad con supervivencias entre 1 y 5 años, y el estadio D (terminal) recibe cuidados paliativos con supervivencia cercana a 3 meses19.
Presentamos una cohorte de pacientes con diagnóstico de HCC seguidos durante un período de 10 años en un centro especializado de Bogotá D. C. con el objetivo principal de analizar las características clínicas, métodos de diagnóstico, tratamientos, variables pronósticas y supervivencia.
Metodología
Estudio descriptivo retrospectivo de una cohorte de pacientes atendidos entre enero de 2011 y diciembre de 2020 en el Centro de Enfermedades Hepáticas y Digestivas (CEHYD), de la ciudad de Bogotá. Como criterios de inclusión se tuvieron en cuenta el diagnóstico confirmado de cirrosis y el diagnóstico concomitante de HCC, confirmado radiológicamente o mediante biopsia hepática. Radiológicamente, se definió HCC por TAC o RNM antes de 2016, a una lesión hipercaptante en fase arterial y con lavado en fase venosa portal o tardía informados en la imagen8,13. A partir de 2016 se empleó el sistema de datos e informes de imágenes del hígado LI-RADS (sistema de terminología y criterios estandarizados para interpretar y notificar los resultados de los exámenes de TAC y RNM del hígado, en pacientes con cirrosis o con mayor riesgo de HCC)20, y se requirió una lectura LI-RADS 5.
Se revisaron las historias clínicas de los pacientes que cumplieron los criterios de inclusión, tabulando los antecedentes clínicos, los datos de laboratorio y la estadificación Child-Pugh de cada paciente. Con respecto al tumor, se tabuló su causa, tamaño máximo en cm de acuerdo con el nódulo de mayor dimensión, número de nódulos, presencia de invasión vascular, invasión extrahepática, principal tratamiento utilizado, cantidad de sesiones de ablación o quimioembolización transarterial (TACE), duración en meses del tratamiento con sorafenib como terapia sistémica e indicación o no de tratamiento paliativo.
La información se analizó de forma descriptiva con medidas de frecuencia absoluta en el caso de las variables categóricas, en las que se utilizaron las pruebas de Pearson o exacta de Fisher para evaluar la existencia de diferencias entre dos grupos. Para las variables continuas se resumió la información con medidas de tendencia central (media o medianas) y su respectiva medida de dispersión según la normalidad en la distribución de cada variable, evaluada mediante la prueba de Shapiro-Wilk. Adicionalmente, se usó la prueba t y Mann-Whitney para evaluar diferencias entre dos grupos para estimaciones de medias y medianas, respectivamente.
Se realizó una evaluación de la supervivencia mediante el análisis de Kaplan Meier, así como un análisis univariado y multivariado de riesgos proporcionales de Cox. El tiempo 0 fue la fecha del diagnóstico de cirrosis, primera descompensación o del diagnóstico de HCC; el tiempo del evento fue la fecha de muerte. Los pacientes fueron censurados a la fecha de la última valoración. Todos los análisis se realizaron con el paquete estadístico Stata versión 13.
Consideraciones éticas
Este proyecto fue evaluado y aprobado por el comité de ética de la Facultad de Medicina de la Universidad de Nacional de Colombia, sede Bogotá (acta n.° 009-073 del 13 de mayo de 2021).
Resultados
Al analizar la cohorte de pacientes con cirrosis y HCC, se consideraron inicialmente 238 pacientes, se descartaron 86 por diagnóstico inconcluso o ausencia de datos completos de la historia clínica. Se incluyeron finalmente 152 pacientes diagnosticados con HCC, con una edad promedio de 69,4 años, de los cuales el 51,3 % eran hombres. Las características clínicas y de laboratorio se muestran en la Tabla 1.
Tabla 1 Características generales de los pacientes con HCC
| Variable | Total, n = 152 n ( %) | Mujeres n = 74 (48,6) n ( %) | Hombres n = 78 (51,3) n ( %) | Valor p |
|---|---|---|---|---|
| Edad al diagnóstico | Media (DE) | |||
| 69,4 (9,4) | 70,9 (8,4) | 67,9 (10,0) | 0,054* | |
| Antecedentes | n (%) | |||
| - Consumo de alcohol | 72 (47,4) | 7 (9,5) | 65 (83,4) | < 0,001** |
| - DM | 62 (40,7) | 28 (37,8) | 34 (43,5) | 0,471*** |
| - HTA | 61 (40,1) | 31 (41,8) | 30 (38,4) | 0,666*** |
| - Obesidad | 49 (32,2) | 25 (33,7) | 24 (30,7) | 0,691*** |
| - Dislipidemia | 23 (15,1) | 8 (10,8) | 15 (19,2) | 0,148*** |
| - Enfermedad coronaria | 15 (9,8) | 5 (6,7) | 10 (12,8) | 0,279** |
| Laboratorios (n = 151) | Me (IQR) | |||
| - Leucocitos | 5610 (4490-6990) | 5050 (4075-6462) | 5830 (4835-7870) | 0,0019**** |
| - Neutrófilos (%) | 56 (50-66) | 55 (50-65) | 56 (49-66) | 0,945**** |
| - Linfocitos (%) | 28 (21-34) | 30 (21-35) | 27 (20-34) | 0,436**** |
| - Plaquetas | 130k (91k-176k) | 132,5k (91,7k-170k) | 127k (90k-186k) | 0,968**** |
| - AST | 61 (41,7-100,7) | 61 (42-92,7) | 63,5 (40,2-114) | 0,504**** |
| - ALT | 49 (34-74) | 48 (28-68) | 52 (37-75) | 0,083**** |
| - GGT | 164 (106-259) | 150 (92-245) | 190 (122-283) | 0,032**** |
| - Fosfatasa alcalina | 166 (117-260) | 158 (118-232) | 190 (115-280) | 0,299**** |
| - INR | 1,1 (1-1,3) | 1,1 (1-1,3) | 1,1 (1-1,2) | 0,196**** |
| - Bilirrubina total | 1,2 (0,8-2) | 1,1 (0,8-1,9) | 1,3 (0,8-2,2) | 0,216**** |
| - Albúmina | 3,7 (3,1-4) | 3,7 (3,1-4) | 3,6 (3-4,1) | 0,869**** |
| - AFP | 25,5 (5- 466) | 20 (5-245) | 27 (5-855) | 0,89**** |
| Várices esofágicas | n ( %) | |||
| - No | 59 (38,8) | 31 (41,9) | 28 (35,9) | 0,745*** |
| - Pequeñas | 34 (22,4) | 16 (21,6) | 18 (32,1) | |
| - Grandes | 59 (38,8) | 27 (36,5) | 32 (41) | |
| Child-Pugh (n = 143) | n ( %) | |||
| - A | 65 (45,5) | 30 (43,5) | 35 (47,3) | 0,864*** |
| - B | 63 (44,0) | 32 (46,4) | 31 (41,9) | |
| - C | 15 (10,5) | 7 (10,1) | 8 (10,8) | |
* Prueba T de dos muestras con varianzas iguales.
**Prueba exacta de Fisher.
***Chi2 de Pearson.
**** Suma de rangos de Wilcoxon (U de Mann-Whitney).
ALT: alanina-aminotransferasa; AST: aspartato-aminotransferasa; GGT: γ-glutamiltransferasa; DE: desviación estándar; DM: diabetes mellitus; HTA: hipertensión arterial; INR: índice internacional normalizado; IQR: rango intercuartílico (p25-p75); Me = mediana.
La principal causa del HCC fue el NAFLD, en su forma de NASH, que representó casi una tercera parte de los casos (32 %), más frecuente aun en el grupo de mujeres donde alcanzó un 39 % de los casos. En los hombres, la principal causa fue el alcohol seguido de NASH (29,4 % y 25,6 %, respectivamente) (Tabla 2).
Tabla 2 Características del HCC
| Variable | Total n = 152 n (%) | Mujeres n = 74 (48,6) n ( %) | Hombres n = 78 (51,3) n (%) | Valor p |
|---|---|---|---|---|
| Causas del HCC | n (%) | < 0,001* | ||
| - NASH | 49 (32,2) | 29 (39,1) | 20 (25,6) | |
| - Alcohol | 24 (15,7) | 1 (1,3) | 23 (29,4) | |
| - VHC | 21 (13,8) | 16 (21,6) | 5 (6,4) | |
| - NASH + alcohol | 17 (11,1) | 1 (1,3) | 16 (20,5) | |
| - Colestásica | 13 (8,5) | 11 (14,9) | 2 (2,6) | |
| - Otras | 28 (18,4) | 16 (21,6) | 12 (15,38) | |
| Datos del HCC | Me (IQR) | |||
| Cantidad de nódulos | 2 (1-3) | 1 (2-3) | 1 (1-3) | 0,0021** |
| Tamaño en cm | 3,85 (2,2-7) | 3,4 (2-7,2) | 4 (2,7-7) | 0,34** |
| Estadio BCLC | n (%) | |||
| - 0 | 10 (6,5) | 6 (8,1) | 4 (5,1) | 0,407* |
| - A | 45 (29,6) | 26 (35,4) | 19 (24,3) | |
| - B | 49 (32,2) | 22 (29,7) | 27 (34,6) | |
| - C | 35 (23,0) | 16 (21,6) | 19 (24,36) | |
| - D | 13 (8,5) | 4 (5,4) | 9 (11,5) | |
| Estado final | n (%) | |||
| - Muerto | 95 (62,5) | 42 (56,8) | 53 (67,9) | 0,154* |
| - Vivo | 57 (37,5) | 32 (43,2) | 25 (32,1) | |
*Prueba exacta de Fisher.
**Suma de rangos de Wilcoxon (U de Mann-Whitney).
Con respecto al tumor, la mediana de presentación fue de 2 nódulos con un tamaño cercano a 4 cm. Con base en el sistema BCLC, el 35 % de los pacientes tenía un estadio con opciones curativas (Tabla 2), el 25 % de los pacientes recibió opciones curativas de tratamiento y, de ellos, 11 pacientes fueron trasplantados (Tabla 3). La terapia sistémica de primera línea utilizada en esta cohorte fue el sorafenib, que se utilizó en 35 pacientes (33,7 %) como tratamiento principal, otros 14 pacientes lo recibieron como tratamiento secundario, para un total de 49 pacientes tratados; de ellos, 15 reportaron efectos colaterales, los más frecuentes fueron el síndrome mano-pie, diarrea y otros gastrointestinales. En un paciente tratado con sorafenib se presentó un sangrado varicoso (Tabla 3). El 17,3 % de los pacientes recibió TACE y el 13,4 %, cuidados paliativos como tratamiento principal no curativo.
Tabla 3 Tratamiento del HCC
| Variable | Total n = 104 n (%) | Mujeres n = 49 n (%) | Hombres n = 55 n (%) | Valor p |
|---|---|---|---|---|
| Tratamiento principal | ||||
| - Trasplante | 11 (10,6) | 3 (6,1) | 8 (14,5) | 0,051* |
| - Radioablación | 26 (25) | 18 (36,7) | 8 (14,5) | |
| - TACE | 18 (17,3) | 10 (20,4) | 8 (14,6) | |
| - Sorafenib | 35 (33,7) | 13 (26,5) | 22 (40) | |
| - Paliativo | 14 (13,4) | 5 (10,2) | 9 (16,4) | |
| Me (IQR) | ||||
| Sesiones de radioablación | 1 (1-2) | 1 (1-2,5) | 1 (1-1,5) | 0,3106** |
| Sesiones con TACE | 1 (1-2) | 1 (1-2,2) | 2 (1-2) | 0,591** |
| Meses con sorafenib | 4 (2,25-8) | 4 (3-10) | 4 (2-8) | 0,779** |
| Efectos colaterales de sorafenib | n = 15 | n = 7 | n = 8 | 0,627* |
| - Síndrome mano-pie | 6 (40,0) | 4 (57,1) | 2 (25) | |
| - Diarrea | 2 (13,3) | 1 (14,3) | 1 (12,5) | |
| - Otros dermatológicos | 1 (6,6) | 0 | 1 (12,5) | |
| - Sangrado durante la toma | 2 (13,3) | 0 | 2 (25) | |
| - Otros gastrointestinales | 3 (20,0) | 1 (14,3) | 2 (25) | |
| - Otros | 1 (6,6) | 1 (14,3) | 0 | |
*Prueba exacta de Fisher.
** Suma de rangos de Wilcoxon (U de Mann-Whitney).
Los resultados del análisis de supervivencia se detallan en la Tabla 4. Se evidenció 1,2, 2,4 y 3,2 muertes en 100 pacientes en un mes después del diagnóstico de cirrosis, primera descompensación y diagnóstico de HCC, respectivamente. Las curvas de supervivencia desde el diagnóstico de HCC por Child-Pugh, estadio BCLC y tratamiento principal presentaron diferencias significativas (Figuras 1 y 2). Los grupos de mujeres, Child-Pugh A y estadio BCLC 0 presentaron mayores medianas de supervivencia (Figura 1), así como los pacientes con tratamientos de trasplante y radioablación (Figura 2), todos con diferencias estadísticamente significativas.
Tabla 4 Análisis de supervivencia
| Tasa de incidencia * 100 (IC 95 %) | Mediana de supervivencia (meses) | Percentil 25 %-percentil 75 % (meses) | |
|---|---|---|---|
| Diagnóstico de cirrosis | 1,2 (0,9 a 1,4) | 49,8 | 17,1 - 158,9 |
| Primera descompensación | 2,4 (2,0 a 3,0) | 26,3 | 8,8-63,3 |
| Diagnóstico de HCC | 3,2 (2,6 a 3,9) | 15,9 | 6,4-50,2 |
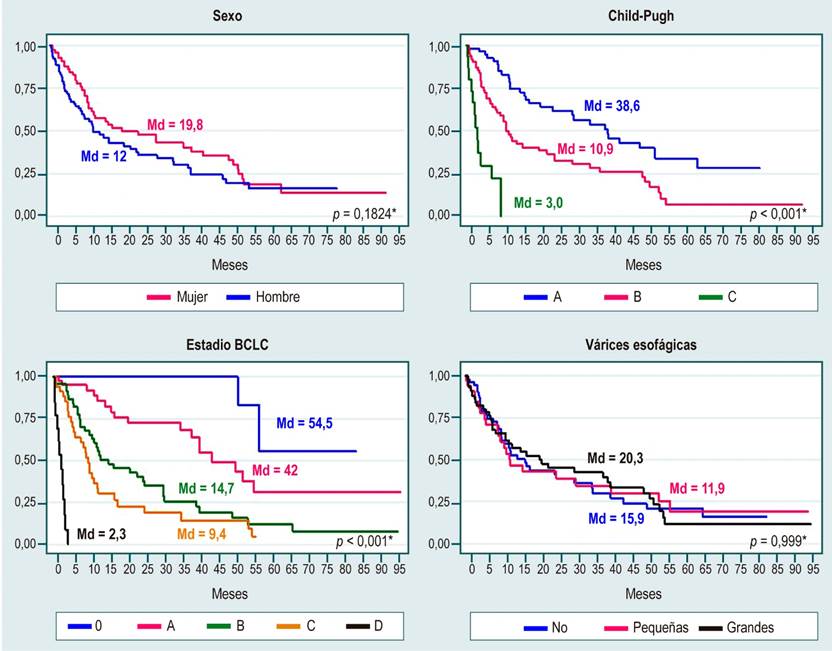
Figura 1 Curvas de supervivencia del riesgo de muerte desde el diagnóstico de HCC por sexo, Child-Pugh, estadio BCLC y várices esofágicas. Estimados de supervivencia de Kaplan-Meier. *Prueba de rango de registro para la igualdad de funciones de supervivencia. Md: mediana.
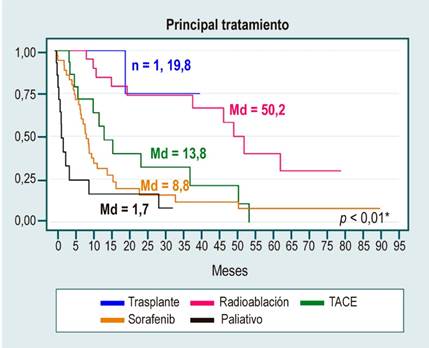
Figura 2 Curvas de supervivencia del riesgo de muerte desde el diagnóstico de hepatocarcinoma por tratamiento principal. Trasplante= 1 paciente falleció posteriormente al trasplante. Estimados de supervivencia de Kaplan-Meier. *Prueba de rango de registro para la igualdad de funciones de supervivencia. Md: mediana.
El análisis multivariado (Tabla 5) evidenció un mayor riesgo de muerte desde el diagnóstico de HCC al ser hombre (Hazard ratio [HR]: 2;16; intervalo de confianza [IC]: 1,24-3,76), estar en los estadios Child-Pugh B (HR: 2,14; IC: 1,16 a 3,95) y Child-Pugh C (HR: 7,52; IC: 2,88 a 19,57), y haber sido tratado con ablación (HR: 4,27; IC: 0,51 a 35,73), TACE (HR: 10,74; IC: 1,35 a 84,85), sorafenib (HR: 17,59; IC: 2,31 a 133,79) y cuidados paliativos (HR: 25,93; IC: 3,17 a 211,48).
Tabla 5 Análisis univariado y multivariado del riesgo de muerte desde el diagnóstico de HCC
| Análisis univariado HR (IC 95 %) | Análisis multivariado HR (IC 95 %) | |||
|---|---|---|---|---|
| >Sexo | ||||
| - Mujeres | Referencia | Referencia | ||
| - Hombres | 1,31 (0,87 a 1,97) | 2,16 (1,24 a 3,76)* | ||
| Child-Pugh al diagnóstico HCC | ||||
| - A | Referencia | Referencia | ||
| - B | 2,23 (1,41 a 3,54)* | 2,14 (1,16 a 3,95)* | ||
| - C | 11,39 (5,52 a 23,50)* | 7,52 (2,88 a 19,57)* | ||
| Estadio BCLC | ||||
| - 0 | Referencia | *** | ||
| - A | 2,75 (0,63 a 11,97) | |||
| - B | 7,03 (1,67 a 29,55)* | |||
| - C | 10,89 (2,56 a 46,34)* | |||
| - D | 146,92 (28,79 a 749,58)** | |||
| Várices esofágicas | ||||
| - No | Referencia | Referencia | ||
| - Pequeñas | 0,98 (0,58 a 1,68) | 0,64 (0,29 a 1,37) | ||
| - Grandes | 0,99 (0,62 a 1,57) | 1,18 (0,65 a 2,13) | ||
| Por tratamiento principal | ||||
| - Trasplante**** | Referencia | Referencia | ||
| - Radioablación | 2,20 (0,27 a 17,37) | 4,27 (0,51 a 35,73) | ||
| - TACE | 6,47 (0,83 a 49,95) | 10,74 (1,35 a 84,85)*± | ||
| - Sorafenib | 9,40 (1,27 a 69,19)* | 17,59 (2,31 a 133,79)*± | ||
| - Paliativo | 22,25 (2,88 a 171,79)* | 25,93 (3,17 a 211,48)*± | ||
*p < 0,05.
** Estimador impreciso debido al número de pacientes en este grupo (n = 13).
***Variable no incluida en el análisis multivariado debido a los estimadores imprecisos.
****1 paciente falleció posteriormente al trasplante. ± Estimadores imprecisos debido al número de pacientes incluidos.
Discusión
Se presenta la experiencia de un centro especializado en hepatología. La edad promedio de los pacientes en esta cohorte concuerda con la reportada en las guías europeas (70 años)16, y es similar a la registrada en una serie latinoamericana (64 años)21. En esta investigación, el 51 % de los pacientes fueron hombres, mostrando una relación casi 1:1 con las mujeres, dato que contrasta con la literatura internacional, en la que la relación favorece a los hombres 2 a 3 veces1,2, como lo muestra White en una serie con 236 290 casos de HCC diagnosticados entre el 2000 y 2012 en Estados Unidos, donde encontró que el 73 % eran hombres22 y estas cifras se explican fundamentalmente por la epidemia de VHC; nosotros diagnosticamos más hígado graso y alcohol, y proporcionalmente menos VHC, lo que concuerda con la tendencia mostrada en los registros nacionales5, y que podría explicar la relación hombre-mujer encontrada en nuestra investigación.
En esta cohorte, la principal causa del HCC fue el NAFLD en su forma de NASH, con antecedentes asociados con el síndrome metabólico entre un 15 % y un 40 %. En un estudio de cirrosis publicada en 2016 con 419 pacientes, el hígado graso fue igualmente la principal causa de cirrosis (25 %)23; en la actualidad, esta cohorte de pacientes cirróticos en seguimiento alcanza 1800 pacientes y el hígado graso sigue siendo la principal causa24. En otra cohorte de pacientes colombianos, se muestra como primera y segunda causa de HCC el alcohol y el NASH, respectivamente25, comportamiento similar a los datos de este estudio en el grupo de los hombres.
La serie latinoamericana de HCC con 1336 pacientes muestra como causas de HCC al VHC (48 %), seguido de la cirrosis alcohólica (22 %), la infección por VHB (14 %) y el hígado graso (9 %)21. Sin embargo, es fundamental mencionar que, en un metaanálisis con más de 8 millones de personas incluidas, se estimó que el 25 % de la población adulta del mundo tiene NAFLD, con tasas de prevalencia en América del Sur del 31 %26; por tanto, el NASH como causa de HCC también podría estar subdiagnosticado. Adicionalmente, datos recientes sugieren que la cirrosis asociada con NASH contribuye al desarrollo de HCC y es un factor de riesgo cada vez más importante en su etiología en los países occidentales10,27-29, con relación a esto, Singal AG y colaboradores estimaron una tasa de incidencia anual de HCC en pacientes con cirrosis por NASH del 1 % al 2 %27, y otro estudio de hígado graso con un alto número de pacientes mostró una incidencia de HCC de 1 por 100 personas/año de seguimiento29.
En nuestro centro hacemos vigilancia de los pacientes con cirrosis mediante ecografía abdominal y AFP cada 6 meses16,17, y se realiza el enfoque terapéutico siguiendo los lineamientos del BCLC19; esta vigilancia explica el 35 % de los pacientes diagnosticados en estadios susceptibles de tratamiento curativo. De los 104 pacientes de quienes se disponía de datos de tratamiento, un 35 % aproximadamente lo recibió (trasplante: 10,6 % y radioablación: 25 %).
Cerca de 2 terceras partes de los pacientes recibieron terapias no curativas: TACE (17,3 %), terapia sistémica (33,7 %) y tratamiento paliativo (13,4 %); en total, cerca de un 64 % recibieron este tipo de tratamientos, lo que indica un diagnóstico muy tardío. De hecho, muchos pacientes son diagnosticados con cirrosis en el primer evento de descompensación, sangrado varicoso o presencia de masa en una imagen, datos que se corroboran con una mediana de supervivencia del HCC de 9,5 meses luego del diagnóstico. En el estudio del Programa Italiano de Cáncer Hepático (CLIP), la mediana fluctúa entre 6 y 20 meses30.
En Colombia, desde 2006 se aprobó el sorafenib como terapia sistémica para HCC31 y fue la única terapia disponible hasta el segundo semestre del 2018, cuando se aprobó el regorafenib como segunda línea de tratamiento32. En este estudio, 35 pacientes recibieron sorafenib como tratamiento principal y 14 pacientes como segunda o tercera opción, con un promedio de uso para los 49 pacientes de 6,8 meses. En la literatura se mencionan supervivencias promedio entre 4,6 y 12 meses33-35. De los 14 pacientes con terapias combinadas, 8 habían recibido previamente ablación (5 recibieron luego TACE) y 6 recibieron TACE previamente. 15 pacientes (30,6 %), informaron efectos colaterales usuales31,34: síndrome mano-pie, otros gastrointestinales y diarrea, en este orden.
De especial interés, 2 pacientes con plaquetas por encima de 100 000 e INR normal presentaron sangrado varicoso durante la toma del sorafenib, el primero con várices grandes con puntos rojos que no se ligaron inicialmente por problemas administrativos y el segundo, con várices previamente ligadas, presentó sangrado al inicio del tratamiento, sangrado no claro luego del cual recibió sorafenib por 12 meses sin nuevos episodios. Por su parte, aunque el 54,5 % de los pacientes presentó várices, no fue estadísticamente significativo en la supervivencia global de los pacientes. En un estudio en Italia se identificó la trombosis venosa profunda (TVP) tumoral como el predictor independiente más fuerte de sangrado (HR: 15,4; IC 95 %: 1,84-129,6)35, pero ninguno de los 2 pacientes en este estudio la presentaron. El metaanálisis de Dai y colaboradores, con 4720 pacientes que recibieron sorafenib por HCC36, mostró un aumento significativo en el riesgo de eventos hemorrágicos de bajo grado (riesgo relativo [RR]: 1,99; IC 95 %: 1,59-2,49; p < 0,00001), el segundo paciente de nuestra serie podría considerarse en este grupo, podríamos decir entonces, que en esta cohorte un paciente (el 2 %) presentó sangrado asociado con sorafenib y de bajo grado.
Reconocemos las limitaciones del estudio por ser retrospectivo; sin embargo, esta es una cohorte de pacientes con HCC que se ha seguido por un largo período en Bogotá, y en donde llama la atención en la etiología, el hígado graso, una condición una condición frecuente en nuestra población y que en el futuro podría cambiar las directrices sobre su tamizaje y seguimiento como un factor de riesgo para el desarrollo de HCC.
Conclusiones
El NAFLD es la principal causa de HCC en la presente cohorte, más de una tercera parte de pacientes son diagnosticados en estadios BCLC tempranos con opción curativa de tratamiento y un 25 % se trata con terapias curativas. El sorafenib fue la terapia de primera línea en HCC avanzado. La supervivencia global luego del diagnóstico de HCC sigue siendo baja y es necesario aunar esfuerzos en el seguimiento de los pacientes con cirrosis para mejorar los porcentajes de diagnósticos tempranos en ellos.
REFERENCIAS
1. Bray F, Ferlay J, Soerjomataram I, Siegel RL, Torre LA, Jemal A. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 2018;68(6):394-424. https://doi.org/10.3322/caac.21492 [ Links ]
2. Global Burden of Disease Liver Cancer Collaboration, Akinyemiju T, Abera S, Ahmed M, Alam N, Alemayohu MA, et al. The Burden of Primary Liver Cancer and Underlying Etiologies From 1990 to 2015 at the Global, Regional, and National Level: Results From the Global Burden of Disease Study 2015. JAMA Oncol. 2017;3(12):1683-1691. https://doi.org/10.1001/jamaoncol.2017.3055 [ Links ]
3. Jemal A, Ward EM, Johnson CJ, Cronin KA, Ma J, Ryerson B, et al. Annual Report to the Nation on the Status of Cancer, 1975-2014, Featuring Survival. J Natl Cancer Inst. 2017;109(9):djx030. https://doi.org/10.1093/jnci/djx030 [ Links ]
4. Kulik L, El-Serag HB. Epidemiology and Management of Hepatocellular Carcinoma. Gastroenterology. 2019;156(2):477-491.e1. https://doi.org/10.1053/j.gastro.2018.08.065 [ Links ]
5. Pardo C, de Vries E, Buitrago L, Gamboa O. Atlas de mortalidad por cáncer en Colombia. 4.a edición. Bogotá D. C.: Instituto Nacional de Cancerología; 2017. p. 124. [ Links ]
6. Fattovich G, Stroffolini T, Zagni I, Donato F. Hepatocellular carcinoma in cirrhosis: incidence and risk factors. Gastroenterology. 2004;127(5 Suppl 1):S35-50. https://doi.org/10.1053/j.gastro.2004.09.014 [ Links ]
7. Kanwal F, Hoang T, Kramer JR, Asch SM, Goetz MB, Zeringue A, et al. Increasing prevalence of HCC and cirrhosis in patients with chronic hepatitis C virus infection. Gastroenterology . 2011;140(4):1182-1188.e1. https://doi.org/10.1053/j.gastro.2010.12.032 [ Links ]
8. El-Serag HB. Hepatocellular carcinoma. N Engl J Med. 2011;365(12):1118-27. https://doi.org/10.1056/NEJMra1001683 [ Links ]
9. Sangiovanni A, Prati GM, Fasani P, Ronchi G, Romeo R, Manini M, et al. The natural history of compensated cirrhosis due to hepatitis C virus: A 17-year cohort study of 214 patients. Hepatology. 2006;43(6):1303-10. https://doi.org/10.1002/hep.21176 [ Links ]
10. Suresh D, Srinivas AN, Kumar DP. Etiology of Hepatocellular Carcinoma: Special Focus on Fatty Liver Disease. Front Oncol. 2020;10:601710. https://doi.org/10.3389/fonc.2020.601710 [ Links ]
11. Makarova-Rusher OV, Altekruse SF, McNeel TS, Ulahannan S, Duffy AG, Graubard BI, et al. Population attributable fractions of risk factors for hepatocellular carcinoma in the United States. Cancer. 2016;122(11):1757-65. https://doi.org/10.1002/cncr.29971 [ Links ]
12. Bruix J, Sherman M, Llovet JM, Beaugrand M, Lencioni R, Burroughs AK, et al. Clinical management of hepatocellular carcinoma. Conclusions of the Barcelona-2000 EASL conference. European Association for the Study of the Liver. J Hepatol. 2001;35(3):421-30. https://doi.org/10.1016/s0168-8278(01)00130-1 [ Links ]
13. Bruix J, Sherman M; Practice Guidelines Committee, American Association for the Study of Liver Diseases. Management of hepatocellular carcinoma. Hepatology. 2005;42(5):1208-36. https://doi.org/10.1002/hep.20933 [ Links ]
14. Matsui O, Kobayashi S, Sanada J, Kouda W, Ryu Y, Kozaka K, et al. Hepatocelluar nodules in liver cirrhosis: hemodynamic evaluation (angiography-assisted CT) with special reference to multi-step hepatocarcinogenesis. Abdom Imaging. 2011;36(3):264-72. https://doi.org/10.1007/s00261-011-9685-1 [ Links ]
15. Marrero JA, Kulik LM, Sirlin CB, Zhu AX, Finn RS, Abecassis MM, et al. Diagnosis, Staging, and Management of Hepatocellular Carcinoma: 2018 Practice Guidance by the American Association for the Study of Liver Diseases. Hepatology. 2018;68(2):723-750. https://doi.org/10.1002/hep.29913 [ Links ]
16. European Association for the Study of the Liver. Electronic address: easloffice@easloffice.eu; European Association for the Study of the Liver. EASL Clinical Practice Guidelines: Management of hepatocellular carcinoma. J Hepatol. 2018;69(1):182-236. https://doi.org/10.1016/j.jhep.2018.03.019 [ Links ]
17. Heimbach JK, Kulik LM, Finn RS, Sirlin CB, Abecassis MM, Roberts LR, et al. AASLD guidelines for the treatment of hepatocellular carcinoma. Hepatology. 2018;67(1):358-380. https://doi.org/10.1002/hep.29086 [ Links ]
18. Llovet JM, Di Bisceglie AM, Bruix J, Kramer BS, Lencioni R, Zhu AX, et al. Design and endpoints of clinical trials in hepatocellular carcinoma. J Natl Cancer Inst. 2008;100(10):698-711. https://doi.org/10.1093/jnci/djn134 [ Links ]
19. Forner A, Reig M, Bruix J. Hepatocellular carcinoma. Lancet. 2018;391(10127):1301-1314. https://doi.org/10.1016/S0140-6736(18)30010-2 [ Links ]
20. Jha RC, Mitchell DG, Weinreb JC, Santillan CS, Yeh BM, Francois R, et al. LI-RADS categorization of benign and likely benign findings in patients at risk of hepatocellular carcinoma: a pictorial atlas. AJR Am J Roentgenol. 2014;203(1):W48-69. https://doi.org/10.2214/AJR.13.12169 [ Links ]
21. Debes JD, Chan AJ, Balderramo D, Kikuchi L, Gonzalez Ballerga E, Prieto JE, et al. Hepatocellular carcinoma in South America: Evaluation of risk factors, demographics and therapy. Liver Int. 2018;38(1):136-143. https://doi.org/10.1111/liv.13502 [ Links ]
22. White DL, Thrift AP, Kanwal F, Davila J, El-Serag HB. Incidence of Hepatocellular Carcinoma in All 50 United States, From 2000 Through 2012. Gastroenterology . 2017;152(4):812-820.e5. https://doi.org/10.1053/j.gastro.2016.11.020 [ Links ]
23. Prieto JE, Sánchez S, Prieto RG, Rojas E, González L, Mendivelso F. Características clínicas y descompensación en pacientes con cirrosis hepática atendidos en dos centros de hepatología en la ciudad de Bogotá D.C., 2010-2014. Rev Col Gastroenterol. 2016;31(1):1-8. https://doi.org/10.22516/25007440.66 [ Links ]
24. Prieto-Ortiz JE, Garzón-Orjuela N, Sánchez Pardo S, Prieto-Ortiz RG, Eslava-Schmalbach J. Sobrevida en pacientes con cirrosis de acuerdo con su etiología. Cohorte retrospectiva. Rev Colomb Gastroenterol. 2022;37(1):24-32. https://doi.org/10.22516/25007440.703 [ Links ]
25. Marín-Zuluaga JI, Vergara-Cadavid J, Cajiao-Castro L, Arroyave-Zuluaga D, Castro-Sánchez S, Ceballos-Ramírez L, et al. Caracterización, manejo y pronóstico de una cohorte de pacientes cirróticos con carcinoma hepatocelular. Hospital Pablo Tobón Uribe 2012-2018. Hepatología. 2020;1(2):134-44. [ Links ]
26. Younossi ZM, Koenig AB, Abdelatif D, Fazel Y, Henry L, Wymer M. Global epidemiology of nonalcoholic fatty liver disease-Meta-analytic assessment of prevalence, incidence, and outcomes. Hepatology. 2016;64(1):73-84. https://doi.org/10.1002/hep.28431 [ Links ]
27. Singal AG, Lampertico P, Nahon P. Epidemiology and surveillance for hepatocellular carcinoma: New trends. J Hepatol. 2020;72(2):250-261. https://doi.org/10.1016/j.jhep.2019.08.025 [ Links ]
28. Ascha MS, Hanouneh IA, Lopez R, Tamimi TA, Feldstein AF, Zein NN. The incidence and risk factors of hepatocellular carcinoma in patients with nonalcoholic steatohepatitis. Hepatology. 2010;51(6):1972-8. https://doi.org/10.1002/hep.23527 [ Links ]
29. Kanwal F, Kramer JR, Mapakshi S, Natarajan Y, Chayanupatkul M, Richardson PA, et al. Risk of Hepatocellular Cancer in Patients With Non-Alcoholic Fatty Liver Disease. Gastroenterology . 2018;155(6):1828-1837.e2. https://doi.org/10.1053/j.gastro.2018.08.024 [ Links ]
30. The Cancer of the Liver Italian Program (CLIP) investigators. A new prognostic system for hepatocellular carcinoma: a retrospective study of 435 patients. Hepatology. 1998;28(3):751-5. https://doi.org/10.1002/hep.510280322 [ Links ]
31. Llovet JM, Ricci S, Mazzaferro V, Hilgard P, Gane E, Blanc JF, et al. Sorafenib in advanced hepatocellular carcinoma. N Engl J Med. 2008;359(4):378-90. https://doi.org/10.1056/NEJMoa0708857 [ Links ]
32. Bruix J, Qin S, Merle P, Granito A, Huang YH, Bodoky G, et al. Regorafenib for patients with hepatocellular carcinoma who progressed on sorafenib treatment (RESORCE): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet. 2017;389(10064):56-66. https://doi.org/10.1016/S0140-6736(16)32453-9 [ Links ]
33. Leal CRG, Magalhães C, Barbosa D, Aquino D, Carvalho B, Balbi E, et al. Survival and tolerance to sorafenib in Child-Pugh B patients with hepatocellular carcinoma: a prospective study. Invest New Drugs. 2018;36(5):911-918. https://doi.org/10.1007/s10637-018-0621-x [ Links ]
34. McNamara MG, Slagter AE, Nuttall C, Frizziero M, Pihlak R, Lamarca A, et al. Sorafenib as first-line therapy in patients with advanced Child-Pugh B hepatocellular carcinoma-a meta-analysis. Eur J Cancer. 2018;105:1-9. https://doi.org/10.1016/j.ejca.2018.09.031 [ Links ]
35. Iavarone M, Primignani M, Vavassori S, Sangiovanni A, La Mura V, Romeo R, et al. Determinants of esophageal varices bleeding in patients with advanced hepatocellular carcinoma treated with sorafenib. United European Gastroenterol J. 2016;4(3):363-70. https://doi.org/10.1177/2050640615615041 [ Links ]
36. Dai C, Zhou F, Shao JH, Wu LQ, Yu X, Yin XB. Bleeding risk in cancer patients treated with sorafenib: A meta-analysis of randomized controlled trials. J Cancer Res Ther. 2018;14(Supplement):S948-S956. https://doi.org/10.4103/0973-1482.188430 [ Links ]
Citación: Prieto-Ortiz JE, Garzón-Orjuela N, Sánchez-Pardo S, Prieto-Ortiz RG, Eslava-Schmalbach J. Hepatocarcinoma: experiencia de la vida real en un centro especializado de Bogotá, Colombia. Rev Colomb Gastroenterol. 2022;37(2):163-173. https://doi.org/10.22516/25007440.823
Recibido: 02 de Septiembre de 2021; Aprobado: 21 de Enero de 2022











 texto en
texto en 



