Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista colombiana de Gastroenterología
versión impresa ISSN 0120-9957versión On-line ISSN 2500-7440
Rev. colomb. Gastroenterol. vol.37 no.2 Bogotá ene./jun. 2022 Epub 24-Ago-2022
https://doi.org/10.22516/25007440.853
Trabajos originales
Comportamiento de las enfermedades hepáticas en una cohorte de pacientes colombianos con COVID-19
1MD, Internal Medicine Specialist, Infectious Diseases Fellow, Universidad Javeriana. Bogotá, Colombia.
2ND, MSc in Clinical Epidemiology. Researcher associated with the Equidad en Salud Group of the Medicine School. Universidad Nacional de Colombia. Hospital Universitario Nacional de Colombia. Bogotá, Colombia.
3MD, General Surgery and Gastroenterology Specialist (CEHYD). Hospital Central de la Policía (HOCEN). Bogotá, Colombia.
4MD, MSc, PhD in Public Health. Leader of the Equidad en Salud Group, Medicine School, Universidad Nacional de Colombia. Hospital Universitario Nacional de Colombia. Bogotá, Colombia.
5MD, Internal Medicine, Gastroenterology, and Hepatology Specialist. Centro de enfermedades hepáticas y digestivas (CEHYD). Bogotá, Colombia.
Introducción:
la infección por coronavirus del síndrome respiratorio agudo grave de tipo 2 (SARS-CoV-2) concentra la mayor atención en el momento. En el hígado es frecuente la elevación asintomática de transaminasas y la afectación hepática varía del 14 % al 78 %. La evaluación de las comorbilidades hepáticas es escasa, con prevalencias que oscilan entre el 2 % y el 11 %.
Objetivo:
describir el comportamiento de una cohorte de pacientes con enfermedades hepáticas que presentaron el coronavirus de 2019 (COVID-19).
Materiales y métodos:
estudio observacional retrospectivo que analizó el comportamiento de una cohorte de pacientes con hepatopatías que enfermaron por COVID-19.
Resultados:
543 pacientes padecieron por COVID-19, de los cuales 300 fueron mujeres (55,3 %). La mediana de edad al diagnóstico de la enfermedad hepática fue de 52 años. Las principales causas de las hepatopatías fueron esteatohepatitis no alcohólica (49,5 %), enfermedad colestásica (7,7 %), virus de la hepatitis C y B (6,3 %). La alanina-aminotransferasa (ALT) presentó una mediana de 52 U/L (rango intercuartílico [RIC]: 30-98) y aspartato-aminotransferasa (AST) 32 U/L (RIC: 23-62). La mortalidad por la infección viral fue del 5,7 % con una tasa de incidencia de 2,9 (intervalo de confianza [IC] 95 %: 2-4,2).
Conclusiones:
es un estudio de carácter retrospectivo; sin embargo, hasta la elaboración del manuscrito es la primera cohorte en Colombia en describir el comportamiento de las enfermedades hepáticas en pacientes que enferman de COVID-19. No se encontraron diferencias estadísticamente significativas entre las causas de hepatopatía que confieran un mayor riesgo de mortalidad; sin embargo, tener una descompensación de cirrosis es la única condición que tiene una relación con la mortalidad.
Palabras clave: Hígado graso; virus del SARS; cirrosis hepática; mortalidad
Introduction:
Severe acute respiratory syndrome type 2 coronavirus infection (SARS-CoV-2) is receiving the most attention now. The asymptomatic elevation of transaminases is typical in the liver, and liver involvement varies from 14 % to 78 %. The assessment of liver comorbidities is scarce, with prevalence ranging between 2 % and 11 %.
Aim:
To describe the behavior of a cohort of patients with liver diseases who fell ill with coronavirus disease 2019 (COVID-19).
Materials and methods:
This retrospective observational study analyzed the behavior of a cohort of patients with liver diseases who fell ill with COVID-19.
Results:
543 patients became ill with COVID-19, of which 300 were women (55.3 %). The median age at diagnosis of liver disease was 52 years. The leading causes of liver disease were nonalcoholic steatohepatitis (49.5 %), cholestatic disease (7.7 %), and hepatitis C and B viruses (6.3 %). Alanine aminotransferase (ALT) had a median of 52 U/L (interquartile range [IQR]: 30-98) and aspartate aminotransferase (AST) 32 U/L (IQR: 23-62). Mortality due to viral infection was 5.7 %, with an incidence rate of 2.9 (95 % confidence interval [CI]: 2-4.2).
Conclusions:
It is a retrospective study but, until the preparation of the manuscript, it had been the first cohort in Colombia to describe the behavior of liver diseases in patients who become ill with COVID-19. No statistically significant differences were found between the causes of liver disease that confer a higher risk of mortality; however, having decompensated cirrhosis is the only condition related to mortality.
Keywords: Fatty liver; SARS virus; cirrhosis of the liver; mortality
Introducción
La infección por el coronavirus del síndrome respiratorio agudo grave de tipo 2 (SARS-CoV-2) denominada infección pandémica COVID-19 (del inglés novel coronavirus disease 2019) concentra la mayor atención en el momento y la afectación hepática no es ajena a la infección viral; es frecuente la elevación asintomática de transaminasas y la lesión hepática varía del 14 % al 78 %1-5. Cada vez se notifican más manifestaciones gastrointestinales como náuseas, vómitos, dolor abdominal, diarrea, pérdida de apetito, disgeusia y alteraciones químicas del hígado, especialmente en pacientes hospitalizados4,5.
En el metaanálisis de Dorrell y colaboradores5 se encontraron 62 estudios en los que se reportaban alteración de las transaminasas con un promedio de alanina-aminotransferasa (ALT) de 34,8 (+/-16,1 U/L) y aspartato-aminotransferasa (AST) 39,0 U/L (+/-17,3) entre todos los pacientes con enfermedad por coronavirus de 2019 (COVID-19) con una relación AST:ALT promedio ponderada de 1,15 (+/-0,20).
El daño hepático puede ser causado directamente por efectos citopáticos inducidos por virus teniendo en cuenta que el SARS-CoV-2 se une al receptor de la enzima convertidora de angiotensina 2 (ECA-2) para entrar en sus células diana6,7. Los datos de dos cohortes independientes revelaron un enriquecimiento significativo de la expresión de ECA-2 en colangiocitos (59,7 % de las células) en comparación con los hepatocitos (2,6 % de las células), lo que sugiere que el SARS-CoV-2 podría unirse directamente a los colangiocitos positivos para ECA-2 y producir alteraciones de la función hepática8-10.
Dentro de las enfermedades hepáticas descritas y asociadas con casos graves de COVID-19, la principal fue la infección crónica por hepatitis B, con 2,4 % de los casos graves. La elevación de AST se observa aproximadamente en 18,2 % de los casos no graves y 39,4 % de los casos graves, y elevación de ALT en el 19,8 % de los casos no graves y 28,1 % de los casos graves.
Pocos estudios han realizado descripciones de las manifestaciones hepáticas con 1 estudio en la ciudad de Wuhan, China, donde inicialmente se describió el origen del virus con una serie de 99 pacientes en la que se observó una disminución de la albúmina en el 98 % de los pacientes, mientras que los niveles séricos de AST, ALT y bilirrubina estaban elevados en el 35 %, 28 % y 18 % de los pacientes, respectivamente11. De manera similar, en un análisis de 1099 pacientes se observaron niveles elevados de AST en el 18,2 % de los pacientes con enfermedad no grave y en el 39,4 % de los pacientes con enfermedad grave12.
Por lo anterior y considerando que la descripción de las manifestaciones hepáticas de la COVID-19 son escasas y que en Colombia no se tiene registro de estas, el objetivo del presente estudio fue describir el comportamiento de una cohorte de pacientes con enfermedades hepáticas que padecieron COVID-19.
Materiales y métodos
Estudio observacional retrospectivo con revisión de historias clínicas que analizó el comportamiento de una cohorte de pacientes con hepatopatías que enfermaron por COVID-19.
Se incluyeron únicamente pacientes mayores de 18 años quienes estaban en seguimiento por hepatopatías en el centro de enfermedades hepáticas y digestivas (CEHYD) durante el período de marzo de 2020 a junio de 2021. Se excluyeron pacientes embarazadas y menores de 18 años.
Análisis estadístico
Se realizó una comparación de las variables de interés con descripción de las variables sociodemográficas mediante medidas de frecuencia y tendencia central. Se realizó una comparación de las variables que tuvieron una distribución normal mediante la prueba de chi cuadrado. Las variables que presentaban una distribución anormal se analizaron mediante la prueba de Mann-Whitney. Se realizó un análisis de la supervivencia comparado por las diferentes variables relacionadas con la variable de mortalidad representado en gráficos de Kaplan-Meier y mediante la prueba de log-rank. Se presentaron los resultados en forma de tablas o gráficas utilizando el software Stata 13.0.
Resultados
Se revisó un total de 1937 historias clínicas de pacientes en seguimiento por hepatopatías y con sospecha de infección por SARS-CoV-2, se confirmó el diagnóstico mediante pruebas moleculares (reacción en cadena de la polimerasa en tiempo real [RT-PCR] o antígenos) en 543 pacientes, de los cuales 300 fueron mujeres (55,3 %).
La mediana de edad al diagnóstico de la enfermedad hepática fue de 52 años (rango intercuartílico [RIC]: 40-61), las principales comorbilidades asociadas fueron hipertensión arterial (HTA) (23 %), dislipidemia (20,1 %) y obesidad (17,6 %), y las principales causas de las hepatopatías fueron, en su orden, esteatohepatitis no alcohólica (NASH; 49,5 %), enfermedad colestásica (7,7 %), virus de la hepatitis C y B (6,3 %) y alcohol (4 %), con una diferencia significativa entre ellas. Las características sociodemográficas se muestran en la Tabla 1.
Tabla 1 Características sociodemográficas y variables de laboratorio en todos los pacientes
| Variable | Total n = 543 n (%) | Mujeres n = 300 (55,3 %) n (%) | Hombres n = 243 (44,7 %) n (%) | Valor p | |
|---|---|---|---|---|---|
| Características sociodemográficas | |||||
| Edad al diagnóstico Mediana (RIC) | 52 (40-61) | 53 (40-61) | 51 (39-62) | 0,628* | |
| Antecedentes | |||||
| DM | 67 (13,3) | 39 (13,8) | 28 (12,6) | 0,7ç | |
| Dislipidemia | 103 (20,1) | 52 (18,1) | 51 (22,6) | 0,2ç | |
| Obesidad | 90 (17,6) | 45 (15,6) | 45 (20,0) | 0,2ç | |
| Consumo de alcohol | 204 (37,5) | 60 (20) | 144 (59,2) | <0,001+ | |
| HTA | 118 (23,0) | 66 (23,0) | 52 (23,1) | 0,976ç | |
| Enfermedad coronaria | 26 (5,0) | 15 (5,2) | 11 (4,8) | 0,863ç | |
| IMC Me (RIC) | 26,5 (24,29,4) | 26 (23-29) | 27 (24,9-30) | 0,002* | |
| Laboratorios (n = 151) | Mediana (RIC) | ||||
| Leucocitos Me (RIC) | 5950 (5000-7230) | 5905 (4762-7157) | 6190 (5070-7295) | 0,2352* | |
| Neutrófilos | 54 (47-60) | 54 (48-61) | 52 (46-59) | 0,0621* | |
| Linfocitos | 34 (27-39) | 33 (28-39) | 34 (26-41) | 0,2057* | |
| VSG (mL/h) | 7 (3-15) | 8 (5-20) | 5 (2-8) | <0,0001* | |
| Hb | 15 (14-16) | 14 (13-15) | 16 (15-17) | <0,0001* | |
| Hcto | 45 (42-48) | 43 (41-46) | 48 (45-50) | <0,0001* | |
| Plaquetas | 242000 (192 x103-288 X103) | 260000 (207 x103-307x103) | 218000 (178 x103-262 x 103) | <0,0001* | |
| Glicemia | 94 (86-102) | 91 (84-100) | 96 (89-104) | <0,0001* | |
| Creatinina | 0,8 (0,7-1) | 0,7 (0,6-0,8) | 0,9 (0,8-1,1) | <0,0001* | |
| Colesterol total | 193 (160-224) | 196 (166-229) | 188 (153-222) | 0,0319* | |
| Triglicéridos | 143 (104-194) | 138 (93-184) | 147 (113-204) | 0,0106* | |
| TSH | 2,5 (1,5-3,6) | 2,5 (1,5- 3,6) | 2,4 (1,6-3,7) | 0,7767* | |
| Función hepática | |||||
| AST | 35 (23-62) | 33 (21-63) | 35,5 (26-61) | 0,1763* | |
| ALT | 52 (30-98) | 49 (23-101) | 58 (36-95) | 0,0064* | |
| Fosfatasa alcalina | 96 (74-136) | 101 (77-142) | 91 (72-134) | 0,0279* | |
| Bilirrubina total | 0,7 (0,4-1,1) | 0,6 (0,4-1) | 0,7 (0,5-1,3) | <0,0001* | |
| Albúmina | 4,4 (4,1-4,7) | 4,4 (4,1-4,6) | 4,5 (4,2-4,8) | 0,0007* | |
| AFP | 2,5 (1,7-3,9) | 2,3 (1,6-3,6) | 2,7 (1,7-4,3) | 0,0882* | |
| Causa de hepatopatía | <0,001+ | ||||
| Hígado graso | 269 (49,5) | 135 (45) | 134 (55,1) | ||
| Alcohol | 22 (4,1) | 3 (1) | 19 (7,8) | ||
| Virus | 34 (6,3) | 19 (6,3) | 15 (6,1) | ||
| Colestásica | 42 (7,7) | 36 (12) | 6 (4,5) | ||
| Mixta 3 o más | 14 (2,6) | 7 (2,3) | 7 (2,8) | ||
| Otros | 162 (29,8) | 100 (33,3) | 62 (25,5) | ||
çChi cuadrado. *Prueba de Mann-Whitney.+Prueba de Fisher. AFP: alfafetoproteína; DM: diabetes mellitus; Hb: hemoglobina; Hcto: hematocrito; Me: mediana; TSH: tirotropina; VSG: velocidad de sedimentación globular.
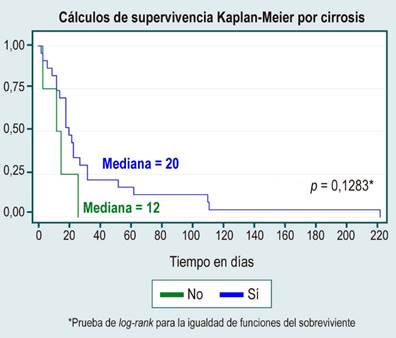
152 pacientes (27,9 %) presentaron diagnóstico de cirrosis con diferencias estadísticamente significativas (p < 0,001) junto con la enfermedad coronaria (p < 0,015) para la mortalidad.
La principal causa de la cirrosis nuevamente fue el NASH en el 36,8 % (n = 42) y el 28,2 % tenía antecedente de descompensación, y la más frecuente fue la ascitis (40 %), seguida del sangrado variceal (20 %).
Las transaminasas presentaron valores elevados más para ALT, que presentó una mediana de 52 U/L (RIC: 30-98), y para AST se presentó un valor discretamente elevado con una mediana de 32 U/L (RIC: 23-62); las variables de laboratorio se tomaron previo al diagnóstico de la infección por SARS-CoV-2.
Adicionalmente, a pesar de no tener diferencias estadísticamente significativas para la mortalidad, destacan una mayor proporción de DM, dislipidemia y obesidad en pacientes que sobrevivieron, lo que se muestra en la Tabla 2.
Tabla 2 Variables relacionadas con la mortalidad por COVID-19 en pacientes con hepatopatía
| Variable | Total n = 543 n (%) | Vivos n = 512 (94,3) n (%) | Fallecidos n = 31 (5,7) n (%) | Valor p |
|---|---|---|---|---|
| Características clínicas | ||||
| Mujeres | 300 (55,3) | 283 (55,2) | 229 (44,7) | 0,962ç |
| Diabetes (n = 503) | 67 (13,3) | 63 (13,3) | 4 (12,9) | 1+ |
| Dislipidemia (n = 512) | 103 (20,1) | 99 (20,5) | 4 (12,9) | |
| Obesidad (n = 511) | 90 (17,6) | 87 (18,1) | 3 (9,6) | |
| Consumo de alcohol | 204 (37,5) | 188(36,7) | 16 (51,6) | 0,001 |
| No consume | 302 (59,6) | 287 (60,4) | 15 (48,3) | |
| HTA | 118 (23,0) | 111 (23,0) | 7 (22,5) | 0,949ç |
| Enfermedad coronaria | 26 (5,0) | 21 (4,3) | 5 (16,1) | 0,015+ |
| Cirrosis | 152 (100) | 74 (100) | 78 (100) | <0,001ç |
| Causa de cirrosis | 0,274+ | |||
| NASH | 42 (36,8) | 29 (39,1) | 20 (25,6) | |
| NASH + alcohol | 10 (8,7) | 1 (1,3) | 16 (20,5) | |
| Virus de la hepatitis C | 8 (7,0) | 16 (21,6) | 5 (6,4) | |
| Autoinmune | 8 (7,0) | 6 (8,1) | 1 (1,2) | |
| Alcohol | 7 (6,1) | 1 (1,3) | 23 (29,4) | |
| Otras causas | 20 (15,6) | 8 (10,8) | 12 (8,9) | |
| Descompensación | 0,005+ | |||
| Ascitis | 12 (20,3) | 6 (13,6) | 6 (40,0) | |
| Sangrado variceal | 8 (13,5) | 5 (11,3) | 3 (20,0) | |
| Encefalopatía | 3 (5,0) | 1 (2,2) | 2 (13,3) | |
| HCC | 2 (3,3) | 1 (2,2) | 1 (6,6) | |
| Ictericia | 7 (11,8) | 6 (13,6) | 1 (6,6) | |
| Coagulopatía | 3 (5,0) | 2 (4,5) | 1 (6,6) | |
çChi cuadrado. *Prueba de Mann-Whitney. +Prueba de Fisher. HCC: hepatocarcinoma.
La mortalidad por COVID 19 fue del 5,7 % (n = 31), con una tasa de incidencia de 2,9 (intervalo de confianza [IC] del 95 %: 2-4,2) y una mediana de supervivencia de 18 días (RIC: 12-32). La única variable relacionada con enfermedad hepática que presentó diferencias estadísticamente significativas con la mortalidad fue tener una descompensación de la cirrosis (p < 0,005), lo cual se muestra en la Tabla 2.
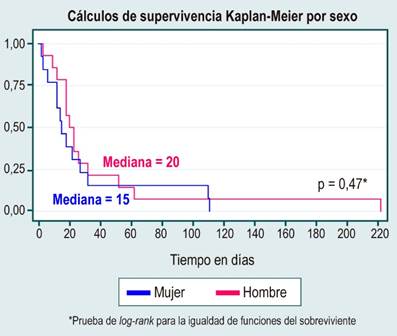
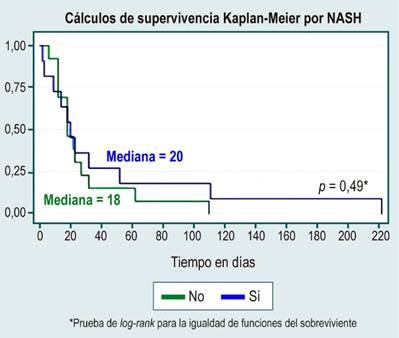
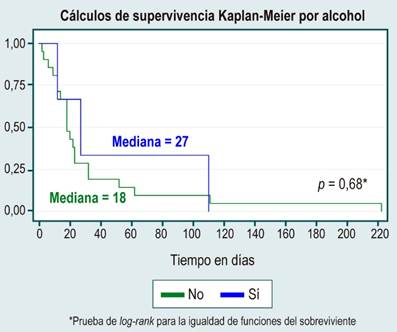
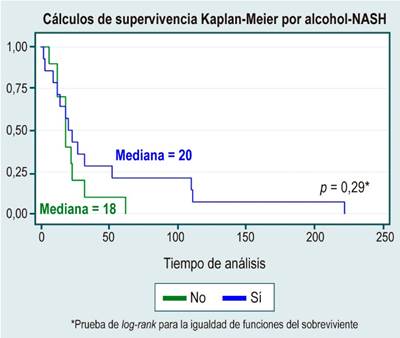
En el análisis de supervivencia no se evidenciaron diferencias estadísticamente significativas entre curvas de supervivencia por sexo, causa de HCC, diagnóstico o no de cirrosis, etiología de la cirrosis por enfermedad del hígado graso no alcohólico (NAFDL), o consumo de alcohol, lo cual se muestra en la Tabla 3 y en las Figuras 1, 2, 3, 4 y 5.
Tabla 3 Análisis de supervivencia.
| Tasa de incidencia * 100 (IC 95 %) | Mediana de supervivencia (días) | Percentil 25 % - percentil 75 % (días) | |
|---|---|---|---|
| Diagnóstico positivo | 2,9 (2 a 4,2) | 18 | 12-32 |
Discusión
Reconocemos las debilidades del estudio por ser de carácter retrospectivo; sin embargo, hasta la elaboración del manuscrito es la primera cohorte en Colombia en describir el comportamiento de las enfermedades hepáticas en pacientes que enferman por la COVID-19.
Se encuentran similitudes comparativamente con otros estudios en los que no se ha encontrado que las enfermedades hepáticas representen un mayor riesgo de infección por el SARS-CoV-2, y los estudios descriptivos publicados hasta el momento encontraron que solo una pequeña cantidad de pacientes con la infección (aproximadamente el 3 %) tiene enfermedad hepática crónica subyacente y no se ha establecido una asociación estadísticamente significativa entre la enfermedad hepática crónica y la gravedad de la COVID-19 o los resultados con respecto a la mortalidad o gravedad de la infección11,13-15. Esto queda reflejado en la tasa de incidencia de 2,9 incluso considerando que este estudio parte de aquellos pacientes que ya tienen una enfermedad hepática crónica y que, además, permite ver que la mortalidad en esta serie está relacionada probablemente con otros factores y en aquellos pacientes que desde la perspectiva de la enfermedad hepática presentaron una enfermedad avanzada con una descompensación de la cirrosis.
No se encontraron diferencias estadísticamente significativas entre las causas de hepatopatía que confieran un mayor riesgo de mortalidad por la infección por SARS-CoV-2 en esta serie, contrario a lo que se ha descrito en otras latitudes, donde se ha evidenciado que las infecciones crónicas como hepatitis B y C ocupan los primeros lugares12, incluso considerando tasas no despreciables de infección por hepatitis C del 7 % en el presente estudio.
Desde el punto de vista de la afectación hepática, desconocemos el comportamiento de las transaminasas considerando que los paraclínicos basales son previos a la infección, aunque muestran una discreta elevación de ALT y AST. Otros estudios5,11,12) evidencian elevaciones de las enzimas hepáticas con la infección.
En comparación con registros mundiales de pacientes con hepatopatías que enferman de COVID-19, como el SECURE-Cirrhosis y COVID-HEP, la mortalidad fue similar con un 13,8 % para el SECURE-Cirrhosis, pero con una diferencia con el COVID-HEP en la que se encontró 36,5 % de muertes entre pacientes con enfermedad hepática crónica y trasplante de hígado16,17.
Únicamente se encontró un registro de un paciente trasplantado, lo que deja abierta la puerta a la investigación en este grupo de pacientes, quienes ya tienen un mayor riesgo de mortalidad por cualquier causa debido a que son pacientes inmunosuprimidos; sin embargo, esto refuerza el concepto de la protección con la inmunización ya que este grupo de pacientes tiene una menor respuesta inmunogénica (50 % aproximadamente), a diferencia de aquellos inmunocompetentes con respuestas cercanas al 94 %18,19.
Por tratarse de un estudio que se desarrolló en un centro de atención ambulatoria, la principal enfermedad hepática fue el NAFLD asociado con la obesidad y dislipidemia, lo cual hasta el momento se ha descrito someramente en pocos estudios observacionales20,21, en los que se encontró que aquellos pacientes especialmente jóvenes y con NAFLD tenían un mayor riesgo de enfermedad grave y un tiempo de excreción viral más prolongado. Sin embargo, el hígado graso se asocia frecuentemente con otras comorbilidades como diabetes o enfermedad cardiovascular, que también son factores de riesgo establecidos para COVID-19 grave y podrían contribuir a peores resultados en estos pacientes, por lo cual se enfatiza en la necesidad de un diagnóstico adecuado del NAFLD y, con esto, definir adecuadamente si representa un factor de riesgo cardiovascular adicional a las comorbilidades crónicas, como la hipertensión arterial o diabetes, además de reforzar nuevamente el concepto de la vacunación temprana en este grupo poblacional y considerarlo un grupo de riesgo.
No se pudieron establecer condiciones de causalidad por las características del estudio y se requieren observaciones a largo plazo para definir el impacto de las enfermedades hepáticas en casos graves de la enfermedad por SARS-CoV-2 y, con esto, definir las posibles intervenciones terapéuticas en aquellos pacientes con enfermedades hepáticas crónicas considerando que hasta el momento existen resultados discordantes en cuanto a si son o no un factor de mayor mortalidad por la COVID-1922,23.
Conclusión
A pesar de ser un estudio retrospectivo, se presenta probablemente la primera cohorte de pacientes con enfermedades hepáticas afectados por SARS-CoV-2. Se encuentran similitudes y diferencias con otros estudios, pero se necesitan estudios prospectivos para evaluar el impacto que tienen las enfermedades hepáticas crónicas en la infección por SARS-CoV-2.
Agradecimientos
Agradecemos a nuestros pacientes por permitirnos ser objeto de nuestro estudio y al personal de salud, que ha tenido de cerca el impacto por la COVID-19
REFERENCIAS
1. Perisetti A, Gajendran M, Mann R, Elhanafi S, Goyal H. COVID-19 extrapulmonary illness - special gastrointestinal and hepatic considerations. Dis Mon. 2020;66(9):101064. https://doi.org/10.1016/j.disamonth.2020.101064 [ Links ]
2. Huang C, Wang Y, Li X, Ren L, Zhao J, Hu Y, et al. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. Lancet. 2020;395(10223):497-506. https://doi.org/10.1016/S0140-6736(20)30183-5 [ Links ]
3. Jin X, Lian JS, Hu JH, Gao J, Zheng L, Zhang YM, et al. Epidemiological, clinical and virological characteristics of 74 cases of coronavirus-infected disease 2019 (COVID-19) with gastrointestinal symptoms. Gut. 2020;69(6):1002-1009. https://doi.org/10.1136/gutjnl-2020-320926 [ Links ]
4. Fan Z, Chen L, Li J, Cheng X, Yang J, Tian C, et al. Clinical Features of COVID-19-Related Liver Functional Abnormality. Clin Gastroenterol Hepatol. 2020;18(7):1561-1566. https://doi.org/10.1016/j.cgh.2020.04.002 [ Links ]
5. Dorrell RD, Dougherty MK, Barash EL, Lichtig AE, Clayton SB, Jensen ET. Gastrointestinal and hepatic manifestations of COVID-19: A systematic review and meta-analysis. JGH Open. 2020;5(1):107-115. https://doi.org/10.1002/jgh3.12456 [ Links ]
6. Musa S. Hepatic and gastrointestinal involvement in coronavirus disease 2019 (COVID-19): What do we know till now? Arab J Gastroenterol. 2020;21(1):3-8. https://doi.org/10.1016/j.ajg.2020.03.002 [ Links ]
7. Hoffmann M, Kleine-Weber H, Schroeder S, Krüger N, Herrler T, Erichsen S, et al. SARS-CoV-2 Cell Entry Depends on ACE2 and TMPRSS2 and Is Blocked by a Clinically Proven Protease Inhibitor. Cell. 2020;181(2):271-280.e8. https://doi.org/10.1016/j.cell.2020.02.052 [ Links ]
8. Chai X, Hu L, Zhang Y, Han W, Lu Z, Ke A, et al. Specific ACE2 expression in cholangiocytes may cause liver damage after 2019-nCoV infection. bioRxiv. 2020. https://doi.org/10.1101/2020.02.03.931766 [ Links ]
9. Zhang C, Shi L, Wang FS. Liver injury in COVID-19: management and challenges. Lancet Gastroenterol Hepatol. 2020;5(5):428-430. https://doi.org/10.1016/S2468-1253(20)30057-1 [ Links ]
10. Kim KD, Zhao J, Auh S, Yang X, Du P, Tang H, et al. Adaptive immune cells temper initial innate responses. Nat Med. 2007;13(10):1248-52. https://doi.org/10.1038/nm1633 [ Links ]
11. Chen N, Zhou M, Dong X, Qu J, Gong F, Han Y, et al. Epidemiological and clinical characteristics of 99 cases of 2019 novel coronavirus pneumonia in Wuhan, China: a descriptive study. Lancet. 2020;395(10223):507-513.https://doi.org/10.1016/S0140-6736(20)30211-7 [ Links ]
12. Guan WJ, Ni ZY, Hu Y, Liang WH, Ou CQ, He JX, et al. Clinical characteristics of coronavirus disease 2019 in China. N Engl J Med. 2020;382(18):1708-1720. https://doi.org/10.1056/NEJMoa2002032 [ Links ]
13. Shi H, Han X, Jiang N, Cao Y, Alwalid O, Gu J,et al. Radiological findings from 81 patients with COVID-19 pneumonia in Wuhan, China: a descriptive study. Lancet Infect Dis. 2020;20(4):425-434. https://doi.org/10.1016/S1473-3099(20)30086-4 [ Links ]
14. Zhang JJ, Dong X, Cao YY, Yuan YD, Yang YB, Yan YQ, et al. Clinical characteristics of 140 patients infected with SARS-CoV-2 in Wuhan, China. Allergy. 2020;75(7):1730-1741. https://doi.org/10.1111/all.14238 [ Links ]
15. Arentz M, Yim E, Klaff L, Lokhandwala S, Riedo FX, Chong M, et al. Characteristics and Outcomes of 21 Critically Ill Patients With COVID-19 in Washington State. JAMA. 2020;323(16):1612-1614. https://doi.org/10.1001/jama.2020.4326 [ Links ]
16. Surveillance Epidemiology of Coronavirus (COVID-19) Under Research Exclusion [internet]. Secure Cirrhosis; 2020 [consultado el 5 de abril de 2022]. Disponible en: Disponible en: https://covidcirrhosis.web.unc.edu/wp-content/uploads/sites/22503/2020/03/SECURE-CIRRHOSIS_Case-Report-Form_3-24-20.pdf [ Links ]
17. COVID-Hep.net: Coronavirus (COVID-19) in liver disease reporting registry [internet]. COVID-Hep; 2020 [consultado el 5 de abril de 2022]. Disponible en: Disponible en: https://covid-hep.net/ [ Links ]
18. Calleri A, Saracco M, Pittaluga F, Cavallo R, Romagnoli R, Martini S. Seroconversion After Coronavirus Disease 2019 Vaccination in Patients Awaiting Liver Transplantation: Fact or Fancy?. Liver Transpl. 2022;28(2):180-187. https://doi.org/10.1002/lt.26312 [ Links ]
19. Rabinowich L, Grupper A, Baruch R, Ben-Yehoyada M, Halperin T, et al. Low immunogenicity to SARS-CoV-2 vaccination among liver transplant recipients. J Hepatol. 2021;75(2):435-8. https://doi.org/10.1016/j.jhep.2021.04.020 [ Links ]
20. Ji D, Qin E, Xu J, Zhang D, Cheng G, Wang Y, et al. Non-alcoholic fatty liver diseases in patients with COVID-19: A retrospective study. J Hepatol. 2020;73(2):451-453. https://doi.org/10.1016/j.jhep.2020.03.044 [ Links ]
21. Zhou YJ, Zheng KI, Wang XB, Yan HD, Sun QF, Pan KH, et al. Younger patients with MAFLD are at increased risk of severe COVID-19 illness: A multicenter preliminary analysis. J Hepatol. 2020;73(3):719-721. https://doi.org/10.1016/j.jhep.2020.04.027 [ Links ]
22. Ponziani FR, Del Zompo F, Nesci A, Santopaolo F, Ianiro G, Pompili M, et al. Liver involvement is not associated with mortality: results from a large cohort of SARS-CoV-2-positive patients. Aliment Pharmacol Ther. 2020;52(6):1060-1068. https://doi.org/10.1111/apt.15996 [ Links ]
23. Singh S, Khan A. Clinical Characteristics and Outcomes of Coronavirus Disease 2019 Among Patients With Preexisting Liver Disease in the United States: A Multicenter Research Network Study. Gastroenterology. 2020;159(2):768-771.e3. https://doi.org/10.1053/j. gastro.2020.04.064 [ Links ]
Citación: Sánchez-Pardo S, Garzón-Orjuela N, Prieto-Ortiz RG, Eslava-Schmalbach J, Prieto-Ortiz J. Comportamiento de las enfermedades hepáticas en una cohorte de pacientes colombianos con COVID-19. Rev Colomb Gastroenterol. 2022;37(2):193-200. https://doi.org/10.22516/25007440.853
Recibido: 29 de Noviembre de 2021; Aprobado: 25 de Abril de 2022











 texto en
texto en