Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Revista colombiana de Gastroenterología
versão impressa ISSN 0120-9957versão On-line ISSN 2500-7440
Rev. colomb. Gastroenterol. vol.37 no.2 Bogotá jan./jun. 2022 Epub 25-Ago-2022
https://doi.org/10.22516/25007440.771
Reporte de caso
Compromiso gastrointestinal por enfermedad de injerto contra huésped
1Internist and Gastroenterologist, Hospital Pablo Tobón Uribe. Medellín, Colombia.
2General Surgeon and Digestive Endoscopy Specialist, Hospital Pablo Tobón Uribe. Medellín, Colombia.
3Physician and Pathologist, Hospital Pablo Tobón Uribe. Medellín, Colombia.
4Physician, Universidad de La Sabana. Rural Doctor, Centro de Salud San José De Nimaima. Nimaima, Cundinamarca, Colombia.
La enfermedad de injerto contra huésped es una complicación frecuente después del trasplante de células madre. El tracto digestivo se afecta en una gran proporción de los pacientes que la sufren, con consecuencias que pueden llegar a ser fatales. El abordaje adecuado, que incluye el uso de estudios endoscópicos, permite descartar diagnósticos diferenciales y brindar un manejo temprano de la enfermedad.
Palabras clave: Enfermedad de injerto contra huésped; sistema digestivo; tracto gastrointestinal; trasplante; células madre
Graft-versus-host disease is a common complication after stem cell transplantation. The digestive tract is affected in many patients who suffer from it, with consequences that can be fatal. The proper approach, which includes endoscopic studies, allows ruling out differential diagnoses and managing the disease early.
Keywords: Graft-versus-host disease; digestive system; gastrointestinal tract; transplant; stem cells
Introducción
La enfermedad de injerto contra huésped (EICH) es una complicación frecuente del trasplante de células madre de tipo alogénico que se produce por una respuesta inmunitaria de los linfocitos del donante contra el paciente receptor1. La incidencia de la EICH en este tipo de trasplante se estima tan alta como de un 39 % a 59 %, con una mortalidad al primer año hasta del 31 %2. La piel, el tracto gastrointestinal (TGI) y el hígado son los principales órganos afectados. El TGI se llega a afectar hasta en un 74 % de los casos y puede presentarse compromiso exclusivo del mismo en un 17 % de los casos. Un 67 % de los casos con compromiso digestivo presenta afección difusa tanto del TGI superior como inferior3. Presentamos tres casos de pacientes atendidos en el Hospital Pablo Tobón Uribe (HPTU) de Medellín con sospecha de EICH con compromiso gastrointestinal y su abordaje diagnóstico.
Caso 1
Se trata de un paciente masculino de 26 años con diagnóstico de leucemia linfoblástica aguda de células B quien recibió terapia de inducción con protocolo PETHEMA-LAL de alto riesgo y 3 ciclos de consolidación con PETHEMA; posteriormente presentó una recaída sistémica con compromiso en el sistema nervioso central, por lo que se administró quimioterapia de alta intensidad con IDA-FLAG, citarabina y terapia intratecal y se logró la remisión morfológica con enfermedad residual medular, por lo que requirió una nueva quimioterapia con miras para trasplante de médula ósea (TMO). Se realizó el trasplante haploidéntico de progenitores hematopoyéticos con su madre como donante. Ingresó al día 24 de trasplante por diarrea aguda, ictericia mucocutánea generalizada y exantema macular eritematoso difuso con descamación. En los paraclínicos se observó pancitopenia y perfil hepático alterado con patrón mixto (hepatocelular y colestásico). Ante la sospecha de EICH se inició el manejo empírico con dosis altas de metilprednisolona y se solicitaron estudios endoscópicos. La esofagogastroduodenoscopia (EGD) demostró como hallazgos relevantes mucosa de primera y segunda porción duodenal con zonas focales de atrofia en parches y ausencia de vellosidades, sin cambios inflamatorios, con mucosa gástrica normal (Figura 1).
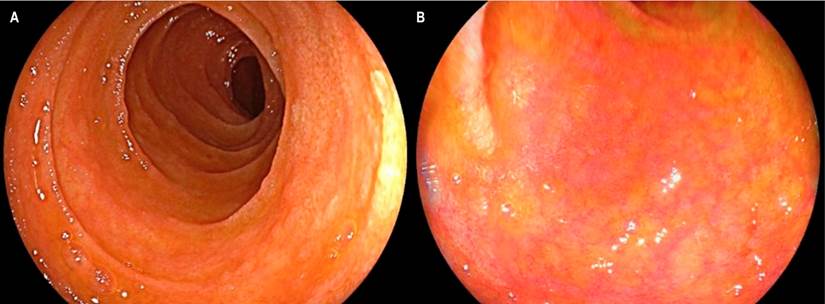
Figura 1 Compromiso por EICH en mucosa duodenal. A. Visión endoscópica con luz blanca que demuestra una reducción en el tamaño y grosor de pliegues duodenales, con mucosa de aspecto atrófico. B. Visión con cromoendoscopia LCI (linked-color imaging) en la que se encontró adelgazamiento de la mucosa, con signos de atrofia y acortamiento de vellosidades.
Por medio de una colonoscopia se accedió al íleon y se encontró atrofia difusa de la mucosa, ausencia de vellosidades, además de marcada friabilidad con sangrado fácil y esfacelación al roce, sangrado moderado e inclusive formación de pequeños hematomas submucosos a la toma de biopsias (Figura 2). La mucosa colónica se encontraba normal. El estudio histopatológico de las biopsias tanto de duodeno como de íleon permitió confirmar el diagnóstico de EICH agudo grado 4/4 (Figura 3). La evolución del paciente fue tórpida con persistencia de la diarrea, alto gasto fecal, sangrado digestivo, desórdenes hidroelectrolíticos de difícil manejo, múltiples transfusiones de hemocomponentes, desarrollo de bacteriemia por Klebsiella pneumoniae y falla respiratoria hipoxémica. Se consideró que cursó con EICH aguda, grave y refractaria a esteroides, con criterios de mal pronóstico, y cuyo desenlace fue la muerte 56 días después de la hospitalización.
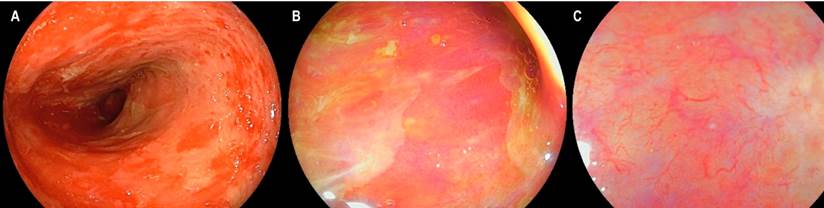
Figura 2 Compromiso por EICH en el íleon terminal. A. Visión endoscópica con luz blanca que demuestra esfacelación de la mucosa ileal en parches, atrofia y marcada friabilidad. B. Visión con LCI que demuestra una zona de denudación con ausencia de vellosidades, hallazgos que se confirman en C al realizar valoración por LCI con magnificación.
Caso 2
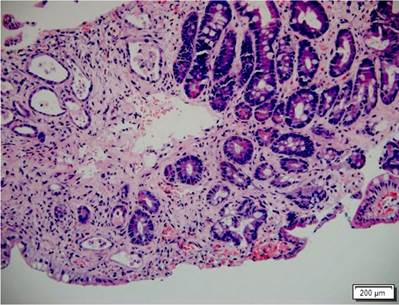
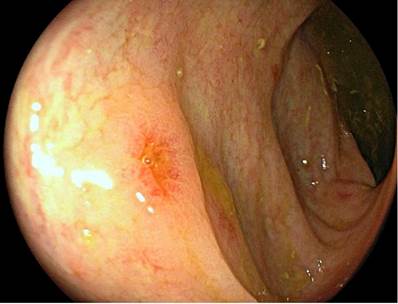
Se presenta el caso de un paciente masculino de 17 años con diagnóstico de linfoma linfoblástico T, que recibió inicialmente terapia de inducción y reinducción con protocolo GRAALL Lysa (citarabina + idarrubicina) con la que se logró la remisión de su enfermedad. Fue llevado a trasplante haploidéntico de progenitores hematopoyéticos con su padre como donante. Durante el proceso de trasplante desarrolló exantema macular difuso, de predominio en las extremidades. La biopsia de piel confirmó el diagnóstico de EICH aguda con compromiso cutáneo grado 3/4. Al día 32 del trasplante comenzó a presentar fiebre, dolor abdominal en el hipogastrio y ambas fosas ilíacas, además de deposiciones líquidas sin moco ni sangre. La tomografía axial computarizada (TAC) de abdomen documentó cambios inflamatorios de la región ileocecal y signos de ileítis terminal, razón por la cual se solicitaron estudios endoscópicos y en la EGD se encontró eritema plano en parches en el estómago, sin cambios inflamatorios en el duodeno. En la colonoscopia se halló mucosa del íleon congestiva con múltiples úlceras, superficiales, irregulares, de bordes planos y superficie lisa; además, en todos los trayectos colónicos incluyendo el recto se evidenciaron pequeñas úlceras puntiformes con fibrina en el centro y bordes planos congestivos (Figura 4). El estudio histopatológico confirmó el diagnóstico de EICH aguda en el íleon grado 3/4, colon derecho 1/4, colon izquierdo 3/4 y recto 4/4 (Figuras 5 y 6). La inmunohistoquímica (IHQ) sobre estas muestras fue negativa para citomegalovirus (CMV).
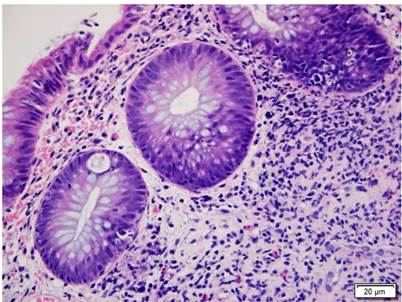
Figura 5 Colon comprometido por EICH. Histopatología de colon con H&E (400 X). Muestra el daño de criptas con cuerpos apoptóticos basales e infiltrado inflamatorio mixto en la lámina propia alrededor de las criptas. EICH grado 1.
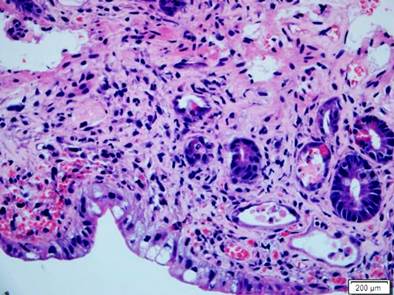
Figura 6 Intestino delgado con compromiso por EICH. Histopatología del intestino delgado con H&E (400 X). Resalta una franca disminución en la cantidad de criptas con depleción marcada de mucina, presencia de cuerpos apoptóticos basales e infiltrado inflamatorio mixto adyacente. EICH grave.
Inicialmente, se brindó manejo con dosis altas de metilprednisolona con respuesta parcial, razón por la cual hacia el día 15 de la enfermedad se decidió llevar a control endoscópico, tanto con EGD, que no demostró ningún hallazgo relevante, como con colonoscopia, que evidenció inclusive un empeoramiento de los hallazgos en el íleon con esfacelación de la mucosa, atrofia difusa con ausencia de vellosidades, sin cambios sobre las ulceraciones en el colon, que se correlacionó en las biopsias con progresión de la EICH aguda a grado 4/4, pero además con positividad para CMV en la IHQ. Se inició el manejo con ganciclovir y se consideró entonces el uso de ruxolitinib como manejo de segunda línea para la EICH. A pesar de esto, la evolución clínica fue hacia el deterioro, con empeoramiento de compromiso hepático por EICH, anemización progresiva por sangrado digestivo, e inclusive se inició terapia de rescate con infliximab sin ninguna respuesta, lo que finalmente condujo al deceso del paciente después de 58 días de hospitalización.
Caso 3
Se trata de una paciente femenina de 41 años con diagnóstico de leucemia mieloide aguda con maduración mielomonocítica, quien fue llevada a trasplante de células madre hematopoyético previa inducción con esquema de quimioterapia HIDAC (dosis altas de citarabina) más midostaurina frente a refractariedad a una primera inducción con un esquema 7 x 3 con citarabina e idarrubicina. Se realizó el trasplante haploidéntico de progenitores hematopoyéticos con su hermano como donante. Ingresó al día 34 postrasplante con un cuadro clínico de 2 semanas consistente en deposiciones diarreicas sin moco ni sangre asociadas con dolor abdominal tipo cólico, náuseas e hiporexia. El estado clínico en general era aceptable, sin signos de choque o respuesta inflamatoria. En los paraclínicos se observó anemia de volúmenes normales y funciones hepática y renal normales. Ante la sospecha de EICH se realizó una EGD sin cambios patológicos y colonoscopia con evidencia de mucosa del colon izquierdo, sigmoide y recto con zonas focales de congestión y microerosiones aftoides. Las biopsias en el duodeno sugirieron EICH agudo grado 1/4 y en recto y sigmoide 3/4.
Dado lo agudo del cuadro, se sospechó colitis infecciosa y por toxina para Clostridium difficile positiva en materia fecal, sin otros signos clínicos sugestivos de EICH. Se brindó manejo con vancomicina oral por 10 días con respuesta inicial adecuada, aunque con una posterior recurrencia de los síntomas, razón por la cual 2 meses después volvió a hospitalizarse. Se realizó un control endoscópico alto y bajo, en el que se encontraron únicamente cicatrices de úlceras en el colon con biopsias sugestivas de EICH grado 1/4 con IHQ negativa para CMV. Por la carga viral sérica positiva para CMV, se brindó el manejo con valganciclovir oral con mejoría de síntomas digestivos. Finalmente, no fue claro si las manifestaciones digestivas de la paciente correspondieron a EICH o cambios por procesos infecciosos múltiples.
Discusión
La EICH es una complicación frecuente en pacientes llevados a trasplante alogénico de células madre. No obstante, también se han reportado casos en pacientes llevados a trasplante de células madre de tipo autólogo, trasplante de órganos sólidos o después de transfusiones sanguíneas1. Existen dos variantes de la enfermedad: aguda y crónica. Previamente se hacía distinción entre ambos tipos a partir del momento de aparición de la complicación (aguda si se presentaba dentro de los primeros 100 días luego del trasplante); sin embargo, en el consenso de 2005 y ratificado en el de 2014 de los National Institutes of Health (NIH) se establece que la diferencia entre ambos tipos se realiza con base en criterios clínicos según el compromiso de los diferentes órganos, en vez de una ventana específica de tiempo4.
La EICH es un desorden multisistémico: los órganos principalmente afectados son la piel, el TGI y el hígado5, y el compromiso digestivo es el más difícil de manejar y el que se asocia con peor pronóstico, pues representa la principal causa de mortalidad relacionada con EICH4-7. Los principales factores de riesgo para EICH aguda incluyen alto grado de disparidad en el complejo mayor de histocompatibilidad (CMHC), presencia de leucemia mieloide crónica, la edad del paciente y del donante, antecedente de EICH aguda, el método de obtención del injerto y discordancia de sexo, principalmente cuando el receptor es masculino y el donante es femenino6,8.
La fisiopatología de la EICH no está completamente dilucidada, se considera que el daño tisular es mediado principalmente por células T del donante y citocinas proinflamatorias6. Inicia con una primera fase de lesión tisular, resultado del régimen mieloablativo con quimiorradioterapia previo al paso del injerto del donante, con posterior producción de citocinas proinflamatorias como el factor de necrosis tumoral alfa (TNF-α) e interleucina (IL) 1, 2 y 6, entre otras, que conducen a un incremento en la expresión de moléculas de adhesión celular, moléculas coestimulantes y antígenos del CMHC, lo que origina una activación de las células presentadoras de antígeno9. Posteriormente, se produce una activación, proliferación y diferenciación de las células T del donante hacia los subtipos Th1, T citotóxicos y Th17, que finalmente culmina con un efecto citotóxico con daño tisular1.
En el TGI, la desregulación inmunitaria produce una perturbación en el epitelio intestinal, específicamente en las células madre, de Paneth y caliciformes6; de hecho, la gravedad histológica en EICH intestinal se categoriza según el grado de daño a las criptas y se ha encontrado que la preservación de células de Paneth en las biopsias duodenales se correlaciona inversamente con la gravedad de la enfermedad, respuesta al tratamiento y mortalidad relacionada con el trasplante7. También se ha planteado que un desbalance en la microbiota intestinal puede tener un rol en el desarrollo de la EICH al existir una relación entre el sistema inmunitario innato y adaptativo con las bacterias intestinales. Factores como el régimen mieloablativo previo al trasplante, el uso de antibióticos de amplio espectro, fármacos inmunosupresores y la adición de linfocitos del donante influyen en este desbalance6,7.
El diagnóstico de la variante aguda es clínico y los criterios del consenso del NIH la subclasifican en una forma clásica, con sintomatología típica dada por la aparición de un exantema maculopapular eritematoso, hepatitis colestásica y síntomas del TGI como diarrea, náusea, vómito y dolor abdominal dentro de los 100 primeros días después del trasplante10; o como una forma persistente, recurrente o de inicio tardío cuando los síntomas típicos se presentan después de los 100 días4. El diagnóstico se puede confirmar con un estudio histopatológico de piel o del TGI1. La EICH aguda puede afectar cualquier segmento del TGI, usualmente de manera parcheada y las manifestaciones en este sistema pueden ser muy sutiles e inespecíficas, lo que constituye un reto diagnóstico. En la orofaringe se puede presentar con una mucositis que puede ser difícil de diferenciar de la inducida por el tratamiento mieloablativo, aunque se espera que esta última se presente dentro de las 3 primeras semanas después del trasplante y, después de este tiempo, podría ser explicado por EICH6.
El compromiso gastroduodenal se presenta con síntomas leves e insidiosos como inapetencia, saciedad temprana, dispepsia y pérdida de peso, lo que puede progresar hasta emesis incesante, epigastralgia y sangrado digestivo3. Se puede afectar también el intestino grueso y delgado, y la diarrea es la manifestación inicial, la cual suele presentarse 2 semanas después del trasplante6. La diarrea por lo general suele ser de tipo secretor y presenta una gravedad de hasta varios litros al día; a medida que progresa el proceso inflamatorio, se puede producir una pérdida de proteínas por la mucosa, esto genera deposiciones con moco y, finalmente, sanguinolentas en el contexto de una denudación completa del epitelio, particularmente en el íleon9. La lesión de la mucosa con pérdida de proteínas puede conducir a malabsorción y malnutrición6.
La variante crónica puede tener una presentación más variada con compromiso a múltiples órganos en los que se incluyen pulmones, sistema hepatobiliar, sistema musculoesquelético, TGI y piel1. El diagnóstico se realiza a partir de la identificación de signos y síntomas patognomónicos, los cuales en caso de estar presentes son suficientes para el diagnóstico, como la poiquilodermia en la piel o estenosis en el TGI4. Finalmente, también se describe un subtipo de la variante crónica, la cual se caracteriza por presentar síntomas típicos de la variante aguda de manera simultánea; este subtipo se conoce como síndrome de superposición y conlleva un peor pronóstico que la variante crónica clásica10.
Los estudios endoscópicos son pieza fundamental en el estudio de la EICH. En general, tienen un buen rendimiento y son seguros, con bajas tasas de complicación11. La presentación de la EICH varía dependiendo de la extensión y gravedad, y puede ir desde zonas parcheadas de mucosa con eritema leve y superficial hasta ulceraciones con esfacelación y denudación completa de la mucosa (Tabla 1). Usar técnicas endoscópicas con magnificación favorece la detección de cambios sutiles como acortamiento y reducción en la cantidad de las vellosidades en el duodeno e íleon12. Desde el punto de vista histológico, la gravedad de los hallazgos va a estar definida por el grado de apoptosis celular en las criptas, la presencia de necrosis o, así como en la endoscopia, la evidencia de denudación completa de la mucosa (Tabla 2).
Tabla 1 Clasificación de Freiburg
| Grado | Hallazgo endoscópico |
|---|---|
| 1 | Mucosa normal |
| 2 | Eritema en parches |
| 3 | Lesiones aftoides o erosión focal |
| 4 | Erosiones confluentes, ulceración o denudación de la mucosa |
Modificado de13.
Dado el amplio espectro de presentación en el TGI, el rendimiento de los estudios endoscópicos en el diagnóstico de la EICH es variable con sensibilidad y especificidad de un 34 %-89 % y un 65 %-79 %, respectivamente, y con concordancia entre la endoscopia y la histología, que puede ser tan baja como el 38 %13,14. Estos también se utilizan para descartar otros diagnósticos diferenciales como enteritis y colitis por micofenolato, infección por gérmenes como CMV, C. difficile o virus entéricos comunes (adenovirus, rotavirus, norovirus, entre otros). Particularmente en el contexto de CMV, dadas las altas tasas de infección en pacientes con trasplante de médula ósea (hasta 15 %) y la importancia de su diagnóstico, se sugiere siempre en las biopsias realizar estudio de IHQ o reacción en cadena de la polimerasa (PCR) en tejido. De igual manera, la infección por C. difficile puede presentarse entre el 12 % y 27 % en este grupo de pacientes, razón por la cual también es importante descartarlo antes de considerar el diagnóstico de EICH15. Se recomienda entonces siempre la toma de biopsias, tanto de mucosa sana como de mucosa con cambios inflamatorios6.
Tabla 2 Clasificación de la gravedad
| Grado | Hallazgo patológico |
|---|---|
| 1 | Aumento de apoptosis en las criptas |
| 2 | Apoptosis con abscesos crípticos |
| 3 | Necrosis individual de criptas |
| 4 | Total de denudación de la mucosa en áreas |
Modificado de6.
El rendimiento diagnóstico de los estudios endoscópicos con biopsias es variable: 67 %-80 % para la EGD, 58 %-80 % para la rectosigmoidoscopia (RSC), 83 %-87 % para la colonoscopia, 87 %-100 % para la ileocolonoscopia y 92 %-93 % para la EGD con RSC11,13. Varios estudios sugieren que la RSC con toma de biopsias del colon distal podría tener mayor precisión en el diagnóstico de EICH aguda (82 %-95 %), por lo que se considera el estudio inicial de elección, además por su facilidad para la preparación y realización13. Las guías de la American Society for Gastrointestinal Endoscopy (ASGE) para el abordaje de la diarrea avalan esta recomendación y sugieren realizar EGD en los casos que la RSC no demuestre diagnóstico, o si se presentan síntomas digestivos superiores16. Otra guía publicada por la misma sociedad para la toma de muestras en endoscopia sugiere dos abordajes: RSC con 4 biopsias de recto y colon izquierdo: si no se obtiene diagnóstico, añadir EGD con biopsias de cuerpo, antro y duodeno (4 en cada segmento); o ileocolonoscopia con 4 biopsias de íleon distal, colon derecho, transverso, izquierdo y rectosigmoide17. Es importante tener en cuenta que en los casos en los que se sospeche de CMV, realizar solamente RSC podría ser insuficiente; sería ideal realizar una colonoscopia completa. Al momento de la toma de biopsias se deberán evitar zonas con inflamación muy grave, por la dificultad en la interpretación para el patólogo y para reducir el riesgo de hematomas (en pacientes con trombocitopenia) e inclusive perforación, particularmente en el duodeno e íleon11. Se recomienda de igual manera el uso de antibióticos profilácticos en pacientes con conteo de neutrófilos < 500 células/µL.
Los hallazgos endoscópicos también pueden predecir la respuesta al manejo con esteroides. En un estudio reciente de 44 pacientes con EICH agudo, de los cuales el 45% fue considerado corticorresistente, se encontró que la presencia de hallazgos macroscópicos en el íleon, hallazgos histológicos en el íleon y colon y la presencia de tejido de granulación en las biopsias fueron predictores de refractariedad a la terapia con esteroides18. En pacientes con falla terapéutica a la primera línea de manejo se podría considerar repetir los estudios endoscópicos para reevaluar el estadio de la enfermedad, objetivar el grado de respuesta y descartar diagnósticos diferenciales (hasta un 25 % de los pacientes con falla terapéutica podría tener infección por CMV en la segunda revisión endoscópica)19. Finalmente, algunos estudios pequeños de pacientes con sospecha de EICH y cápsula endoscópica han encontrado una alta sensibilidad (100 %) y valor predictivo negativo (VPN). Los hallazgos, así como en los estudios convencionales, usualmente son parcheados y van desde eritema hasta erosiones o ulceraciones20-22. En general, se recomienda su uso en pacientes con alta sospecha de EICH y que por su condición clínica no puedan tolerar la realización de estudios convencionales.
El estándar de manejo de la EICH es los esteroides a dosis altas, particularmente se recomienda el uso de metilprednisolona 1-2 mg/kg/día en dosis divididas o prednisolona (1 mg/kg/día). En compromiso colónico por EICH se ha descrito el uso de budesónida MMX6,23. La respuesta a la terapia con esteroides es variable, y hasta un 31 %-57 % de los pacientes puede ser corticorresistente24. En pacientes con síntomas digestivos graves se debería suspender la ingesta por vía oral y brindar nutrición parenteral. Para síntomas digestivos superiores se sugiere el uso de inhibidores de la bomba de protones (IBP) y sucralfato. Se deberá evitar el uso de antiinflamatorios no esteroideos (AINE) y opiáceos, incluyendo la loperamida, dado el riesgo de sangrado e íleo. Para el control de la diarrea se ha descrito el uso de octreotida y colestiramina, pero se deberán tener en cuenta potenciales efectos adversos y el riesgo de alteración en la absorción de otros medicamentos25,26.
Conclusión
En los tres casos presentados encontramos el amplio espectro de presentación de la EICH, desde síntomas y cambios leves en la mucosa, dados por eritema y erosiones, hasta síntomas graves, como sangrado, diarrea de difícil manejo y cambios extensos en el intestino con denudación de la mucosa y atrofia grave en el intestino delgado. Encontramos utilidad al uso de la magnificación, particularmente en el intestino delgado, donde hubo una correlación significativa entre la endoscopia y las biopsias, con respecto a la atrofia. Se debe tener en cuenta el riesgo de complicaciones asociadas con los procedimientos endoscópicos, particularmente sangrado y perforación, que, aunque no se presentaron en nuestros casos, hubo algunos signos como hematomas submucosos con las biopsias, que alertaron sobre la limitación en la cantidad de muestras a tomar. Es importante descartar diagnósticos diferenciales, sobre todo infecciosos, que podrían tener impacto en los desenlaces del paciente; así como vimos en nuestros casos, repetir los estudios endoscópicos podría ser útil en el seguimiento y excluir infección por gérmenes oportunistas. En pacientes de alto riesgo, por su condición clínica, debe considerarse una adherencia a las recomendaciones de la ASGE, realizando únicamente RSC para el diagnóstico de EICH, pero teniendo en cuenta que con la ileocolonoscopia se realiza un abordaje diagnóstico más completo.
REFERENCIAS
1. Ramachandran V, Kolli SS, Strowd LC. Review of Graft-Versus-Host Disease. Dermatol Clin. 2019;37(4):569-82. https://doi.org/10.1016/j.det.2019.05.014 [ Links ]
2. Jagasia M, Arora M, Flowers MED, Chao NJ, McCarthy PL, Cutler CS, et al. Risk factors for acute GVHD and survival after hematopoietic cell transplantation. Blood. 2012;119(1):296-307. https://doi.org/10.1182/blood-2011-06-364265 [ Links ]
3. Ratanatharathorn V, Nash RA, Przepiorka D, Devine SM, Klein JL, Weisdorf D, et al. Phase III study comparing methotrexate and tacrolimus (prograf, FK506) with methotrexate and cyclosporine for graft-versus-host disease prophylaxis after HLA-identical sibling bone marrow transplantation. Blood. 1998;92(7):2303-14. [ Links ]
4. Jagasia MH, Greinix HT, Arora M, Williams KM, Wolff D, Cowen EW, et al. National Institutes of Health Consensus Development Project on Criteria for Clinical Trials in Chronic Graft-versus-Host Disease: I. The 2014 Diagnosis and Staging Working Group Report. Biol Blood Marrow Transplant. 2015;21(3):389-401.e1. [ Links ]
5. Endo K, Fujishima F, Kuroha M, Moroi R, Onodera M, Naito T, et al. Effective and less invasive diagnostic strategy for gastrointestinal GVHD. Endosc Int Open. 2018;06(03):E281-91. https://doi.org/10.1055/s-0043-122226 [ Links ]
6. Naymagon S, Naymagon L, Wong SY, Ko HM, Renteria A, Levine J, et al. Acute graft-versus-host disease of the gut: Considerations for the gastroenterologist. Nat Rev Gastroenterol Hepatol. 2017;14(12):711-26. https://doi.org/10.1038/nrgastro.2017.126 [ Links ]
7. Ferrara JLM, Chaudhry MS. GVHD: Biology matters. Blood Adv. 2018;2(22):3411-7. https://doi.org/10.1182/bloodadvances.2018020214 [ Links ]
8. Saidu NEB, Bonini C, Dickinson A, Grce M, Inngjerdingen M, Koehl U, et al. New Approaches for the Treatment of Chronic Graft-Versus-Host Disease: Current Status and Future Directions. Front Immunol. 2020 Oct 9;11:578314. https://doi.org/10.3389/fimmu.2020.578314 [ Links ]
9. Jamil MO, Mineishi S. State-of-the-art acute and chronic GVHD treatment. Int J Hematol. 2015;101(5):452-66. https://doi.org/10.1007/s12185-015-1785-1 [ Links ]
10. Socié G, Ritz J. Current issues in chronic graft-versus-host disease. Blood. 2014;124(3):374-84. https://doi.org/10.1182/blood-2014-01-514752 [ Links ]
11. Rajan AV, Trieu H, Chu P, Lin J, Kidambi TD. Assessing the yield and safety of endoscopy in acute graft-vs-host disease after hematopoietic stem cell transplant. World J Gastrointest Endosc. 2020;12(10):341-54. https://doi.org/10.4253/wjge.v12.i10.341 [ Links ]
12. Matsuda K, Ono S, Tanaka I, Inoue M, Kinowaki S, Ishikawa M, et al. Histological and magnified endoscopic evaluation of villous atrophy in gastrointestinal graft-versus-host disease. Ann Hematol. 2020;99(5):1121-8. https://doi.org/10.1007/s00277-020-03966-y [ Links ]
13. Kreisel W, Dahlberg M, Bertz H, Harder J, Potthoff K, Deibert P, et al. Endoscopic diagnosis of acute intestinal GVHD following allogeneic hematopoietic SCT: a retrospective analysis in 175 patients. Bone Marrow Transplant. 2012;47(3):430-8. https://doi.org/10.1038/bmt.2011.137 [ Links ]
14. Velasco-Guardado A, López-Corral L, Alvarez-Delgado A, Flores-Corral T, Geijo-Martínez F, Caballero-Barrigón D, et al. Endoscopic evaluation and histological findings in graft-versus-host disease. Rev Espanola Enfermedades Dig Organo Of Soc Espanola Patol Dig. 2012;104(6):310-4. https://doi.org/10.4321/S1130-01082012000600005 [ Links ]
15. Trifilio SM, Pi J, Mehta J. Changing epidemiology of Clostridium difficile-associated disease during stem cell transplantation. Biol Blood Marrow Transplant J Am Soc Blood Marrow Transplant. 2013;19(3):405-9. https://doi.org/10.1016/j.bbmt.2012.10.030 [ Links ]
16. ASGE Standards of Practice Committee, Shen B, Khan K, Ikenberry SO, Anderson MA, Banerjee S, et al. The role of endoscopy in the management of patients with diarrhea. Gastrointest Endosc. 2010;71(6):887-92. https://doi.org/10.1016/j.gie.2009.11.025 [ Links ]
17. ASGE Standards of Practice Committee, Sharaf RN, Shergill AK, Odze RD, Krinsky ML, Fukami N, et al. Endoscopic mucosal tissue sampling. Gastrointest Endosc. 2013;78(2):216-24. https://doi.org/10.1016/j.gie.2013.04.167 [ Links ]
18. Morita K, Fujiwara S-I, Ikeda T, Kawaguchi S-I, Toda Y, Ito S, et al. Identification of endoscopic factors that predict poor responses to steroids in patients with gastrointestinal acute graft-versus-host disease. Bone Marrow Transplant. 2021;56(4):963-967. https://doi.org/10.1038/s41409-020-01096-7 [ Links ]
19. Bhutani D, Dyson G, Manasa R, Deol A, Ratanatharathorn V, Ayash L, et al. Incidence, risk factors, and outcome of cytomegalovirus viremia and gastroenteritis in patients with gastrointestinal graft-versus-host disease. Biol Blood Marrow Transplant J Am Soc Blood Marrow Transplant. 2015;21(1):159-64. https://doi.org/10.1016/j.bbmt.2014.10.004 [ Links ]
20. Malard F, Mohty M. New insight for the diagnosis of gastrointestinal acute graft-versus-host disease. Mediators Inflamm. 2014;2014:701013. https://doi.org/10.1155/2014/701013 [ Links ]
21. Coron E, Laurent V, Malard F, Le Rhun M, Chevallier P, Guillaume T, et al. Early detection of acute graft-versus-host disease by wireless capsule endoscopy and probe-based confocal laser endomicroscopy: results of a pilot study. United Eur Gastroenterol J. 2014;2(3):206-15. https://doi.org/10.1177/2050640614529283 [ Links ]
22. Blanco-Velasco G, Palos-Cuellar R, Domínguez-García MR, Solórzano-Pineda OM, Zamarripa-Mottú RA, Martínez-Camacho C, et al. Utility of capsule endoscopy in the diagnosis of gastrointestinal graft-versus-host disease. Rev Gastroenterol Mex. 2021;86(3):215-219. https://doi.org/10.1055/s-0040-1704848 [ Links ]
23. Bertz H, Afting M, Kreisel W, Duffner U, Greinwald R, Finke J. Feasibility and response to budesonide as topical corticosteroid therapy for acute intestinal GVHD. Bone Marrow Transplant. 1999;24(11):1185-9. https://doi.org/10.1038/sj.bmt.1702055 [ Links ]
24. MacMillan ML, Robin M, Harris AC, DeFor TE, Martin PJ, Alousi A, et al. A refined risk score for acute graft-versus-host disease that predicts response to initial therapy, survival, and transplant-related mortality. Biol Blood Marrow Transplant J Am Soc Blood Marrow Transplant. 2015;21(4):761-7. https://doi.org/10.1016/j.bbmt.2015.01.001 [ Links ]
25. Ippoliti C, Champlin R, Bugazia N, Przepiorka D, Neumann J, Giralt S, et al. Use of octreotide in the symptomatic management of diarrhea induced by graft-versus-host disease in patients with hematologic malignancies. J Clin Oncol Off J Am Soc Clin Oncol. 1997;15(11):3350-4. https://doi.org/10.1200/JCO.1997.15.11.3350 [ Links ]
26. Akpek G, Valladares JL, Lee L, Margolis J, Vogelsang GB. Pancreatic insufficiency in patients with chronic graft-versus-host disease. Bone Marrow Transplant. 2001;27(2):163-6. https://doi.org/10.1038/sj.bmt.1702769 [ Links ]
Citación: Gómez-Venegas AA, Mosquera-Klinger G, Carvajal JJ, Juliao-Baños F, Goldstein-Rothstein A, Pérez-Cadavid JC, Morantes-Rubiano JF. Compromiso gastrointestinal por enfermedad de injerto contra huésped. Rev Colomb Gastroenterol. 2022;37(2):225-232. https://doi.org/10.22516/25007440.771
Recibido: 03 de Mayo de 2021; Aprobado: 02 de Junio de 2021











 texto em
texto em