Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista colombiana de Gastroenterología
versión impresa ISSN 0120-9957versión On-line ISSN 2500-7440
Rev. colomb. Gastroenterol. vol.37 no.3 Bogotá jul./set. 2022 Epub 21-Dic-2022
https://doi.org/10.22516/25007440.813
Reporte de caso
Presentación polipoide de un tumor neuroendocrino: reporte de caso y revisión de la literatura
1General Surgery Resident, Universidad Industrial de Santander. Bucaramanga, Colombia
2Coloproctologist, Universidad Industrial de Santander, Universidad Militar Nueva Granada, Clínica Foscal, Hospital Universitario de Santander. Bogotá, Colombia.
3General Physician, Universidad Industrial de Santander. Bucaramanga, Colombia
4Pathology Resident, Universidad Industrial de Santander. Bucaramanga, Colombia
Debido a la implementación de las colonoscopias como método de tamizaje, ha aumentado el diagnóstico de tumores neuroendocrinos rectales (TNER), la mayoría tiene un tamaño menor de 1 centímetro en el momento del diagnóstico, confinado a la submucosa y bien diferenciado; generalmente tienen un curso benigno y en su mayoría se tratan por métodos endoscópicos. Las metástasis son raras y dependen del tamaño tumoral y otros factores como la invasión a la submucosa, diseminación linfática y clasificación histológica, lo cual determinará el pronóstico y tratamiento a elección. Se presenta el caso de un tumor neuroendocrino rectal presentado en forma de pólipo durante un tamizaje endoscópico de rutina y una aproximación de la literatura actual.
Palabras clave: Tumor neuroendocrino; neoplasia rectal; pólipo
Diagnosis of rectal neuroendocrine tumor (NET) has increased due to the implementation of colonoscopies as a screening method. Most rectal NETs are less than 1cm at diagnosis time, confined to the submucosa, and well differentiated. They generally have a benign course and are treated mainly using endoscopic methods. Metastases are rare and depend on tumor size and other factors such as submucosal invasion, lymphatic spread, and histologic classification, which will determine the prognosis and treatment. We present a case of a rectal neuroendocrine tumor as a polyp during routine endoscopic screening and a review of the current literature.
Keywords: Neuroendocrine tumor; rectal neoplasia; polyp
Introducción
Los tumores neuroendocrinos (TNE) se han diagnosticado con más frecuencia en las últimas décadas gracias a la implementación de la colonoscopia y estudios complementarios de imagen en enfermedades gastrointestinales; tienen características histológicas, biológicas y clínicas distintivas1; se originan en las células neuroendocrinas provenientes del endodermo ubicadas a lo largo de la mucosa y submucosa del tracto gastrointestinal1) con capacidad de sintetizar y secretar monoaminas, péptidos y hormonas, y de transmitir y recibir señales nerviosas2. Descubiertos en 1888 por Lubarsch, posteriormente en 1907 Obendorfer bautiza estos tumores como carcinoides (parecidos a un carcinoma); en la actualidad se conocen como tumor neuroendocrino (TNE) teniendo en cuenta su etiología, comportamiento y localización3,4.
Los TNE constituyen el 0,5 % de todos los cánceres malignos y el 2 % de los tumores malignos del tracto gastrointestinal2, presentan una incidencia de 0,86 por 100 000 habitantes aproximadamente, frecuentes en varones de raza negra con mayor predisposición en la población asiática4-7. Los TNE rectales representan el 18 % del total de TNE y el 27 % de los TNE gastrointestinales5.
La presentación clínica es inespecífica, puede haber sangrado rectal, alteraciones del ritmo intestinal, dolor abdominal y síndrome carcinoide en 10 % de los casos6,7; sin embargo, casi la mitad de los pacientes es asintomática y se diagnostica en la colonoscopia de tamizaje o en otros estudios de patología colorrectal7-9. Generalmente se hallan en forma de tumoraciones pequeñas únicas de tipo polipoide, la enfermedad metastásica es poco frecuente, el tamaño tumoral y la invasión demarcan el pronóstico de la enfermedad10-13.
En la última edición de la clasificación de tumores digestivos de la Organización Mundial de la Salud (OMS) (quinta edición, publicada en 2019) se mantiene la clasificación de los TNE bien diferenciados o carcinomas neuroendocrinos mal diferenciados con subtipo de células pequeñas y células grandes14. La clasificación histológica se basa en el índice mitótico y el índice Ki-67 que se registran en los puntos calientes del tumor. Durante la división celular, la proteína Ki-67 se encuentra en el núcleo celular. La proporción de células tumorales positivas para Ki-67 (índice Ki-67) se correlaciona con la proliferación celular, el curso clínico y su pronóstico2,14-16. La clasificación de la OMS de 2019 de TNE se describe en la Tabla 1.
Tabla 1 Clasificación de tumores neuroendocrinos, OMS, 201916
| Índice Ki-67 (%) | Mitosis/10 CAP | |
|---|---|---|
| Neoplasias neuroendocrinas bien diferenciadas | ||
| Grado 1 (bajo) | < 3 | < 2 |
| Grado 2 (intermedio) | 3-20 | 2-20 |
| Grado 3 (alto) | > 20 | > 20 |
| Neoplasias neuroendocrinas pobremente diferenciada | ||
| N/A (sin asignación numérica: alto grado) | > 20 | > 20 |
CAP: campos de alto poder; N/A: no aplica. Tomado y adaptado de: Lloyd RV, Osamura RY, Kloppel G, Rosai J. WHO Classification of Tumors of Endocrine Organs. 5.a edición. WHO; 2019.
En general, los tumores bien diferenciados son de grado bajo o intermedio, los TNE de alto grado bien diferenciados son menos frecuentes, pero tienen mejor pronóstico que los TNE pobremente diferenciados, clasificación fundamental para conocer el curso de la enfermedad y definir el tratamiento más adecuado para el paciente1,12-14. A continuación, se presenta el caso de un tumor neuroendocrino presentado en forma de pólipo en el recto.
Presentación de caso
Se trata de una paciente femenina de 88 años con antecedente de hipertensión arterial, hiperlipidemia, diabetes mellitus tipo II, cáncer de mama en remisión y hemorroides internas grado I quien consultó por un cuadro clínico de larga data caracterizado por estreñimiento, sin otros síntomas gastrointestinales. Se le indicó una colonoscopia en la cual se evidenció un pólipo en el tercio superior del recto a 12 cm del borde anal de 2 cm de diámetro (Figura 1). Se realizó una polipectomía y se envió una muestra a estudio patológico, el cual reportó hallazgos morfológicos compatibles con tumor neuroendocrino bien diferenciado, tamaño tumoral de 1 cm de dimensión mayor, localización submucosa, márgenes de resección laterales y profundos negativos para compromiso tumoral (Figuras 2 y 3). La tinción de inmunohistoquímica evidenció un tumor neuroendocrino bien diferenciado de baja tasa mitótica con Ki-67 < 1 %. Se indicó continuar con seguimiento ambulatorio con colonoscopia de control en 1 año.
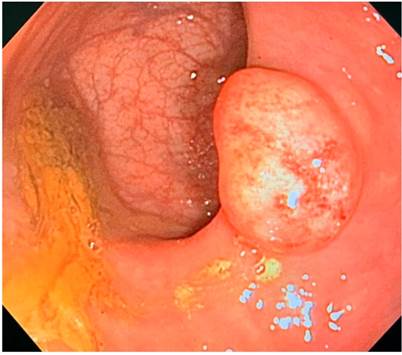
Figura 1 Imagen tomada de la colonoscopia que muestra un pólipo neuroendocrino en el tercio superior del recto de 2 cm de diámetro.
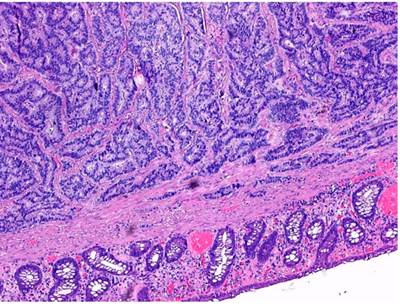
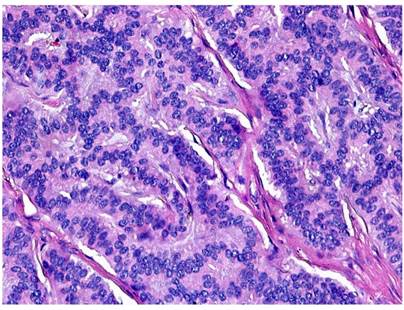
Figura 2 El corte de colón muestra una lesión submucosa de patrón organoide (4x). Tinción de hematoxilina y eosina (H&E).
Discusión
Durante los últimos años se ha incrementado el diagnóstico de los TNE rectales gracias al uso de la colonoscopia como método de tamizaje en cáncer de colon y la implementación de otros estudios de imagen del tracto gastrointestinal5. En una cohorte británica de 13 061 716 pacientes que fueron tamizados con sangre oculta en materia fecal, 259 765 de los participantes obtuvieron resultados anormales y se realizaron 216 707 colonoscopias de tamizaje; 146 pacientes tuvieron diagnóstico de TNE y se evidenció que las tasas de diagnóstico por 100 000 colonoscopias fueron 29 rectales, 18 colónicas y 11 TNE ileales17.
Existe una tendencia al retraso en el diagnóstico de todos los tipos de TNE, el cual puede ser hasta de 5 años, lo cual se relaciona con su presentación clínica asintomática17,18. Los TNE rectales en su gran mayoría (93 %-100 %) de tienen un tamaño < 1 cm al momento del diagnóstico, están confinados a la submucosa, son bien diferenciados y generalmente tienen un curso clínico benigno14,19.
El riesgo de enfermedad metastásica de los TNE aumenta con el tamaño del tumor, que es hasta del 60 %-80 % cuando es ≥ 2 cm20. El tamaño del tumor > 10 mm y la invasión muscular y linfovascular se asocian de forma independiente con un mayor riesgo de metástasis20,21; sin embargo, se registra una mayor detección de la enfermedad en estadios tempranos relacionado con menor riesgo de metástasis. En un estudio retrospectivo que evaluó a 48 pacientes evidenció que los tumores en estadios I (TNM) representaron el 78,8 % y fueron los más frecuentes, mientras que las metástasis a distancia presentaron menor incidencia22, lo cual se relaciona con los hallazgos de una revisión sistemática reciente en la que se evidenció que solo el 5 % medía más de 20 mm al momento del diagnóstico20,21. La ecografía endoscópica y la resonancia magnética (RM) se usan para evaluar el tamaño exacto del tumor, su extensión en la pared rectal y el estado de los ganglios linfáticos perirrectales, lo que facilita una mejor selección del tratamiento y mejora la tasa de resección completa10.
Se puede usar una variedad de procedimientos endoscópicos en la resección de TNE rectales, incluida la polipectomía convencional, resección endoscópica de la mucosa y disección submucosa endoscópica10,19. Según el consenso de la Sociedad Europea de Tumores Neuroendocrinos, los TNE rectales bien diferenciados por debajo de 1,5 cm sin invasión de la muscularis propia o afectación de los ganglios linfáticos pueden tratarse inicialmente por vía endoscópica10,20. Se debe considerar la escisión transanal cuando los márgenes de la resección endoscópica son positivos19. Se deben tener en cuenta a distancia entre el tumor y el canal anal y el potencial del tumor para causar obstrucción para elegir el tratamiento más apropiado19-21. Cuando existen ganglios linfáticos locorregionales positivos o la invasión de la muscularis propia deben elegirse métodos más radicales como la escisión con resección anterior baja o resección abdominoperineal20,21.
Según la Sociedad Europea de Tumores Neuroendocrinos (SETNE), los pacientes deben someterse a vigilancia después de la resección completa de los TNE rectales, como se describe en la Tabla 2.
Los TNE rectales tienen la mejor supervivencia general de todos los TNE gastroenteropancreáticos, esto se debe en gran parte a la alta incidencia de TNE rectales pequeños que no tienen evidencia de invasión y tienen un pronóstico excelente a largo plazo21,23. Los NETS rectales localizados (T1, N0, M0) tienen una supervivencia a 5 años del 98 %-100 %, mientras que aquellos con metástasis regionales (N1) y a distancia (M1) tienen una supervivencia de 54 %-74 % y 15 %-37 %, respectivamente5,23,24.
Tabla 2 Indicaciones de seguimiento y vigilancia de acuerdo con el tamaño y grado tumoral según la SETNE6,10,14,21
| Tamaño | Grado | Seguimiento |
|---|---|---|
| < 1 cm | 1-2 | No se necesita vigilancia |
| < 1 cm | 3 | Colonoscopia anual durante 5 años |
| 1-2 cm | N/A | Colonoscopia, ecografía y RM a los 12 meses, luego colonoscopia cada 5 años |
| > 2 cm | 1-2 | Colonoscopia y RM anual por 5 años |
| > 2 cm | 3 | Colonoscopia y RM cada 4 a 6 meses durante el primer año, luego anualmente durante 5 años |
N/A: no aplica; RM: resonancia magnética; SETNE: Sociedad Europea de Tumores Neuroendocrinos.
Se resalta la importancia de realizar el tamizaje endoscópico regular en pacientes seleccionados, detectar y reconocer tempranamente la presencia de TNE para evitar las complicaciones relacionadas con los estados avanzados de dicha enfermedad y, con ello, disminuir las tasas de morbimortalidad. Al momento de evaluar pólipos del tracto gastrointestinal, se debe considerar como posibilidad el diagnóstico de TNE y tener en cuenta sus características para definir pronósticos y seguimiento.
Conclusión
Gracias a la incursión de la colonoscopia como método de screening en el cáncer colorrectal, ha aumentado el diagnóstico de los TNE rectales; aún se desconocen los factores de riesgo que pueden llevar a su aparición dada la carencia de estudios epidemiológicos grandes. En general, al momento del diagnóstico, los tumores en su mayoría son menores de 1 cm, bien diferenciados y se pueden encontrar en forma polipoide, como es nuestro caso, lo cual les confiere mejor pronóstico a largo plazo; dado su menor tamaño, se pueden tratar endoscópicamente sin ningún riesgo; no obstante, se debe tener en cuenta la clasificación histológica, el tamaño y localización para definir la necesidad de tratamientos más radicales. Los TNE rectales tienen mejor supervivencia general de todos los TNE, es importante continuar la tamización poblacional mediante el estudio endoscópico para la detección temprana y tratamiento de este tipo de tumores.
REFERENCIAS
1. Bolsolino A. Tumores neuroendocrinos de colon y recto. Acta Gastroenterol Latinoam. 2018;48(4):328-338. [ Links ]
2. Ahmed M. Gastrointestinal neuroendocrine tumors in 2020. World J Gastrointest Oncol. 2020;12(8):791-807. https://doi.org/10.4251/wjgo.v12.i8.791 [ Links ]
3. Lubarsch O. Uber den primaren Krebs des Ileum nebst Bemerkungen uber das gleichzeitige Vorkommen von Krebs und Tuberkulose. Virchows Arch. 1888;3:280-317. https://doi.org/10.1007/BF01966242 [ Links ]
4. Oberndorfer S. Karzinoid Tumore des Dunndarms. Frankf Z Pathol. 1907;1:426-30. [ Links ]
5. Hrabe J. Neuroendocrine Tumors of the Appendix, Colon, and Rectum. Surg Oncol Clin N Am. 2020;29(2):267-279. https://doi.org/10.1016/j.soc.2019.11.010 [ Links ]
6. André TR, Brito M, Freire JG, Moreira A. Rectal and anal canal neuroendocrine tumours. J Gastrointest Oncol. 2018;9(2):354-357. https://doi.org/10.21037/jgo.2017.10.01 [ Links ]
7. Partelli S, Maurizi A, Tamburrino D, Baldoni A, Polenta V, Crippa S, et al. GEP-NETS update: a review on surgery of gastro-entero-pancreatic neuroendocrine tumors. Eur J Endocrinol. 2014;171(4):R153-62. https://doi.org/10.1530/EJE-14-0173 [ Links ]
8. Jann H, Roll S, Couvelard A, Hentic O, Pavel M, Müller-Nordhorn J, et al. Neuroendocrine tumors of midgut and hindgut origin: tumor-node-metastasis classification determines clinical outcome. Cancer. 2011;117(15):3332-41. https://doi.org/10.1002/cncr.25855 [ Links ]
9. Tichansky DS, Cagir B, Borrazzo E. Risk of second cancer in patients with colorectal carcinoids. Dis Colon Rectum 2002;45(1):91-97. https://doi.org/10.1007/s10350-004-6119-y [ Links ]
10. Caplin M, Sundin A, Nillson O, Baum RP, Klose KJ, Kelestimur F, et al. Barcelona Consensus Conference participants. ENETS Consensus Guidelines for the management with digestive neuroendocrine neoplasms: colorectal neuroendocrine neoplasms. Neuroendocrinology 2012;95(2):88-97. https://doi.org/10.1159/000335594 [ Links ]
11. Starzyńska T, Deptała A, Królicki L, Kunikowska J, Londzin-Olesik M, Nasierowska-Guttmejer A, et al. Colorectal neuroendocrine neoplasms - management guidelines (recommended by the Polish Network of Neuroendocrine Tumours). Endokrynol Pol. 2013;64(6):494-504. https://doi.org/10.5603/EP.2013.0032 [ Links ]
12. Ramage JK, De Herder WW, Delle Fave G, Ferolla P, Ferone D, Ito T, et al. ENETS Consensus Guidelines Update for Colorectal Neuroendocrine Neoplasms. Neuroendocrinology. 2016;103(2):139-43. https://doi.org/10.1159/000443166 [ Links ]
13. Ramage JK, Ahmed A, Ardill J, Bax N, Breen DJ, Caplin ME, et al. Guidelines for the management of gastroenteropancreatic neuroendocrine (including carcinoid) tumours (NETs). Gut. 2012;61(1):6-32. https://doi.org/10.1136/gutjnl-2011-300831 [ Links ]
14. Gonzalez RS. Diagnosis and Management of Gastrointestinal Neuroendocrine Neoplasms. Surg Pathol Clin. 2020;13(3):377-397. https://doi.org/10.1016/j.path.2020.04.002 [ Links ]
15. Kim JY, Hong SM, Ro JY. Recent updates on grading and classification of neuroendocrine tumors. Ann Diagn Pathol. 2017;29:11-16. https://doi.org/10.1016/j.anndiagpath.2017.04.005 [ Links ]
16. Lloyd RV, Osamura RY, Kloppel G, Rosai J. WHO Classification of Tumors of Endocrine Organs. 5.a edición. WHO; 2019. [ Links ]
17. Basuroy R, O›Donnell CM, Srirajaskanthan R, Ramage JK. Ileocolonic neuroendocrine tumours identified in the English bowel cancer screening programme. Colorectal Dis. 2018;20(4):O85-O91. https://doi.org/10.1111/codi.14033 [ Links ]
18. Shim KN, Yang SK, Myung SJ, Chang HS, Jung SA, Choe JW, et al. Atypical endoscopic features of rectal carcinoids. Endoscopy. 2004;36(4):313-316. https://doi.org/10.1055/s-2004-814202 [ Links ]
19. Rakici H, Akdogan RA, Yurdakul C, Canturk N. A case of rectal neuroendocrine tumor presenting as polyp. Int J Surg Case Rep. 2015;8C:59-61. https://doi.org/10.1016/j.ijscr.2015.01.031 [ Links ]
20. Bertani E, Ravizza D, Milione M, Massironi S, Grana CM, Zerini D, et al. Neuroendocrine neoplasms of rectum: A management update. Cancer Treat Rev. 2018;66:45-55. https://doi.org/10.1016/j.ctrv.2018.04.003 [ Links ]
21. Basuroy R, Haji A, Ramage JK, Quaglia A, Srirajaskanthan R. Review article: the investigation and management of rectal neuroendocrine tumours. Aliment Pharmacol Ther. 2016;44(4):332-45. https://doi.org/10.1111/apt.13697 [ Links ]
22. Chi Y, Du F, Zhao H, Wang JW, Cai JQ. Characteristics and long-term prognosis of patients with rectal neuroendocrine tumors. World J Gastroenterol. 2014;20(43):16252-16257. https://doi.org/10.3748/wjg.v20.i43.16252 [ Links ]
23. Yao JC, Hassan M, Phan A, Dagohoy C, Leary C, Mares JE, et al. One hundred years after «carcinoid»: epidemiology of and prognostic factors for neuroendocrine tumors in 35,825 cases in the United States. J Clin Oncol. 2008;26(18):3063-72. https://doi.org/10.1200/JCO.2007.15.4377 [ Links ]
24. Dasari A, Shen C, Halperin D, Zhao B, Zhou S, Xu Y, et al. Trends in the Incidence, Prevalence, and Survival Outcomes in Patients With Neuroendocrine Tumors in the United States. JAMA Oncol. 2017;3(10):1335-1342. https://doi.org/10.1001/jamaoncol.2017.0589 [ Links ]
Citación: Romero-Serrano SA, Báez-Ariza EA, Pardo-González S, Martínez-Martínez S. Presentación polipoide de un tumor neuroendocrino: reporte de caso y revisión de la literatura. Rev Colomb Gastroenterol. 2022;37(3):325-329. https://doi.org/10.22516/25007440.813
Recibido: 06 de Agosto de 2021; Aprobado: 21 de Enero de 2022











 texto en
texto en