Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Revista colombiana de Gastroenterología
versão impressa ISSN 0120-9957versão On-line ISSN 2500-7440
Rev. colomb. Gastroenterol. vol.37 no.4 Bogotá out./dez. 2022 Epub 07-Jul-2023
https://doi.org/10.22516/25007440.923
Trabajos originales
Variables hemodinámicas cardíacas y desenlaces postrasplante hepático en un centro de referencia de trasplantes en Colombia a 2600 metros sobre el nivel del mar
1Internist, Hospital Universitario Mayor Mederi, Gastroenterology fellow, Universidad Nacional. Bogotá, Colombia.
2Internist, Hospital Universitario Mayor Mederi. Bogotá, Colombia.
3Internist, Gastroenterology fellow, Universidad del Rosario. Bogotá, Colombia.
4General physician, Universidad del Rosario. Bogotá, Colombia.
5Pneumologist, Fundación Neumológica Colombiana. Bogotá, Colombia.
6Hepatologist, LaCardio. Bogotá, Colombia.
Introducción:
la valoración hemodinámica mediante ecocardiografía Doppler tiene importancia en la identificación de alteraciones sistólicas/diastólicas como predictor de desenlaces en el postrasplante hepático desde alteraciones cardiovasculares hasta disfunción del injerto y mortalidad.
Métodos:
estudio de cohorte retrospectivo. Paciente con trasplante hepático en el hospital LaCardio, en Bogotá, Colombia entre enero de 2005 y julio de 2021. Análisis de variables sociodemográficas, comorbilidades, ecocardiografía y variables intraoperatorias con desenlaces primarios como disfunción temprana del injerto, lesión renal aguda (LRA) y mortalidad durante el seguimiento. Se realizó un árbol de clasificación y regresión (CART).
Resultados:
se analizaron a 397 pacientes, el 54,4% eran hombres, y el 71% tenía algún grado de disfunción diastólica, hipertrofia ventricular izquierda (30,9%) con presencia de disfunción del injerto en el 8% y LRA en el 21%, y una mortalidad del 15% durante el seguimiento del estudio. En el modelo CART para desenlaces de mortalidad y disfunción del injerto se relacionó con la presencia de índice de masa corporal (IMC) < 19 o la combinación de IMC entre 19 y < 24 con diálisis.
Conclusión:
las variables ecocardiográficas, la sarcopenia y la LRA o requerimiento de terapia de reemplazo renal se relacionan con desenlaces de mortalidad y disfunción del injerto.
Palabras clave: Trasplante de hígado; cirrosis hepática; disfunción ventricular
Introduction:
Hemodynamic assessment by Doppler echocardiography is essential in identifying systolic/diastolic changes as a predictor of outcomes in post-liver transplantation, from cardiovascular changes to graft dysfunction and mortality.
Materials and methods:
Retrospective cohort study. Patient with a liver transplant at the LaCardio hospital in Bogotá, Colombia, between January 2005 and July 2021. Analysis of sociodemographic variables, comorbidities, echocardiography, and intraoperative variables with primary outcomes such as early graft dysfunction, acute kidney injury (AKI), and mortality during follow-up. A classification and regression tree (CART) was performed.
Results:
397 patients were analyzed; 54.4% were men, 71% had some degree of diastolic dysfunction and left ventricular hypertrophy (30.9%) with graft dysfunction in 8% and AKI in 21%, and a mortality of 15% during the study follow-up. In the CART model, mortality and graft dysfunction outcomes were related to a body mass index (BMI) < 19 or a combination of BMI between 19 and < 24 with dialysis.
Conclusion:
Echocardiographic variables, sarcopenia, AKI, or the requirement for renal replacement therapy are related to mortality and graft dysfunction outcomes.
Keywords: Liver transplantation; liver cirrhosis; ventricular dysfunction
Introducción
El trasplante hepático es una terapia que salva vidas en pacientes con enfermedad hepática en estadio final. Se han identificado múltiples factores de riesgo, y a pesar de los avances en terapia inmunosupresora y en técnicas quirúrgicas para mejorar los desenlaces en el postrasplante hepático, el rechazo al injerto ocurre entre el 23% y 64%1,2. Es de suma importancia entender los factores predictivos relacionados con desenlaces adversos del injerto, es por eso que la identificación de condiciones cardiovasculares sin intervención previa al trasplante marca desenlaces de morbilidad y mortalidad a corto y largo plazo con el injerto3,4. El estrés hemodinámico postrasplante después de la reperfusión del injerto caracterizado por aumento de la precarga puede llevar a múltiples complicaciones cardiovasculares, por lo que dentro del protocolo de estudio pretrasplante se incluye el tamizaje de factores de riesgo cardiovasculares tradicionales, enfermedad coronaria y el análisis de ecocardiografía Doppler en la búsqueda de disfunción ventricular derecha o izquierda, hipertensión portopulmonar, síndrome hepatopulmonar y cardiomiopatía cirrótica5,6.
La cardiomiopatía cirrótica es una entidad sin criterios diagnósticos aún establecidos, pero la definición con mejor aceptación es la del Cirrhotic Cardiomyopathy Consortium (2019), la cual se conforma de variables como las alteraciones sistólicas/diastólicas, apoyado en la valoración de la deformación longitudinal global (GLS) y alteraciones electrocardiográficas como es la prolongación del QT7,8. Este síndrome, que usualmente no es reconocido en la fase inicial, sino en su descompensación, en los últimos años ha tomado importancia como predictor en su alteración de desenlaces como insuficiencia cardíaca, lesión renal e incluso pérdidas del injerto a corto y largo plazo3,9-11. Se encuentran datos de complicaciones cardiovasculares y muertes por insuficiencia cardíaca hasta en el 70% en el postrasplante12.
La discordancia en algunos datos y las limitaciones en la evaluación de parámetros de función sistólica/diastólica, datos incompletos en el grado de disfunción diastólica, sin una clara determinación de disfunción cardíaca en el estadio final de la cirrosis con base fisiológica de un estado hiperdinámico con alto gasto cardíaco, y adicionalmente la no adherencia a protocolos de evaluación ecocardiográficos muestran limitantes en la exposición de datos en la literatura9,11,13.
Debido a la importancia de la valoración hemodinámica mediante ecocardiografía en su correlación con los desenlaces postrasplante como insuficiencia cardíaca, disfunción del injerto y mortalidad, de los cuales no se encuentran datos específicos en la literatura en nuestro medio, se expone la experiencia de un hospital colombiano referente en trasplante hepático.
MATERIALES Y MÉTODOS
Población de estudio y recolección de datos
Estudio de cohorte retrospectiva. Los datos se obtuvieron de las historias clínicas del grupo de trasplante hepático en el hospital La Cardio en Bogotá, Colombia, desde el 1 de enero de 2005 hasta el 31 julio de 2021.
Los datos demográficos, paraclínicos, antecedentes y condiciones relacionadas con el procedimiento quirúrgico se tomaron de la historia clínica de cada paciente.
Criterios de inclusión
Pacientes mayores de 18 años con diagnóstico de cirrosis y enfermedad estable llevados a trasplante hepático.
Criterios de exclusión
Pacientes con insuficiencia hepática aguda sin cirrosis con requerimiento de trasplante.
Pacientes con retrasplante, trasplante de más de un órgano, enfermedad cardíaca previa (isquémica o valvular).
Tasa de filtración glomerular (TFG) < 30 mL/min/1,73 (cálculo mediante Chronic Kidney Disease Epidemiology Collaboration [CKD-EPI]).
Dentro del protocolo institucional de valoración pretrasplante se tomaron datos de los ecocardiogramas Doppler tomados de los cuales se basan en el protocolo de evaluación ventricular diastólica de las guías de la American Society of Echocardiography/European Association of Cardiovascular Imaging (ASE/EACVI)14 y se analizaron a los pacientes a quienes se les realizó cateterismo cardíaco derecho.
Desenlaces
Nuestro desenlace primario fue la disfunción temprana del injerto definido como alteración del perfil hepático en los primeros 7 días postrasplante, de la siguiente manera: bilirrubina >10 mg/dL, índice internacional normalizado (INR) > 1,5, alanina-aminotransferasa (ALT) o aspartato-aminotransferasa (AST) > 2000 UI.
Otro desenlace primario fue la presencia de lesión renal aguda durante la hospitalización en el postrasplante y se basó en la definición de las guías de Kidney Disease: Improving Global Outcome (KDIGO).
La mortalidad se evaluó desde el trasplante hepático hasta la fecha de terminación del estudio, que fue el 31 de julio de 2021.
Se tomaron otros desenlaces como el requerimiento de terapia de reemplazo renal durante el postrasplante, complicaciones infecciosas, soporte transfusional y paro intraoperatorio.
Análisis estadístico
Las características sociodemográficas y clínicas se presentan en frecuencias y porcentajes para las variables categóricas; para el caso de las variables continuas, en promedio con desviación estándar (DE) cuando la distribución fue normal, o en mediana con rango intercuartílico (RIC) cuando no se cumplía este criterio. Para evaluar estas comparaciones se utilizó la prueba de chi cuadrado o prueba de Fisher según la frecuencia de observaciones en el caso de variables categóricas. Para comparar las variables continuas se utilizó la prueba de T student de muestras independientes. Un valor p < 0,05 fue considerado como estadísticamente significativo.
Instalamos un árbol de clasificación y regresión (CART) con todas las variables recopiladas con fines de comparación15. La selección de covariables incluidas para el modelo se basó en su relevancia biológica y clínica, de acuerdo con lo previamente reportado en la literatura y su estadística significancia en el análisis bivariado. El algoritmo CART cuantificó el peso de cada variable y construyó perfiles de riesgo. Esta metodología contrasta con los modelos de regresión clásicos en los que el algoritmo CART puede descubrir efectos modificadores e interacciones complejas entre variables. El análisis estadístico se realizó con el software R versión 3.6.3 y el modelo CART se realizó con el paquete RPART (Recursive Partition and Regression Trees).
Resultados
Dentro de la fecha establecida, en el estudio se encontraron 550 pacientes con trasplante hepático, de los cuales 397 pacientes tenían datos completos y cumplían criterios de inclusión y exclusión.
Características generales
Del total de pacientes, la mediana de edad fue de 56 años al momento del trasplante hepático, el 54,4% fueron hombres. El 75% al momento del trasplante tenían una clase funcional I y dentro de los antecedentes más frecuentes fueron hipertensión arterial (15,8%), diabetes mellitus (24,1%) y tabaquismo (25,44%). Se calculó un índice de Charlson con promedio de 4,4 (DE ± 1,5).
Según la etiología de la cirrosis, la principal fue la alcohólica (17,8%), seguido de criptogénica (16%), virus de la hepatitis C (VHC) (15,3%) y hepatitis autoinmune (12,5%).
Al momento del trasplante hepático, las complicaciones por la patología generaron al menos un episodio ascítico o más (63%), encefalopatía (47%), sangrado varicoso (34,2%), hepatocarcinoma (22,1%) síndrome hepatopulmonar (15,6%) y peritonitis bacteriana espontánea (8,3%). En la estadificación de la patología, el 52,3% estaba en un Child-Pugh B y 26% en un Child-Pugh C, con un Model for End-Estage Liver Disease (MELD-Na) promedio de 16 (DE ± 6) (Tabla 1).
Tabla 1 Características de la población de estudio
| Pacientes, n. | 397 |
| Edad, años (mediana, RIC) | 56 (45-62) |
| Sexo (hombre: mujer), n | 216:181 |
| IMC, kg/m2 (promedio, DE) | 25,7 ± 4,2 |
| Clase funcional, n (%) | |
| Clase 1 | 298 (75) |
| Clase 2 | 90 (22,6) |
| Clase 3 | 8 (2) |
| Clase 4 | 1 (0,2) |
| Etiología de la cirrosis, n (%) | |
| Alcohólica | 71 (17,8) |
| Criptogénica | 64 (16) |
| VHC | 61 (15,3) |
| Hepatitis autoinmune | 50 (12,5) |
| NASH | 42 (10,5) |
| Cirrosis biliar primaria | 39 (9,8) |
| Cirrosis biliar secundaria | 13 (3,2) |
| VHB | 13 (3,2) |
| Otros | 44 (11) |
| Antecedentes, n (%) | |
| Hipertensión | 63 (15,8) |
| Diabetes mellitus | 96 (24,1) |
| EPOC | 2 (0,5) |
| Hipertensión pulmonar | 3 (0,7) |
| LES | 4 (1) |
| ERC | 30 (7,5) |
| Tabaquismo | 101 (25,44) |
| Complicaciones de la cirrosis, n (%) | |
| Ascitis | 250 (63) |
| Sangrado varicoso | 136 (34,2) |
| PBE | 33 (8,3) |
| Síndrome hepatopulmonar | 62 (15,6) |
| Encefalopatía | 187 (47) |
| Prurito | 19 (4,7) |
| Hepatocarcinoma | 88 (22,1) |
| Puntaje Child-Pugh, n (%) | |
| Clase A | 86 (21,6) |
| Clase B | 208 (52,3) |
| Clase C | 103 (26) |
| MELD-NA (promedio, DE) | 16 ± 6 |
| Índice de Charlson (promedio, DE) | 4,4 ± 1,5 |
| Variables ecocardiográficas | |
| FEVI (promedio, DE) | 62 ± 6,4 |
| TAPSE, n (promedio, DE) | 22 (25 ± 4,3) |
| DD, n (%) | 71 (17,8) |
| DD grado 1, n (%) | 45 (11,33) |
| DD grado 2, n (%) | 7 (1,7) |
| PSAP anormal, n (%) | 88 (22,2) |
| PAD aumentada, n (%) | 4 (1) |
| HVI, n (%) | 130 (30,9) |
| HVD, n (%) | 4 (1) |
| Dilatación de ventrículo derecho, n (%) | 12 (3) |
| Presencia de cortocircuito, n (%) | 79 (19) |
| Variables de cateterismo derecho (promedio, DE) | n: 7 |
| PMAP | 27,2 ± 9,5 |
| RVP | 3,2 ± 3 |
| Presión cuña | 15,83 ± 5,3 |
| Índice cardíaco | 4,3 ± 2,4 |
| Presión de la aurícula derecha | 15,83 ± 5 |
| Variables intraoperatorias | |
| Fase anhepática (mediana, RIC) | 57 (47-69) |
| Fase isquémica (mediana, RIC) | 6,3 (5,7-8,2) |
| Paro cardíaco intraoperatorio, n (%) | 10(2,5) |
| Días en UCI, mediana (RIC) | 2 (2-4) |
| Requerimiento de trasfusión, n (%) | 244 (61,6) |
| Desenlaces, n (%) | |
| Disfunción del injerto, n (%) | 32 (8) |
| LRA, n (%) | 84 (21) |
| LRA KDIGO 1 (%) | 37,9 |
| LRA KDIGO 2 (%) | 32,1 |
| LRA KDIGO 3 (%) | 29,88 |
| Requerimiento de diálisis, n (%) | 29 (7,3) |
| Infección, n (%) | 116 (29,2) |
| Abdominal | 49 (39,6) |
| Pulmonar | 25 (21,5) |
| Urinaria | 21 (18,1) |
| Bacteriemia | 6 (5,1) |
| Sitio operatorio | 5 (4,3) |
| Otros | 10 (8,6) |
| Muerte, n (%) | 60 (15,1) |
DD: disfunción diastólica; EPOC: enfermedad pulmonar obstructiva crónica; ERC: enfermedad renal crónica; FEVI: fracción de eyección del ventrículo izquierdo; HVD: hipertrofia ventricular derecha; HVI: hipertrofia ventricular izquierda; IMC: índice de masa corporal; LES: lupus eritematoso sistémico; LRA: lesión renal aguda; NASH: esteatohepatitis no alcohólica; PAD: presión arterial diastólica; PBE: peritonitis bacteriana espontánea; PMAP: presión media de la arteria pulmonar; PSAP: presión sistólica de la arteria pulmonar; RVP: resistencia vascular pulmonar; TAPSE: desplazamiento sistólico del plano del anillo tricuspídeo; UCI: unidad de cuidados intensivos. Fuente: elaborada por los autores.
Variables hemodinámicas: ecocardiográficas y cateterismo cardíaco derecho
De los 397 pacientes analizados, todos tenían valoración mediante ecocardiografía Doppler 2D y se encontró una FEVI promedio de 62% (DE ± 6,4), el 71% con disfunción diastólica, pero solo 45 pacientes tenían disfunción diastólica tipo 1 y 7 pacientes disfunción diastólica tipo 2, hipertrofia ventricular izquierda (30,9%) y presencia de cortocircuito compatible con síndrome hepatopulmonar en el 19%. Solo se realizó cateterismo cardíaco derecho en 7 pacientes (Tabla 1).
Variables intraoperatorias y postrasplante
La fase anhepática fue de una mediana de 57 minutos (RIC: 47-69) y la fase isquémica, de 6,3 minutos (RIC: 5,7-8,2). Dentro de las complicaciones intraoperatorias, 10 pacientes presentaron paro cardiorrespiratorio y 61,6% requirieron soporte transfusional, y la estancia en la UCI fue de un promedio de 2 días. Solo 32 pacientes presentaron disfunción temprana del injerto (8%), 21% pacientes presentaron lesión renal aguda y 29 pacientes tuvieron requerimiento de terapia de reemplazo renal. El 29,2% presentaron complicaciones infecciosas y las principales fueron con foco abdominal (39,6%) y pulmonar (21,5%). Durante el período de estudio hubo una mortalidad del 15,1%.
Desenlaces primarios
Los desenlaces primarios se resumen en la Tabla 2.
Tabla 2 Análisis univariado Cox de desenlaces primarios
| Variables | Disfunción del injerto | Lesión renal | Muerte | ||||||
|---|---|---|---|---|---|---|---|---|---|
| No DH | DH | p | No | Sí | p | No | Sí | p | |
| Edad (mediana, RIC) | 56 (45-62) | 52,5 (38,7-58,2) | 0,03405083 | 55 (44-61) | 58 (48,7-63) | 0,0626625 | 56 (45-62) | 58 (49-63) | 0,19050336 |
| Mujer, n (%) | 158 (87,8) | 22 (21,1) | 0,01052545 | 151 (83,4) | 30(16,5) | 0,05438623 | 149 (82,3) | 32 (17,6) | 0,24357336 |
| Hombre, n (%) | 206 (95,3) | 10 (4,6) | 162 (75) | 54 (25) | 188 (87) | 28 (12,9) | |||
| IMC (promedio, DE) | 25,8 ± 4,1 | 24,6 ± 4,9 | 0,11739833 | 25,5 ± 4 | 26.7 ± 4,6 | 0,04914905 | 26 ± 4,25 | 24,4 ± 3,9 | 0,01242746 |
| CF I | 276 (92,6) | 22 (7,3) | 0,55109023 | 234 (78,5) | 64 (21,4) | 0,24305443 | 251 (84,2) | 47 (15,7) | 0,09592338 |
| CF II | 80 (88,8) | 10 (11,1) | 72 (80) | 18 (20) | 79 (87,7) | 11 (12,2) | |||
| CF III | 8 (100) | 0 | 7 (87,5) | 1 (12,5) | 7 (87,5) | 1 (12,5) | |||
| CF IV | 1 (100) | 0 | 0 | 1 | 0 | 1 | |||
| Índice de Charlson (promedio, DE) | 4,47 ± 1,55 | 4,06 ± 1,1 | 0,16534394 | 4,32 ± 1,5 | 4,7 ± 1,5 | 0,0372914 | 4,3 ± 1,5 | 4,7 ± 1,6 | 0,15445272 |
| Etiología de la cirrosis, n (%) | |||||||||
| Alcohol | 69 (97,1) | 2 (2,8) | 0,13026919 | 55 (77,4) | 16 (22,5) | 0,9251709 | 63 (88,7) | 8 (11,2) | 0,67038578 |
| Criptogénica | 60 (93,7) | 4 (6,2) | 53 (82,8) | 11 (17,1) | 56 (87,5) | 8 (12,5) | |||
| VHC | 57 (93,4) | 4 (6,5) | 44 (72,1) | 17 (27,8) | 47 (77) | 14 (22,9) | |||
| Hepatitis autoinmune | 47 (94) | 3 (6) | 40 (80) | 10 (20) | 43 (86) | 7 (14) | |||
| NASH | 39 (92,8) | 3 (7,1) | 31 (73,8) | 11 (26,1) | 37 (88) | 5 (12) | |||
| CBP | 33 (84,6) | 6 (15,3) | 33 (84,6) | 6 (15,3) | 31 (79,4) | 8 (20,5) | |||
| CBS | 11 (84,6) | 2 (15,3) | 11 (84,6) | 2 (15,3) | 9 (69,2) | 4 (30,7) | |||
| VHB | 12 (92,3) | 1 (7,6) | 10 (76,9) | 3 (23) | 12 (92,3) | 1 (7,6) | |||
| Antecedentes, n (%) | |||||||||
| Hipertensión | 60 (95,2) | 3 (4,7) | 0,42588466 | 48 (76,1) | 15 (23,8) | 0,69396299 | 56 (88,8) | 7 (11,1) | 0,43822945 |
| Diabetes mellitus | 91 (94,7) | 5 (5,2) | 0,33522914 | 72 (75) | 24 (25) | 0,360296 | 82 (85,4) | 14 (14,5) | 0,99769806 |
| EPOC | 2 (100) | 0 | 1 | 1 | 1 | 0,89392224 | 2 | 0 | 1 |
| HTP | 3 (100) | 0 | 1 | 3 | 0 | 0,8483549 | 3 | 0 | 1 |
| LES | 4 (100) | 0 | 1 | 2 | 2 | 0,4212489 | 3 | 1 | 1 |
| ERC | 14 (100) | 0 | 1 | 10 (71,4) | 4 (28,5) | 0,72013665 | 12 (85,7) | 2 (14,2) | 1 |
| Tabaquismo | 97 (96) | 4 (3,9) | 0,12324534 | 78 (77,2) | 23 (22,7) | 0,74992213 | 88 (87,1) | 13 (12,8) | 0,57024989 |
| Complicaciones de la cirrosis, n (%) | |||||||||
| Ascitis | 233 (93,2) | 17 (6,8) | 0,3114414 | 194 (77,6) | 56 (22,4) | 0,507671 | 215 (86) | 35 (14) | 0,50759422 |
| Sangrado varicoso | 124 (91,1) | 12 (8,8) | 0,83450994 | 110 (80,8) | 26 (19,2) | 0,55567329 | 120 (88,2) | 16 (11,7) | 0,23129388 |
| PBE | 31 (93,9) | 2 (6) | 0,91493425 | 25 (75,7) | 8 (24,2) | 0,81777885 | 30 (90,9) | 3 (9) | 0,45028031 |
| Síndrome hepatopulmonar | 58 (93,5) | 4 (6,4) | 0,80053717 | 54 (87) | 8 (12,9) | 0,11797885 | 56 (90,3) | 6 (9,6) | 0,26790479 |
| Complicaciones de la cirrosis, n (%) | |||||||||
| Encefalopatía | 169 (90,3) | 18 (9,6) | 0,3700466 | 139 (74,3) | 48 (25,3) | 0,05082367 | 160 (85,5) | 27 (14,4) | 0,83062933 |
| Prurito | 16 (84,2) | 3 (15) | 0,40289368 | 19 | 0 | 1 | 16 (84,2) | 3 (15,7) | 1 |
| Hepatocarcinoma | 84 (95,4) | 4 (4,5) | 0,24972757 | 67 (76,1) | 21 (23,8) | 0,57802013 | 68 (77,2) | 20 (22,7) | 0,03647202 |
| Puntaje Child-Pugh, n (%) | |||||||||
| Child A | 79 (91,8) | 7 (8,1) | 0,48422153 | 65 (75,5) | 21 (24,4) | 0,66648793 | 71 (82,5) | 15 (17,4) | 0,64598336 |
| Child B | 194 (93,2) | 14 (6,7) | 167 (80,2) | 41 (19,7) | 176 (84,6) | 32 (15,3) | |||
| Child C | 92 (89,3) | 11 (10,6) | 81 (78,6) | 22 (21,3) | 90 (87,3) | 13 (12,6) | |||
| MELD-NA (promedio, DE) | 15,9 ± 6,8 | 17,4± 7,7 | 0,28508139 | 15,8 ± 6,4 | 16,6 ± 8,5 | 0,89719791 | 16 ± 7 | 15.9 ± 8,2 | 0,50753706 |
| Variables ecocardiográficas | |||||||||
| FEVI (promedio, DE) | 62,39 ± 6,5 | 61,2 ± 5,4 | 0,92794776 | 61,7 ± 6,5 | 64,4 ± 5,8 | 0,00059796 | 62 ± 6,3 | 64,1 ± 6,9 | 0,03786134 |
| TAPSE, n (promedio, DE) | 25,5 (4,4) | 25,3 | 0,93718292 | 25,3 | 30,1 | 0,18031438 | |||
| Disfunción diastólica, n (%) | 65 (91,4) | 6 (8,4) | 1 | 49 (69) | 22 (30,9) | 0,03780355 | 57 (80,2) | 14 (19,7) | 0,3112245 |
| PSAP | 80 (90,9) | 8 (9) | 0,86944739 | 68 (77,2) | 20 (22,7) | 0,81631308 | 68 (77,2) | 20 (22,7) | 0,03881794 |
| PAD aumentada, n (%) | 3 (75) | 1 (25) | 0,74304706 | 4 | 0 | 0,67000042 | 3 | 1 | 1 |
| HVI, n (%) | 110 (89,4) | 13 (10,5) | 0,30260062 | 83 (67,4) | 40 (32,5) | 0,00034267 | 98 (79,6) | 25 (20,3) | 0,07329209 |
| HVD, n (%) | 4 (100) | 0 | 1 | 3 | 1 | 1 | 3 | 1 | 1 |
| Dilatación VD, n (%) | 12 (100) | 0 | 0,60608871 | 10 (83,3) | 2 (16,6) | 0,97293598 | 12 | 0 | 0,2751521 |
| Presencia de cortocircuito, n (%) | 71 (89,8) | 8 (10,1) | 0,60107922 | 60 (75,9) | 19 (24,05) | 0,58281122 | 66 (83,5) | 13 (16,4) | 0,84406117 |
| Variables intraoperatorias | |||||||||
| Fase anhepática (mediana, RIC) | 57 (47-68) | 60 (50-77) | 0,16471272 | 56 (46-66) | 60 (51 -75) | 0,01654853 | 57 (47-68) | 56 (50-73) | 0,60601576 |
| Fase isquémica (mediana, RIC) | 6,3 (5,1-8,1) | 6,4 (5,3-9) | 0,54891242 | 6,3 (5,2-8,3) | 6,1 (5-7,5) | 0,3038509 | 6,2 (5-8) | 6,9 (5,4-9) | 0,05746276 |
| Requerimiento de trasfusión, n (%) | 219 (89,7) | 25 (10,2) | 0,03781268 | 189 (77) | 55 (26) | 0,48819885 | 205 (84) | 39 (15,9) | 0,53335917 |
| LRA, n (%) | 71 (84,5) | 13 (15,4) | 0,00970643 | 12 (41,3) 17 (58,6) | 56 (66,6) | 28 (33,3) | 3,79E-07 | ||
| Requerimiento de diálisis, n (%) | 21 (72,4) | 8 (27,5) | 0,00027098 | 7,9935E-11 | |||||
| Infección, n (%) | 104 (89,6) | 12 (10,3) | 0,38345075 | 78 (67,2) | 38 (32,7) | 0,00046397 | 87 (75) | 29 (25) | 0,00072601 |
CBP: colangitis biliar primaria; CBS: colangitis biliar secundaria; CF: clase funcional; DH: disfuncion del injerto; HTP: hipertensión pulmonar; VHB: virus de la hepatitis B. Fuente: elaborada por los autores.
Disfunción temprana del injerto
Dentro del análisis univariado con análisis Cox se encontró relación con el sexo femenino (p = 0,010), requerimiento de soporte transfusional (p = 0,037), lesión renal aguda (p = 0,0097) y requerimiento de terapia de reemplazo renal (p = 0,0002).
Lesión renal aguda
Se relacionó con el sexo masculino (p = 0,054), IMC (p = 0,049), índice de Charlson (p = 0,0372), episodios de encefalopatía antes del trasplante (p = 0,0508), FEVI (p = 0,00059), disfunción diastólica (p = 0,037), HVI (p = 0,00034), fase anhepática (p = 0,016) e infección (p = 0,0004).
Mortalidad
Se relacionó con hepatocarcinoma (p = 0,036), lesión renal aguda (p < 0,005), terapia de reemplazo renal (p < 0,005) e infección (p < 0,005).
Modelo predictivo CART
Este método construyó un modelo predictivo con las variables de mortalidad durante el estudio, disfunción del injerto y lesión renal aguda. En el modelo de mortalidad durante el período de estudio se encontró una mortalidad del 15%, en el que los pacientes con IMC < 19 tenían 56% de probabilidad de fallecer; mientras que con un IMC > 19 (98% de pacientes con desenlace fatal) los pacientes que no requieren diálisis tienen 95% de posibilidades de sobrevivir; sin embargo, los pacientes con un IMC >19 y < 24 y requerimiento de diálisis tienen 55% de probabilidades de fallecer (Figura 1).

Figura 1 Distribución de pacientes trasplantados con mortalidad durante el estudio, con clasificación por grupos de riesgo en el árbol de regresión (CART). Este método construye un modelo predictivo de 3 perfiles de riesgo con IMC < 19 y < 24, con o sin requerimiento de diálisis. Fuente: elaborada por los autores.
En disfunción del injerto, fueron 8% del total de pacientes; los pacientes con IMC < 19 tenían 56% de probabilidades de disfunción del injerto y los que tenían IMC > 19 y < 24 con requerimiento de diálisis tenían 55% de probabilidades de muerte (Figura 2).
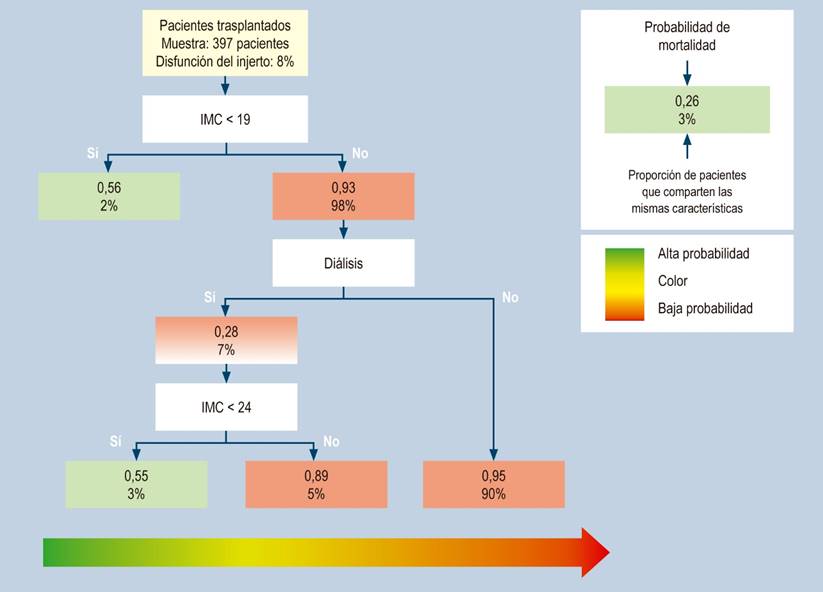
Figura 2 Distribución de pacientes trasplantados con disfunción del injerto, con clasificación por grupos de riesgo en el árbol de regresión (CART). Este método construye un modelo predictivo de 3 perfiles de riesgo con IMC < 19 y < 24, con o sin requerimiento de diálisis. Fuente: elaborada por los autores.
Discusión
A nivel mundial, en 2017 aproximadamente 1,5 millones de personas tenían cirrosis hepática, y las principales etiologías eran NASH (60%), VHB (29%), VHC (9%) y cirrosis alcohólica (2%), produjo 1,2 millones de muertes a nivel mundial y fue el 3,5% de todas las causas de muerte16. En datos de estudios locales cobra importancia como etiología alcohólica de la cirrosis alcohólica, como se logra ver en nuestro estudio17. Son múltiples los factores de riesgo en el estudio pretrasplante, que incluso su mala selección se relaciona con un carga en costos para el sistema de salud18. La detección pretrasplante de disfunción cardíaca es un predictor de eventos adversos después del trasplante hepático, con base en análisis de anormalidades sistólicas o diastólicas9,11,19. La presencia de disfunción cardíaca conlleva a mortalidad temprana por causa cardiovascular (40%), seguida por otras causas de mortalidad como infecciones (27,2%) y rechazo del injerto (12%)20. Incluso hay datos de estudios que han mostrado al trasplante hepático como tratamiento para alteraciones cardiovasculares, como lo muestra un estudio en el cual se observa la disminución de la dilatación biventricular y la mejoría de la deformación global en el postrasplante21.
Con respecto a los hallazgos en nuestro estudio, no se encontró una relación de la FEVI con la mortalidad durante el seguimiento, los datos son similares a los de la literatura, en la que no se encontró una relación con los desenlaces de mortalidad ni de insuficiencia cardíaca postrasplante9. Sin embargo, en otro estudio la presencia de una FEVI baja tiene relación con mortalidad22; incluso en el contexto del estado hiperdinámico se correlaciona con FEVI altas, cuyas variaciones mínimas se relacionan con desenlaces cardiovasculares(10, 22). Por lo anterior, en la evaluación de un paciente con un estado hiperdinámico asociado a disminución de resistencias vasculares periféricas cobra importancia no solo la evaluación del componente sistólico para el diagnóstico de cardiomiopatía cirrótica, sino también una integración de variables como las estipuladas en la última clasificación del CCC, con hallazgos de FEVI < 50% y disminución de la GLS > 18%, con la valoración cuidadosa del componente diastólico teniendo en cuenta las múltiples variables que pueden afectar la precarga, con base en anormalidades electromecánicas como la prolongación del QT8.
Es debido a la complejidad de la valoración de disfunción cardíaca, que no hay una evaluación protocolizada en esta condición específica mediante ecocardiografía, sin el uso de las últimas recomendaciones para el diagnóstico de cardiomiopatía cirrótica, tal como lo vemos en nuestro estudio, en el que no hay detalle de la evaluación diastólica sin presencia de la medición de la GLS y las consideraciones de la medición del componente electromecánico. En la literatura la afectación sistólica es baja, como se muestra en nuestro estudio, donde en el 100% de los pacientes no se encuentran criterios para alteraciones sistólicas22. Incluso algunos estudios muestran una incidencia de tan solo 2% de afectación sistólica13.
Aunque en la última clasificación de cardiomiopatía cirrótica de la CCC tiene de corte una FEVI < 55%, hay que tener en cuenta que los datos de FEVI < 60% en pacientes sometidos a inmunosupresión deben tener un seguimiento más estrecho por ser un predictor de mortalidad y de desenlaces cardiovasculares23.
Dentro de los hallazgos de nuestro estudio se encontró que el 17,8% presentaron disfunción diastólica, datos no concordantes con la literatura, ya que muestra una prevalencia variada, posiblemente secundaria a la no estandarización de variables ecocardiográficas. En los reportes en la literatura se ha encontrado que hasta el 66% de los pacientes con enfermedad hepática terminal tienen disfunción diastólica, según la clasificación de la ASE, de tipo 1 (53%) y tipo 2 (47%), y no se encontró a ningún paciente de tipo 322, tal como se encontró en nuestro estudio (sin hallazgos de pacientes de tipo 3). Otro estudio muestra una prevalencia similar al nuestro con datos de disfunción diastólica del 19%, con disfunción leve (48%), moderada (30%) y grave (22%), y se relacionaron los hallazgos de disfunción diastólica pretrasplante con riesgo de rechazo al injerto, falla del injerto y mortalidad3. Sin embargo, en nuestro estudio el hallazgo de disfunción diastólica se relacionó con el desarrollo de lesión renal aguda (p = 0,0378).
Las variables ecocardiográficas adicionales, como el volumen indexado de aurícula izquierda (LAVI) > 40 mL/m2, se relacionaron con riesgo de mortalidad en 1 año postrasplante9. La tasa de regurgitación tricúspidea moderada a grave se relaciona con mortalidad, ya que los hallazgos leves son normales en el estado hiperdinámico del paciente24; estos datos no se midieron en nuestro estudio debido a que se encontraron normales. Otros hallazgos son la HVI, que ocurre en 12% a 30% de los pacientes con cirrosis, un indicativo de posible disfunción diastólica en el contexto de remodelación ventricular izquierda en un estado hiperdinámico del paciente; en nuestro estudio se encontró en el 30,9% de los pacientes, sin relación con desenlaces de mortalidad ni disfunción del injerto. Estos datos son diferentes a los de la literatura, en la que la HVI se relacionó con mortalidad a los 9 meses postrasplante, fue más frecuente en ancianos y pacientes con antecedentes de hipertensión arterial25. Incluso su presencia pretrasplante se ha observado como predictor de deterioro ecocardiográfico postrasplante26. Sin embargo, la relación de HVI y disfunción diastólica se relacionó con la presencia de lesión renal aguda, tal como lo muestran estudios relacionados con un bajo índice cardíaco en los cambios de vasodilatación arterial grave22,27,28; algunos datos incluso muestran una correlación entre una FEVI alta con el deterioro de la función renal posiblemente secundario a este estado hiperdinámico29. Adicionalmente, progresar al requerimiento de terapia de reemplazo renal se relacionó en nuestro estudio con la disfunción del injerto y la mortalidad, datos similares a los encontrados en la literatura, en la que se observó su relación con la mortalidad, con un odds ratio (OR) de 14,18 (intervalo de confianza [IC] 1,65-121,89; p < 0,05)11.
Dentro de nuestro estudio, la PSAP aumentada se observa en el 22% de los pacientes, la cual se relacionó con la mortalidad con una p = 0,038; este hallazgo se puede relacionar con el aumento de la presión diastólica de ventrículo izquierdo y, por consiguiente, ser marcador de disfunción diastólica. En un estudio se relacionó con riesgo de eventos cardíacos (Hazard ratio [HR]: 1,79 [1,48-2,17]; p < 0,001)29 e incluso se ha relacionado de manera directa en algunos estudios con la presión de la arteria pulmonar con cateterismo, lo que permite un tamizaje adecuado con un ecocardiograma hecho de manera detallada30.
El requerimiento transfusional en el postrasplante tuvo una relación con disfunción del injerto, y en el árbol de regresión se relacionó con lesión renal aguda en estadios iniciales y progresión a diálisis. En estudios previos ya se han relacionado estos hallazgos con desenlaces adversos postrasplante31. Otra variable relacionadas con mortalidad y lesión renal aguda fue la presencia de infección en el postrasplante, dato que se relaciona con los de la literatura debido al estado de inmunosupresión por la patología y el nivel de activación inmunológica al estímulo infeccioso en un paciente con un estado inflamatorio crónico y con desregulación hemodinámica, lo cual lleva a tasas de mortalidad cercanas al 50%32.
Dentro del análisis de regresión en árbol (CART), los datos importantes relacionados con mortalidad y disfunción del injerto son IMC bajos, con corte en nuestro estudio < 19, incluso relacionado o no con terapia de reemplazo renal, datos indicativos indirectos de sarcopenia, ya que se muestra que el 30%-70% de los cirróticos padecen esta condición debido al grado de inflamación del paciente, traslocación bacteriana crónica, resistencia a la insulina, hiperamonemia y disminución de testosterona; datos anteriores condicionan una mayor mortalidad (19 ± 6 meses con sarcopenia frente a 34 ± 11 meses sin sarcopenia; p = 0,005)33,34. Incluso, datos ya relacionados con desenlaces postrasplante de los índices de músculo esquelético medido por tomografía se relacionaron con una menor supervivencia postrasplante35.
Conclusiones
Las consideraciones de variables pretrasplante, desde ayudas a nivel del ecocardiograma, condiciones previas asociadas como sarcopenia e incluso consideraciones durante el trasplante hepático y el requerimiento o no de terapia de reemplazo renal, relacionados con la presentación de lesión renal aguda, son puntos de intervención y seguimiento para disminuir complicaciones a largo plazo e incluso impactar en la mortalidad de estos pacientes.
Agradecimientos
A la Fundación Cardioinfantil y a la Universidad del Rosario.
REFERENCIAS
1. Wiesner RH, Demetris AJ, Belle SH, Seaberg EC, Lake JR, Zetterman RK, et al. Acute hepatic allograft rejection: Incidence, risk factors, and impact on outcome. Hepatology. 1998;28(3):638-45. https://doi.org/10.1002/hep.510280306 [ Links ]
2. Rdmji A, Yosbidu EM, Buin VG, Knetemun NM, Erb SR, Purtovi N, et al. The Western Canada Experience. Liver Transpl. 2002;8(10):945-51. https://doi.org/10.1053/jlts.2002.34969 [ Links ]
3. Mittal C, Qureshi W, Singla S, Ahmad U, Huang MA. Pre-transplant left ventricular diastolic dysfunction is associated with post transplant acute graft rejection and graft failure. Dig Dis Sci. 2014;59(3):674-80. https://doi.org/10.1007/s10620-013-2955-8 [ Links ]
4. Therapondos G, Flapan AD, Plevris JN, Hayes PC. Cardiac morbidity and mortality related to orthotopic liver transplantation. Liver Transplant. 2004;10(12):1441-53. https://doi.org/10.1002/lt.20298 [ Links ]
5. Raval Z, Harinstein ME, Skaro AI, Erdogan A, Dewolf AM, Shah SJ, et al. Cardiovascular risk assessment of the liver transplant candidate. J Am Coll Cardiol. 2011;58(3):223-31. https://doi.org/10.1016/j.jacc.2011.03.026 [ Links ]
6. Aghaulor B, VanWagner LB. Cardiac and Pulmonary Vascular Risk Stratification in Liver Transplantation. Clin Liver Dis. 2021;25(1):157-77. https://doi.org/10.1016/j.cld.2020.08.008 [ Links ]
7. Zambruni A, Trevisani F, Caraceni P, Bernardi M. Cardiac electrophysiological abnormalities in patients with cirrhosis. J Hepatol. 2006;44(5):994-1002. https://doi.org/10.1016/j.jhep.2005.10.034 [ Links ]
8. Liu H, Lee SS. Diagnostic Criteria of Cirrhotic Cardiomyopathy: Out With the Old, in With the New? Hepatology. 2021;74(6):3523-3525. https://doi.org/10.1002/hep.32021 [ Links ]
9. Dowsley TF, Bayne DB, Langnas AN, Dumitru I, Windle JR, Porter TR, et al. Diastolic Dysfunction in Patients With End-Stage Liver Disease is Associated With Development of Heart Failure Early After Liver Transplantation. Transplantation Journal. 2012;94(6):646-51. https://doi.org/10.1097/TP.0b013e31825f0f97 [ Links ]
10. Moon YJ, Kim JW, Bang YS, Lim YS, Ki Y, Sang BH. Prediction of all-cause mortality after liver transplantation using left ventricular systolic and diastolic function assessment. PLoS One. 2019;14(1):e0209100. https://doi.org/10.1371/journal.pone.0209100 [ Links ]
11. Josefsson A, Fu M, Allayhari P, Björnsson E, Castedal M, Olausson M, et al. Impact of peri-transplant heart failure & left-ventricular diastolic dysfunction on outcomes following liver transplantation. Liver Int. 2012;32(8):1262-9. https://doi.org/10.1111/j.1478-3231.2012.02818.x [ Links ]
12. Rayes N, Bechstein WO, Keck H, Blumhardt G, Lohmann R, Neuhaus P. Changing patterns of causes of death after liver transplantation: an analysis of 41 cases in 382 patients. Transplant Proc. 1995;27(1):1237-8. [ Links ]
13. Raevens S, De Pauw M, Geerts A, Berrevoet F, Rogiers X, Troisi RI, et al. Prevalence and outcome of diastolic dysfunction in liver transplantation recipients. Acta Cardiol. 2014;69(3):273-80. https://doi.org/10.1080/AC.69.3.3027830 [ Links ]
14. Nagueh SF, Smiseth OA, Appleton CP, Byrd BF, Dokainish H, Edvardsen T, et al. Recommendations for the Evaluation of Left Ventricular Diastolic Function by Echocardiography: An Update from the American Society of Echocardiography and the European Association of Cardiovascular Imaging. J Am Soc Echocardiogr. 2016;29(4):277-314. https://doi.org/10.1016/j.echo.2016.01.011 [ Links ]
15. Therneau T, Atkinson B, Ripley B. Rpart: Recursive Partitioning. R Package Version 4.1-3. 2013. Disponible en: http://CRAN.R-project.org/package=rpart [ Links ]
16. Moon AM, Singal AG, Tapper EB. Contemporary Epidemiology of Chronic Liver Disease and Cirrhosis. Clin Gastroenterol Hepatol. 2020;18(12):2650-2666. https://doi.org/10.1016/j.cgh.2019.07.060 [ Links ]
17. Escorcia Charris EJ, Marrugo Balceiro WR. Caracterización epidemiológica y clínica de la cirrosis hepática en un centro regional del caribe colombiano: clínica general del norte. Enero 2012 a marzo 2017. Biociencias. 2018;13(1):17-30. https://doi.org/10.18041/2390-0512/bioc.1.2242 [ Links ]
18. Axelrod DA, Schnitzler M, Salvalaggio PR, Swindle J, Abecassis MM. The economic impact of the utilization of liver allografts with high donor risk index. Am J Transplant. 2007;7(4):990-7. https://doi.org/10.1111/j.1600-6143.2006.01724.x [ Links ]
19. Qureshi W, Mittal C, Ahmad U, Alirhayim Z, Hassan S, Qureshi S, et al. Clinical predictors of post-liver transplant new-onset heart failure. Liver Transplant. 2013;19(7):701-10. https://doi.org/10.1002/lt.23654 [ Links ]
20. VanWagner LB, Lapin B, Levitsky J, Wilkins JT, Abecassis MM, Skaro AI, et al. High early cardiovascular mortality after liver transplantation. Liver Transplant Off Publ Am Assoc Study Liver Dis Int Liver Transplant Soc. 2014;20(11):1306-16. https://doi.org/10.1002/lt.23950 [ Links ]
21. Chen Y, Chan AC, Chan S, Chok S, Sharr W, Fung J, et al. Original article A detailed evaluation of cardiac function in cirrhotic patients and its alteration with or without liver transplantation. J Cardiol. 2016;67(2):140-6. https://doi.org/10.1016/j.jjcc.2015.08.001 [ Links ]
22. Ruíz-del-Árbol L, Achécar L, Serradilla R, Rodríguez-Gandía MÁ, Rivero M, Garrido E, et al. Diastolic dysfunction is a predictor of poor outcomes in patients with cirrhosis, portal hypertension, and a normal creatinine. Hepatology. 2013;58(5):1732-41. https://doi.org/10.1002/hep.26509 [ Links ]
23. Bianchi G, Marchesini G, Marzocchi R, Pinna AD, Zoli M. Metabolic syndrome in liver transplantation: relation to etiology and immunosuppression. Liver Transplant Off Publ Am Assoc Study Liver Dis Int Liver Transplant Soc. 2008;14(11):1648-54. https://doi.org/10.1002/lt.21588 [ Links ]
24. Leithead JA, Kandiah K, Steed H, Gunson BK, Steeds RP, Ferguson JW. Tricuspid regurgitation on echocardiography may not be a predictor of patient survival after liver transplantation. Am J Transplant. 2014;14(9):2192-3. https://doi.org/10.1111/ajt.12821 [ Links ]
25. Batra S, Machicao VI, Bynon JS, Mehta S, Tanikella R, Krowka MJ, et al. The impact of left ventricular hypertrophy on survival in candidates for liver transplantation. Liver Transpl. 2014;20(6):705-12. https://doi.org/10.1002/lt.23875 [ Links ]
26. Sonny A, Ibrahim A, Schuster A, Jaber WA, Cywinski JB. Impact and persistence of cirrhotic cardiomyopathy after liver transplantation. Clin Transplant. 2016;30(9):986-93. https://doi.org/10.1111/ctr.12778 [ Links ]
27. Krag A, Bendtsen F, Henriksen JH, Møller S. Low cardiac output predicts development of hepatorenal syndrome and survival in patients with cirrhosis and ascites. Gut. 2010;59(1):105-10. https://doi.org/10.1136/gut.2009.180570 [ Links ]
28. Chaney A. A Review for the Practicing Clinician: Hepatorenal Syndrome, a Form of Acute Kidney Injury, in Patients with Cirrhosis. Clin Exp Gastroenterol. 2021;14:385-96. https://doi.org/10.2147/CEG.S323778 [ Links ]
29. Bushyhead D, Kirkpatrick JN, Goldberg D. Pretransplant echocardiographic parameters as markers of posttransplant outcomes in liver transplant recipients. Liver Transpl. 2016;(3):316-23. https://doi.org/10.1002/lt.24375 [ Links ]
30. Habash F, Gurram P, Almomani A, Duarte A, Hakeem A, Vallurupalli S, et al. Correlation between echocardiographic pulmonary artery pressure estimates and right heart catheterization measurement in liver transplant candidates. J Cardiovasc Imaging. 2018;26(2):75-84. https://doi.org/10.4250/jcvi.2018.26.e2 [ Links ]
31. Hsieh CE, Hsu YL, Lin KH, Lin PY, Hung YJ, Lai YC, et al. Association between surgical volumes and hospital mortality in patients: a living donor liver transplantation single center experience. BMC Gastroenterol. 2021;21(1):228. https://doi.org/10.1186/s12876-021-01732-6 [ Links ]
32. Bajaj JS, Kamath PS, Reddy KR. The Evolving Challenge of Infections in Cirrhosis. N Engl J Med. 2021;384(24):2317-30. https://doi.org/10.1056/NEJMra2021808 [ Links ]
33. Dhaliwal A, Armstrong MJ. Sarcopenia in cirrhosis: A practical overview. Clin Med (Lond). 2020;20(5):489-492. https://doi.org/10.7861/clinmed.2020-0089 [ Links ]
34. Montano-Loza AJ, Meza-Junco J, Prado CMM, Lieffers JR, Baracos VE, Bain VG, et al. Muscle wasting is associated with mortality in patients with cirrhosis. Clin Gastroenterol Hepatol. 2012;10(2):166-73, 173.e1. https://doi.org/10.1016/j.cgh.2011.08.028 [ Links ]
35. Lee J, Jeong WK, Kim JH, Kim JM, Kim TY, Choi GS, et al. Serial Observations of Muscle and Fat Mass as Prognostic Factors for Deceased Donor Liver Transplantation. Korean J Radiol. 2021;22(2):189-97. https://doi.org/10.3348/kjr.2019.0750 [ Links ]
Citación: Martínez-Montalvo CM, Gutiérrez LC, Rojas DV, Saummet SV, Galindo-Escucha CS, Conde-Camacho R, Varón A. Variables hemodinámicas cardíacas y desenlaces postrasplante hepático en un centro de referencia de trasplantes en Colombia a 2600 metros sobre el nivel del mar. Revista. colomb. Gastroenterol. 2022;37(4):390-401. https://doi.org/10.22516/25007440.923
Limitaciones Los datos son de un estudio retrospectivo de un solo hospital. La valoración ecocardiográfica muestra muchos datos incompletos con respecto al detalle del componente diastólico, sin presencia de medición de GLS, regurgitación tricúspidea, entre otros; además de la protocolización según la ASE, sin tomarse en cuenta el detalle de la última evidencia según la clasificación de la CCC. Al ser una cohorte retrospectiva hasta la fecha, hay ausencia de seguimiento a largo plazo de los pacientes. No se incluyó la causa de muerte postrasplante, ni la medicación postrasplante ni el tipo de inmunosupresión como variables que posiblemente se relacionen con lesión renal aguda. Sin embargo, en nuestra institución la inmunosupresión es seguida en su mayoría con niveles séricos y es guiada por un grupo experto
Consideraciones éticas El estudio fue aproado por el comité de ética institucional de la Fundación Cardioinfantil-La Cardio, con acta número 06-2021
Recibido: 10 de Junio de 2022; Aprobado: 18 de Agosto de 2022











 texto em
texto em 



