Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista colombiana de Gastroenterología
Print version ISSN 0120-9957On-line version ISSN 2500-7440
Rev. colomb. Gastroenterol. vol.37 no.4 Bogotá Oct./Dec. 2022 Epub July 07, 2023
https://doi.org/10.22516/25007440.938
Trabajos originales
Utilidad de la coloración de Giemsa para diagnosticar Helicobacter pylori en pacientes con lesiones preneoplásicas
1Patology Resident, Patology Department, Faculty of Medicine, Universidad de Antioquia. Medellín, Colombia.
2Patology Department, Faculty of Medicine, Universidad de Antioquia, Medellín, Colombia. Biology and Clinic research group, Faculty of Medicine, Universidad de Antioquia. Medellín, Colombia.
3Patology Department, Faculty of Medicine, Universidad de Antioquia. Medellín, Colombia.
4Medicine student, Faculty of Medicine, Universidad de Antioquia. Medellín, Colombia.
5Bacteria & Cancer group, Microbiology Department, Faculty of Medicine, Universidad de Antioquia. Medellín, Colombia.
6Professor, Faculty of Medicine, Universidad de Antioquia. Medellín, Colombia.
Introducción:
Helicobacter pylori es una bacteria asociada con enfermedades gastroduodenales inflamatorias y neoplásicas. La histopatología es uno de los métodos diagnósticos empleados para su detección, la cual tiene sensibilidad del 90% al 95% cuando hay alta densidad de H. pylori; sin embargo, la bacteria puede pasar desapercibida en infecciones de baja densidad porque la coloración de rutina de hematoxilina y eosina (H&E) no es una tinción específica para su detección y presenta variabilidad interobservador. El objetivo de este estudio fue determinar la utilidad de la tinción complementaria de Giemsa para el diagnóstico de H. pylori en lesiones preneoplásicas en las que la bacteria se encuentra en baja densidad.
Materiales y métodos:
se realizó un estudio descriptivo retrospectivo y prospectivo que incluyó a 65 pacientes con diagnóstico de lesiones preneoplásicas. Las biopsias gástricas se tiñeron con H&E y Giemsa, y fueron evaluadas por dos patólogos.
Resultados:
la coloración de Giemsa diagnosticó 20,3% de casos más de infección por H. pylori que la H&E, la mayoría de ellos con baja densidad de la bacteria. No hubo diferencias estadísticamente significativas en el diagnóstico de H. pylori de acuerdo con el tipo de muestra.
Conclusión:
este estudio encontró que la tinción de Giemsa mejora el diagnóstico histopatológico de H. pylori en pacientes con lesiones preneoplásicas.
Palabras clave: Técnicas histológicas; Helicobacter pylori; diagnóstico; lesiones preneoplásicas; enfermedades gastrointestinales
Introduction:
Helicobacter pylori is a bacterium associated with inflammatory and neoplastic gastroduodenal diseases. Histopathology is one of the diagnostic methods used for its detection, which has a sensitivity of 90% to 95% when there is a high density of H. pylori; however, the bacterium may be missed in low-density infections because routine hematoxylin and eosin (H&E) staining is not specific for its detection and has interobserver variability. This study aimed to determine the usefulness of complementary Giemsa staining for diagnosing H. pylori in preneoplastic lesions where the bacterium was found in low density.
Materials and methods:
A retrospective/prospective descriptive study was carried out that included 65 patients diagnosed with preneoplastic lesions. Gastric biopsies were stained with H&E and Giemsa and evaluated by two pathologists.
Results:
Giemsa staining analyzed 20.3% more cases of H. pylori than H&E, most with a low density of the bacteria. There were no statistically significant differences in the diagnosis of H. pylori according to the sample type.
Conclusion:
This study found that Giemsa staining improves the histopathological diagnosis of H. pylori in patients with preneoplastic lesions.
Keywords: Histological techniques; Helicobacter pylori; diagnosis; preneoplastic lesions; gastrointestinal diseases
Introducción
Helicobacter pylori es un bacilo gramnegativo helicoidal que tiene una prevalencia mundial mayor del 50% en países de medianos a bajos ingresos y menor del 50% en países de altos ingresos1. En Colombia, la frecuencia es variable según diferentes estudios (41,7%-99,1%)2-4. H. pylori se asocia con enfermedades gastroduodenales inflamatorias y neoplásicas y fue reconocido como carcinógeno gástrico definitivo desde 1994, de acuerdo con la IARC (International Agency for Research on Cancer)5. En 2020 en Colombia el cáncer gástrico (CG) ocupó el segundo lugar de incidencia en hombres (4989) y el quinto en mujeres (3225)6. La infección crónica por H. pylori conduce a gastritis atrófica y metaplasia intestinal (MI), ambas consideradas lesiones preneoplásicas (LPN) del CG, las cuales son potencialmente reversibles cuando se instaura un tratamiento precoz y efectivo para erradicar la bacteria7,8; por tanto, el diagnóstico y manejo terapéutico temprano de la infección permiten reducir el riesgo de CG.
Para el diagnóstico de H. pylori existen métodos no invasivos e invasivos. Los primeros detectan indirectamente la bacteria o sus productos e incluyen la serología (sensibilidad [S] = 76%-84% y especificidad [E] = 79%-90%), antígenos fecales (S = 69%-95% y E = 97,6%)9) y la prueba de ureasa en el aliento (S = 96%-100% y E = 93%-100%)10. Los segundos están basados en la realización de endoscopia digestiva superior (EDS) con toma de biopsias e incluyen la prueba de la ureasa rápida (S = 80%-95% y E = 95%-100%), el cultivo microbiológico (S = 70% y E = 100%), las pruebas moleculares (S = 91% y E = 100%) e histopatología (S = 90%-95% y E = 95%-98%)11. Esta última tiene varias ventajas porque permite el diagnóstico de la infección, determina el grado de inflamación de la mucosa gástrica y permite evaluar la presencia de LPN12.
Por una parte, para el estudio histopatológico de H. pylori se recomienda realizar muestreos estandarizados (protocolo de Sydney) en los que se toman varias biopsias de sitios específicos del estómago. Lo anterior se recomienda dada la distribución heterogénea de la bacteria que puede conducir a falsos negativos cuando se selecciona un solo sitio de muestreo11. Por otra parte, la coloración empleada de rutina para el diagnóstico histopatológico es la hematoxilina y eosina (H&E), esta coloración suele ser suficiente en infecciones con alta densidad, aunque tiene sensibilidad variable entre el 69% y 93%; sin embargo, la densidad de H. pylori disminuye con el aumento de las LPN13, por lo que en pacientes con LPN, la sensibilidad de la H&E es menor del 70%14 y se ha reportado que el uso exclusivo de H&E pasa por alto infecciones por H. pylori con escasa densidad15.
La implementación del protocolo de Sydney mejora la sensibilidad y especificidad en el diagnóstico de H. pylori16. Este consiste en evaluar 5 muestras, dos del antro, dos del cuerpo gástrico y una de la incisura angularis, lo cual aumenta la probabilidad de encontrar la presencia de la bacteria. Un estudio previo publicado por nuestro grupo determinó la presencia de H. pylori no solo en el antro gástrico, sino también en otras de las muestras empleadas en el protocolo de Sydney17.
La evaluación de atrofia y metaplasia intestinal se determinan mejor en la región de la incisura angularis, que es también el sitio con mayor probabilidad de revelar los cambios displásicos, de ahí la importancia de esta biopsia. Este protocolo sumado al uso de coloraciones especiales como Giemsa, Alcian Blue, ácido peryódico de Schiff (PAS) o Warthin-Starry mejoran el diagnóstico especialmente en pacientes con LPN1,14,18.
Chahuan y colaboradores demostraron que, adicionalmente al uso de H&E, se prefiere la coloración de Giemsa por ser sensible (42,6%-94%), fácil de realizar, económica, ampliamente disponible y no produce precipitados que se puedan confundir con la bacteria15. Varios estudios muestran la superioridad de la coloración de Giemsa frente a la H&E, cuya sensibilidad oscila entre 28,7% y 83,9% para la detección de la bacteria15,18,19. Además, la coloración de Giemsa reduce la variabilidad interobservador en el diagnóstico de la infección porque facilita su visualización17,20.
Hasta el 75% de los casos de gastritis atrófica se encuentran asociados con la presencia de H. pylori, pero la detección de la bacteria puede pasar inadvertida21. Lo anterior ocasiona resultados falsos negativos en el diagnóstico y no permite que el paciente tenga la oportunidad de recibir tratamiento oportuno para la erradicación22, lo cual se ha demostrado en estudios previos22-26.
En Colombia no se encontraron estudios que determinen la utilidad de las coloraciones especiales como el Giemsa para el diagnóstico de H. pylori en pacientes con LPN gástricas. Por lo anterior, el propósito de este estudio fue determinar la utilidad de la coloración de Giemsa para el diagnóstico de H. pylori en biopsias gástricas de pacientes con LPN que consultaron a 7 instituciones de salud de tres regiones de Antioquia, Colombia, durante los años 2016-2018.
Materiales y métodos
Población de estudio y criterios de elegibilidad
Este estudio deriva del proyecto CODI 2014-1062 aprobado por el Comité de Ética de Investigación de la Facultad de Medicina de la Universidad de Antioquia. Se incluyeron individuos ≥ 18 años que asistieron a 7 instituciones de salud de tres subregiones de Antioquia (área metropolitana del Valle de Aburrá, Oriente y Urabá Antioqueño). Los participantes acudieron para la realización de EDS y la participación en el proyecto fue voluntaria mediante la firma del consentimiento.
Se excluyeron a individuos que recibieron inhibidores de la bomba de protones (IBP) o antagonistas de los receptores de histamina H2 durante los 15 días previos a la EDS o antibióticos en el último mes; individuos con diagnóstico de hemorragia digestiva superior; pacientes anticoagulados o con trastornos de coagulación; embarazadas; personas con antecedentes quirúrgicos previos en el tracto digestivo superior; diagnóstico previo de enfermedades crónicas graves (renal, hepática, insuficiencia cardíaca descompensada y diabetes mellitus descompensada) y personas con antecedentes de radioquimioterapia. De 272 individuos incluidos en el estudio anterior, se seleccionó una muestra de 65 pacientes con diagnóstico histopatológico de LPN (gastritis atrófica o metaplasia intestinal) para este estudio. No se incluyeron pacientes con displasia dado que este hallazgo histopatológico no fue reportado en los pacientes incluidos en este estudio17.
Recolección de las biopsias y procesamiento
Se tomaron 5 muestras a cada participante siguiendo las recomendaciones del protocolo de Sydney actualizado que incluyen una muestra de la curvatura mayor del antro (A1), curvatura menor del antro (A2), incisura angularis (I), curvatura mayor del cuerpo (C1) y curvatura menor del cuerpo (C2); una sexta muestra fue tomada en los casos en que se evidenció tumor. Las muestras se almacenaron y transportaron a la Unidad de Citología y Patología de la Clínica las Vegas para su procesamiento. Las muestras de cada paciente fueron teñidas con H&E y Giemsa modificado-Diff Quick.
Lectura de las biopsias y diagnóstico histopatológico de H. pylori
Se evaluaron las cinco biopsias teñidas con Giemsa y se realizó una lectura ciega y aleatoria por parte de uno de dos patólogos y un residente de patología de tercer año. La presencia o ausencia de la bacteria se determinó como positiva o negativa mediante la observación directa de bacilos gramnegativos helicoidales con un microscopio de luz (Leica® DM500), y para su cuantificación se utilizó la escala visual análoga del protocolo de Sydney actualizado (ausente, escaso, moderado y abundante)16. La búsqueda de la bacteria se realizó en las áreas no atróficas y sin metaplasia intestinal de la mucosa. Las características tintoriales de la bacteria para especificar en la coloración de H&E fueron el monocromatismo similar al epitelio foveolar y en la coloración especial de Giemsa, la tinción azul oscura que se resalta. En los casos en que se presentó discordancia para la presencia o cuantificación de la bacteria, se realizó una tercera lectura por el segundo patólogo y el residente de patología y los resultados fueron consensuados.
Análisis de datos
Se utilizó el paquete estadístico SPSS (IBM) v. 27. Para las variables cualitativas se usó la distribución de frecuencias absolutas y relativas de las categorías de las variables. Para la variable cuantitativa de edad se utilizó la media ± desviación estándar (DE), ya que se observó una distribución normal según la prueba de Kolmogorov-Smirnov. La proporción entre las dos coloraciones se definió con base en una tabla de 2 x 2 dividiendo la cantidad de coincidencias tanto positivas como negativas por el total.
Resultados
En el estudio se evaluaron 325 biopsias gástricas de 65 pacientes con LPN. La edad promedio fue de 54,4 años (DE: 16,4) y el 63% (41) eran del sexo femenino. El 69,2% (45) de los participantes vivían en el área metropolitana de Medellín, el 23,1% (15) en el Oriente y el 7,7% (5) en el Urabá Antioqueño.
En cuanto al diagnóstico histopatológico de la infección por H. pylori, la coloración de Giemsa tuvo una proporción de positividad del 98,5%, que fue menor con H&E (Figura 1).
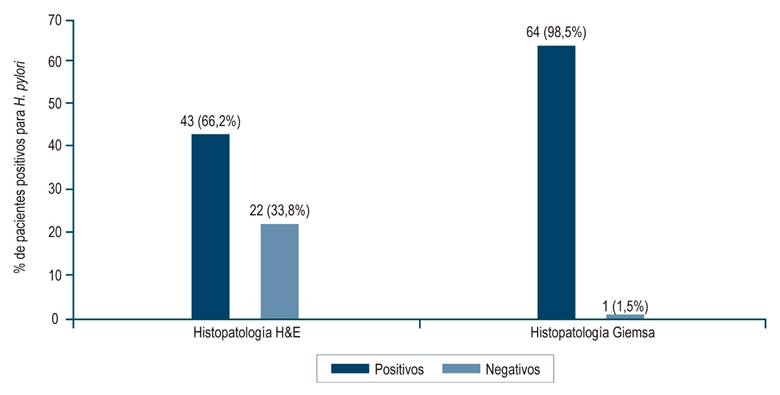
Figura 1 Distribución de los pacientes según los resultados de las coloraciones histopatológicas para H. pylori. Fuente: elaboración propia.
Al analizar la presencia de la bacteria por el sitio de toma de la biopsia se encontró que H. pylori fue más frecuente en A1, A2 e I. La positividad para el diagnóstico de H. pylori fue mayor con la coloración de Giemsa en todos los sitios anatómicos (61,5%-72%), mientras que con H&E varió entre 41,5% y 49% (Figura 2).
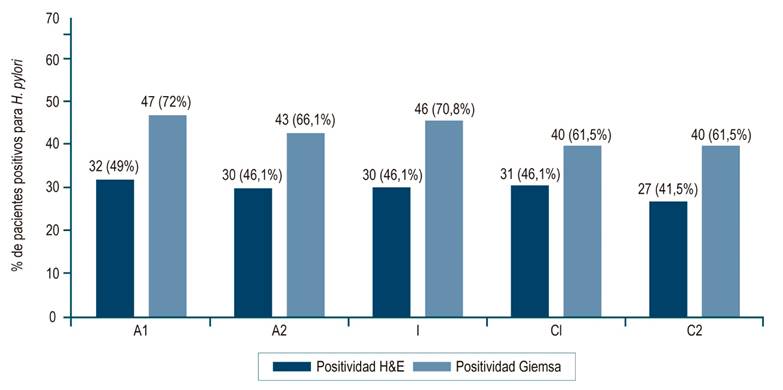
Figura 2 Distribución de los resultados positivos de H&E y Giemsa para H. pylori por el sitio anatómico. A1: curvatura mayor del antro; A2: curvatura menor del antro; I: incisura angularis; C1: curvatura mayor del cuerpo; C2: curvatura menor del cuerpo. Fuente: elaboración propia.
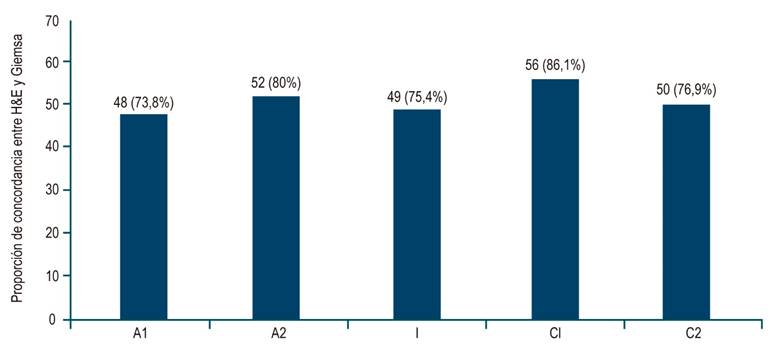
La proporción para los resultados positivos y negativos entre la coloración de H&E y la coloración de Giemsa fue mayor en las muestras de C1, con 86,1%, y menor en A1, con 73,8% (Figura 3).
La proporción de muestras positivas para H. pylori evaluadas con la coloración de Giemsa fue mayor en comparación con H&E. La diferencia fue mayor en las muestras con escasa cantidad de bacterias, con una diferencia estadísticamente significativa (p = 0,035) (Tabla 1).
Tabla 1 Proporción de positividad para H. pylori de acuerdo con la densidad de la infección y coloración utilizada en cada sitio anatómico
| Sitio de muestreo | Cantidad de H. pylori | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Escasa | Moderada | Abundante | ||||||||||
| H&E | Giemsa | H&E | Giemsa | H&E | Giemsa | |||||||
| n | % | n | % | n | % | n | % | n | % | n | % | |
| A1 | 13 | 8,5 | 23 | 10,5 | 11 | 7,2 | 12 | 5,5 | 8 | 5,2 | 12 | 5,5 |
| A2 | 8 | 5,2 | 21 | 9,6 | 13 | 8,5 | 10 | 4,6 | 9 | 5,9 | 12 | 5,5 |
| I | 10 | 6,5 | 25 | 11,4 | 10 | 6,5 | 12 | 5,5 | 10 | 6,5 | 9 | 4,1 |
| C1 | 15 | 9,8 | 18 | 8,2 | 9 | 5,9 | 13 | 5,9 | 9 | 5,9 | 11 | 5,0 |
| C2 | 14 | 9,1 | 19 | 8,7 | 8 | 5,2 | 13 | 5,9 | 6 | 3,9 | 9 | 4,1 |
| Total | 60 | 39,1 | 106 | 48,4 | 51 | 33,3 | 60 | 27,4 | 42 | 27,4 | 53 | 24,2 |
A1: curvatura mayor del antro; A2: curvatura menor del antro; I: Incisura angularis; C1: curvatura mayor del cuerpo; C2: curvatura menor del cuerpo. Cantidad de casos positivos para H&E: 153 y para Giemsa: 219. Fuente:elaboración propia.
Discusión
Varios métodos invasivos y no invasivos están disponibles para la detección de H. pylori, pero si se tiene en cuenta la sensibilidad, la especificidad, el costo, la reproducibilidad y la rapidez, no existe una prueba que se considere el estándar de oro para el diagnóstico11. En este estudio, se utilizaron dos técnicas histológicas (H&E y Giemsa) para el diagnóstico de H. pylori en pacientes con LPN (gastritis atrófica y metaplasia intestinal), cuya densidad bacteriana es baja. Según los resultados obtenidos, la coloración de Giemsa tuvo mayor proporción de positividad en cada uno de los 5 sitios anatómicos evaluados según el protocolo de Sydney actualizado y esta proporción fue consistentemente más elevada en el grupo de muestras con escasa cantidad de bacterias.
El uso de coloraciones complementarias se ha evaluado en estudios previos, Khan H y colaboradores reportaron la necesidad de tinciones adicionales como Giemsa, PAS-AB, Warthin-Starry e inmunohistoquímica (IHQ) en pacientes que presenten baja carga bacteriana (inflamación leve) asociada a mucosa atrófica o posterior a la terapia de erradicación27. En nuestra experiencia se seleccionó la coloración de Giemsa como complementaria, por ser una coloración reportada en la literatura para la detección de H. pylori dadas sus características: económica, sensible, fácil de realizar y reproducible9. En un estudio de 2014, Boldt y colaboradores encontraron que la tinción de Giemsa presentó mayor sensibilidad y especificidad al compararse con H&E28. Alkhamiss AS y colaboradores encontraron que la especificidad de la H&E para H. pylori es alta (91,18%), pero su sensibilidad es baja (66,67%), en contraste con la tinción de Giemsa, cuya sensibilidad y especificidad fueron altas (93,33% y 100%, respectivamente), lo que sugiere que Giemsa es una mejor opción al compararla con H&E29.
En este estudio se observó que la tinción de H&E tuvo una proporción de positividad menor (66,2%) en comparación con la coloración complementaria de Giemsa (98,5%), similar a lo registrado por Alkhamiss AS y colaboradores29. Por su parte, Mawlood y colaboradores reportaron hallazgos similares para Giemsa con una proporción de positividad de 93,5% y para H&E de 83,9%17. Laine y colaboradores encontraron una sensibilidad similar entre las dos coloraciones (H&E: 92% y Giemsa: 88%) y resaltan que la especificidad de Giemsa fue significativamente mayor que la coloración de H&E (98% y 89%, respectivamente), por lo cual la recomiendan para el diagnóstico de H. pylori18.
La proporción de muestras positivas para H. pylori con Giemsa fue consistentemente más elevada que la de H&E en muestras con cantidad escasa de bacterias (p = 0,035); diagnostica en promedio 20,3% más casos positivos. Lo anterior sugiere que la coloración de H&E debe ser complementada con una coloración adicional como Giemsa cuando la cantidad de bacterias es escasa. Esto se demostró también por Moayyedi y colaboradores30 y por Vaira D y colaboradores, quienes determinaron que el examen histológico, en particular, si se realiza solo con H&E, puede pasar por alto infecciones de baja densidad31, debido a que en estas circunstancias la bacteria puede ser fácilmente confundida con detritos celulares ya que la tinción con H&E no es específica para H. pylori. Sabbagh P y colaboradores demostraron que la precisión del diagnóstico histopatológico de H. pylori depende de la cantidad y la ubicación de las biopsias recogidas11.
En este estudio fue posible realizar el diagnóstico de la infección por H. pylori en muestras provenientes de los 5 sitios anatómicos, lo cual es congruente con lo reportado por Lee JY y colaboradores, quienes mencionan que en los casos de gastritis atrófica y metaplasia intestinal existe un cambio en la colonización habitual del antro hacia el estómago proximal (cuerpo y fondo gástrico) como resultado de condiciones antrales hostiles, incluido el aumento del pH, en el que la atrofia y la metaplasia ocurren con mayor frecuencia, y reportaron que el sitio de biopsia apropiado para detectar la infección por H. pylori en pacientes con estas lesiones es el cuerpo gástrico32.
En Colombia no existe un consenso sobre el diagnóstico histológico de la infección por H. pylori. Sabbagh P y colaboradores refieren que por este método se podría hacer el diagnóstico con una sola muestra de biopsia gástrica, pero se recomiendan biopsias múltiples para aumentar la precisión diagnóstica y la sensibilidad11, y por lo general, se utilizan dos métodos de tinción diferentes: H&E para la evaluación de células inflamatorias y Giemsa para la visualización de la bacteria11. Alkhamiss AS y colaboradores, Makristathis y colaboradores, y Batts KP y colaboradores sugirieron que los estudios complementarios a la H&E, como la coloración del Giemsa para el diagnóstico de H. pylori, se deben realizar solo para los casos en los que existe alta sospecha de la presencia de una infección por la bacteria que no se puede visualizar con H&E, como los casos con gastritis activa o con formación de centros germinales29,33,34.
Lee JY y colaboradores también refieren que la especificidad de la histología puede mejorarse mediante tinciones especiales como Giemsa y tinciones inmunohistoquímicas32, esta última se utiliza en otros países en casos de baja densidad bacteriana, gastritis atrófica con metaplasia intestinal extensa y gastritis activa crónica sin identificación de H. pylori por la tinción estándar. La IHQ es más específica; sin embargo, es más costosa, de mayor dificultad técnica y no está disponible en todos los laboratorios9.
Según la guía de práctica clínica de la Asociación Colombiana de Gastroenterología para el diagnóstico y tratamiento de la infección por H. pylori en adultos se recomienda la coloración básica de rutina con H&E y la coloración especial con Giemsa para determinar la presencia o no de H. pylori; la IHQ se reserva para casos que presentan negatividad con las coloraciones, inflamación activa, biopsias postratamiento de linfomas MALT y cuando las formas cocoides u otros organismos no se pueden identificar con certeza35. Según Kocsmár É y colaboradores, el uso de IHQ es razonable en casos negativos con la coloración de Giemsa y no presentan actividad inflamatoria, en los que el papel etiológico de H. pylori se sugiere por datos clínicos, anamnésicos u otros36.
Conclusión
En los países de medianos a bajos ingresos, como Colombia, cada vez es más crítico que los sistemas de salud encuentren alternativas de diagnóstico rentables y eficientes para diagnosticar la infección por H. pylori. La coloración de Giemsa demostró tener utilidad en el estudio histopatológico de H. pylori en muestras con baja densidad bacteriana, como en las provenientes de los pacientes con LPN; sin embargo, no se descarta su utilidad en la evaluación de la mucosa gástrica no atrófica, en úlceras y en neoplasias. El uso de la coloración de Giemsa podría aumentar la sensibilidad del diagnóstico de la infección y, con ello, optimizar el tratamiento de erradicación para la bacteria con miras a reducir o revertir la progresión a enfermedad.
Agradecimientos
A la doctora Ana María Cock Botero y a la Unidad De Citología y Patología de la Clínica las Vegas (Medellín, Colombia) por el procesamiento de las muestras. Al grupo de investigación Bacterias & Cáncer y al Departamento de Patología de la Facultad de Medicina de la Universidad de Antioquia.
REFERENCIAS
1. Zamani M, Ebrahimtabar F, Zamani V, Miller WH, Alizadeh-Navaei R, Shokri- Shirvani J, et al. Systematic review with meta-analysis: the worldwide prevalence of Helicobacter pylori infection. Aliment Pharmacol Ther. 2018;47(7):868-76. https://doi.org/10.1111/apt.14561 [ Links ]
2. Roldán IJ, Castaño R, Navas MC. Mutaciones del gen ARN ribosómico 23S de Helicobacter pylori asociadas con resistencia a claritromicina en pacientes atendidos en una unidad de endoscopia de Medellín, Colombia. Biomedica. 2019;39(Supl. 2):117-29. https://doi.org/10.7705/biomedica.v39i4.4377 [ Links ]
3. Bravo LE, Cortés A, Carrascal E, Jaramillo R, García LS, Bravo PE. Helicobacter pylori: patología y prevalencia en biopsias gástricas en Colombia. Colomb Médica. 2003;34(3):124-31. [ Links ]
4. Correa GS, Cardona A, Correa GT, García G, Estrada S. Prevalencia de Helicobacter pylori y características histopatológicas en biopsias gástricas de pacientes con síntomas dispépticos en un centro de referencia de Medellín. Rev Colomb Gastroenterol. 2016;31(1):9-15. https://doi.org/10.22516/25007440.67 [ Links ]
5. IARC Working Group on the Evaluation of Carcinogenic Risks to Humans. Schistosomes, Liver Flukes and Helicobacter pylori. Lyon (FR): International Agency for Research on Cancer; 1994. (IARC Monographs on the Evaluation of Carcinogenic Risks to Humans, No. 61.) INFECTION WITH HELICOBACTER PYLORI. Available from: https://www.ncbi.nlm.nih.gov/books/NBK487794/ [ Links ]
6. IARC. Colombia. source: Globocan 2020 [Internet]. Iarc.fr.; 2021 [citado el 31 de marzo de 2022]. Disponible en: Disponible en: https://gco.iarc.fr/today/data/factsheets/populations/170- colombia-fact-sheets.pdf [ Links ]
7. Weng C-Y, Xu J-L, Sun S-P, Wang K-J, Lv B. Helicobacter pylori eradication: Exploring its impacts on the gastric mucosa. World J Gastroenterol. 2021;27(31):5152-70. https://doi.org/10.3748/wjg.v27.i31.5152 [ Links ]
8. Basso L, Gallo G, Biacchi D, Carati MV, Cavallaro G, Esposito L, et al. Role of new anatomy, biliopancreatic reflux, and Helicobacter pylori status in postgastrectomy stump cancer. J Clin Med. 2022;11(6):1498. https://doi.org/10.3390/jcm11061498 [ Links ]
9. Bordin DS, Voynovan IN, Andreev DN, Maev IV. Current Helicobacter pylori diagnostics. Diagnostics (Basel). 2021;11(8):1458. https://doi.org/10.3390/diagnostics11081458 [ Links ]
10. Chahuán AJ, La DP, Villalón FA. Métodos de diagnóstico para la detección de la infección por Helicobacter pylori. Rev Gastroenterol Latinoam. 2020;31(2):98-106. https://doi.org/10.46613/gastrolat202002-08 [ Links ]
11. Sabbagh P, Mohammadnia-Afrouzi M, Javanian M, Babazadeh A, Koppolu V, Vasigala VR, et al. Diagnostic methods for Helicobacter pylori infection: ideals, options, and limitations. Eur J Clin Microbiol Infect Dis. 2019;38(1):55-66. https://doi.org/10.1007/s10096-018-3414-4 [ Links ]
12. Nizeyimana T, Rugwizangoga B, Manirakiza F, Laga AC. Occurrence of Helicobacter pylori in specimens of chronic gastritis and gastric adenocarcinoma patients: A retrospective study at university teaching hospital, Kigali, Rwanda. East Afr Health Res J. 2021;5(2):159-63. https://doi.org/10.24248/eahrj.v5i2.667 [ Links ]
13. Zhang C, Yamada N, Wu YL, Wen M, Matsuhisa T, Matsukura N. Helicobacter pylori infection, glandular atrophy and intestinal metaplasia in superficial gastritis, gastric erosion, erosive gastritis, gastric ulcer and early gastric cancer. World J Gastroenterol. 2005;11(6):791-796. https://doi.org/10.3748/wjg.v11.i6.791 [ Links ]
14. Chahuan J, Pizarro M, Riquelme A. Métodos diagnósticos para la detección de infección por Helicobacter pylori. ¿Cuál y cuándo deben solicitarse? Acta Gastroenterol Latinoam. 2022;52(1):36-46. https://doi.org/10.52787/agl.v52i1.176 [ Links ]
15. Loor A, Dumitraşcu DL. Helicobacter pylori Infection, Gastric Cancer and Gastropanel. Rom J Intern Med. 2016;54(3):151-6. https://doi.org/10.1515/rjim-2016-0025 [ Links ]
16. Dixon MF, Genta RM, Yardley JH, Correa P. Classification and grading of gastritis. The updated Sydney System. International Workshop on the Histopathology of Gastritis, Houston 1994. Am J Surg Pathol. 1996;20(10):1161-81. https://doi.org/10.1097/00000478-199610000-00001 [ Links ]
17. Salazar BE, Pérez-Cala T, Gomez-Villegas SI, Cardona-Zapata L, Pazos- Bastidas S, Cardona-Estepa A, et al. The OLGA-OLGIM staging and the interobserver agreement for gastritis and preneoplastic lesion screening: a cross-sectional study. Virchows Arch. 2022;480(4):759-769. https://doi.org/10.1007/s00428-022-03286-8 [ Links ]
18. Mawlood AH, Kawther RS, Balaky S. Evaluation of Invasive and Non-Invasive Methods for the Diagnosis of H. pylori in Dyspepsia Patients. Diyala J Med. 2019;16(2):55-63. https://doi.org/10.26505/DJM.16024460122 [ Links ]
19. Laine L, Lewin DN, Naritoku W, Cohen H. Prospective comparison of H&E, Giemsa, and Genta stains for the diagnosis of Helicobacter pylori. Gastrointest Endosc. 1997;45(6):463-7. https://doi.org/10.1016/S0016-5107(97)70174-3 [ Links ]
20. Miwata T, Quach DT, Hiyama T, Aoki R, Le HM, Tran PLN, et al. Interobserver and intraobserver agreement for gastric mucosa atrophy. BMC Gastroenterol. 2015;15:95. https://doi.org/10.1186/s12876-015-0327-x [ Links ]
21. Zolezzi-Francis A. Gastritis atrófiaca y Helicobacter pylori. Rev Gastroenterol Peru. 2002;22(3):197-8. [ Links ]
22. Kong Y-J, Yi H-G, Dai J-C, Wei M-X. Histological changes of gastric mucosa after Helicobacter pylori eradication: a systematic review and meta-analysis. World J Gastroenterol. 2014;20(19):5903-11. https://doi.org/10.3748/wjg.v20.i19.5903 [ Links ]
23. Sung JJY, Coker OO, Chu E, Szeto CH, Luk STY, Lau HCH, et al. Gastric microbes associated with gastric inflammation, atrophy and intestinal metaplasia 1 year after Helicobacter pylori eradication. Gut. 2020;69(9):1572-80. https://doi.org/10.1136/gutjnl-2019-319826 [ Links ]
24. Hwang Y-J, Kim N, Lee HS, Lee JB, Choi YJ, Yoon H, et al. Reversibility of atrophic gastritis and intestinal metaplasia after Helicobacter pylori eradication - a prospective study for up to 10 years. Aliment Pharmacol Ther. 2018;47(3):380-90. https://doi.org/10.1111/apt.14424 [ Links ]
25. Chiang T-H, Chang W-J, Chen SL-S, Yen AM-F, Fann JC-Y, Chiu SY-H, et al. Mass eradication of Helicobacter pylori to reduce gastric cancer incidence and mortality: a long-term cohort study on Matsu Islands. Gut. 2021;70(2):243-50. https://doi.org/10.1136/gutjnl-2020-322200 [ Links ]
26. Shah DK, Jain SS, Mohite A, Amarapurkar AD, Contractor QQ, Rathi PM. Effect of H. pylori density by histopathology on its complications and eradication therapy. Trop Gastroenterol. 2015;36(2):101-6. https://doi.org/10.7869/tg.261 [ Links ]
27. Khan H, Rauf F, Muhammad N, Javaid M, Alam S, Nasir S. Comparación de tinciones especiales (tinción de Giemsa y tinción de azul de toluidina modificada) con inmunohistoquímica como estándar de oro para la detección de H. pylori en biopsias gástricas. Arab J Gastroenterol. 2022;23(2):75-81. [ Links ]
28. Boldt MS, Pereira RD, Barbosa AJA. Identificación histológica de H. pylori stained por hematoxilina-eosina y Giemsa: revisión para el control de calidad. J Bras Patol Med Lab. 2015;51(2):108-12. [ Links ]
29. Alkhamiss AS. Evaluation of better staining method among hematoxylin and eosin, Giemsa and periodic acid Schiff-Alcian blue for the detection of Helicobacter pylori in gastric biopsies. Malays J Med Sci. 2020;27(5):53-61. https://doi.org/10.21315/mjms2020.27.5.6 [ Links ]
30. Moayyedi P, Dixon MF. Any role left for invasive tests? Histology in clinical practice. Gut. 1998;43 Suppl 1:S51-5. https://doi.org/10.1136/gut.43.2008.S51 [ Links ]
31. Vaira D, Ricci C, Holton J. Diagnosis of Helicobacter pylori: invasive and non- invasive tests. Best Pract Res Clin Gastroenterol. 2007;21(2):299-313. https://doi.org/10.1016/j.bpg.2006.11.002 [ Links ]
32. Lee JY, Kim N. Diagnosis of Helicobacter pylori by invasive test: histology. Ann Transl Med. 2015;3(1):10. Disponible en: http://dx.doi.org/10.3978/j.issn.2305-5839.2014.11.03 [ Links ]
33. Makristathis A, Hirschl AM, Mégraud F, Bessède E. Review: Diagnosis of Helicobacter pylori infection. Helicobacter. 2019;24 Suppl 1(S1):e12641. https://doi.org/10.1111/hel.12641 [ Links ]
34. Batts KP, Ketover S, Kakar S, Krasinskas AM, Mitchell KA, Wilcox R, et al. Appropriate use of special stains for identifying Helicobacter pylori: Recommendations from the Rodger C. Haggitt Gastrointestinal Pathology Society. Am J Surg Pathol. 2013;37(11):e12-22. https://doi.org/10.1097/PAS.0000000000000097 [ Links ]
35. Sabbagh LC, Otero W, Hani A, Galindo A, Leguízamo A, Maldonado C, et al. Guías de práctica clínica basadas en la evidencia. Guía de práctica clínica para el diagnóstico y tratamiento de la infección por Helicobacter pylori en adultos [Internet]. Asociación Colombiana de Gastroenterología; 2016-2017 [citado el 9 de julio de 2022]. Disponible en: Disponible en: https://www.gastrocol.com/wp-content/uploads/2020/04/GPC3_Helicobacter.pdf [ Links ]
36. Kocsmár É, Szirtes I, Kramer Z, Szijártó A, Bene L, Buzás GM, et al. Sensitivity of Helicobacter pylori detection by Giemsa staining is poor in comparison with immunohistochemistry and fluorescent in situ hybridization and strongly depends on inflammatory activity. Helicobacter. 2017;22(4):e12387. https://doi.org/10.1111/hel.12387 [ Links ]
Citación: García-Carmona S, Arango-Viana JC, Ahumada-Rodríguez E, Agudelo-Mesa J, Pérez-Cala T, Martínez A, Ospina-Ospina S, Salazar BE. Utilidad de la coloración de Giemsa para diagnosticar Helicobacter pylori en pacientes con lesiones preneoplásicas. Revista. colomb. Gastroenterol. 2022;37(4):402-409. https://doi.org/10.22516/25007440.938
Recibido: 12 de Julio de 2022; Aprobado: 26 de Septiembre de 2022











 text in
text in