Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista colombiana de Gastroenterología
versión impresa ISSN 0120-9957versión On-line ISSN 2500-7440
Rev. colomb. Gastroenterol. vol.37 no.4 Bogotá oct./dic. 2022 Epub 10-Jul-2023
https://doi.org/10.22516/25007440.917
Artículo de revisión
Reinfección por virus de la hepatitis C: revisión de tema y presentación de un caso
1Gastrohepatology group, Faculty of Medicine, Universidad de Antioquia. Medellín, Colombia.
2Clínica Las Américas AUNA. Medellín, Colombia.
La infección crónica por el virus de la hepatitis C (VHC) afecta a 58 millones de personas y es una importante causa de morbimortalidad alrededor del mundo. La reinfección por VHC es un problema creciente en personas con factores de riesgo como consumo pesado de alcohol, sexo anal, sexo grupal y compartir agujas y jeringas; este tipo de infección se define como un nuevo contagio de VHC con un genotipo viral diferente al de la primera infección en un paciente luego de lograr una respuesta viral sostenida (RVS). La reinfección se presenta, en parte, debido a la ausencia de estrategias de promoción y prevención. Teniendo en cuenta estos antecedentes, se han propuesto estrategias más pragmáticas para controlar la infección por VHC y evitar la reinfección, tales como la microeliminación.
En el presente artículo se presenta un caso de un paciente que presenta alteración en los marcadores de la bioquímica hepática, por lo que se solicita una prueba diagnóstica de infección por VHC y luego genotipificación viral, y se evidenció una infección por VHC genotipo 1, subgenotipo 1A. Se inició el manejo con antivirales de acción directa y se documentó una adecuada RVS12. Tres meses después el paciente regresó a consulta y en los exámenes de control se evidenció una carga viral elevada de VHC, por lo que se solicitó genotipificación y se demostró una nueva infección por VHC genotipo 4.
Palabras clave: Antivirales de acción directa; virus de la hepatitis C; respuesta virológica sostenida; reinfección; coinfección VIH/VHC
Chronic hepatitis C (HCV) infection affects 58 million people and is a significant cause of morbidity and mortality worldwide. HCV reinfection is a growing problem in people with risk factors such as heavy alcohol use, anal sex, group sex, and sharing needles and syringes. This type of infection is defined as a new HCV infection with a different viral genotype than the first infection in a patient after achieving a sustained viral response (SVR). Reinfection occurs, in part, due to the absence of promotion and prevention strategies. Taking this background into account, more pragmatic approaches have been proposed to control HCV infection and avoid reinfection, such as micro elimination.
This article reports the case of a patient with alterations in biochemical liver markers, for which a diagnostic test for HCV infection and then viral genotyping was requested. Infection by HCV genotype 1, subgenotype 1A, was evidenced. Management with direct-acting antivirals was started, and an adequate SVR12 was documented. Three months later, the patient returned, and the control tests showed a high HCV viral load, for which genotyping was requested, showing a new HCV genotype 4 infection.
Keywords: Direct-acting antivirals; hepatitis C virus; sustained virological response; reinfection; HIV/HCV coinfection
Introducción
La hepatitis C crónica es un importante desafío para la salud pública. Se estima que en 2019 aproximadamente 290 000 personas murieron de hepatitis C, principalmente por el desarrollo de hepatopatías terminales (cirrosis y carcinoma hepatocelular). Actualmente existen 58 millones de personas infectadas por el virus de la hepatitis C (VHC) y se reportan aproximadamente 1,5 millones de nuevas infecciones al año1.
La infección crónica por VHC desencadena un proceso inflamatorio que puede evolucionar a fibrosis hepática, cirrosis, carcinoma hepatocelular y la muerte2. La cirrosis y descompensación hepática están asociadas a un riesgo anual del 2% a 5% de muerte, y del 15%-20% de las personas con enfermedad hepática mueren durante el primer año luego de la descompensación3. Además, la hepatitis C crónica es una de las principales causas de trasplante hepático en Occidente (Figura 1)4-6.
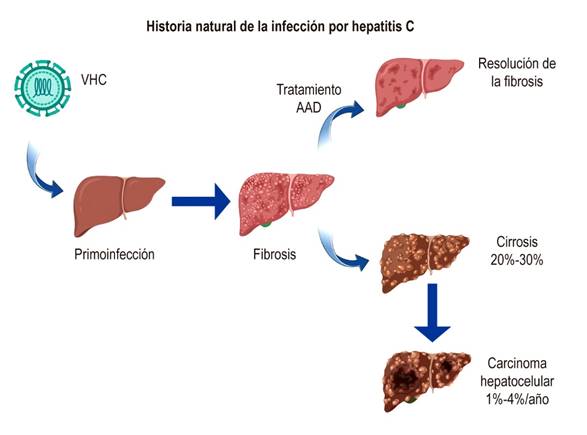
Figura 1 Historia natural de la infección por hepatitis C. AAD: antivirales de acción directa. Adaptado de Lingala y colaboradores3.
La Organización Mundial de la Salud (OMS) ha establecido una estrategia mundial contra la hepatitis viral; entre sus objetivos están el diagnóstico del 90% de los casos y el tratamiento del 80% de los pacientes, y así lograr la reducción del 65% en la mortalidad asociada a las hepatitis virales para el 20307. Para lograr estos objetivos es necesario realizar una búsqueda activa de casos con un adecuado ingreso al sistema de salud. Igualmente, es imperativo conocer las tasas de infección y la posibilidad de recurrencia, ya que esta información puede orientar intervenciones enfocadas a reducir esta situación en grupos de riesgo8.
Además de una búsqueda activa y una adecuada caracterización de la población, es necesario contar con el esquema de tratamiento antiviral para cumplir la meta de la OMS de control y eliminación. Es un indicativo de curación de la infección por VHC cuando se demuestra una respuesta viral sostenida (RVS), la cual es definida como ausencia del genoma de VHC en suero o plasma mediante un ensayo (LLOD ≤ 15 UI/mL) a la semana 12 (SVR12) o semana 24 (SVR24) luego de finalizar el esquema de tratamiento. El aclaramiento viral también se asocia con la normalización de los niveles séricos de las enzimas hepáticas, mejoría o desaparición de la necroinflamación hepática y fibrosis, así como la disminución de las manifestaciones extrahépaticas de la infección por VHC9.
Para lograr esta RVS se requieren medicamentos altamente efectivos. Durante mucho tiempo la única terapia disponible para los pacientes con hepatitis C era basada en el interferón tipo I, con muchas limitaciones por los efectos secundarios y por la resistencia viral, lo que conducía al fracaso de la terapia en un porcentaje importante de los pacientes10. Sin embargo, actualmente hay antivirales de acción directa (AAD) que van dirigidos contra las proteínas virales como NS3 y su cofactor NS4A (inhibidores de proteasa), NS5B (inhibidores de la polimerasa viral tipo nucleósidos o no nucleósidos) y NS5A (inhibidores de la formación del complejo de replicación viral)11. Estos antivirales tienen una tasa de aclaramiento viral cercana al 95%, incluso en casos de coinfección por virus de la inmunodeficiencia humana (VIH), cirrosis hepática descompensada y enfermedad renal terminal12,13. Los esquemas de tratamiento con AAD pueden ser dirigidos contra un genotipo específico o de tipo pangenómico, el cual es la preferencia actual. La secuenciación del genoma viral (NS3, NS5A y NS5B) antes del tratamiento se recomienda en algunos casos puntuales en los que el riesgo de resistencia es elevado para ciertos esquemas con AAD10.
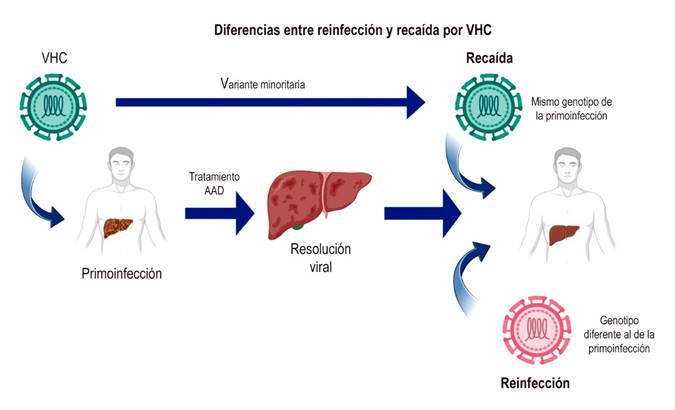
Se debe sospechar una recurrencia (recaída o reinfección) en caso de una reaparición de la viremia después de RVS14. Si se presenta luego de RVS12, puede ser debido a una recaída, en la que el VHC persiste en el individuo y reaparece debido a una selección de una variante viral minoritaria; esta variante es el resultado de la actividad de la ARN polimerasa viral dependiente de ARN del VHC que no tiene actividad de corrección y, por tanto, tiene una alta tasa de error, lo que conduce a la heterogeneidad genética y la generación de cuasiespecies (Figura 2)15. Además, se ha descrito en algunos casos recaída tardía, en los cuales se han documentado niveles indetectables de carga viral luego del tratamiento (SVR) y reaparición del genoma viral en sangre 24 semanas después de finalizado el esquema de tratamiento con AAD. Los casos de recaída tardía se han documentado mediante la secuenciación de nueva generación o deep sequencing; esta metodología permite calcular la diversidad genética en términos de cantidad de mutaciones por sitio en las cuasiespecies del genoma de VHC aislado de un paciente antes del tratamiento y durante la recaída tardía. Este análisis es necesario para demostrar una recaída tardía o una reinfección con el mismo genotipo de VHC de la primera infección y por las implicaciones en el esquema de tratamiento, y plantea la necesidad de reconsiderar el tiempo de seguimiento de un paciente luego de cumplir con el esquema de tratamiento16,17. La recaída tardía es un fenómeno facilitado por la infección por VHC de sitios extrahepáticos, como se ha documentado en células mononucleares de sangre periférica y células dendríticas18,19, así como células de la mucosa gastrointestinal20.
La posibilidad de reinfección se debe considerar en un individuo luego de completar el esquema de tratamiento y con aclaramiento viral. Uno de los factores más importantes asociados a la reinfección es una respuesta inmune humoral y celular con poca actividad contra el VHC; además, es de anotar que la respuesta es específica del genotipo viral y, por tanto, existe susceptibilidad a los otros genotipos de VHC diferentes al de la primera infección21-23. Por esta razón, es indispensable caracterizar el genotipo viral pre- y postratamiento para distinguir entre una recaída y una reinfección. Dado que la reinfección corresponde a un nuevo contagio por otro genotipo del VHC, el diagnóstico de reinfección se establece por la detección de un genotipo de VHC diferente al de la primera infección24-26.
Con los AAD, las tasas de recaída virológica después de la RVS12 son muy bajas. Los casos de una recaída virológica generalmente se presentan en las primeras 4 semanas luego de terminar el esquema de tratamiento, mientras que la reinfección se puede definir como la detección de viremia por VHC en personas con una RVS12 después de completar el tratamiento con un régimen de AAD y que tienen factores de riesgo8.
Según la Asociación Europea para el Estudio del Hígado (EASL), se recomienda que los pacientes que alcancen una RVS deben someterse a seguimiento de carga viral 24 semanas después de completar el tratamiento, principalmente en poblaciones con factores de riesgo, como personas que se inyectan (PID) y hombres que tienen sexo con hombres (HSH). La curación de la infección se puede considerar definitiva cuando el genoma del VHC es indetectable a ese tiempo27.
Por su parte, la Asociación Estadounidense para el Estudio de Enfermedades Hepáticas (AASLD) recomienda hacer controles cada 6-12 meses en personas con factores de riesgo o con disfunción hepática inexplicable para evaluar si hay recaída o reinfección por VHC28.
En este artículo se presenta el primer caso de reinfección por VHC en un paciente luego de RVS luego de tratamiento con AAD.
Virus de la hepatitis C
El VHC fue descubierto en 1989 y, desde entonces, la investigación clínica y en ciencias básicas ha permitido el progreso en la comprensión de la fisiopatogénesis y el desarrollo de herramientas para el diagnóstico y tratamiento29,30. Hasta el momento se han caracterizado 8 genotipos de VHC y más de 90 subgenotipos31,32. El VHC es un miembro de la familia Flaviviridae, género Hepacivirus. El genoma viral es un ARN monocatenario de sentido positivo de 9,6 kb, aproximadamente, que codifica una sola poliproteína que se escinde en 10 proteínas, a saber: 3 proteínas estructurales, proteína de la cápside (Core) y 2 glicoproteínas presentes en la envoltura (E1 y E2), así como 7 proteínas no estructurales que incluyen 2 proteínas necesarias para el ensamblaje de viriones (p7 y NS2), y 5 proteínas que forman el complejo de replicación viral (NS3, NS4A, NS4B, NS5A y NS5B)10.
Transmisión y factores de riesgo para la infección por hepatitis C
El VHC se transmite fundamentalmente por vía parenteral. Generalmente requiere una exposición a la sangre a través de transfusiones, vía iatrogénica, reutilización de agujas y jeringas y transmisión vertical33,34.
Adicionalmente, se ha documentado la transmisión sexual del VHC y está asociada a factores como relaciones sexuales sin condón, fisting y sexo en grupo. Por otro lado, existen factores de riesgo biológicos que se han descrito en la literatura como una ulceración o infecciones de transmisión sexual concurrentes e infección por el virus de la inmunodeficiencia humana (VIH)35,36. Se ha observado un aumento de casos de VHC adquiridos por esta ruta desde la década del 2000, particularmente en hombres que tienen sexo con hombres (HSH) y en personas con infección por VIH37.
La importancia del conocimiento de los factores de riesgo asociados se ha demostrado en el estudio realizado por Knick y colaboradores, en el que identificaron que los habitantes de regiones con alta incidencia de VHC tenían menos información de los factores de riesgo en comparación con los habitantes de regiones de baja incidencia38.
Historia natural del virus de hepatitis C
La hepatitis C se caracteriza por el desarrollo de una infección transitoria en 15% a 40% de los casos y de infección crónica en 60%-85% de los casos. El aclaramiento espontáneo de la infección se caracteriza por una respuesta inmune celular y humoral temprana, funcional, sostenida y dirigida contra múltiples epítopos de las proteínas virales y está asociado a variables del hospedero y del virus21-23.
La gran mayoría de pacientes desarrolla anticuerpos específicos contra el VHC en una fase temprana de la infección, aunque aún es controversial el papel de los anticuerpos neutralizantes dirigidos contra epítopos conformacionales ubicados en las glicoproteínas E1 y E2 en el aclaramiento viral23.
Una de las estrategias de evasión de la respuesta inmune por parte del virus es la alta variabilidad genética del VHC representada en la cantidad de cuasiespecies a lo largo de la evolución de la infección en un individuo. Además, el fenotipo de agotamiento de las células T CD8+ (CD127low PD-1high), la actividad disminuida de las células T CD4 para expresar moléculas inhibitorias como la proteína de muerte celular programada 1 (PD-1), inmunorreceptor de células T con dominios IgE “immunoreceptor tyrosine-based inhibition motif” (TIGIT), el antígeno 4 del linfocito T citotóxico (CTLA-4) y la producción de citocinas inmunomoduladoras como IL-10 y TGF-β por los linfocitos Treg son mecanismos descritos en la infección persistente por VHC21-23.
Luego del tratamiento con AAD, se ha descrito un aumento en la frecuencia de células T CD8 + específicas para VHC, así como una capacidad proliferativa parcialmente restaurada. Estos cambios se deben al mantenimiento de una población celular T CD8+ memory-like y desaparición de los linfocitos T CD8+ con perfil de agotamiento terminal después del aclaramiento del VHC. Sin embargo, las células memory-like no se restauran completamente al nivel de las células T CD8+ de memorias convencionales, lo que configura un patrón de agotamiento funcional21-23.
Factores de riesgo de reinfección
En un metaanálisis de 61 estudios se estimaron tasas de reinfección de 0,95%, 10,67% y 15,02% de reinfección a 5 años en los grupos de bajo riesgo, de alto riesgo y con coinfección por VIH, respectivamente34. Es importante destacar que la mayoría de los estudios incluidos en esta revisión evaluó la recurrencia después del tratamiento con terapias basadas en interferón.
No existen muchos estudios que evalúen las tasas de reinfección en la era de los AAD; sin embargo, algunos expertos especulan que el tratamiento con AAD puede estar asociado con tasas más altas de reinfección debido a la disponibilidad de los antivirales, a menos efectos adversos y la alta probabilidad de curación, lo que puede favorecer comportamientos de riesgo en las personas luego de la curación de una primera infección8. Ingilis P y colaboradores publicaron un estudio de cohorte retrospectivo que evaluaba la reinfección en HSH en pacientes tratados con AAD; los autores encontraron que el riesgo de reinfección en la población de estudio era mayor que en el del grupo control (1,89 por 100 personas-año; intervalo de confianza [IC] del 95%: 1,41-2,48); así como la tasa de reinfección era mayor en esta población tratada con AAD en comparación con pacientes con tratamiento con interferón, aunque sin significancia estadística (Hazard ratio [HR]: 1,05; IC 95%: 0,64-1,74; p = 0,831)39.
Por su parte, en un estudio de cohorte del Registro de Madrid (Estudio Madrid-CoRe) de pacientes con coinfección por VIH/VHC tratados con AAD se detectaron 12/177 casos de reinfección en HSH (6,8%), que corresponde a una tasa de incidencia de 5,93 por 100 personas/año (IC 95%: 3,37-10,44). En la misma cohorte se presentaron 5/1459 casos de reinfección en PID (0,21 por 100 personas/año)40. En un estudio similar, Smit y colaboradores describieron los hallazgos del estudio ATHENEA de 2000 a 2019. ATHENEA es un registro nacional de observación de la infección por VIH establecido en 1998 que recopila datos clínicos de adultos y niños en los Países Bajos. De un total de 23 590 casos se documentaron 1269 diagnósticos de infección primaria por VHC (incidencia: 5,2 por 1000 personas/año [IC 95%: 5,0-5,5]) y 274 reinfecciones por VHC (incidencia: 26,9 por 1000 personas/año [IC del 95%: 23,9-30,3])41,42.
Se ha descrito que factores como el consumo pesado de alcohol, reutilización de agujas y jeringas, sexo anal y sexo grupal están asociados a la reinfección por VHC en pacientes con infección por VIH y HSH. Por otra parte, se ha demostrado que la consejería de salud mental permite la reducción del riesgo de reinfección por el VHC (HRa: 0,24; IC 95%: 0,13-0,46)43.
Prevención de reinfección por hepatitis C
Una de las condiciones que facilita la reinfección es la ausencia de estrategias de promoción y prevención; por consiguiente, esta problemática representa una carga importante para el sistema de salud y para los pacientes. Teniendo en cuenta que no está disponible una vacuna, la piedra angular del control y la eliminación de la infección por VHC es el tratamiento con los AAD y, por tanto, se han propuesto estrategias más pragmáticas para evitar la reinfección. Estrategias como la microeliminación, que consiste en adaptar los objetivos de eliminación de la OMS a grupos pequeños de la población para ir abordando segmentos de la población en forma individual y específica. De este modo, las intervenciones de tratamiento y prevención se podrían realizar de manera más rápida y eficiente, y lograr la microeliminación del VHC en subpoblaciones determinadas, como las personas con coinfección por VIH o las personas privadas de libertad44. Un ejemplo de esta estrategia es el ensayo Swiss HCVree, cuyo objetivo era evaluar esta estrategia en pacientes con coinfección VHC/VIH y HSH. La alta tasa de persistencia de la infección por VHC en combinación con el alto riesgo de transmisión en estos grupos hacen que el tratamiento antiviral sea una intervención de prevención y una forma de lograr la microeliminación del VHC en HSH. Este programa de microeliminación condujo en un período de 2 años a una disminución de 57% y 84% de las infecciones por VHC incidentes y prevalentes, respectivamente45.
En las estrategias de prevención de la reinfección también se encuentra el adecuado seguimiento a los pacientes luego del tratamiento con AAD, como se puede evidenciar en un estudio en Japón. El seguimiento a 1392 pacientes con RVS se realizó mediante carga viral en una muestra obtenida cada 6 meses. Del total de pacientes en seguimiento, 434 pacientes (31,2%) continuaron con las visitas regulares por más de 10 años; ninguno de los pacientes del seguimiento fue positivo durante el estudio, lo que evidencia la importancia de una vigilancia clínica estricta46.
La estrategia ideal de prevención de la infección por VHC es la vacunación; sin embargo, los diferentes mecanismos del VHC de evasión de la respuesta inmune, incluida la variabilidad genética, han sido un gran impedimento para el desarrollo de una vacuna21-23.
Por otro lado, se ha descrito la coinfección con dos o más genotipos del VHC, particularmente, en poblaciones como PID, HSH, individuos con coinfección por VIH, entre otras. Es de anotar que los métodos utilizados en la práctica clínica limitan la posibilidad de demostrar coinfecciones con 2 o más genotipos de VHC adecuadamente, en particular, cuando se emplean estrategias de secuenciación tipo Sanger, con las que generalmente se logra la identificación únicamente del genotipo predominante. Por el contrario, las tecnologías de secuenciación de nueva generación permiten la lectura de todas las secuencias, además de diferenciar cuál es el genotipo mayoritario y cuál el minoritario.
De todos modos, la terapia antiviral pangenotípica es la recomendada en la gran mayoría de casos de reinfección o coinfección por su alta probabilidad de RVS, lo que es una gran ventaja en países en vías de desarrollo, donde la secuenciación de una nueva generación puede ser poco accesible, aunque siempre se debe tener en cuenta la posibilidad de insuficiencia terapéutica en caso de coinfección con más de un genotipo47.
Otro de los pilares en el manejo multidisciplinario de la hepatitis C es el adecuado rastreo y evaluación de las parejas sexuales del paciente con el fin de ofrecer el tratamiento antiviral y disminuir las tasas de incidencias y de complicaciones. Aunque es responsabilidad del paciente contactar e informar a sus parejas, es necesario ofrecer un vínculo con el sector salud para la educación y oportunidades de prevención y tratamiento de la enfermedad.
Por otro lado, la tasa de incidencia de infección por VHC en las parejas seronegativas de individuos con infección crónica se ha descrito entre 0% y 0,6% en estudios de cohortes prospectivos de parejas heterosexuales monógamas; por lo cual se espera una incidencia mayor en individuos con múltiples parejas; sin embargo, los resultados de los estudios son controversiales y esto puede deberse a que en ocasiones el registro de factores de riesgo es difícil, así como también la información de las parejas sexuales48,49.
Tratamiento de reinfección por hepatitis C
La efectividad de la terapia con AAD para la infección por el VHC está respaldada tanto por estudios aleatorizados controlados como por estudios de vida real; sin embargo, en términos de reinfección por VHC, los datos disponibles sobre la efectividad del tratamiento son extremadamente limitados, y como ya se ha descrito anteriormente, la reinfección puede comprometer los beneficios de la cura a nivel individual y poblacional si no se trata adecuadamente50.
Actualmente, la recomendación de la EASL sobre la reinfección es ofrecer un nuevo curso de tratamiento con AAD, teniendo un período de espera de 3 meses para permitir la posible eliminación espontánea, excepto si se necesita un tratamiento urgente14.
El estudio REACH-C es un estudio observacional que evaluó los resultados del tratamiento de AAD en 33 servicios de salud en Australia entre marzo de 2016 y junio de 2019. De los 10 843 individuos que iniciaron AAD por primera vez, se informaron 99 reinfecciones. El tratamiento para la reinfección ocurrió en 88 individuos, en los que no se solicitaron estudios de resistencia y los regímenes utilizados para tratar la reinfección incluyeron glecaprevir/pibrentasvir (50%), sofosbuvir/velpatasvir (36%), sofosbuvir/ledipasvir (5%), sofosbuvir/daclatasvir (5%), grazoprevir/elbasvir (3%) y sofosbuvir/velpatasvir/voxilaprevir (1%).
El desenlace primario fue la SVR12 y esta fue similar al tratamiento de la primoinfección (95% frente a 95%; p = 0,745) y comparables en entornos de nivel de complejidad primarios, terciarios y penitenciarios. Por lo anterior, el estudio concluye que el tratamiento de la reinfección con AAD pangenotípicos es altamente efectivo y puede administrarse en entornos no especializados50.
No obstante, en Colombia únicamente contamos con la combinación sofosbuvir/velpatasvir (régimen pangenotípico) como terapia disponible para el tratamiento de los pacientes con infección por el VHC a través de la cuenta de alto costo, esto debido a su alta efectividad, posibilidad de uso incluso en pacientes con disfunción renal grave y la compra centralizada de medicamentos; adicionalmente, por la característica del esquema pangenotípico en Colombia no está recomendado desde las guías de práctica clínica hacer una prueba de genotipo antes de iniciar el tratamiento51.
Lo anterior implica una gran dificultad para el manejo de los pacientes que se presentan con reinfección por VHC, primero, por la imposibilidad de saber si realmente se trata de una reinfección o de una recaída y, por ende, no hay posibilidad de realizar estudios de resistencia para definir una terapia adecuada de VHC, especialmente en pacientes VIH positivo, cuyo genotipo predominante en Colombia es el genotipo 4. Por lo anterior, es importante realizar la evaluación basal del genotipo previo al inicio de AAD para dar una mejor orientación al tratamiento en aquellos pacientes con factores de riesgo claramente identificables.
Pruebas para la identificación de mutaciones asociadas a resistencia
Uno de los temas de debate más importantes en el manejo farmacológico de la hepatitis C es el uso de secuenciación para la identificación de mutaciones asociadas a resistencia (RAS) previo al tratamiento; sin embargo, el acceso a pruebas es limitado y no hay consenso sobre las técnicas, la interpretación y el informe de las mismas. Actualmente hay disponibles tratamientos altamente eficaces en casos de infección por VHC con mutaciones o sustituciones preexistentes asociadas a resistencia (RAS); por esta razón, en muchas sociedades científicas no recomiendan las pruebas sistemáticas para identificar RAS antes del tratamiento en personas sin tratamiento previo con AAD. No obstante, la Asociación Estadounidense para el Estudio de Enfermedades del Hígado recomienda la RAS para la identificación de la sustitución Y93H en NS5A en pacientes previamente tratados o cirróticos infectados con VHC genotipo 3 en los que se pretenda usar sofosbuvir/velpatasvir (esquema disponible en Colombia); así mismo, se recomiendan pruebas de RAS en el caso de intención de tratamiento con elbasvir/grazoprevir e infección por VHC de genotipo 1a, independientemente de que el paciente haya tenido tratamiento previo. Por último, la guía de la AASLD recomienda solicitar RAS en aquellos pacientes previamente tratados e infectados con el genotipo 1a en los que se pretende iniciar ledipasvir/sofosbuvir52,53.
Por otro lado, el retratamiento de pacientes que fracasaron después de un régimen debe guiarse por el conocimiento de qué fármacos se administraron en los cursos de tratamiento previos si no se dispone de pruebas de resistencia o, si se realizan pruebas de resistencia, por las probabilidades de respuesta de acuerdo con el perfil de resistencia observado. Por lo anterior, cuando estén disponibles, las pruebas de RAS deben guiar la elección individualizada de los regímenes de retratamiento, especialmente si se usaron previamente inhibidores de NS5A14.
En el caso puntual de la reinfección, no hay estudios que recomienden el uso o no de las pruebas de resistencia molecular; no obstante, actualmente se considera que deberán tener las mismas indicaciones anteriormente expuestas.
Caso clínico
Paciente masculino de 37 años con infección por VIH en el manejo con lopinavir/ritonavir y abacavir. En el examen físico se percibió una discreta hepatomegalia, sin estigmas adicionales de hepatopatía crónica al examen físico. En el perfil bioquímico hepático solicitado se encontró una alteración y anti-VHC positivos, por lo que se solicitaron pruebas adicionales para establecer el diagnóstico. Se confirmó una infección por VHC, genotipo 1, subgenotipo 1a. Además, se detectaron marcadores serológicos que demostraron una infección previa por el virus de la hepatitis B (VHB). Por otro lado, la ecografía hepática no mostró signos de hepatopatía crónica y el FIB-4 no sugirió fibrosis avanzada (Tabla 1).
Tabla 1 Resultados de paraclínicos del paciente
| Bioquímica sérica | Resultado |
|---|---|
| Fosfatasa alcalina | 113 UI/L (44-147 UI/L) |
| Bilirrubina total | 1,67 mg/dL (0,1-1,2 mg/dL) |
| Bilirrubina directa | 0,64 mg/dL (< 0,3 mg/dL) |
| AST | 27 U/L (0-35 UI/L) |
| ALT | 56 U/L (0-45 UI/L) |
| GGT | 31 (0-30 UI/L) |
| HbsAg | Negativo |
| Anti-Hbc | Positivo |
| Anti-Hbs | Positivo |
| FIB-4 | 0,48 |
| Anti-VHC | Positivo |
| ARN VHC | 254 287 UI/mL |
| Genotipo VHC | Genotipo 1, subgenotipo 1a |
ALT: alanina-aminotransferasa; anti-Hbc: anticuerpo del núcleo del virus de la hepatitis B; anti-Hbs: anticuerpo de la superficie del virus de la hepatitis B; AST: aspartato-aminotransferasa; FIB-4: índice de fibrosis 4; GGT: gamma-glutamil transferasa; HbsAg: antígeno de superficie de la hepatitis B. Fuente: elaboración propia.
Se ordenó el manejo con el esquema pangenotípico para la hepatitis C (sofosbuvir, inhibidor de NS5B, y velpatasvir, inhibidor de NS5A) por 12 semanas. La carga viral al final del tratamiento fue indetectable (< 12 UI/mL), por lo que se confirmó RVS; adicionalmente, se demostraron niveles séricos en el rango normal de las enzimas hepáticas (alanina-aminotransferasa [ALT]: 12 U/L; aspartato-aminotransferasa [AST]:18 U/L).
Tres meses después, el paciente acudió a la cita de control. Según los exámenes de seguimiento, se detectó carga viral (ARN VHC: 8354 UI/mL), por lo que se interrogó al paciente sobre posibles comportamientos de riesgo.
Después de una anamnesis exhaustiva, el paciente refirió relaciones sexuales sin protección en 5 ocasiones, con múltiples parejas. Por consiguiente, se ordenó una genotipificación que demostró una infección por VHC genotipo 4. Con este hallazgo se confirmó que el paciente presentaba una reinfección por VHC. Al paciente se le prescribió un nuevo esquema de tratamiento con sofosbuvir y velpatasvir por 84 días y la posterior confirmación de RVS12.
Conclusión
Presentamos un caso de un paciente con infección por VIH que presenta alteración en el perfil hepático con diagnóstico de la infección por VHC genotipo 1, subgenotipo 1a. El paciente recibió tratamiento con AAD, luego del cual se confirmó el aclaramiento viral a las 12 semanas de tratamiento. Tres meses después se sospecha una reinfección por elevación de carga viral y bioquímica hepática alterada y se confirma la reinfección por VHC genotipo 4.
La reinfección del VHC es frecuente, principalmente en poblaciones como HSH, individuos con infección por VIH y personas con múltiples parejas sexuales. La evidencia y los estudios demuestran la importancia de estar atentos a la posibilidad de reinfección, y por esto es pertinente realizar genotipificación de VHC antes de iniciar el tratamiento, incluso en casos con un esquema pangenotípico de AAD. Es muy importante recordar e insistir en los cuidados que se deben tener para la disminución de comportamientos de riesgo, ya que el tratamiento efectivo de VHC y el consecuente aclaramiento viral no induce respuesta inmune adaptativa específica contra otros genotipos del VHC y, por tanto, no elimina la susceptibilidad a la infección por los otros 7 genotipos de VHC. Por lo anterior, una educación continua y apoyo multidisciplinario es de gran importancia en estos pacientes.
REFERENCIAS
1. Hepatitis C [Internet]. WHO [citado el 14 de noviembre de 2021]. Disponible en: Disponible en: https://www.who.int/news-room/fact-sheets/detail/hepatitis-c [ Links ]
2. Stanaway JD, Flaxman AD, Naghavi M, Fitzmaurice C, Vos T, Abubakar I, et al. The global burden of viral hepatitis from 1990 to 2013: findings from the Global Burden of Disease Study 2013. Lancet. 2016;388(10049):1081-8. https://doi.org/10.1016/S0140-6736(16)30579-7 [ Links ]
3. Lingala S, Ghany MG. Natural History of Hepatitis C. Gastroenterol Clin North Am. 2015;44(4):717-34. https://doi.org/10.1016/j.gtc.2015.07.003 [ Links ]
4. Singal AK, Satapathy SK, Reau N, Wong R, Kuo YF. Hepatitis C remains leading indication for listings and receipt of liver transplantation for hepatocellular carcinoma. Dig Liver Dis. 2020;52(1):98-101. https://doi.org/10.1016/j.dld.2019.08.022 [ Links ]
5. Toniutto P, Bitetto D, Fornasiere E, Fumolo E. Challenges and future developments in liver transplantation. Minerva Gastroenterol Dietol. 2018;65(2):136-52. https://doi.org/10.23736/S1121-421X.18.02529-1 [ Links ]
6. Durand F, Francoz C. The future of liver transplantation for viral hepatitis. Liver Int [Internet]. 2017;37 Suppl 1:130-5. https://doi.org/10.1111/liv.13310 [ Links ]
7. Global health sector strategy on viral hepatitis 2016-2021. Towards ending viral hepatitis [Internet]. WHO; 2016 [citado el 14 de noviembre de 2021]. Disponible en: Disponible en: https://apps.who.int/iris/handle/10665/246177 [ Links ]
8. Falade-Nwulia O, Sulkowski MS, Merkow A, Latkin C, Mehta SH. Understanding and addressing hepatitis C reinfection in the oral direct acting antiviral era. J Viral Hepat. 2018;25(3):220-227. https://doi.org/10.1111/jvh.12859 [ Links ]
9. Mahale P, Engels EA, Li R, Torres HA, Hwang LY, Brown EL, et al. The effect of sustained virological response on the risk of extrahepatic manifestations of hepatitis C virus infection. Gut. 2018;67(3):553-561. https://doi.org/10.1136/gutjnl-2017-313983 [ Links ]
10. Li DK, Chung RT. Overview of direct-acting antiviral drugs and drug resistance of hepatitis C virus. Methods Mol Biol. 2019;1911:3-32. https://doi.org/10.1007/978-1-4939-8976-8_1 [ Links ]
11. Asselah T, Boyer N, Saadoun D, Martinot-Peignoux M, Marcellin P. Direct-acting antivirals for the treatment of hepatitis C virus infection: optimizing current IFN-free treatment and future perspectives. Liver Int. 2016;36 Suppl 1:47-57. https://doi.org/10.1111/liv.13027 [ Links ]
12. Manns MP, Buti M, Gane E, Pawlotsky JM, Razavi H, Terrault N, et al. Hepatitis C virus infection. Nat Rev Dis Primers. 2017;3:17006. https://doi.org/10.1038/nrdp.2017.6 [ Links ]
13. Manns MP, von Hahn T. Novel therapies for hepatitis C - one pill fits all? Nat Rev Drug Discov. 2013;12(8):595-610. https://doi.org/10.1038/nrd4050 [ Links ]
14. Pawlotsky JM, Negro F, Aghemo A, Berenguer M, Dalgard O, Dusheiko G, et al. EASL Recommendations on Treatment of Hepatitis C 2018. J Hepatol. 2018;69(2):461-511. https://doi.org/10.1016/j.jhep.2018.03.026 [ Links ]
15. Tsukiyama-Kohara K, Kohara M. Molecular Sciences Hepatitis C Virus: Viral Quasispecies and Genotypes. Int J Mol Sci. 2017;19(1):23. https://doi.org/10.3390/ijms19010023 [ Links ]
16. Minosse C, Gruber CEM, Rueca M, Taibi C, Zaccarelli M, Grilli E, et al. Late Relapse and Reinfection in HCV Patients Treated with Direct-Acting Antiviral (DAA) Drugs. Viruses. 2021;13(6):1151. https://doi.org/10.3390/v13061151 [ Links ]
17. Sarrazin C, Isakov V, Svarovskaia ES, Hedskog C, Martin R, Chodavarapu K, et al. Late Relapse Versus Hepatitis C Virus Reinfection in Patients With Sustained Virologic Response After Sofosbuvir-Based Therapies. Clin Infect Dis. 2017;64(1):44-52. https://doi.org/10.1093/cid/ciw676 [ Links ]
18. Navas MC, Fuchs A, Schvoerer E, Bohbot A, Aubertin AM, Stoll-Keller F. Dendritic cell susceptibility to hepatitis C virus genotype 1 infection. J Med Virol. 2002;67(2):152-61. https://doi.org/10.1002/jmv.2204 [ Links ]
19. di Lello FA, Culasso ACA, Parodi C, Baré P, Campos RH, García G. New evidence of replication of hepatitis C virus in short-term peripheral blood mononuclear cell cultures. Virus Res. 2014;191(1):1-9. https://doi.org/10.1016/j.virusres.2014.07.020 [ Links ]
20. Russelli G, Pizzillo P, Iannolo G, Barbera F, Tuzzolino F, Liotta R, et al. HCV replication in gastrointestinal mucosa: Potential extra-hepatic viral reservoir and possible role in HCV infection recurrence after liver transplantation. PLoS One. 2017;12(7):e0181683. https://doi.org/10.1371/journal.pone.0181683 [ Links ]
21. Kemming J, Thimme R, Neumann-Haefelin C. Adaptive Immune Response against Hepatitis C Virus. Int J Mol Sci. 2020;21(16):5644. https://doi.org/10.3390/ijms21165644 [ Links ]
22. Rehermann B, Thimme R. Insights From Antiviral Therapy Into Immune Responses to Hepatitis B and C Virus Infection. Gastroenterology. 2019;156(2):369-383. https://doi.org/10.1053/j.gastro.2018.08.061 [ Links ]
23. Neumann-Haefelin C, Thimme R. Adaptive immune responses in hepatitis C virus infection. Curr Top Microbiol Immunol. 2013;369:243-62. https://doi.org/10.1007/978-3-642-27340-7_10 [ Links ]
24. Muller A, Vlahov D, Akiyama MJ, Kurth A. Hepatitis C Reinfection in People Who Inject Drugs in Resource-Limited Countries: A Systematic Review and Analysis. Int J Environ Res Public Health. 2020;17(14):4951. https://doi.org/10.3390/ijerph17144951 [ Links ]
25. Simmons B, Saleem J, Hill A, Riley RD, Cooke GS. Clinical Infectious Diseases Risk of Late Relapse or Reinfection With Hepatitis C Virus After Achieving a Sustained Virological Response: A Systematic Review and Meta-analysis. Clin Infect Dis. 2016;62(6):683-694. https://doi.org/10.1093/cid/civ948 [ Links ]
26. Mohd Hanafiah K, Groeger J, Flaxman AD, Wiersma ST. Global epidemiology of hepatitis C virus infection: new estimates of age-specific antibody to HCV seroprevalence. Hepatology. 2013;57(4):1333-42. https://doi.org/10.1002/hep.26141 [ Links ]
27. European Association for the Study of the Liver. EASL Recommendations on Treatment of Hepatitis C 2016. J Hepatol. 2017;66(1):153-94. https://doi.org/10.1016/j.jhep.2016.09.001 [ Links ]
28. Chung RT, Davis GL, Jensen DM, Masur H, Saag MS, Thomas DL, et al. Hepatitis C guidance: AASLD-IDSA recommendations for testing, managing, and treating adults infected with hepatitis C virus. Hepatology. 2015;62(3):932-54. https://doi.org/10.1002/hep.27950 [ Links ]
29. Lok AS, Gardiner DF, Lawitz E, Martorell C, Everson GT, Ghalib R, et al. Preliminary Study of Two Antiviral Agents for Hepatitis C Genotype 1. New England Journal of Medicine. 2012;366(3):216-24. https://doi.org/10.1056/NEJMoa1104430 [ Links ]
30. Choo QL, Kuo G, Weiner AJ, Overby LR, Bradley DW, Houghton M. Isolation of a cDNA clone derived from a blood-borne non-A, non-B viral hepatitis genome. Science. 1989;244(4902):359-62. https://doi.org/10.1126/science.2523562 [ Links ]
31. Borgia SM, Hedskog C, Parhy B, Hyland RH, Stamm LM, Brainard DM, et al. Identification of a Novel Hepatitis C Virus Genotype From Punjab, India: Expanding Classification of Hepatitis C Virus Into 8 Genotypes. J Infect Dis. 2018;218(11):1722-9. https://doi.org/10.1093/infdis/jiy401 [ Links ]
32. Hedskog C, Parhy B, Chang S, Zeuzem S, Moreno C, Shafran SD, et al. Identification of 19 Novel Hepatitis C Virus Subtypes-Further Expanding HCV Classification. Open Forum Infect Dis. 2019;6(3):ofz076. https://doi.org/10.1093/ofid/ofz076 [ Links ]
33. Lanini S, Easterbrook PJ, Zumla A, Ippolito G. Hepatitis C: global epidemiology and strategies for control. Clin Microbiol Infect. 2016;22(10):833-8. https://doi.org/10.1016/j.cmi.2016.07.035 [ Links ]
34. Cooke GS, Andrieux-Meyer I, Applegate TL, Atun R, Burry JR, Cheinquer H, et al. Accelerating the elimination of viral hepatitis: a Lancet Gastroenterology & Hepatology Commission. Lancet Gastroenterol Hepatol. 2019;4(2):135-84. https://doi.org/10.1016/S2468-1253(18)30270-X [ Links ]
35. Jin F, Matthews G v., Grulich AE. Sexual transmission of hepatitis C virus among gay and bisexual men: a systematic review. Sex Health. 2017;14(1):28-41. https://doi.org/10.1071/SH16141 [ Links ]
36. Daskalopoulou M, Rodger A, Thornton A, Phillips A, Sherr L, Gilson R, et al. Sexual behaviour, recreational drug use and hepatitis C co-infection in HIV-diagnosed men who have sex with men in the United Kingdom: results from the ASTRA study. J Int AIDS Soc. 2014;17(4 Suppl 3):19630. https://doi.org/10.7448/IAS.17.4.19630 [ Links ]
37. Jordan AE, Perlman DC, Neurer J, Smith DJ, des Jarlais DC, Hagan H. Prevalence of hepatitis C virus infection among HIV+ men who have sex with men: a systematic review and meta-analysis. Int J STD AIDS. 2017;28(2):145-59. https://doi.org/10.1177/0956462416630910 [ Links ]
38. Knick T, Sherbuk JE, Dillingham R. Knowledge of Hepatitis C Risk Factors is Lower in High Incidence Regions. J Community Health. 2019;44(1):12-5. https://doi.org/10.1007/s10900-018-0545-6 [ Links ]
39. Ingiliz P, Wehmeyer MH, Boesecke C, zur Wiesch JS, Schewe K, Lutz T, et al. Reinfection With the Hepatitis C Virus in Men Who Have Sex With Men After Successful Treatment With Direct-acting Antivirals in Germany: Current Incidence Rates, Compared With Rates During the Interferon Era. Clin Infect Dis. 2020;71(5):1248-54. https://doi.org/10.1093/cid/ciz949 [ Links ]
40. Berenguer J, Gil-Martin Á, Jarrin I, Montes ML, Domínguez L, Aldámiz-Echevarría T, et al. Reinfection by hepatitis C virus following effective all-oral direct-acting antiviral drug therapy in HIV/hepatitis C virus coinfected individuals. AIDS. 2019;33(4):685-9. https://doi.org/10.1097/QAD.0000000000002103 [ Links ]
41. Smit C, Boyd A, Rijnders BJA, van de Laar TJW, Leyten EM, Bierman WF, et al. HCV micro-elimination in individuals with HIV in the Netherlands 4 years after universal access to direct-acting antivirals: a retrospective cohort study. Lancet HIV. 2021;8(2):e96-105. https://doi.org/10.1016/S2352-3018(20)30301-5 [ Links ]
42. Boender TS, Smit C, van Sighem A, Bezemer D, Ester CJ, Zaheri S, et al. AIDS Therapy Evaluation in the Netherlands (ATHENA) national observational HIV cohort: cohort profile. BMJ Open. 2018;8(9):e022516. https://doi.org/10.1136/bmjopen-2018-022516 [ Links ]
43. Adu PA, Rossi C, Binka M, Wong S, Wilton J, Wong J, et al. HCV reinfection rates after cure or spontaneous clearance among HIV-infected and uninfected men who have sex with men. Liver International. 2021;41(3):482-93. https://doi.org/10.1111/liv.14762 [ Links ]
44. Lazarus JV, Wiktor S, Colombo M, Thursz M. Micro-elimination - A path to global elimination of hepatitis C. J Hepatol. 2017;67(4):665-6. https://doi.org/10.1016/j.jhep.2017.06.033 [ Links ]
45. Braun DL, Hampel B, Ledergerber B, Grube C, Nguyen H, Künzler-Heule P, et al. A Treatment-as-Prevention Trial to Eliminate Hepatitis C Among Men Who Have Sex With Men Living With Human Immunodeficiency Virus (HIV) in the Swiss HIV Cohort Study. Clin Infect Dis. 2021;73(7):e2194-202. https://doi.org/10.1093/cid/ciaa1124 [ Links ]
46. Toyoda H, Yasuda S, Shiota S, Kumada T, Tanaka J. Lack of hepatitis C virus reinfection in lifetime of Japanese general population with previous hepatitis C virus (HCV) infection successfully treated with anti-HCV therapy. J Infect Chemother. 2021;27(11):1674-1675. https://doi.org/10.1016/j.jiac.2021.08.018 [ Links ]
47. Okamoto H, Sugiyama Y, Okada S, Kurai K, Akahane Y, Sugai Y, et al. Typing hepatitis C virus by polymerase chain reaction with type-specific primers: application to clinical surveys and tracing infectious sources. J Gen Virol. 1992;73(Pt 3):673-9. https://doi.org/10.1099/0022-1317-73-3-673 [ Links ]
48. Vandelli C, Renzo F, Romanò L, Tisminetzky S, de Palma M, Stroffolini T, et al. Lack of evidence of sexual transmission of hepatitis C among monogamous couples: results of a 10-year prospective follow-up study. Am J Gastroenterol. 2004;99(5):855-9. https://doi.org/10.1111/j.1572-0241.2004.04150.x [ Links ]
49. Terrault NA, Dodge JL, Murphy EL, Tavis JE, Kiss A, Levin TR, et al. Sexual transmission of hepatitis C virus among monogamous heterosexual couples: the HCV partners study. Hepatology. 2013;57(3):881-9. https://doi.org/10.1002/hep.26164 [ Links ]
50. Carson JM, Hajarizadeh B, Hanson J, O’Beirne J, Iser D, Read P, et al. Effectiveness of treatment for hepatitis C virus reinfection following direct acting antiviral therapy in the REACH-C cohort. Int J Drug Policy. 2021;96:103422. https://doi.org/10.1016/j.drugpo.2021.103422 [ Links ]
51. Situación de la hepatitis C crónica en los regímenes subsidiado y contributivo de Colombia. Bogotá D. C.: Fondo Colombiano de Enfermedades de Alto Costo, Cuenta de Alto Costo (CAC); 2021. [ Links ]
52. American Association for the Study of Liver Diseases, Infectious Diseases Society of America. Simplified HCV treatment algorithm for treatment-naive adults with compensated cirrhosis [Internet]. [citado el 26 de septiembre de 2021]. Disponible en: Disponible en: https://www.hcvguidelines.org/treatment-naive/simplified-treatment-compensated-cirrhosis Google Scholar [ Links ]
53. Antiviral resistance testing in the management of hepatitis C virus infection [Internet]. Public Health England; 2018 [citado el 8 de Agosto de 2022]. Disponible en: Disponible en: https://assets.publishing.service.gov.uk/government/uploads/system/uploads/attachment_data/file/1110853/Antiviral_resistance_testing_in_the_management_of_hepatitis_C_virus_infection.pdf [ Links ]
Citación: De La Espriella V, Urán JM, Orrego M, Navas MC. Reinfección por virus de la hepatitis C: revisión de tema y presentación de un caso. Revista. colomb. Gastroenterol. 2022;37(4):434-443. https://doi.org/10.22516/25007440.917
Recibido: 31 de Mayo de 2022; Aprobado: 21 de Septiembre de 2022











 texto en
texto en