Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista colombiana de Gastroenterología
Print version ISSN 0120-9957On-line version ISSN 2500-7440
Rev. colomb. Gastroenterol. vol.37 no.4 Bogotá Oct./Dec. 2022 Epub July 10, 2023
https://doi.org/10.22516/25007440.814
Reporte de caso
Síndrome del linfocito pasajero por anticuerpos anti-D en trasplante hepático. Reporte de caso
1Doctor, Internal medicine resident, Universidad Libre. Interinstitutional Group of Internal Medicine (GIMI 1). Cali, Colombia.
2Doctor, Internal medicine resident, Gastroenterology and Digestive Endoscopy, Trasplant unit, Clínica Farallones, Clínica Nuestra, Associated Gastroenterologists, Clínica Imbanaco. Cali, Colombia.
El síndrome del linfocito pasajero (PLS) es una complicación de injerto contra huésped que se presenta en el trasplante de órganos sólidos o en el trasplante de células progenitoras hematopoyéticas. Es una causa importante de hemólisis inmune después del trasplante causada por la producción de anticuerpos por parte de los clones específicos de linfocitos B viables transferidos a través del órgano del donante contra los antígenos de los glóbulos rojos del receptor. Generalmente ocurre en los trasplantes con discordancia menor ABO o Rh. Este estudio descriptivo describe el caso de un paciente de 54 años con grupo sanguíneo O/Rh(D) positivo, con cirrosis secundaria a enfermedad metabólica asociada al hígado graso (MAFLD) que fue llevado a trasplante hepático de donante O/Rh(D) negativo. A los 9 días del trasplante presentó una anemia hemolítica inmune por anticuerpos anti-D por efecto del linfocito B pasajero del donante sensibilizado. El paciente recibió medidas de soporte, transfusión de glóbulos rojos e inmunosupresión con esteroides, con lo que se logró la estabilización de los parámetros hemolíticos. En conclusión, esta es una entidad que se debe sospechar en caso de anemia hemolítica aguda en el período postrasplante.
Palabras clave: Prueba de Coombs directo; anemia hemolítica; trasplante de hígado; reporte de caso
Passenger lymphocyte syndrome (PLS) is a graft-versus-host complication in solid organ transplantation or hematopoietic stem cell transplantation. It is a major cause of immune hemolysis after transplantation caused by the production of antibodies by the specific clones of viable B lymphocytes transferred through the donor organ against the antigens of the recipient’s red blood cells. It usually occurs in transplants with minor ABO or Rh mismatch. This descriptive study explains the case of a 54-year-old patient with O/Rh(D) positive blood group, with cirrhosis secondary to metabolic disease associated with fatty liver (NAFLD), who underwent liver transplantation from an O/Rh(D) negative donor. Nine days after the transplant, the patient presented with immune hemolytic anemia due to anti-D antibodies because of the transient B lymphocyte from the sensitized donor. The patient received support measures, transfusion of red blood cells, and immunosuppression with steroids, which stabilized the hemolytic parameters. In conclusion, this entity should be suspected in the case of acute hemolytic anemia in the post-transplant period.
Keywords: Direct Coombs test; hemolytic anemia; liver transplantation; case report.
Introducción
El trasplante hepático es actualmente la opción terapéutica de elección en la enfermedad hepática en estadios avanzados o terminales, en insuficiencia hepática aguda con indicadores de mal pronóstico o tumores hepáticos primarios cuando el paciente cumple los criterios según los análisis pretrasplante multidisciplinario. La cantidad de pacientes en lista espera de trasplantes de órganos es cada vez mayor, pero la disponibilidad de donantes es insuficiente. Este panorama, sumado al desarrollo de terapia inmunosupresora y el pronóstico de los pacientes, ha favorecido la selección de órganos de donantes con incompatibilidades menores1.
El trasplante hepático rutinariamente se realiza con compatibilidad del grupo sanguíneo del sistema ABO (ABO idéntico). Se define ABO compatible (p. ej. donante tipo O a receptor tipo B), idéntico (mismo grupo) o incompatible (grupos diferentes, ejemplo donante tipo A a un receptor tipo B), en el emparejamiento donante-receptor no se tiene en cuenta el Rh2. Solo en casos emergentes se realiza el trasplante hepático con incompatibilidad de grupo, dado que la supervivencia es menor cuando se trasplanta con un grupo ABO incompatible y existe mayor riesgo de complicaciones y pérdida del injerto por el rechazo mediado por anticuerpos. En dichos casos, se requiere un abordaje terapéutico diferente y en centros de experiencia en trasplante hepático con incompatibilidad ABO3.
En cualquier tejido trasplantado se produce un traspaso de clonas de linfocitos B viables y células plasmáticas del donante que pasan a la circulación del receptor. Esos linfocitos “pasajeros” que sobreviven y proliferan escapan de la vigilancia inmunológica por la inmunodepresión a la que se somete el receptor. Es decir, no hay rechazo a las clonas linfoides, por lo que al exponerse al antígeno presente en los glóbulos rojos del receptor se producen anticuerpos anti-isohemaglutininas o anti-Rh, lo que produce una hemólisis inmunomediada4.
El riesgo de hemólisis aumenta dependiendo de la masa linfocitaria, y es más frecuente en el trasplante de corazón y pulmón, seguido del de hígado y riñón5. Cuando esos linfocitos proliferan, generan una respuesta inmunitaria, que puede ser primaria o secundaria, con el inicio de la hemólisis que ocurre en los primeros días a semanas después del trasplante6.
Generalmente, el síndrome de linfocito pasajero (PLS) se asocia con los trasplantes con discordancia ABO. En otros casos se puede presentar en pacientes que reciben un órgano ABO idéntico, pero hay discordancia en antígenos menores de los glóbulos rojos entre el donante y receptor. En el trasplante hepático frecuentemente se han reportado anticuerpos frente a los antígenos Rh (D, C, c, E, e y V) y en otros casos, aloanticuerpos frente a antígenos Jk, Kp, Fy y M, con los cuales se puede presentar la reacción hemolítica7,8.
A continuación, se presenta el caso de un paciente con cirrosis secundaria a enfermedad metabólica asociada al hígado graso (MAFLD) con tipo de sangre O/Rh(D) positivo que recibió un trasplante hepático de un donante O/Rh(D) negativo, que durante el posoperatorio presentó anemia hemolítica inmune por anticuerpos antieritrocitarios anti-D por sensibilización previa del donante. Es una causa poco sospechada de anemia hemolítica autoinmune aguda en las semanas siguientes al trasplante, por lo que, ante el aumento de la cantidad de procedimientos a nivel mundial, siempre se debe considerar.
Presentación del caso
Se trata de un hombre de 54 años, con antecedente de hipertensión arterial, diabetes mellitus y cirrosis secundaria a MAFLD, estadio Child-Pugh B, escala MELD-Na (Model for End-Stage Liver Disease) de 18 puntos, con múltiples hospitalizaciones por encefalopatía hepática con criterios para trasplante. En su evaluación previa al mismo, se destaca una hemoclasificación O/Rh(D) positivo, con rastreo de anticuerpos irregulares negativos y prueba antiglobulina (Coombs directo) negativo. Se realizó el trasplante ortotópico de hígado de donante masculino O/Rh(D) negativo, pero con anticuerpos antieritrocitarios anti-D y anti-C positivos por una previa sensibilización en un contexto desconocido. El tiempo de isquemia fue de 5 horas, no hubo complicaciones durante el procedimiento ni requerimiento de transfusión de glóbulos rojos en el peri- o posoperatorio. Durante el posquirúrgico requirió soporte vasoactivo por unas horas, se realizó una extubación temprana y presentó elevación de aminotransferasas con un pico de citólisis precoz (aspartato-aminotransferasa [AST]: 588 U/L y alanina-aminotransferasa [ALT]: 413 U/L). Se indicó terapia inmunosupresora temprana con metilprednisolona y tacrolimus al día uno. Los controles ecográficos y de Doppler realizados no presentaron ninguna alteración, por lo que egresó al quinto día de la intervención, con manejo con tacrolimus a 0,1 mg/kg, prednisolona y profilaxis con valganciclovir debido a la presencia de anticuerpos positivos para citomegalovirus en el donante y receptor, sumado a trimetoprima/sulfametoxazol como profilaxis frente a Pneumocystis jirovecii.
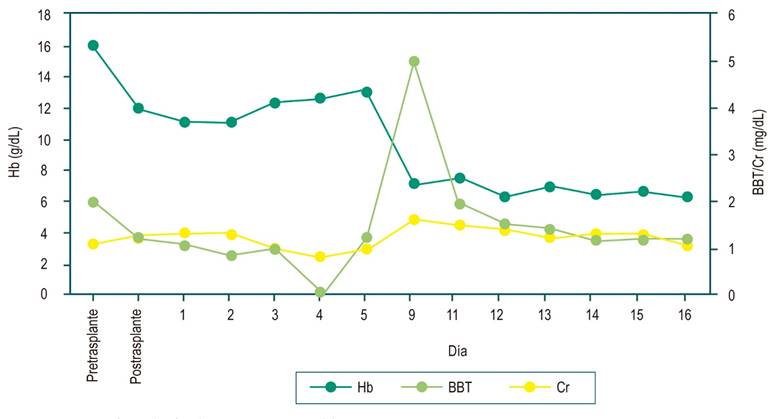
Al noveno día postrasplante, el paciente acudió a urgencias porque presentaba ictericia, orina color rojizo, astenia, adinamia e hiporexia. Se documentó en los laboratorios de ingreso (Figura 1) anemia grave (7,1 g/dL, referencia: 13-18 g/dL), hiperbilirrubinemia a expensas de la indirecta (bilirrubina total [BBT]: 5,01 mg/dL [0,2-1,2 mg/dL], bilirrubina indirecta [BI]: 3,63 mg/dL), deshidrogenasa láctica elevada (531 U/L), haptoglobina consumida (< 5 mg/dL) y la prueba antiglobulina (Coombs) directa positiva con evidencia de aloanticuerpo anti-D y compromiso renal con creatinina (Cr) elevada (1,6 mg/dL). La ecografía de abdomen y Doppler portal fueron normales. Los niveles de tacrolimus se encontraban en el rango normal. Se consideró una presentación clínica asociada al síndrome de linfocito pasajero, por lo que se indicó el manejo con líquidos intravenosos, transfusión de dos unidades de glóbulos rojos O negativo asociado a pulsos de metilprednisolona 500 mg cada día por tres días. Se logró la estabilización de la hemoglobina (Hb), el control de parámetros de hemólisis y la mejoría de la función renal, y se continuó el manejo inmunosupresor con prednisona a 1 mg/kg/día asociado al uso de tacrolimus.
Se ha realizado seguimiento ambulatorio en la unidad de trasplantes sin presentar recurrencia del proceso hemolítico hasta la fecha. Se redujo gradualmente la dosis de esteroides y se han mantenido los niveles de tacrolimus en metas con laboratorios de función y estructura hepatocelular en el rango normal: AST: 17 U/L, ALT: 12 U/L, gamma-glutamil transferasa (GGT): 13 U/L, BBT: 0,50 mg/dL, BI: 0,32 mg/dL, bilirrubina directa (BD): 0,18 mg/dL, fosfatasa alcalina: 74 U/L, albúmina: 3,39 g/dL, Hb: 15,2 g/dL, tacrolimus: 6,8 ng/mL.
Discusión
En los primeros 15 días del trasplante hepático, la anemia tiene diferentes etiologías como sangrado, sepsis, medicamentos, rechazo o hemólisis. Esta última es una causa importante de anemia en este período y puede producirse por fármacos, transfusiones, hiperesplenismo, enfermedad de injerto contra huésped o incompatibilidad de los sistemas antigénicos entre el donante y el receptor9. A su vez, los hallazgos de ictericia y anemia obligan a descartar trombosis arterial o venosa, estenosis vascular, complicaciones biliares o sepsis10.
El síndrome de linfocito pasajero (PLS) es un tipo de anemia que se presenta después del trasplante11. Se considera un subtipo de enfermedad de injerto contra huésped que afecta a los pacientes en el primer mes, generalmente en los 3 a 24 días después del trasplante de órgano sólido o de células progenitoras hematopoyéticas6. En el caso descrito, el compromiso se presentó al noveno día.
La incidencia del PLS en órganos sólidos depende de su masa linfocitaria, por lo que es más frecuente en trasplantes de pulmón y corazón (en un 70%), seguido de los de hígado y riñón (en un 40% y 17%, respectivamente)5. Un 50% de los pacientes desarrolla anticuerpos en casos de incompatibilidad, pero no todos presentan evidencia de hemólisis. En la serie de Ramsey en 1991, en 1200 trasplantes de hígado se presentaron 12 casos de PLS, para una prevalencia del 1%12. En 2015, en una serie de 1217 trasplantes hepáticos, Romero y colaboradores reportaron 56 casos de incompatibilidad de grupo ABO, de los cuales el 17,9% desarrolló PLS, y de 147 casos con incompatibilidad Rh, el 1,4% lo presentó8.
Los linfocitos B viables transferidos en el injerto del donante proliferan y son los causantes de la entidad debido a la producción de anticuerpos frente a antígenos específicos de los glóbulos rojos del receptor, lo que produce una respuesta inmunitaria primaria o secundaria7. Esta entidad es consecuencia de incompatibilidad menor ABO o sistema Rh y rara vez frente a otros sistemas antigénicos menores de los glóbulos rojos (D, C, E, Jk, Kell, Fy y M)13. Los anticuerpos séricos son predominantemente de tipo inmunoglobulina G (IgG), pero en algunos casos son de tipo inmunoglobulina M (IgM)13. Estos tienden a desaparecer a los 3 a 6 meses, con excepción del anti-D, que puede persistir hasta por un año14.
Los factores de riesgo para presentar el PLS incluyen la sensibilización previa por transfusión o embarazo, donante grupo O frente a un receptor del grupo A o B, o tratamiento con ciclosporina15. En el caso descrito, el receptor fue O/Rh(D) positivo, pero el donante fue O/Rh(D) negativo, lo cual indica que este último estaba sensibilizado en un contexto desconocido debido a la documentación de anti-D y anti-C en su suero y a la detección del aloanticuerpo anti-D en los glóbulos rojos del receptor previamente ausentes, por lo que se le adjudica al anticuerpo anti-D la causa de la hemólisis.
Generalmente la presentación es leve y autolimitada con remisión espontánea, aunque en ocasiones la presentación puede ser grave16. En otros casos puede ser subclínica y encontrarse como hallazgo incidental en los laboratorios de seguimiento o sobreponerse a complicaciones perioperatorias. La gravedad va a depender de 3 factores: cantidad de tejido linfoide trasplantado, el título de isohemaglutininas de glóbulos rojos del donante y la cinética de la producción de anticuerpos en el postrasplante17. Se han reportado variantes no hemolíticas, reacciones serológicas e incluso eventos graves como rechazo hepático, hipotensión, coagulación intravascular diseminada e insuficiencia renal o multiorgánica5. En el presente caso, el paciente desarrolló anemia hemolítica y lesión renal aguda en estadio KDIGO 1 (Kidney Disease: Improving Global Outcomes).
Los hallazgos de laboratorio son consistentes con una anemia hemolítica aguda, con disminución de la haptoglobina, un aumento de la deshidrogenasa láctica, unos reticulocitos aumentados, hiperbilirrubinemia a expensas de la indirecta y extendido de sangre periférica con esferocitos, policromasia, aglutinación o nucleación de glóbulos rojos18. La prueba de antiglobulina directa se vuelve positiva en el paciente trasplantado, lo que es un buen indicador en la detección de anticuerpos derivados de los linfocitos del donante6. En el presente caso se presentaron las características de hemólisis descritas con una prueba de antiglobulina directa fuertemente positiva, previamente negativa en la evaluación pretrasplante.
En la actualidad no existe un manejo específico, este se basa en medidas de soporte y transfusión de glóbulos rojos. Es importante aclarar que, para esto último, la recomendación es transfundir unidades compatibles con el donante o con antígeno negativo debido al riesgo de perpetuar la hemólisis6. Ante la presencia de incompatibilidad bidireccional por grupo ABO, se deben transfundir unidades de glóbulos rojos de grupo O que sean compatibles con el donante y receptor. En caso de anticuerpos contra antígenos menores, se deben transfundir unidades negativas. Por tal motivo, el paciente recibió unidades de glóbulos rojos O negativas irradiadas y leucorreducidas.
Adicionalmente, se puede requerir terapia inmunosupresora o inmunomoduladora cuando la hemólisis es grave o persistente para inducir la remisión en la producción de anticuerpos. La administración de glucocorticoides, cuya dosis se sugiere aumentar a 1 mg/kg/día o dar pulsos de esteroides intravenosos (250 a 500 mg de metilprednisolona), es el tratamiento más utilizado y suele ser suficiente para resolver el cuadro clínico. También se ha descrito el uso de rituximab, inmunoglobulina intravenosa o plasmaféresis en algunos casos19. La mayoría de los soportes terapéuticos están basados en estudios observacionales o reportes de caso. Se requieren estudios clínicos para definir un abordaje práctico, así como el tipo y la duración del tratamiento. En el caso presentado hubo una evolución y respuesta clínica favorable con el aporte hídrico, transfusión de glóbulos rojos y pulsos de metilprednisolona. En caso de recurrencia, se puede optar por una medida de depleción de células B y células plasmáticas con el uso de rituximab o la realización de plasmaféresis basado en el principio patogénico para remover de la circulación inmunocomplejos, componentes del complemento y anticuerpos6.
Los anticuerpos del PLS pueden persistir en niveles detectables desde 12 días hasta 851 días postrasplante, por lo que es importante el seguimiento ambulatorio de variables hemolíticas20. El paciente se encuentra en seguimiento en la unidad de trasplante, con hemograma, pruebas hepáticas, de hemólisis y niveles de tacrolimus de rutina, sin evidencia de alteración a un año del trasplante, con perfil hepático sin alteraciones, Hb estable y niveles de inmunosupresión según las metas.
Conclusión
El diagnóstico del síndrome de linfocito pasajero es un reto. Se debe sospechar ante la presencia de anemia aguda en los primeros días y semanas de un trasplante hepático, principalmente si existe presencia de incompatibilidad, ya sea de grupo o de Rh, o si hubo rastreo de anticuerpos positivos en el donante. Los hallazgos clínicos y de laboratorio sugestivos de hemólisis, una prueba de antiglobulina directa positiva, la evidencia serológica de anticuerpos frente a los antígenos de los glóbulos rojos y la ausencia de otra etiología de hemólisis favorecen el diagnóstico. Según la presentación clínica se define el manejo. La mayoría de los casos se resuelven con medidas de soporte y transfusión sanguínea, y en algunos casos específicos con esteroides u otras terapias. El seguimiento del paciente en el período postrasplante se debe realizar con parámetros hemolíticos.
REFERENCIAS
1. Jung J, Lee JM, Yang M, Choi SJ, Lim J. Transient loss of A1 phenotype in a patient with passenger lymphocyte syndrome after ABO minor incompatible liver transplantation: The first case report. Transfus Apher Sci. 2018;57(6):759-61. https://doi.org/10.1016/j.transci.2018.09.014 [ Links ]
2. Neuberger J, Ferguson J, Newsome PN, Lucey MR. Liver Transplantation: Clinical Assessment and Management. Wiley; 2021. https://doi.org/10.1002/9781119634010 [ Links ]
3. Gugenheim J, Samuel D, Bismuth H, Reynes M. Liver transplantation across ABO blood group barriers. Lancet. 1990;336(8714):519-23. https://doi.org/10.1016/0140-6736(90)92082-s [ Links ]
4. Brunetta DM, Albuquerque LM, Batista AHM, Santos LHO, Schreen D, Lima CA, et al. Passenger lymphocyte syndrome in liver transplantation. Rev Bras Hematol Hemoter. 2017;39(4):364-7. http://doi.org/10.1016/j.bjhh.2017.07.006 [ Links ]
5. Yazer MH, Triulzi DJ. Immune hemolysis following ABO-mismatched stem cell or solid organ transplantation. Curr Opin Hematol. 2007;14(6):664-70. http://doi.org/10.1097/MOH.0b013e3282e9a576 [ Links ]
6. Moosavi MM, Duncan A, Stowell SR, Roback JD, Sullivan HC. Passenger Lymphocyte Syndrome; a Review of the Diagnosis, Treatment, and Proposed Detection Protocol. Transfus Med Rev. 2020;34(3):178-87. https://doi.org/10.1016/j.tmrv.2020.06.004 [ Links ]
7. Audet M, Panaro F, Piardi T, Huang P, Cag M, Cinqualbre J, et al. Passenger lymphocyte syndrome and liver transplantation. Clin Dev Immunol. 2008;2008:715769. https://doi.org/10.1155/2008/715769 [ Links ]
8. Romero S, Solves P, Lancharro A, Cano I, Moscardó F, Carpio N, et al. Passenger lymphocyte syndrome in liver transplant recipients: A description of 12 cases. Blood Transfus. 2015;13(3):423-8. https://doi.org/10.2450/2015.0148-14 [ Links ]
9. Maheshwari A, Mishra R, Thuluvath PJ. Post-liver-transplant anemia: Etiology and management. Liver Transplant. 2004;10(2):165-73. https://doi.org/10.1002/lt.20031 [ Links ]
10. Smith EP. Hematologic Disorders after Solid Organ Transplantation. Hematology. 2010;2010(1):281-6. https://doi.org/10.1182/asheducation-2010.1.281 [ Links ]
11. Jacobs J, Pogue E, Johnson M, Eichbaum Q. Passenger lymphocyte syndrome with severe haemolysis misdiagnosed/treated as cold agglutinin syndrome: Analysis of case and diagnostic error. Transfus Med. 2021;31(4):305-7. https://doi.org/10.1111/tme.12773 [ Links ]
12. Ramsey G. Red cell antibodies arising from solid organ transplants. Transfusion. 1991;31(1):76-86. http://doi.org/10.1046/j.1537-2995.1991.31191096190.x [ Links ]
13. de Bruijn S, Philipse E, Couttenye MM, Bracke B, Ysebaert D, Michielsen P, et al. Passenger lymphocyte syndrome (PLS): A single-center retrospective analysis of minor ABO-incompatible liver transplants. J Clin Transl Hepatol. 2017;5(1):9-15. https://doi.org/10.14218/JCTH.2016.00072 [ Links ]
14. Squires JE. Passenger lymphocyte syndrome: A case report involving non-ABO antibodies. Transfus Med Hemother. 2014;41(2):153-5. https://doi.org/10.1159/000357985 [ Links ]
15. Nadarajah L, Ashman N, Thuraisingham R, Barber C, Allard S, Green L. Literature Review of Passenger Lymphocyte Syndrome Following Renal Transplantation and Two Case Reports. Am J Transplant. 2013;13(6):1594-600. https://doi.org/10.1111/ajt.12219 [ Links ]
16. Brunetta DM, Barros Carlos LM, Da Silva VFP, Oliveira Alves TM, Macedo ÊS, Coelho GR, et al. Prospective evaluation of immune haemolysis in liver transplantation. Vox Sang. 2020;115(1):72-80. https://doi.org/10.1111/vox.12865 [ Links ]
17. Monfort M, Honoré P, Gothot A, Gérard C. Simultaneous passenger lymphocyte syndrome and multiple alloimmunization against donor’s blood group antigens after liver transplantation. Vox Sang. 2015;109(1):86-90. https://doi.org/10.1111/vox.12253 [ Links ]
18. Nguyen C, Fontaine M, Meier R, Jakhete N. Passenger Lymphocyte Syndrome: A Rare Case of Anemia After Liver Transplant. Exp Clin Transplant. 2022;20(2):222-3. https://doi.org/10.6002/ect.2021.0328 [ Links ]
19. Peck JR, Elkhammas EA, Li F, Stanich PP, Latchana N, Black S, et al. Passenger lymphocyte syndrome: a forgotten cause of postliver transplant jaundice and anemia. Exp Clin Transplant. 2015;13(2):200-2. https://doi.org/10.6002/ect.2013.0239 [ Links ]
20. Marton A, Pendergrast JM, Keshavjee S, Singer L, Hawes J, Cserti-Gazdewich C. Passenger Lymphocyte Syndrome Following Solid Organ Transplantation: Graft Source, Incidence, Specificity, Duration, and Severity Of Hemolysis. Blood. 2013;122(21):37. https://doi.org/10.1182/blood.V122.21.37.37 [ Links ]
Citación: Paredes-Fernández A, Gómez-Ramírez D, Kuratomi-Nakamura K. Síndrome del linfocito pasajero por anticuerpos anti-D en trasplante hepático. Reporte de caso. Revista. colomb. Gastroenterol. 2022;37(4):444-449. https://doi.org/10.22516/25007440.814
Recibido: 13 de Agosto de 2021; Aprobado: 30 de Marzo de 2022











 text in
text in