Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista colombiana de Gastroenterología
Print version ISSN 0120-9957On-line version ISSN 2500-7440
Rev. colomb. Gastroenterol. vol.37 no.4 Bogotá Oct./Dec. 2022 Epub July 11, 2023
https://doi.org/10.22516/25007440.847
Reporte de caso
Trasplante ortóptico de hígado en un paciente con una prueba positiva de SARS-CoV-2 y sus complicaciones posoperatorias. Reporte de caso
1Internal medicine resident, Faculty of Health Sciences, Universidad Libre. Cali, Colombia.
2Internal medicine resident, FFaculty of Health Sciences, Universidad Libre. Cali, Colombia.
3Internal Medicine program coordinator. Faculty of Health Sciences, Universidad Libre. Cali, Colombia.
4Gastroenterologist, Hepatologist. Gastroenterology and Endoscopy Department. Clínica Imbanaco. Cali, Colombia.
Objetivo:
describir un caso de trasplante hepático en un paciente con resultado positivo en la prueba del coronavirus del síndrome respiratorio agudo grave de tipo 2 (SARS-CoV-2) con éxito en el postrasplante temprano, pero que desarrolló complicaciones asociadas a la inmunosupresión y trombosis portal sin una trombofilia identificada en un centro de alta complejidad de un país latinoamericano.
Descripción del caso:
paciente de 48 años con diagnóstico de cirrosis hepática secundaria a esteatohepatitis no alcohólica (NASH) complicada por varios episodios de ascitis portal hipertensiva y encefalopatía hepática, ingresada para trasplante hepático ortóptico. En los exámenes iniciales tuvo una prueba positiva para SARS-CoV-2 y era asintomático respiratorio. El trasplante se realizó con éxito luego de la autorización del comité de infección. Después del primer mes posoperatorio presentó diarrea, ascitis y daño renal agudo. Los niveles de tacrolimus en el reingreso fueron superiores a 10 ng/mL y hubo una mejoría clínica significativa con la suspensión del fármaco. Finalmente, el paciente requirió retrasplante por trombosis de la vena porta y de las venas suprahepáticas, aunque no se identificó la etiología.
Conclusión:
se describe uno de los primeros informes de trasplante de hígado en un paciente con recuperación reciente de COVID-19 y pruebas persistentemente positivas. En el postrasplante temprano hubo una buena respuesta; sin embargo, luego del primer mes presentó complicaciones relacionadas con la inmunosupresión. Este caso también plantea la posible asociación entre el SARS-CoV-2 y el desarrollo de trombosis en la circulación portal hepática.
Palabras clave: SARS-CoV-2; COVID-19; trasplante de hígado; hepatología; tacrolimus; portal; trombosis
Objective:
To describe a case of liver transplantation in a patient with a positive result in the severe acute respiratory syndrome coronavirus type 2 (SARS-CoV-2) test with success in the early post-transplantation, but who developed complications associated with immunosuppression and portal vein thrombosis without thrombophilia identified at a tertiary referral center in a Latin American country.
Case:
A 48-year-old patient diagnosed with liver cirrhosis secondary to non-alcoholic steatohepatitis (NASH) complicated by several episodes of portal hypertension ascites and hepatic encephalopathy was admitted for orthoptic liver transplantation. On initial examinations, he had a positive test for SARS-CoV-2 and was asymptomatic in the respiratory tract. The transplant was carried out successfully after the authorization of the infection committee. After the first postoperative month, he presented with diarrhea, ascites, and acute kidney injury. Tacrolimus levels at readmission were more significant than 10 ng/mL, and there was a significant clinical improvement with drug discontinuation. Finally, the patient required re-transplantation due to thrombosis of the portal vein and suprahepatic veins, although the etiology was not identified.
Conclusion:
One of the first reports of liver transplantation in a patient with recent recovery from COVID-19 and persistently positive tests is described. In the early post-transplant, there was a good response; however, after the first month, he had complications related to immunosuppression. This case also posits the possible association between SARS-CoV-2 and the development of thrombosis in the hepatic portal circulation.
Keywords: SARS-CoV-2; COVID-19; liver transplantation; hepatology; tacrolimus; portal vein; thrombosis
Introducción
El 31 de diciembre de 2019, hospitales de Wuhan, Hubei, China, notificaron un grupo de casos de neumonía de causa desconocida hasta ese momento. El 7 de enero de 2020, los investigadores aislaron un nuevo coronavirus de pacientes con neumonía y a este se le dio la denominación de SARS-CoV-2. Desde el 30 de enero, la Organización Mundial de la Salud (OMS) declaró que la COVID-19 (como se le conoce a la enfermedad por coronavirus 2019 desde el 11 de febrero), era una emergencia de salud pública de importancia internacional y más tarde se reconocería como pandemia1,2. Con el pasar del tiempo, también se ha encontrado una amplia asociación con manifestaciones extraintestinales3. Entre ellas, existe un incremento significativo en la incidencia de eventos trombóticos; particularmente, se ha reportado trombosis de la vena porta (PVT) en pacientes sin otras causas potenciales de trombofilia, diferentes a una infección actual o reciente por SARS-CoV-2, tal como sucedió en el caso que exponemos4.
Existen diversos esquemas de inmunosupresión en el postrasplante ortóptico hepático5. Uno de los utilizados con mayor frecuencia es la inducción con corticoesteroides y el mantenimiento con tacrolimus. Sin embargo, es necesario conocer que este inhibidor de la calcineurina exhibe, además de numerosas interacciones farmacológicas, un sinnúmero de efectos adversos, entre los que cabe mencionar: diarrea, ascitis persistente y lesión renal aguda. Por ende, en el posoperatorio de trasplante hepático se debe valorar su nivel sérico, para tener en cuenta sus efectos adversos como un diagnóstico diferencial de estas complicaciones6-8.
Presentación del caso
Se trata de un paciente masculino de 48 años de edad, con cirrosis hepática descompensada, con puntajes Child-Pugh clase B, Model for End-stage Liver Disease (MELD) 15, diagnosticada hace un año, secundaria a esteatohepatitis no alcohólica (NASH). Durante ese período tuvo múltiples episodios de encefalopatía, ascitis, sangrado portal hipertensivo, con requerimiento de manejo intrahospitalario y ligadura de várices esofágicas. Ingresó a la Clínica Imbanaco para la realización de un trasplante ortóptico hepático debido a que contaba con un donante cadavérico compatible. Previamente, se lo citó para el procedimiento 40 días antes, sin embargo, en ese momento no se realizó al presentar una prueba de reacción en cadena de la polimerasa (PCR) para SARS-CoV-2 positiva. Dentro de los exámenes iniciales, nuevamente la PCR para SARS-CoV-2 resultó positiva. El comité de infecciones autorizó el trasplante al considerar que la muestra positiva correspondía a ARN residual en ausencia de partículas virales infecciosas activas.
El trasplante hepático se efectúo con un tiempo de isquemia fría de 5 horas y 45 minutos, isquemia caliente de 40 minutos, con necesidad de soporte vasopresor, sangrado intraoperatorio de 1,7 litros, transfusión de 2 UGR, 6 de crioprecipitado y pool de plaquetas. Ingresó a la unidad de cuidados intensivos (UCI) sin soporte ventilatorio, con soporte vasoactivo con noradrenalina y un gasto urinario adecuado. Según el protocolo, se inició la inmunosupresión con metilprednisolona a dosis de 200 mg/día en un esquema de descenso progresivo como inducción y al segundo día tacrolimus XL a 7 mg/día para el mantenimiento. Luego de una estancia hospitalaria sin complicaciones, con una función renal (creatinina 0,63 mg/dL, nitrógeno ureico en sangre 5,2 mg/dL) y hepática preservadas, estabilidad hemodinámica, sin síntomas respiratorios ni elevación de reactantes de inflamación aguda, con ecografía Doppler de hígado trasplantado dentro de los límites normales, al octavo día postrasplante se dio egreso con fórmula de tacrolimus XL a 9 mg/día, prednisolona 5 mg/día y valganciclovir 450 mg cada 12 horas.
Un mes después del trasplante, el paciente reingresó por un cuadro de 10 días de evolución de distensión abdominal, aumento en la frecuencia de las deposiciones de consistencia líquida, sin fiebre y con diuresis normal. Al ingreso se encontraba normotenso, taquicárdico, taquipneico, eutérmico y con dolor abdominal. Se realizó un Doppler portal en el que se evidenció una cantidad abundante de líquido ascítico y el hígado trasplantado de aspecto normal. El paciente requirió una paracentesis evacuatoria con reposición de albúmina a 8 g por cada litro, se inició la administración de diuréticos y el suministro de líquidos endovenosos. Durante la estancia se descartaron etiologías infecciosas, con carga viral para Citomegalovirus, PCR para Clostridium difficile, hemocultivos, urocultivos, coproscópico y coprocultivos negativos. La función renal mostró un deterioro progresivo con una creatinina inicial de 2,33 mg/dL hasta 4,04 el cuarto día de hospitalización. Se obtuvieron niveles de tacrolimus en 10,7 ng/mL, por lo que se optó por suspender temporalmente el medicamento. Al día siguiente disminuyó el número de deposiciones a 3 en 24 horas, así como de la creatinina a 2,4 mg/dL, cifra que al sexto día de hospitalización alcanzó rangos normales.
Sesenta días después del trasplante, el paciente presentó una vez más diarrea y ascitis. El Doppler portal mostró una trombosis portal y de las venas suprahepáticas, confirmado por angiotomografía de abdomen (Figura 1). Se inició la anticoagulación y el paciente recibió el aval para el retrasplante hepático. Las pruebas para descartar trombofilias resultaron negativas. Sin una causa encontrada del evento trombótico, el antecedente de infección reciente por SARS-CoV-2 sugiere una etiología potencial.
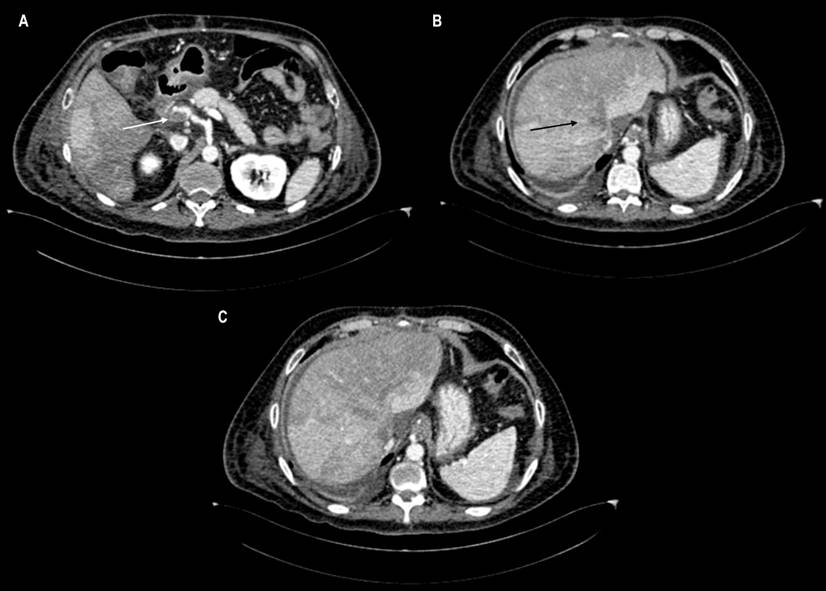
Figura 1 Tomografía axial computarizada (TAC) de abdomen. A. La reconstrucción en plano axial muestra un trombo con obstrucción subtotal en la vena porta (flecha blanca). B. Oclusión total en las venas suprahepáticas (flecha negra), que integran el diagnóstico de un síndrome de Budd-Chiari. C. Las áreas hepáticas de realce heterogéneo son un patrón característico de este síndrome.
Discusión
Se ha descrito que el riesgo de contagio en pacientes asintomáticos o con síntomas leves es bajo a partir del día 7. Wölfel y colaboradores valoraron virológicamente a 9 pacientes con COVID-19 leve; encontraron que la tasa de replicación del virus disminuye a partir del día 5 y existe una probabilidad de continuar más allá del día 7 en un 5%9. El Centro para el Control y Prevención de Enfermedades (CDC) recomienda suspender el aislamiento 10 días después del inicio de los síntomas y la resolución de la fiebre durante al menos 24 horas, sin el uso de medicamentos para reducir la fiebre y con la mejoría de otros síntomas, en pacientes con COVID-19 leve o moderado; en asintomáticos, 10 días después de su primera PCR positiva para SARS-CoV-210.
Acerca de la indicación de trasplante, existen reportes de grupos de trasplante de órgano sólido con distintos tipos de indicaciones para llevar a cabo la cirugía, con restricciones basadas en las decisiones del equipo multidisciplinario. Rouphael y colaboradores publicaron el caso de un trasplante ortóptico hepático exitoso en una paciente con insuficiencia hepática aguda secundaria a una intoxicación farmacológica. El procedimiento se efectuó a pesar de presentar una PCR inicial para SARS-CoV-2 positiva luego de una exposición de riesgo 6-10 semanas previas11. Algunos grupos de trasplantes sugieren que los pacientes se coloquen como activos en la lista si han pasado 6 semanas desde que presentaron una prueba positiva inicial para COVID-19 con al menos 4 semanas sin síntomas, y que no se vuelvan a realizar la prueba con otra PCR antes del trasplante si están dentro de los 3 meses posteriores a la prueba positiva inicial12.
Presentamos el caso de un paciente con una historia de cirrosis hepática descompensada, quien ingresó para trasplante ortóptico hepático; sin embargo, en un primer momento no se realizó debido a que la PCR para SARS-CoV-2 resultó positiva, a pesar de no tener síntomas respiratorios. Cuarenta días después, el paciente continuó con la PCR positiva. En este caso, el comité de infecciones lo consideró como persistencia de partículas virales no infecciosas y autorizó la realización del trasplante ortóptico hepático.
Se especula que la COVID-19 tiene múltiples mecanismos fisiopatológicos desencadenantes del compromiso en órganos sólidos, entre ellos el hígado. El daño vascular estaría mediado por una alteración en el proceso de coagulación, el deterioro de la circulación sanguínea o del endotelio. Sonzogni y colaboradores, en Bérgamo, evaluaron post mortem las características histológicas de 48 muestras de hígado en 47 pacientes positivos para COVID-19, fallecidos por insuficiencia respiratoria grave, sin antecedentes, signos o síntomas de enfermedad hepática hasta el momento de la estancia hospitalaria. Todos presentaron algún grado de trombosis vascular: 24, portal parcial; 11, portal completa; 7, incompleta sinusoidal; y 6, completa sinusoidal. Además, se reportaron grados variables de fleboesclerosis, herniación y fibrosis portal13.
Se ha reportado una alta incidencia de complicaciones trombóticas en pacientes críticos con COVID-19. Klok y colaboradores estudiaron en Holanda a 184 pacientes con COVID-19 ingresados a la UCI para buscar el desenlace compuesto de accidente cerebrovascular (ACV) isquémico, infarto de miocardio o embolia arterial sistémica. Se presentó una mortalidad del 22%, complicaciones trombóticas en 75 casos, 65 tromboembolismos pulmonares, 1 trombosis venosa profunda, 2 trombosis de extremidades superiores, 5 pacientes con ACV isquémico y 2 pacientes con embolias arteriales sistémicas. Los pacientes con terapia de anticoagulación crónica al momento de la admisión se asociaron con un menor riesgo del resultado compuesto (Hazard ratio [HR] 0,29; intervalo de confianza [IC] del 95% 0,091-0,92), mientras que los pacientes con complicaciones trombóticas tenían un mayor riesgo de muerte por cualquier causa (HR 5,4; IC del 95% 2,4-12)3.
Se ha visto como la PVT puede presentarse en pacientes sin otras posibles causas identificables. Borazjani reportó el caso de un hombre, asmático, de 23 años, con neumonía por coronavirus, quien presentó un dolor abdominal agudo generalizado, ascitis leve y PVT. Los datos de laboratorio de rutina, con respecto a las causas secundarias de la PVT, fueron normales. En nuestro paciente se encontró una PVT parcial y trombosis de las venas suprahepáticas, con lo que se descartaron las causas secundarias de trombosis, y se produjo una hepatomegalia progresiva, razón por la cual nuevamente se le realizó un trasplante ortóptico hepático.
Aparte del antecedente de recuperación reciente de la infección por SARS-CoV-2, nuestro paciente presentó efectos adversos generados por la inmunosupresión, específicamente por el tacrolimus. Tuvo diarrea y lesión renal aguda prerrenal asociada a la hipovolemia luego de un mes postrasplante. Al suspender el tacrolimus, la diarrea se detuvo y presentó un descenso progresivo de los azoados hasta lograr cifras normales. Según las directrices de la Comunidad de Práctica de Enfermedades Infecciosas de la American Society of Transplantation (AST), después de descartar las etiologías infecciosas de diarrea en trasplantados de órgano sólido es necesario considerar la reducción de las dosis de los inmunosupresores y evaluar la respuesta8. Además de los episodios de vómito o diarrea, también se ha descrito que la toxicidad por inhibidores de calcineurina por sí misma puede generar lesión renal aguda en el postrasplante, razón por la que se deben medir los niveles del fármaco y ajustar su dosis según la concentración deseada6. Rodríguez y colaboradores mostraron que al obtener una concentración valle de tacrolimus entre 6 y 10 ng/mL durante las primeras 4-6 semanas después del trasplante ortóptico hepático, se reduce la insuficiencia renal sin aumentar simultáneamente el riesgo de rechazo celular agudo; luego debe lograrse una reducción progresiva de la dosis para lograr un nivel sérico de tacrolimus entre 4 ng/mL y 8 ng/mL a largo plazo14.
Conclusión
Existen recomendaciones de grupos de trasplantes acerca del aislamiento y las indicaciones quirúrgicas del paciente con COVID-19, sin embargo, estas deben definirse mediante protocolos institucionales y por el comité de infecciones. Una vez trasplantado, se pueden presentar múltiples complicaciones en el paciente recuperado recientemente de una infección por SARS-CoV-2, entre ellas, se deben reconocer de forma precoz las extrapulmonares con componente trombótico. Por otra parte, conocer las interacciones y hacer un reconocimiento prematuro de los efectos adversos de la inmunosupresión permite prever las modificaciones en la dosis para lograr una concentración meseta segura y efectiva.
REFERENCIAS
1. Jiang F, Deng L, Zhang L, Cai Y, Cheung CW, Xia Z. Review of the Clinical Characteristics of Coronavirus Disease 2019 (COVID-19). J Gen Intern Med. 2020;35(5):1545-49. https://doi.org/10.1007/s11606-020-05762-w [ Links ]
2. He F, Deng Y, Li W. Coronavirus disease 2019: What we know? J Med Virol. 2020;92(7):719-25. https://doi.org/10.1002/jmv.25766 [ Links ]
3. Klok FA, Kruip MJHA, van der Meer NJM, Arbous MS, Gommers DAMPJ, Kant KM, et al. Incidence of thrombotic complications in critically ill ICU patients with COVID-19. Thromb Res. 2020;191:145-147. https://doi.org/10.1016/j.thromres.2020.04.041 [ Links ]
4. Borazjani R, Seraj SR, Fallahi MJ, Rahmanian Z. Acute portal vein thrombosis secondary to COVID-19: a case report. BMC Gastroenterol. 2020;20(1):386. https://doi.org/10.1186/s12876-020-01518-2 [ Links ]
5. Moini M, Schilsky ML, Tichy EM. Review on immunosuppression in liver transplantation. World J Hepatol. 2015;7(10):1355-68. https://doi.org/10.4254/wjh.v7.i10.1355 [ Links ]
6. Rossi AP, Vella JP. Acute Kidney Disease After Liver and Heart Transplantation. Transplantation. 2016;100(3):506-14. https://doi.org/10.1097/TP.0000000000000916 [ Links ]
7. Hosseini M, Aliakbarian M, Akhavan-Rezayat K, Shadkam O, Milani S. Tacrolimus-induced Ascites after Liver Transplant. Int J Organ Transplant Med. 2018;9(2):102-04. [ Links ]
8. Angarone M, Snydman DR; AST ID Community of Practice. Diagnosis and management of diarrhea in solid-organ transplant recipients: Guidelines from the American Society of Transplantation Infectious Diseases Community of Practice. Clin Transplant. 2019;33(9):e13550. https://doi.org/10.1111/ctr.13550 [ Links ]
9. Wölfel R, Corman VM, Guggemos W, Seilmaier M, Zange S, Müller MA, et al. Virological assessment of hospitalized patients with COVID-2019. Nature. 2020;581(7809):465-69. https://doi.org/10.1038/s41586-020-2196-x [ Links ]
10. Centers for Disease Control and Prevention (CDC). Ending Isolation and Precautions for People with COVID-19: Interim Guidance. Atlanta; 2020 [citado el 26 de octubre de 2021]. Disponible en: Disponible en: https://www.cdc.gov/coronavirus/2019-ncov/hcp/duration-isolation.html [ Links ]
11. Rouphael C, D’Amico G, Ricci K, Cywinski J, Miranda C, Koval C, et al. Successful orthotopic liver transplantation in a patient with a positive SARS-CoV2 test and acute liver failure secondary to acetaminophen overdose. Am J Transplant. 2021;21(3):1312-16. https://doi.org/10.1111/ajt.16330 [ Links ]
12. Murad H, Dubberke E, Mattu M, Parikh B, Wellen J, Alhamad T. Repeat SARS-CoV-2 testing after recovery. Is a pretransplant PCR necessary? Am J Transplant. 2021;21(9):3206-07. https://doi.org/10.1111/ajt.16506 [ Links ]
13. Sonzogni A, Previtali G, Seghezzi M, Alessio MG, Gianatti A, Licini L, et al. Liver and COVID 19 Infection: A Very Preliminary Lesson Learnt from Histological Post-mortem Findings in 48 patients. Preprints. 2020;2020040438. https://doi.org/10.20944/preprints202004.0438.v1 [ Links ]
14. Rodríguez-Perálvarez M, Germani G, Darius T, Lerut J, Tsochatzis E, Burroughs AK. Tacrolimus trough levels, rejection and renal impairment in liver transplantation: a systematic review and meta-analysis. Am J Transplant. 2012;12(10):2797-814. https://doi.org/10.1111/j.1600-6143.2012.04140.x [ Links ]
Citación: Rivera-Martínez WA, Pantoja-Rosero ME, Casanova-Valderrama ME, Gómez-Ramírez DM. Trasplante ortóptico de hígado en un paciente con una prueba positiva de SARS-CoV-2 y sus complicaciones posoperatorias. Reporte de caso. Revista. colomb. Gastroenterol. 2022;37(4):454-458. https://doi.org/10.22516/25007440.847
Aprobación ética y consentimiento para participar No se obtuvo aprobación ética para la publicación de este caso clínico, ya que no implicaba compartir los datos personales y fotografías del paciente en el artículo
Recibido: 08 de Noviembre de 2021; Aprobado: 22 de Noviembre de 2021











 text in
text in 



