Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista colombiana de Gastroenterología
Print version ISSN 0120-9957On-line version ISSN 2500-7440
Rev. colomb. Gastroenterol. vol.37 no.4 Bogotá Oct./Dec. 2022 Epub July 11, 2023
https://doi.org/10.22516/25007440.840
Reporte de caso
Neoplasia sólida pseudopapilar de páncreas: una serie de cinco casos y revisión de la literatura
1Hepatobiliary and pancreatic surgeon, Hospital de la Samaritana, Bogota. Clínica Marly, Chía. Clínica Reina Sofía, Clínica Universitaria Colombia. Bogota, Colombia.
2General surgeon, Hospital Universitario de la Samaritana, Clínica Medical SAS, Clínica Universitaria Colombia. Bogota, Colombia.
3Pathologist, Universidad Militar Nueva Granada, Clínica Universitaria Colombia. Bogota, Colombia.
4General Surgery Fourth Year Resident, Clínica Santa María del Lago, Fundación Universitaria Sanitas. Bogota, Colombia.
5Eighth semester Medicine student, Fundación Universitaria Sanitas. Bogotá, Colombia.
6Gastroenterologist, Universidad Nacional de Colombia. Centro de Enfermedades Digestivas, GutMedica. Bogota, Colombia.
Introducción:
las neoplasias sólidas pseudopapilares de páncreas representan alrededor del 3% de los tumores pancreáticos quísticos resecados. Se presentan con mayor frecuencia en mujeres jóvenes entre la segunda y tercera décadas de la vida. Es un tumor con poco potencial maligno que se ubica principalmente en la cola; sin embargo, puede encontrarse en cualquier localización anatómica pancreática.
Métodos:
se presentan 5 casos de cuatro mujeres y un hombre, entre 16 y 36 años, que consultaron principalmente por dolor abdominal.
Resultados:
cuatro pacientes fueron llevados a pancreatectomía distal sin esplenectomía por laparoscopia, y una paciente a pancreatoduodenectomía por laparotomía. Se logró extraer por completo y satisfactoriamente el tumor a los cinco pacientes. No se evidenció metástasis. Los tumores se localizaron en la cabeza (1), cuello (1) y predominantemente en cuerpo y cola (3). El reporte histopatológico posoperatorio confirmó el diagnóstico en los cinco casos, en la paciente más joven se había realizado una biopsia percutánea previa a la intervención quirúrgica.
Conclusiones:
la resección quirúrgica completa del tumor con preservación del bazo es el tratamiento de elección en pacientes con neoplasia sólida pseudopapilar de páncreas.
Palabras clave: Páncreas; sólido; pseudopapilar; neoplasia; tumor
Introduction:
Solid pseudopapillary neoplasms of the pancreas represent around 3% of resected cystic pancreatic tumors. They occur more frequently in young women between the second and third decades of life. It is a tumor with little malignant potential located mainly in the tail; however, it can be found in any pancreatic anatomical location.
Materials and methods:
We reported five cases of four women and one man, between 16 and 36 years of age, who consulted mainly for abdominal pain.
Results:
Four patients underwent distal pancreatectomy without laparoscopic splenectomy, and one underwent laparotomy pancreatoduodenectomy. The tumor was completely and satisfactorily removed from all five patients. No metastasis was found. The tumors were located on the head (1), neck (1), and predominantly on the body and tail (3). The postoperative histopathological report confirmed the diagnosis in all five cases; in the youngest patient, a percutaneous biopsy had been performed before surgical intervention.
Conclusions:
Complete surgical resection of the tumor with preservation of the spleen is the treatment of choice in patients with solid pseudopapillary neoplasm of the pancreas.
Keywords: Pancreas; solid; pseudopapillary; neoplasia; tumor
Introducción
El tumor sólido pseudopapilar de páncreas también se denomina tumor de Frantz, tumor sólido y papilar, tumor sólido-quístico, tumor quístico papilar o neoplasia epitelial papilar y sólida1. Lichtenstein fue el primero en reportar esta entidad en 19342, pero Virginia Kneeland Frantz en 1959 describió su patología3 y Hamoudi y colaboradores describieron sus características de microscopía electrónica en 19704. La Organización Mundial de la Salud (OMS) lo clasificó como neoplasia sólida pseudopapilar (NSSP) en 19965. La prevalencia ha aumentado en los últimos años porque se ha incrementado la detección incidental de lesiones quísticas de páncreas por la realización de imágenes como tomografía axial computarizada (TAC) y resonancia magnética nuclear (RMN) de abdomen, para estudiar otras causas6. La cantidad de casos reportados en la literatura ha aumentado 7 veces en las últimas dos décadas6.
En el presente estudio se reporta una serie de 5 casos de NSSP y se revisan los aspectos clínicos, radiológicos, histológicos, tratamiento y pronóstico.
Métodos y materiales
Se reporta una serie de 5 casos, de 4 mujeres y 1 hombre entre 16 y 36 años, con diagnóstico de NSSP. Los pacientes fueron diagnosticados y tratados entre mayo de 2017 y abril de 2020 en un hospital de tercer nivel en Bogotá, Colombia. La mayoría debutó con sintomatología similar, que consiste en dolor y distensión abdominal. Dos de los cinco pacientes presentaron náuseas, emesis y fiebre. Un paciente presentó dolor lumbar y otra, pérdida de peso. El tamaño y localización del tumor fue variable a nivel de la cabeza (1), cuello (1), cuerpo y cola de páncreas (3), con predominio distal. Se realizaron cuatro pancreatectomías distales laparoscópicas con preservación de bazo y una pancreatoduodenectomía abierta. Para la revisión bibliográfica se realizó una búsqueda de la literatura en PubMed y Google Scholar, se incluyeron artículos en español e inglés, no se excluyó ningún artículo por fecha de publicación.
Presentación de casos
Caso 1
Mujer de 27 años acude al servicio de urgencias por dolor abdominal difuso e intermitente de dos meses de evolución asociado a distensión abdominal. Se le realizó una ecografía y una TAC de abdomen con contraste que reportaron una masa quística en el cuello del páncreas (3,6 cm x 3,6 cm x 3,5 cm) con alta sospecha de tumor sólido pseudopapilar de páncreas. Los marcadores tumorales CA 19-9 y antígeno carcinoembrionario fueron negativos. Se le solicitó un ultrasonido endoscópico (USE) biliopancreático que reportó una lesión en el cuerpo del páncreas distal a la confluencia esplenoportal, con una elastografía sugestiva de lesión maligna con un strain ratio de 180 (normal < 25).
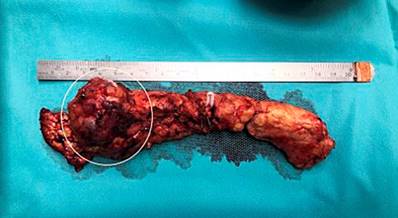
Se realizó una pancreatectomía distal por laparoscopia con preservación del bazo, en la cual se encontró un tumor en el cuello del páncreas de aproximadamente 5 cm (Figura 1) que no comprometía las estructuras vasculares y una adenopatía sobre la arteria hepática, la cual se logró resecar. El reporte histopatológico confirmó el diagnóstico de neoplasia sólida pseudopapilar (Figura 2) con adenopatía negativa para tumor. No hubo complicaciones posoperatorias. Tras 4 meses de la intervención, el estado de la paciente es adecuado, con modulación del dolor abdominal. Se le realizó una TAC de abdomen con contraste de control con hallazgos posquirúrgicos de pancreatectomía distal e infarto esplénico antiguo.
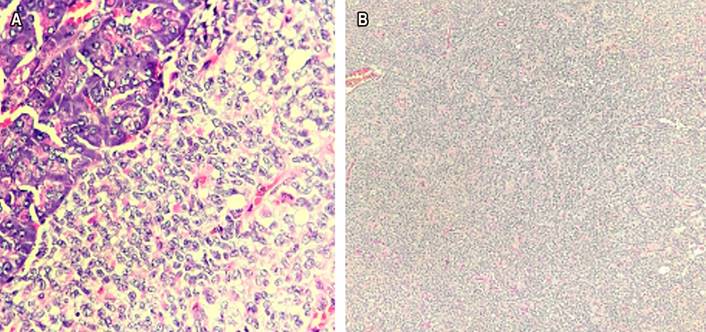
Figura 2 A. Las células tumorales muestran un citoplasma eosinófilo, algunos con vacuolas intracitoplasmáticas perinucleares y glóbulos hialinos. B. Lesión tumoral constituida por nidos sólidos de células que se agregan alrededor de los vasos sanguíneos y generan una arquitectura pseudopapilar. Fuente: archivo de los autores.
Caso 2
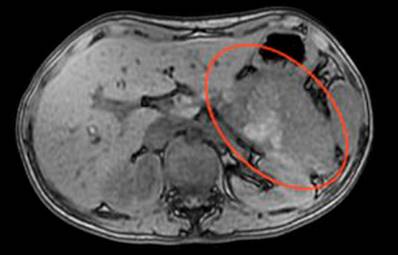
Se trata de una paciente femenina de 23 años que consultó al servicio de urgencias por dolor abdominal de un mes de evolución asociado a episodios febriles de 38 ºC, múltiples episodios eméticos, pérdida de peso y dismenorrea, con estudios extrainstitucionales que descartaron foco infeccioso. El reporte de TAC de abdomen con contraste fue consistente con masa en el cuerpo del páncreas de aspecto neoplásico con compresión de la cámara gástrica. Al ingreso se encontró con hemoglobina de 9,4 g/dL y recuento de plaquetas de 608 000. Se le solicitó una RMN de abdomen (Figura 3) con protocolo para páncreas que reportó una masa en la cola de 10 cm x 8 cm con un componente quístico anterior y sólido posterolateral, con un efecto compresivo sobre las vísceras y con una pobre visualización de la vena esplénica, la cual sugería la presencia de trombosis. El reporte de Doppler esplenoportal no registró alteraciones vasculares.
Fue programada para una pancreatectomía distal con esplenectomía vía laparoscópica. Durante la cirugía se resecó una masa de 15 cm hipervascularizada, la cual se encontraba adherida al mesocolon transverso, con fibrosis de la cara posterior del estómago en contacto con la arteria y la vena esplénicas que se lograron disecar y preservar; había presencia de adenopatías en el tronco celíaco, las cuales se resecaron y enviaron a biopsia por congelación y no reportaron malignidad; no se realizó esplenectomía y se transfundieron 4 unidades de glóbulos rojos empaquetados. En el posoperatorio presentó anemización en relación con los valores de ingreso (7,6 g/dL) e hipotensión, por lo cual requirió soporte transfusional adicional.
A la paciente se le dio salida y reingresó a los 8 días por presencia de contenido hemático mayor de 300 mL en el dren, se le realizó una TAC de abdomen con cambios posquirúrgicos esperados, con escasa cantidad de líquido libre sobre el lecho quirúrgico considerado normal. El diagnóstico de neoplasia sólida pseudopapilar se confirmó con el reporte histopatológico. A los 16 meses de la intervención la paciente está asintomática, se le realizó una TAC de abdomen de control que no evidenció una recaída tumoral.
Caso 3
Es una mujer de 36 años con antecedente de hipertensión arterial que ingresó programada para pancreatectomía distal y colecistectomía vía laparoscópica por un tumor sólido pseudopapilar de la cola del páncreas y colelitiasis sintomática. Durante la cirugía se evidenció una lesión de 8 cm a nivel del cuerpo y cola del páncreas con contenido quístico dependiente del conducto principal, la cual se resecó con preservación del bazo, sin complicaciones. Tuvo un difícil manejo posoperatorio por el dolor, episodios eméticos e infección del sitio operatorio, por lo cual se dio manejo analgésico, antiemético y antibiótico. El diagnóstico histopatológico (Figura 4) confirmó neoplasia sólida pseudopapilar. A los 2 meses de la cirugía cursó con fístula pancreática, que requirió un drenaje percutáneo con una adecuada resolución. En el último control, 20 meses después de la cirugía, se encontró asintomática.
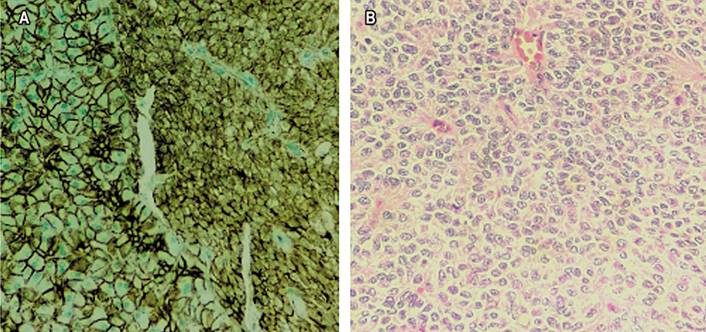
Figura 4 A. El estudio de inmunohistoquímica para β-catenina muestra una expresión nuclear anormal en las células neoplásicas (derecha), en contraste con la expresión de la membrana normal en el tejido pancreático adyacente (izquierda). B. Las células tumorales muestran núcleos con cromatina finamente granular, superficie nuclear irregular, algunos con hendiduras longitudinales características. Fuente: archivo de los autores.
Caso 4
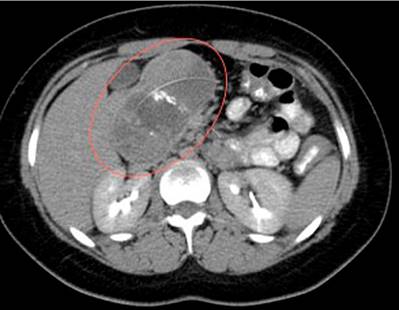
Es una paciente femenina de 16 años que consultó al servicio de urgencias por un cuadro clínico de una semana de dolor abdominal en el epigastrio, deposiciones diarreicas y fiebre no cuantificada asociada a cefalea global. Tenía antecedente de púrpura trombocitopénica autoinmune a los 2 años. Se le realizó una ecografía de abdomen total en la que se evidenció una masa retroperitoneal. Posteriormente, se le realizó una TAC de abdomen con contraste (Figura 5), que reportó una lesión focal de aspecto neoplásico en la cabeza del páncreas, se planteó como diagnóstico diferencial un cistoadenoma mucinoso o tumor neuroendocrino (TNE). Finalmente, se realizó una RMN de abdomen con contraste que reportó una masa de aspecto complejo dependiente de la cabeza del páncreas sin signos de invasión hacia las estructuras adyacentes, que tenía como diagnósticos diferenciales una neoplasia quística compleja o TNE.
Se le realizó una biopsia percutánea guiada por ecografía que reportó una neoplasia sólida pseudopapilar, así como una pancreatoduodenectomía por laparotomía con hallazgos de tumor sólido dependiente de la cabeza del páncreas que midió 9,5 cm x 7 cm, con distorsión de la anatomía del duodeno, vasos nutricios de la arteria gastroduodenal hacia el tumor, vía biliar de calibre normal y ganglios periportales aumentados de tamaño. El posoperatorio fue en la unidad de cuidados intensivos (UCI) con una adecuada evolución clínica y egreso sin complicaciones. A los 6 meses de la cirugía presentó pancreatitis aguda leve que resolvió sin complicaciones. En el último control, 17 meses después de la cirugía, se encontró asintomática.
Caso 5
Se trata de un paciente masculino de 21 años que consulta por un cuadro clínico de tres meses de evolución consistente en dorsolumbalgia, sin otra sintomatología asociada. No hubo hallazgos relevantes en el examen físico. Con la impresión diagnóstica de urolitiasis se le realizó una uroTAC que reportó en la cola del páncreas una imagen nodular bilobulada de 28 mm x 29 mm con calcificaciones en su interior, sugestiva de tumor neuroendocrino (exocrino) tipo mucinoso. Posteriormente, se realizó una RMN de abdomen con protocolo para páncreas, en la cual se observó una lesión quística sólida sugestiva de tumor pseudopapilar. El paciente fue programado para pancreatectomía distal por laparoscopia con preservación esplénica. Durante la resección del tumor se encontró una lesión sólida en la cola del páncreas de aproximadamente 5 cm de diámetro, homogénea, hipervascularizada y con bordes irregulares, la cual comprometía la vena y arteria esplénicas, sin evidencia de lesiones metastásicas.
Se realizó la disección con identificación de la vena mesentérica superior y disección de páncreas distal con arteria y vena esplénicas, se evidenció el tumor descrito y se realizó una ligadura con Hem-O-Lock® distal y proximal de la vena y arteria esplénicas y se resecó la infiltración del tumor, se preservaron los vasos gástricos cortos y la arteria gastroepiploica izquierda; posteriormente, se resecó el páncreas distal. Se revisó el bazo con una adecuada perfusión sin signos de isquemia o infarto, sin complicaciones. La patología diagnosticó una neoplasia sólida pseudopapilar.
Reingresó a los 14 días por un cuadro de seis horas de evolución consistente en dolor epigástrico irradiado al dorso, asociado a emesis, sin fiebre. No hay signos de abdomen agudo. Al ingreso se solicitaron paraclínicos que evidenciaron leucocitosis con neutrofilia, hiperbilirrubinemia directa, sin acidosis metabólica, equilibrio electrolítico, función renal preservada y amilasa sin alteración. Se sospechó una colección intraabdominal, por lo que se inició el manejo antibiótico de amplio espectro, analgésico y se realizó una TAC de abdomen con contraste que reportó una colección de aproximadamente 62 mm x 138 mm x 50 mm en el lecho quirúrgico, con imágenes que sugerían múltiples infartos esplénicos, sin otras alteraciones. La radiología intervencionista realizó el drenaje de 140 mL de líquido hemático residual con reporte de amilasa positiva y cursó con fístula pancreática.
El paciente tuvo una buena evolución con el manejo antibiótico y el drenaje de la colección, sin requerimiento de esplenectomía. Un mes después se realizó una TAC de abdomen de control con un reporte de infartos esplénicos sin cambios, pancreatectomía distal y colección residual de 33 mL, por lo cual se retiró el catéter. Tras 5 meses de la intervención el estado del paciente era adecuado y se realizó una TAC de abdomen control con cambios de pancreatectomía distal, sin evidencia de colección.
Resultados
Cuatro pacientes fueron llevados a pancreatectomía distal por laparoscopia sin esplenectomía, y una paciente a pancreatoduodenectomía por laparotomía. Se logró extraer por completo y satisfactoriamente el tumor a los cinco pacientes. No se evidenció metástasis. Los tumores se localizaron en la cabeza (1), cuello (1), cuerpo y cola del páncreas (3), con predominio distal. El reporte histopatológico posoperatorio confirmó el diagnóstico en los cinco casos, en la paciente más joven se había realizado una biopsia percutánea guiada por ecografía, previa a la intervención quirúrgica.
Discusión
Las NSSP son definidas por la quinta edición de la Clasificación de Tumores del Aparato Digestivo de la OMS como tumores malignos de bajo grado compuestos por células epiteliales poco cohesionadas que forman estructuras sólidas y pseudopapilares y carecen de una línea específica de diferenciación epitelial pancreática7. Las NSSP son raras: representan alrededor del 1%-3% de todos los tumores quísticos resecados8. Se presentan frecuentemente en mujeres entre la segunda y tercera décadas de la vida, y menos del 10% se diagnostica en hombres1. En nuestra serie, el 80% de las NSSP se presentó en mujeres. Se localizaron principalmente a nivel del cuerpo y cola del páncreas, aunque también puede comprometer la cabeza y el cuello9, datos similares a los encontrados en nuestra serie. El 1%-1,8% de las NSSP tienen localización extrapancreática, principalmente en el retroperitoneo, omento, mesenterio, estómago, duodeno, colon, hígado, glándula suprarrenal, ovario, testículo y pulmón1,10.
No se ha podido establecer con claridad cuáles son las células involucradas en el desarrollo de la NSSP, parecen derivarse de células madre pluripotentes de las crestas genitales que se unen al páncreas durante la embriogénesis11. Se ha relacionado con mutaciones en el cromosoma 11q, el cual contiene material genético para la formación de proteínas como la ciclina D1, FLI-1, CD56 y el receptor de progesterona1,12. A pesar de que la NSSP expresa receptor de progesterona que la hace sensible a hormonas, lo cual podría explicar su prevalencia en mujeres, su rol no se ha probado en la tumorogénesis13. Adicionalmente, hay mutaciones en el exón 3 del gen de la β-catenina, por el cual se activa la vía de señalización Wnt, lo cual se ve potenciado por el gen BCL9, que se encuentra presente en este tipo tumores, y esto aumenta la actividad transcripcional y la oncogénesis (Figura 6)1,12,14.
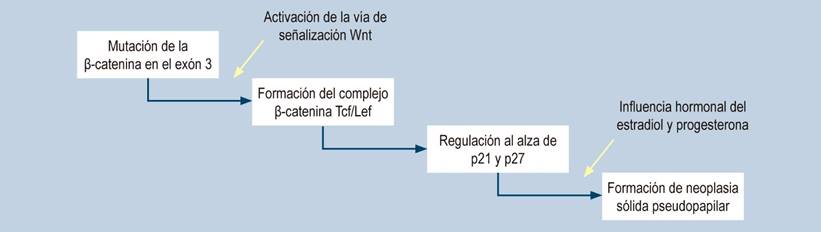
Figura 6 Fisiopatología de la neoplasia sólida pseudopapilar de páncreas1. Modificado de: Lanke G et al. World J Gastrointest Endosc. 2018;10(9):145-155.
La NSSP afecta el tejido exocrino pancreático, el cual se conforma por células acinares, que producen enzimas digestivas; a nivel morfológico son células piramidales que contienen gránulos rodeados por una membrana que contiene tripsinógeno, quimiotripsinógeno, procarboxipeptidasa, proelastasa, calicreinógeno y las profosfolipasas A y B15. Las NSSP suelen componerse de diferentes elementos, tales como zonas hemorrágicas y calcificaciones, y presentan una cápsula fibrosa16. A nivel celular, las vacuolas citoplasmáticas, los núcleos granulares y los glóbulos hialinos pueden estar presentes, lo cual ayuda al diagnóstico, como se observa en la Figura 2A 17,18. Adicionalmente, hay una población celular monomorfa, uniforme, de pequeño a mediano tamaño, sobre un fondo limpio o hemorrágico, y estructuras papilares, como se muestra en la Figura 2B 11. El diagnóstico confirmatorio se realiza a través de estudios inmunohistoquímicos que comprueban principalmente la mutación de la proteína β-catenina, como se puede evidenciar en la Figura 4A 14. El panel de inmunohistoquímica propuesto para el diagnóstico de NSSP es de marcadores positivos para β-catenina y CD99 (patrón puntiforme), y marcadores negativos para cromogranina, tripsina, BCL10 y E-cadherina11. La aspiración con aguja fina (AAF) guiada por USE es útil para el diagnóstico, confirmado por la inmunocitoquímica sobre el bloque celular, la cual sirve para excluir otros tumores pancreáticos19. La biopsia con aguja fina (BAF) guiada por USE tiene la ventaja de proporcionar una muestra de tejido adecuada para una mayor exactitud diagnóstica1. El estudio histopatológico y la inmunohistoquímica permiten evaluar los diagnósticos diferenciales (Tabla 1).
Este tipo de tumor suele tener manifestaciones clínicas inespecíficas, la mayoría de ellas causadas por compresión del tumor al parénquima pancreático normal (Tabla 2)1,20. Cerca del 15% de los pacientes son asintomáticos20.
Tabla 1 Diagnóstico diferencial de neoplasia sólida pseudopapilar de páncreas1
| Adenoma quístico |
| Cistoadenocarcinoma |
| Adenoma microquístico |
| Sarcoma |
| Angiolinfoma |
| Cistoadenocarcinoma de células acinares |
Modificado de: Lanke G et al. World J Gastrointest Endosc. 2018;10(9):145-155.
Tabla 2 Presentación clínica de neoplasia sólida pseudopapilar de páncreas1
| Dolor epigástrico y dorsal |
| Saciedad precoz |
| Distensión abdominal |
| Ictericia |
| Pérdida de peso |
| Náuseas y vómitos |
| Masa abdominal palpable |
Modificado de: Lanke G et al. World J Gastrointest Endosc. 2018;10(9):145-155.
Los estudios de imágenes que se pueden realizar son ultrasonografía, TAC y RMN de abdomen con contraste (Tabla 3). La TAC y RMN del abdomen tienen una precisión alrededor del 60% para determinar el correcto diagnóstico histológico de las lesiones quísticas del páncreas. Adicionalmente, son un medio diagnóstico que ayuda a diferenciar lesiones agresivas de las no agresivas en un 75% a 90% de los casos21. Uno de los elementos en común que se puede apreciar en las imágenes diagnósticas es una lesión encapsulada, con componentes sólido y quístico, hemorragia intramural, cápsula fibrosa y eventualmente calcificaciones22. Se debe considerar como principal diagnóstico diferencial la NSSP cuando se evidencia una gran masa a nivel del cuerpo o cola del páncreas, de contornos definidos con porciones sólidas y quísticas sin tabiques internos21,23. En un estudio se encontró que, en las imágenes de tomografía computarizada multicorte, los hombres generalmente tienen lesiones más pequeñas con mayor componente sólido y calcificaciones, en comparación con las mujeres24.
Tabla 3 Hallazgos de neoplasia sólida pseudopapilar de páncreas según el estudio imagenológico21
| USE | TAC | RMN |
|---|---|---|
| Masa circunscrita bien delimitada con cápsula fibrosa. | Masa encapsulada con contornos definidos con componente sólido o quístico. | Permite una mejor visualización de la cápsula y de la extensión tumoral. |
| Efecto de masa que comprime diferentes estructuras con alta ecogenicidad. | Cuando el tumor es de características quísticas puede variar el grado de atenuación según la extensión de la necrosis hemorrágica contenida en el quiste. | En T1: se observa una cápsula fibrosa hipointensa con hemorragia interna de alta intensidad. |
| Tumor pequeño con componente sólido. | Tumor con coeficiente de atenuación de 20 a 50 unidades Hounsfield. | En T2: se observa intensidad de señal heterogénea. |
| Tumor grande con componente quístico que muestra un reforzamiento acústico posterior. | El componente quístico varía de tamaño de acuerdo con la extensión de la necrosis, coágulos sanguíneos y tejido necrótico tumoral. Sin embargo, no se asocia con el tamaño del tumor. | Las porciones sólidas son isointensas o hipointensas comparadas con el parénquima pancreático. |
| Masa de baja ecogenicidad con áreas quísticas que sugieren necrosis hemorrágica. | Algunas veces se observan focos hiperintensos en el tumor, lo cual puede corresponder a detritus celulares o áreas de necrosis hemorrágica. | |
| Con medio de contraste se podría evidenciar realce periférico heterogéneo en la fase arterial temprana y un posterior llenado heterogéneo de la lesión en la fase portal. |
Modificado de: Tafur A et al Rev Med. 2017;25(1):70-77.
Es importante diferenciar este tumor de otras neoplasias pancreáticas porque la piedra angular del tratamiento en estos casos es la resección quirúrgica, la cual es curativa en la mayoría de los pacientes25. Existen cinco estudios que comparan el abordaje quirúrgico: cirugía mínimamente invasiva frente a intervención abierta con los diferentes tipos de resección pancreática dependiendo de la localización: pancreatoduodenectomía, pancreatectomía central, pancreatectomía distal o enucleación (Figura 7)26. En los tumores que comprometen el cuerpo o la cola y tienen algún tipo de compromiso vascular se debe realizar una pancreatectomía distal27. En la actualidad, se prefiere realizar este tipo de cirugía con preservación esplénica, debido a que está asociada a menor morbilidad, menos complicaciones infecciosas, menor incidencia de fistula pancreática y menor estancia hospitalaria27-29. Además, se ha documentado un significativo aumento del recuento de plaquetas después de la esplenectomía, lo cual se ha asociado con complicaciones tromboembólicas30. Por último, la preservación esplénica se ha relacionado a largo plazo con una mejor condición general30.
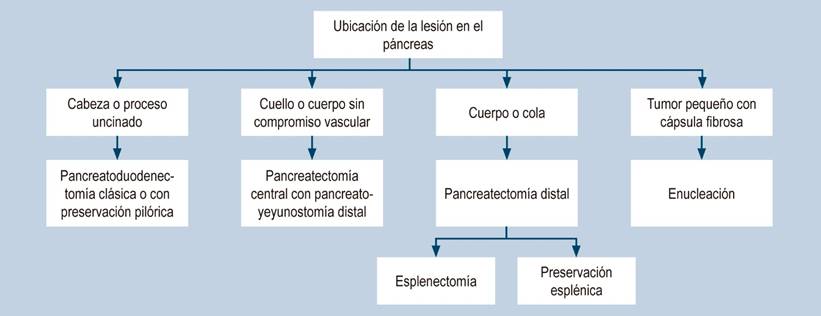
Figura 7 Algoritmo para determinar el tipo de resección pancreática25. Modificado de Liu M et al. Pancreatology. 2019;19(5):681-685.
En lo posible, siempre se debe intentar preservar el bazo, aun cuando el paquete vascular esplénico se encuentre comprometido y deba ligarse. La preservación esplénica se puede lograr mediante pancreatectomía distal con preservación de vasos esplénicos o por la técnica quirúrgica de Warshaw31. esta técnica consiste en ligar la arteria y vena esplénicas conservando la circulación del bazo mediante la preservación de los vasos gástricos cortos y los gastroepiploicos izquierdos32,33. Un metaanálisis que comparó la preservación de vasos esplénicos con la técnica de Warshaw mostró que esta técnica tiene significativamente mayor incidencia de infarto esplénico y várices gástricas/epigástricas, además de que más pacientes con infarto esplénico fueron llevados a esplenectomía, pero no hubo diferencias entre los dos procedimientos en términos de fístula pancreática, morbilidad y estancia hospitalaria31. Asimismo, realizar la preservación esplénica mediante la técnica de Warshaw está asociada a menor morbilidad posoperatoria que la esplenectomía34. Actualmente, se ha demostrado que es preferible la cirugía mínimamente invasiva debido a que esta se asocia con menor tiempo quirúrgico y menor estancia posoperatoria. Sin embargo, no hay diferencias intraoperatorias asociadas a menor pérdida de sangre, requerimientos transfusionales, complicaciones posoperatorias, mortalidad o márgenes de resección quirúrgica35-39.
En la mayoría de los pacientes la enfermedad es localizada, solo 9%-15% tiene una invasión local o metástasis6. La malignidad no se puede predecir fácilmente con base en los hallazgos preoperatorios y los patrones de inmunohistoquímica40. La invasión parenquimatosa profunda en el tejido circundante es la característica patológica más frecuente que sugiere malignidad41, además de márgenes lobulados y discontinuidad focal de la cápsula, patrón de crecimiento exofítico, proporción del componente sólido-quístico y el índice Ki-6740. En un metaanálisis reciente se confirmó que el riesgo de malignidad en la NSSP aumenta con el incremento gradual del índice Ki-6742.
El pronóstico generalmente es bueno. La supervivencia a 5 años es cercana al 97% incluso en presencia de metástasis, lo cual demuestra que es una enfermedad relativamente indolente comparada con otras neoplasias pancreáticas43. Las metástasis se presentan principalmente hacia el hígado o peritoneo. Las alteraciones moleculares encontradas en NSSP con metástasis son mutaciones con activación de CTNNB1 e inactivación de reguladores epigenéticos como KDM6A, TET1 y BAP144.
La recurrencia luego de la resección quirúrgica de NSSP no metastásica es del 2%. Los principales factores de riesgo de recurrencia son: hombres (odds ratio [OR]: 1,96), ganglios linfáticos positivos (OR: 11,9), márgenes R1 (OR: 11,1) e invasión linfovascular (OR: 5,5), todos con p < 0,0545. Adicionalmente, el tamaño del tumor (> 5 cm) y las metástasis sincrónicas se han asociado a recurrencia46. No hay un sistema de clasificación específico para predecir los resultados en NSSP. A pesar de que existen muchos factores, no se ha podido consolidar un elemento determinante relacionado con la recurrencia47. Recientemente se han encontrado similitudes fisiopatológicas entre los TNE pancreáticos y las NSSP, con la asociación del índice Ki-67 como un factor que podría reflejar la recurrencia48,49. El índice Ki-67, un antígeno que se ha utilizado para estudiar la velocidad de crecimiento tumoral, fue introducido por la OMS en 2017 para TNE pancreáticos47. Se ha incorporado el grado del tumor (Tabla 4), según el índice Ki-67 en TNE pancreáticos, a las NSSP como un estudio histopatológico clave para estudiar las tasas de crecimiento tumoral48,49. Zou y colaboradores realizaron un estudio en el que relacionaron el grado del tumor acorde al índice Ki-67 y el tamaño de la lesión con la recurrencia posterior a la resección tumoral. El grado basado en Ki-67 fue superior al propuesto por el Comité Estadounidense de Cáncer, quienes propusieron el sistema TNM para evaluar la recurrencia en NSSP42. En un estudio europeo multicéntrico en el cual se incluyeron 149 pacientes a quienes se les resecó completamente una NSSP, se encontró que la realización de AAF guiada por USE preoperatoria no afectó esta recurrencia50.
Tabla 4 Grado del tumor asociado al índice Ki-6747
| Grado 1 | < 3% |
| Grado 2 | 3%-20% |
| Grado 3 | > 20% |
Modificado de: Inzani F et al. Endocrinol Metab Clin North Am 2018;47(3): 463-470.
Finalmente, se presenta un algoritmo para el correcto abordaje diagnóstico, tratamiento y seguimiento de los pacientes con NSSP teniendo en cuenta las manifestaciones clínicas y los estudios complementarios que se dispongan en cada institución (Figura 8)1.
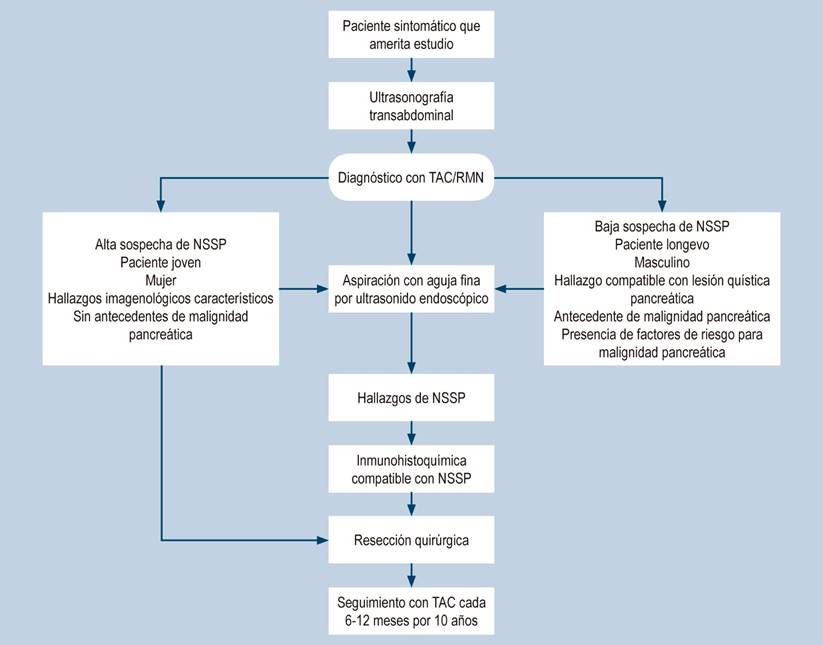
Figura 8 Algoritmo para el diagnóstico, tratamiento y seguimiento de NSSP1. RMN: resonancia magnética nuclear; TAC: tomografía axial computarizada. Modificado de: Lanke G et al. World J Gastrointest Endosc. 2018;10(9):145-155.
Conclusiones
La NSSP es una rara entidad maligna de bajo grado que afecta sobre todo a mujeres jóvenes. El síntoma de presentación puede ser vago, o incluso el paciente puede estar asintomático, por lo que a menudo se diagnostica incidentalmente. Los hallazgos clínicos junto con las imágenes radiológicas y la citología constituyen la base de su diagnóstico. La resección quirúrgica del tumor sigue siendo el pilar de su tratamiento. Se utilizan diferentes métodos quirúrgicos para resecar estos tumores dependiendo de la parte del páncreas afectada, el tamaño del tumor y la extensión de su invasión local.
Agradecimientos
Ninguno declarado por los autores.
REFERENCIAS
1. Lanke G, Ali FS, Lee JH. Clinical update on the management of pseudopapillary tumor of pancreas. World J Gastrointest Endosc. 2018;10(9):145-155. https://doi.org/10.4253/wjge.v10.i9.145 [ Links ]
2. Lichtenstein L. Papillary cystadenocarcinoma of pancreas: case report, with notes on classification of malignant cystic tumors of pancreas. Am J Cancer. 1934;21(3):542-553. https://doi.org/10.1158/ajc.1934.542 [ Links ]
3. Frantz VK. Tumors of the pancreas. En: Frantz VK (editor). Atlas of tumor pathology, vol. 1, no. 27. Washington, DC: US Armed Forces Institute of Pathology; 1959. p. 32-33. [ Links ]
4. Hamoudi AB, Misugi K, Grosfeld JL, Reiner CB. Papillary epithelial neoplasm of pancreas in a child. Report of a case with electron microscopy. Cancer. 1970;26(5):1126-1134. https://doi.org/10.1002/1097-0142(197011)26:5<1126::aid-cncr2820260524>3.0.co;2-k [ Links ]
5. Jena SS, Ray S, Das SAP, Mehta NN, Yadav A, Nundy S. Rare Pseudopapillary Neoplasm of the Pancreas: A 10-Year Experience. Surg Res Pract. 2021;2021:7377991. https://doi.org/10.1155/2021/7377991 [ Links ]
6. Law JK, Ahmed A, Singh VK, Akshintala VS, Olson MT, Raman SP, et al. A systematic review of solid-pseudopapillary neoplasms: are these rare lesions? Pancreas. 2014;43(3):331-337. https://doi.org/10.1097/MPA.0000000000000061 [ Links ]
7. Kloppel G, Basturk O, Klimstra DS, Lam AK, Notohara K. Tumors of Pancreas. En: Gill AJ, Klimstra DS, Lam AK, Washington MK (editores). WHO Classification of Tumours. Digestive System Tumours. 5.a edición. International Agency for Research on Cancer; 2019. p. 283-360. [ Links ]
8. Valsangkar NP, Morales-Oyarvide V, Thayer SP, Ferrone CR, Wargo JA, Warshaw AL, et al. 851 resected cystic tumors of the pancreas: a 33-year experience at the Massachusetts General Hospital. Surgery. 2012;152(3 Suppl 1):S4-S12. https://doi.org/10.1016/j.surg.2012.05.033 [ Links ]
9. Guo T, Wang L, Xie P, Zhang Z, Yu Y. Diagnosis and Surgical Treatment and Pathological Findings of Solid Pseudopapillary Tumor of the Pancreas: A Single-Institution Experience. Cancer Manag Res. 2020;12:581-588. https://doi.org/10.2147/CMAR.S238527 [ Links ]
10. Gurzu S, Bara T, Sincu M, Gabos S, Vlad DM, Bara Jr T, et al. Solid pseudopapillary neoplasm of pancreas: Two case reports. Medicine (Baltimore). 2019;98(29):e16455. https://doi.org/10.1097/MD.0000000000016455 [ Links ]
11. La Rosa S, Bongiovanni M. Pancreatic Solid Pseudopapillary Neoplasm: Key Pathologic and Genetic Features. Arch Pathol Lab Med. 2020;144(7):829-837. https://doi.org/10.5858/arpa.2019-0473-RA [ Links ]
12. Tiemann K, Heitling U, Kosmahl M, Klöppel G. Solid pseudopapillary neoplasms of the pancreas show an interruption of the Wnt-signaling pathway and express gene products of 11q. Mod Pathol. 2007;20(9):955-960. https://doi.org/10.1038/modpathol.3800902 [ Links ]
13. Papavramidis T, Papavramidis S. Solid pseudopapillary tumors of the pancreas: review of 718 patients reported in English literature. J Am Coll Surg. 2005;200(6):965-972. https://doi.org/10.1016/j.jamcollsurg.2005.02.011 [ Links ]
14. Tanaka Y, Kato K, Notohara K, Hojo H, Ijiri R, Miyake T, et al. Frequent beta-catenin mutation and cytoplasmic/nuclear accumulation in pancreatic solid-pseudopapillary neoplasm. Cancer Res. 2001;61(23):8401-8404. [ Links ]
15. Hruban R, Lacobuzio-Donahue C. Pancreas. En: Kumar V, Abbas A, Aster J (editores). Patología Estructural y Funcional. 9.a Edición. España: Elsevier Saunders; 2015. p. 883-896. [ Links ]
16. Santini D, Poli F, Lega S. Solid-papillary tumors of the pancreas: histopathology. JOP 2006;7(1):131-136. [ Links ]
17. Jhala N, Siegal GP, Jhala D. Large, clear cytoplasmic vacuolation: an under-recognized cytologic clue to distinguish solid pseudopapillary neoplasms of the pancreas from pancreatic endocrine neoplasms on fine-needle aspiration. Cancer. 2008;114(4):249-254. https://doi.org/10.1002/cncr.23595 [ Links ]
18. Meriaden Z, Shi C, Edil BH, Ellison T, Wolfgang CL, Cornish TC, et al. Hyaline globules in neuroendocrine and solid- pseudopapillary neoplasms of the pancreas: a clue to the diagnosis. Am J Surg Pathol. 2011;35(7):981-988. https://doi.org/10.1097/PAS.0b013e31821a9a14 [ Links ]
19. Singh P, Kumar P, Rohilla M, Gupta P, Gupta N, Dey P, et al. Fine needle aspiration cytology with the aid of immunocytochemistry on cell-block confirms the diagnosis of solid pseudopapillary neoplasm of the pancreas. Cytopathology. 2021;32(1):57-64. https://doi.org/10.1111/cyt.12838 [ Links ]
20. Dinarvand P, Lai J. Solid Pseudopapillary Neoplasm of the Pancreas: A Rare Entity with Unique Features. Arch Pathol Lab Med. 2017;141(7):990-995. https://doi.org/10.5858/arpa.2016-0322-RS [ Links ]
21. Tafur A, Suarez D. Tumor de Frantz: el tumor de las mujeres jóvenes. Correlación radiológico-patológica de dos casos en tomografía. Revisión de la literatura. Rev Med. 2017;25(1):70-77. https://doi.org/10.18359/rmed.2922 [ Links ]
22. Chung EM, Travis MD, Conran RM. Pancreatic tumors in children: radiologic-pathologic correlation. Radiographics. 2006;26(4):1211-1238. https://doi.org/10.1148/rg.264065012 [ Links ]
23. Escobar MA, Bond BJ, Schopp J. Solid pseudopapillary tumour (Frantz’s tumour) of the pancreas in childhood. BMJ Case Rep. 2014;2014:bcr2013200889. https://doi.org/10.1136/bcr-2013-200889 [ Links ]
24. Shi S, Zhou Y, Hu C. Clinical manifestations and multi-slice computed tomography characteristics of solid pseudopapillary neoplasms of the pancreas between males and females. BMC Med Imaging. 2019;19(1):87. https://doi.org/10.1186/s12880-019-0390-9 [ Links ]
25. Liu M, Liu J, Hu Q, Xu W, Liu W, Zhang Z, et al. Management of solid pseudopapillary neoplasms of pancreas: A single center experience of 243 consecutive patients. Pancreatology. 2019;19(5):681-685. https://doi.org/10.1016/j.pan.2019.07.001 [ Links ]
26. Cai Y, Ran X, Xie S, Wang X, Peng B, Mai G, et al. Surgical Management and Long-Term Follow-Up of Solid Pseudopapillary Tumor of Pancreas: A Large Series from a Single Institution. J Gastrointest Surg. 2014;18(5):935-940. https://doi.org/10.1007/s11605-014-2476-6 [ Links ]
27. Tang CW, Feng WM, Bao Y, Fei MY, Tao YL. Spleen-preserving distal pancreatectomy or distal pancreatectomy with splenectomy?: Perioperative and patient-reported outcome analysis. J Clin Gastroenterol. 2014;48(7):e62-6. https://doi.org/10.1097/MCG.0000000000000021 [ Links ]
28. Shoup M, Brennan MF, McWhite K, Leung DHY, Klimstra D, Conlon KC. The value of splenic preservation with distal pancreatectomy. Arch Surg. 2002;137(2):164-168. https://doi.org/10.1001/archsurg.137.2.164 [ Links ]
29. White SA, Sutton CD, Berry DP, Dennison AR. Value of splenic preservation during distal pancreatectomy for chronic pancreatitis. Br J Surg. 2000;87(1):124. https://doi.org/10.1046/j.1365-2168.2000.01329-7.x [ Links ]
30. Kashuk JL, Moore EE, Johnson JL, Biffl WL, Burlew CC, Barnett C, et al. Progressive postinjury thrombocytosis is associated with thromboembolic complications. Surgery. 2010;148(4):667-674. https://doi.org/10.1016/j.surg.2010.07.013 [ Links ]
31. Li BQ, Qiao YX, Li J, Yang WQ, Guo JC. Preservation or Ligation of Splenic Vessels During Spleen-Preserving Distal Pancreatectomy: A Meta-Analysis. J Invest Surg. 2019;32(7):654-669. https://doi.org/10.1080/08941939.2018.1449918 [ Links ]
32. Matsushima H, Kuroki T, Adachi T, Kitasato A, Hirabaru M, Hidaka M, et al. Laparoscopic spleen-preserving distal pancreatectomy with and without splenic vessel preservation: The role of the Warshaw procedure. Pancreatology. 2014;14(6):530-535. https://doi.org/10.1016/j.pan.2014.09.007 [ Links ]
33. Zhou ZQ, Kim SC, Song KB, Park KM, Lee JH, Lee YJ. Laparoscopic spleen-preserving distal pancreatectomy: comparative study of spleen preservation with splenic vessel resection and splenic vessel preservation. World J Surg. 2014;38(11):2973-2979. https://doi.org/10.1007/s00268-014-2671-3 [ Links ]
34. Tsiouris A, Cogan CM, Velanovich V. Distal pancreatectomy with or without splenectomy: Comparison of postoperative outcomes and surrogates of splenic function. HPB (Oxford). 2011;13(10):738-744. https://doi.org/10.1111/j.1477-2574.2011.00369.x [ Links ]
35. Kang CM, Choi SH, Hwang HK, Lee WJ, Chi HS. Minimally invasive (laparoscopic and robot-assisted) approach for solid pseudopapillary tumor of the distal pancreas: A single-center experience. J Hepatobiliary Pancreat Sci. 2011;18(1):87-93. https://doi.org/10.1007/s00534-010-0316-y [ Links ]
36. Zhang RC, Yan JF, Xu XW, Chen K, Ajoodhea H, Mou YP. Laparoscopic vs open distal pancreatectomy for solid pseudopapillary tumor of the pancreas. World J Gastroenterol. 2013;19(37):6272-6277. https://doi.org/10.3748/wjg.v19.i37.6272 [ Links ]
37. Namgoong JM, Kim DY, Kim SC, Kim SC, Hwang JH, Song KB. Laparoscopic distal pancreatectomy to treat solid pseudopapillary tumors in children: Transition from open to laparoscopic approaches in suitable cases. Pediatr Surg Int. 2014;30(3):259-266. https://doi.org/10.1007/s00383-014-3471-4 [ Links ]
38. Stewart CL, Meguid C, Chapman B, Schulick R, Edil BH. Evolving Trends Towards Minimally Invasive Surgery for Solid-Pseudopapillary Neoplasms. Ann Surg Oncol. 2016;23(13):4165-4168. https://doi.org/10.1245/s10434-016-5491-x [ Links ]
39. Tan HL, Tan EK, Teo JY, Kam JH, Lee SY, Cheow PC, et al. Outcome of minimally-invasive versus open pancreatectomies for solid pseudopapillary neoplasms of the pancreas: A 2:1 matched case-control study. Ann Hepato-Biliary-Pancreatic Surg. 2019;23(3):252-257. https://doi.org/10.14701/ahbps.2019.23.3.252 [ Links ]
40. You L, Yang F, Fu DL. Prediction of malignancy and adverse outcome of solid pseudopapillary tumor of the pancreas. World J Gastrointest Oncol. 2018;10(7):184-193. https://doi.org/10.4251/wjgo.v10.i7.184 [ Links ]
41. Park JK, Cho EJ, Ryu JK, Kim YT, Yoon YB. Natural history and malignant risk factors of solid Pseudopapillary tumors of the pancreas. Postgrad Med. 2013;125(2):92-99. https://doi.org/10.3810/pgm.2013.03.2634 [ Links ]
42. Zou C, Yang F, Wu W, Fu D. Ki-67 and malignancy in solid pseudopapillary tumor of the pancreas: A systematic review and meta-analysis. Pancreatology. 2020;20(4):683-685. https://doi.org/10.1016/j.pan.2020.03.015 [ Links ]
43. Tang LH, Aydin H, Brennan MF, Klimstra DS. Clinically aggressive solid pseudopapillary tumors of the pancreas: A report of two cases with components of undifferentiated carcinoma and a comparative clinicopathologic analysis of 34 conventional cases. Am J Surg Pathol. 2005;29(4):512-519. https://doi.org/10.1097/01.pas.0000155159.28530.88 [ Links ]
44. Amato E, Mafficini A, Hirabayashi K, Lawlor RT, Fassan M, Vicentini C, et al. Molecular alterations associated with metastases of solid pseudopapillary neoplasms of the pancreas. J Pathol. 2019;247(1):123-134. https://doi.org/10.1002/path.5180 [ Links ]
45. Yepuri N, Naous R, Meier AH, Cooney RN, Kittur D, Are C, et al. A systematic review and meta-analysis of predictors of recurrence in patients with Solid Pseudopapillary Tumors of the Pancreas. HPB (Oxford). 2020;22(1):12-19. https://doi.org/10.1016/j.hpb.2019.06.005 [ Links ]
46. Gao H, Gao Y, Yin L, Wang G, Wei J, Jiang K, et al. Risk factors of the recurrences of pancreatic solid pseudopapillary tumors: A systematic review and meta-analysis. J Cancer. 2018;9(11):1905-1914. https://doi.org/10.7150/jca.24491 [ Links ]
47. Inzani F, Petrone G, Rindi G. The New World Health Organization Classification for Pancreatic Neuroendocrine Neoplasia. Endocrinol Metab Clin North Am. 2018;47(3):463-470. https://doi.org/10.1016/j.ecl.2018.04.008 [ Links ]
48. Yang F, Jin C, Long J, Yu XJ, Xu J, Di Y, et al. Solid pseudopapillary tumor of the pancreas: a case series of 26 consecutive patients. Am J Surg. 2009;198(2):210-215. https://doi.org/10.1016/j.amjsurg.2008.07.062 [ Links ]
49. Kim EK, Jang M, Park M, Kim H. LEF1, TFE3, and AR are putative diagnostic markers of solid pseudopapillary neoplasms. Oncotarget. 2017;8(55):93404-93413. https://doi.org/10.18632/oncotarget.21854 [ Links ]
50. Karsenti D, Caillol F, Chaput U, Perrot B, Koch S, Vuitton L, et al. Safety of Endoscopic Ultrasound-Guided Fine-Needle Aspiration for Pancreatic Solid Pseudopapillary Neoplasm before Surgical Resection: A European Multicenter Registry-Based Study on 149 Patients. Pancreas. 2020;49(1):34-38. https://doi.org/10.1097/MPA.0000000000001460 [ Links ]
Citación: Padrón-Pardo O, Salamanca-Chaparro W, González-Salebe V, Gutiérrez-Arias P, Ramírez-Moreno J, Lúquez-Mindiola A. Neoplasia sólida pseudopapilar de páncreas: una serie de cinco casos y revisión de la literatura. Revista. colomb. Gastroenterol. 2022;37(4):466-477. https://doi.org/10.22516/25007440.840
Recibido: 21 de Octubre de 2021; Aprobado: 14 de Enero de 2022











 text in
text in