Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista colombiana de Gastroenterología
versión impresa ISSN 0120-9957versión On-line ISSN 2500-7440
Rev. colomb. Gastroenterol. vol.37 no.4 Bogotá oct./dic. 2022 Epub 12-Jul-2023
https://doi.org/10.22516/25007440.846
Reporte de caso
Síndrome de Budd-Chiari secundario asociado a hepatitis alcohólica grave: reporte de caso
1Surgeon. Resident, Gastroenterology Service, Hospital Víctor Lazarte Echegaray. Trujillo, Perú.
2Gastroenterology specialist. Gastroenterologist, Gastroenterology Service, Hospital Víctor Lazarte Echegaray. Trujillo, Perú.
La hepatitis alcohólica es la inflamación aguda del hígado secundaria al consumo de alcohol en cantidades hepatotóxicas, su fisiopatología está influida por diversos factores asociados. El diagnóstico tiene tres escenarios: la hepatitis alcohólica probable, posible y definitiva. La hepatitis alcohólica probable se basa en el cumplimiento de criterios diagnósticos clínicos y laboratoriales; la hepatitis alcohólica posible corresponde a casos de cumplimiento de estos criterios, pero con presencia de factores potencialmente confusores del diagnóstico, y la definitiva se sustenta sobre una base histopatológica. El síndrome de Budd-Chiari es una entidad poco frecuente, heterogénea y potencialmente letal, caracterizada por la presencia de trombos a nivel de las venas suprahepáticas, así como de la vena cava inferior. El diagnóstico definitivo está basado en pruebas de imagen. Por su parte, el síndrome de Budd-Chiari secundario es una entidad aún más infrecuente, poco estudiada, cuyo diagnóstico es difícil debido a su gran similitud al síndrome de Budd-Chiari primario, tanto clínica como en imágenes diagnósticas, por lo que se tiene que acudir a métodos diagnósticos de mayor complejidad e incluso invasivos. A continuación, se presenta un caso inusual de un paciente con consumo crónico de alcohol que presenta síndrome de Budd-Chiari secundario asociado a hepatitis alcohólica grave confirmada mediante biopsia hepática y sometido a múltiples estudios de imagen que descartaron la presencia de trombosis a nivel de las venas suprahepáticas.
Palabras clave: Hepatitis alcohólica; síndrome de Budd-Chiari; síndrome de Budd-Chiari secundario
Alcoholic hepatitis is an acute inflammation of the liver secondary to the consumption of alcohol in hepatotoxic amounts; various associated factors influence its pathophysiology. The diagnosis has three scenarios: probable, possible, and definite alcoholic hepatitis. Probable alcoholic hepatitis is based on compliance with clinical and laboratory diagnostic criteria; possible alcoholic hepatitis corresponds to cases that meet these criteria but with potentially confounding factors in the diagnosis, and the definite one is based on histopathology. Budd-Chiari syndrome is a rare, heterogeneous, potentially lethal entity characterized by thrombi in the suprahepatic veins and the inferior vena cava. The final diagnosis relies on imaging tests. Moreover, secondary Budd-Chiari syndrome is an even rarer entity, little studied, whose diagnosis is difficult due to its remarkable similarity to primary Budd-Chiari syndrome, both clinically and in diagnostic images, for which more complex and even invasive diagnostic methods must be used. Then, we describe an unusual case of a male patient with chronic alcohol consumption presenting with secondary Budd-Chiari syndrome associated with severe alcoholic hepatitis confirmed by liver biopsy and subjected to multiple imaging studies that ruled out thrombosis in the suprahepatic veins.
Keywords: Alcoholic hepatitis; Budd-Chiari syndrome; secondary Budd-Chiari syndrome
Introducción
La hepatitis alcohólica es la inflamación aguda del hígado secundaria al consumo de alcohol en cantidades hepatotóxicas y cuya fisiopatología se ve influida por diversos factores de riesgo. En promedio, afecta a personas en la cuarta y quinta década de vida, principalmente varones; sin embargo, en años recientes, se ha descrito un aumento en la incidencia de hepatitis alcohólica en mujeres y en pacientes jóvenes de ambos sexos, con edades entre 15 a 44 años1.
Esta patología está asociada al consumo superior a 50 gramos de etanol por día, en un lapso menor a cuatro semanas previas, en un paciente con consumo crónico de alcohol por un período mayor a seis meses. Puede afectar a pacientes sin patologías de fondo, pero también a pacientes con enfermedades hepáticas crónicas, desde la esteatosis hasta la cirrosis hepática, y puede producir casos de falla hepática aguda y falla hepática aguda sobre crónica (acute-on-chronic liver failure, ACLF), ambas con pronósticos sombríos1,2.
El diagnóstico de hepatitis alcohólica está definido por la presencia de criterios basados en una adecuada anamnesis, examen físico integral y exhaustivo, exámenes serológicos e imagenológicos compatibles. No obstante, el diagnóstico definitivo es histopatológico mediante biopsia hepática3.
El síndrome de Budd-Chiari es una entidad rara, heterogénea y potencialmente letal, caracterizada por la presencia de trombosis a nivel de venas suprahepáticas (derecha, media y/o izquierda), que involucra el trayecto de estas, y la posibilidad de afectación de la vena cava inferior (VCI)4. El diagnóstico oportuno es imprescindible, para lo cual el Doppler venoso ecográfico es el examen diagnóstico de primera línea5; sin embargo, la angiografía por resonancia magnética ha demostrado mayor sensibilidad (93%) y un área bajo la curva de 90,8%, comparada con 88,4% y 86,6% de la angiografía por tomografía computarizada y del Doppler venoso ecográfico, respectivamente6.
Existe una identidad similar, denominada síndrome de Pseudo-Budd-Chiari, que fue descrita por primera vez en 1977 y es poco conocida y estudiada. Hay una escasez de estudios científicos que lo aborden y su fisiopatología no es clara. El diagnóstico es difícil debido a su gran similitud con el síndrome de Budd-Chiari, tanto clínicamente como por estudios imagenológicos, por lo que se debe recurrir a métodos diagnósticos invasivos como la biopsia hepática7.
Recientemente, el último consenso de Baveno VII considera el síndrome de Budd-Chiari como secundario cuando el mecanismo de acción de la obstrucción venosa suprahepática está asociado con una compresión extrínseca, por ejemplo, por tumoraciones benignas, malignas o ya sea otro tipo de entidades que involucren el parénquima hepático y se encuentren adyacentes al territorio de las venas suprahepáticas. Por otro lado, el síndrome de Budd-Chiari es considerado como primario en casos en los cuales su fisiopatología está asociada puramente a trombosis de venas suprahepáticas, como se le conoce originalmente8.
Presentación del caso
Paciente masculino de 51 años, conductor de transporte pesado, con sobrepeso y antecedente de consumo de alcohol por más de 20 años (> 60 g/día), quien tras un episodio de consumo excesivo de alcohol (> 360 g en 10 horas) estuvo enfermo durante 15 días y presenta: aparición de ictericia en las escleras y la piel con notable progresión, distensión abdominal asociada a dolor en el hipocondrio derecho y posterior aparición de edema en los miembros inferiores. En el examen se evidencia hepatoesplenomegalia dolorosa a la palpación, ascitis a gran volumen, edema de miembros inferiores (+++/+++), ictericia en la piel y las escleras (+++/+++). Neurológicamente, el paciente se encuentra lúcido y orientado en tiempo, espacio y persona.
Los exámenes tomados al paciente en el ingreso se muestran en la Tabla 1. El estudio de líquido ascítico resultó no patológico en relación con los procesos infecciosos. El gradiente de albúmina sérica y de líquido ascítico (GASA) tuvo un valor de 2,11. Los cultivos de líquido ascítico, orina, y hemocultivos I y II fueron negativos.
Tabla 1 Analítica laboratorial de ingreso
| BT | 12,59 |
| BD | 7,53 |
| FA | 595 |
| GGTP | 817 |
| TGO | 159 |
| TGP | 74 |
| Proteínas totales y albúmina | PT: 5,93; Alb: 2,9; Globulinas: 2,9 |
| Leucocitos | L: 19.200; S: 88%; Ab: 2% |
| Hemoglobina | 8,9 g/dL |
| Plaquetas | 406.000 |
| INR-TP/TPT | 1,4-16/46 |
| Lámina periférica | Serie blanca: neutrofilia, linfocitos reactivos 2% |
| Serie roja: normocítica normocrómica | |
| Serie plaquetaria: algunas macroplaquetas | |
| Coombs (D e I) | Negativos |
| Creatinina/Urea | 0,68 mg/dL/15 |
| PCR | 65 |
| PCT | 0,4 |
| AFP | 8,3 |
| Anti-HCV | No reactivo |
| HBs-Ac | No reactivo |
| HB-Ac core | No reactivo |
| HBsAg | No reactivo |
| Estudio de líquido ascítico | 101 cel/mm3; mononucleares: 88%; Alb: 0,79 g/dL; LDH: 55 U/L; proteínas: 1,5 g/dL |
Ab: abastonados; AFP: alfafetoproteína; Alb: albúmina; Anti-HCV: anticuerpos contra el virus de la hepatitis C; BD: bilirrubina directa; BT: bilirrubina total; FA: fosfatasa alcalina; GGTP: gamma glutamil transpeptidasa; HBs-Ac: anticuerpo específico dirigido contra el antígeno de superficie del virus de la hepatitis B; HB-Ac core: anticuerpo core total de virus de hepatitis B; HBs-Ag: antígeno de superficie del virus de la hepatitis B; INR-TP: tiempo de protrombina con índice internacional normalizado; L: leucocitos; PCR: proteína C-reactiva; PCT: procalcitonina; PT: proteínas totales; S: segmentados; TGO: aspartato-aminotransferasa; TGP: alanina-aminotransferasa; TPT: tiempo parcial de tromboplastina. Fuente: Servicio de Patología Clínica, Hospital Víctor Lazarte Echegaray.
El paciente fue sometido a una endoscopía digestiva alta, la cual reveló la presencia de gastropatía hipertensiva portal leve y ausencia de várices esofágicas o gástricas; la colonoscopia evidenció únicamente la presencia de hemorroides internas congestivas de tamaño mediano, sin otras lesiones agregadas. La ecografía abdominal confirmó la hepatoesplenomegalia y determinó la presencia de líquido libre en abundancia en la cavidad abdominal. Se realizó una ecografía Doppler de la vena porta y las venas suprahepáticas, que evidenció la vena suprahepática izquierda de calibre de 8,4 mm y flujo visible, la vena suprahepática media filiforme de 4 mm con flujo visible y la vena suprahepática derecha de 9,4 mm con flujo ausente; esto sugiere la presencia probable de trombosis y tiene relación con un probable síndrome de Budd-Chiari.
Por lo anterior, se decidió realizar una angiografía venosa por resonancia magnética, la cual evidenció el adelgazamiento de la vena suprahepática derecha con un calibre irregularmente adelgazado de hasta 3 mm, compatible con una probable trombosis y ausencia del vacío de la señal proximal a la VCI, trayectos adelgazados y filiformes de la vena suprahepática izquierda y la porción proximal de la vena suprahepática media, lo que sugiere una probable trombosis parcial; la vena porta con calibre de 13 mm, sin signos de trombosis. El informe radiológico de la angiografía venosa por resonancia magnética encontró la vena porta con un trayecto conservado y un afinamiento de las venas suprahepáticas, lo que sugiere un probable síndrome de Budd-Chiari (Figuras 1 y 2).
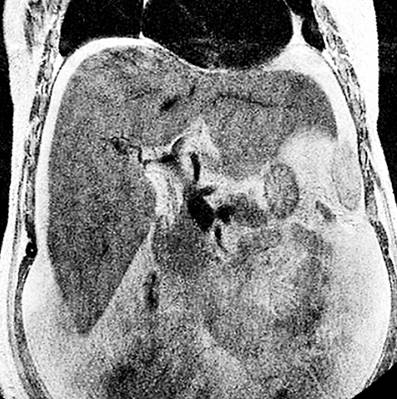
Figura 1 Afinamiento de las venas suprahepáticas (MRI). Fuente: Servicio de Radiología, Hospital Víctor Lazarte Echegaray.
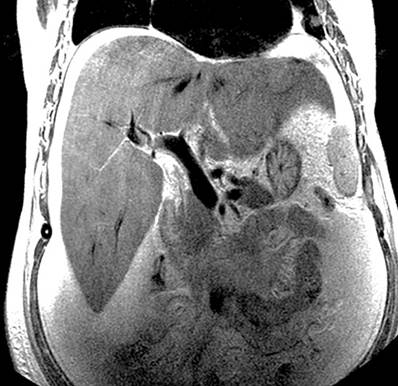
Figura 2 Afinamiento de las venas suprahepáticas y vena porta de calibre conservado (MRI). Fuente: Servicio de Radiología, Hospital Víctor Lazarte Echegaray.
Se realizó la biopsia hepática percutánea guiada por ecografía. La muestra estuvo constituida por 15 espacios porta; el informe histopatológico encontró un parénquima hepático caracterizado por edema de hepatocitos, presencia de cuerpos de Mallory-Denk, cuerpos acidófilos (apoptóticos), de localización predominantemente de la zona 3, asociados a inflamación mixta (inflamación portal moderada y hepatitis de interfase moderada), presencia de necrosis en parche de 2 a 4 focos/10x, esteatosis macrovesicular en un 60%, presencia de fibrosis difusa con formación de puentes porta-vena centrolobulillar, sin signos de colestasis ni signos congestivos en la microvasculatura sinusoidal; estos hallazgos son compatibles con el diagnóstico de esteatohepatitis alcohólica, no cirrótica, con fibrosis Ishak grado 3 (Figuras 3, 4 y 5). Por esta razón, se confirmó la ausencia de criterios histopatológicos definitivos de síndrome de Budd-Chiari. Se calcularon los puntajes de Maddrey’s discriminant function o índice de Maddrey (32,6 puntos), Model for End-Stage Liver Disease (MELD) (21 puntos) y Glasgow Alcoholic Hepatitis Score (GAHS) (8,7 puntos) y se definió el diagnóstico de hepatitis alcohólica severa.
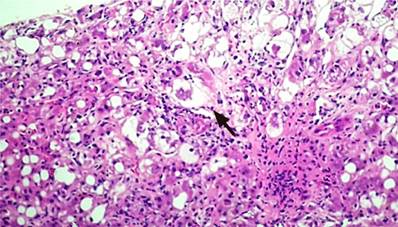
Figura 3 Esteatosis macrovesicular y edema de hepatocitos. Cuerpo de Mallory-Denk (flecha). Fuente: Servicio de Anatomopatología, Hospital Víctor Lazarte Echegaray.
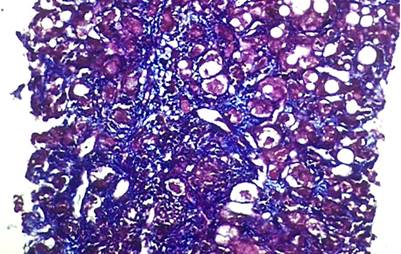
Figura 4 Tinción tricrómica de Masson: fibrosis en puentes. Fuente: Servicio de Anatomopatología, Hospital Víctor Lazarte Echegaray.
Se inició un tratamiento basado en corticoides: prednisona 40 mg/día por vía oral con un esquema planteado de 28 días y N-acetilcisteína 100 mg/kg/día por cinco días por vía endovenosa; no se administraron anticoagulantes. Como control de respuesta al tratamiento basado en corticoides se determinó el puntaje de Lille al séptimo día, el cual reveló un valor de 0,08 (menor a 0,45); por esta razón, se decidió continuar con el esquema planteado de 28 días a base de corticoides.
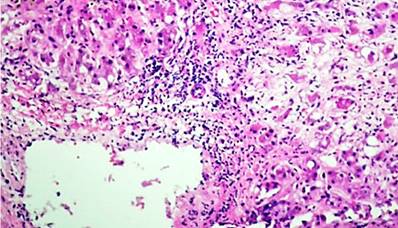
Figura 5 Infiltrado inflamatorio, esteatosis macrovesicular. Fuente: Servicio de Anatomopatología, Hospital Víctor Lazarte Echegaray.
Tras 28 días de culminado el esquema, la analítica de control evidenció una mejoría (Tabla 2) paralela a una buena evolución clínica. El paciente fue dado de alta a los 33 días de estancia hospitalaria en su estado basal de persona independiente (que realiza por sí mismo sus actividades cotidianas y de cuidado personal sin ayuda de otra persona), con un óptimo estado funcional.
Tabla 2 Analítica de control
| BT | 3 |
| BD | 1,6 |
| FA | 620 |
| GGTP | 430 |
| TGO | 109 |
| TGP | 56 |
| Proteínas totales y albúmina | PT: 5,3; Alb: 3,1; Alb/Glob: 1,2 |
| Leucocitos | 12.500 |
| Hemoglobina | 9,8 |
| Plaquetas | 260.000 |
| INR-TP/TPT | 1,3-15/43 |
| Creatinina | 0,5 |
| Urea | 22 |
Fuente: Servicio de Patología Clínica, Hospital Víctor Lazarte Echegaray.
Discusión
El diagnóstico de hepatitis alcohólica tiene tres escenarios: la hepatitis alcohólica probable, posible y definitiva. La probable se basa en el cumplimiento de criterios diagnósticos como: aparición reciente o empeoramiento de la ictericia con o sin ascitis, así como con o sin encefalopatía, asociados al consumo de alcohol en dosis hepatotóxicas (mayores a 50 g/día) en un lapso menor a cuatro semanas previas por parte de una persona que consume alcohol de forma crónica por más de seis meses. Asimismo, hallazgos serológicos como: bilirrubina total mayor a 3 mg/dL, GOT y GPT mayores de 50 UI/L y menores de 400 UI/L, cociente AST/ALT mayor a 2, GGTP mayor a 100 U/L, albúmina sérica menor a 3g/dL, INR mayor a 1,5, leucocitosis mayor a 12.000 asociada a neutrofilia, grados variables de anemia o trombocitopenia en casos de cirrosis. Todo lo mencionado anteriormente sin la presencia de factores potencialmente confusores del diagnóstico presuntivo1,3.
La hepatitis alcohólica posible se identifica cuando se cumplen los criterios señalados, pero con la presencia de factores potencialmente confusores como en el presente caso: la posibilidad de síndrome de Budd-Chiari concomitante con hepatitis alcohólica.
Finalmente, la hepatitis alcohólica definitiva se identifica por la presencia de hallazgos histopatológicos hepáticos confirmatorios como: presencia de infiltración de células inflamatorias a nivel portal y periportal, con ciertos grados de fibrosis, esteatosis macro o microvesicular con balonización de hepatocitos, megamitocondrias y cuerpos de Mallory-Denk como hallazgos patognomónicos de hepatitis alcohólica.
La entidad conocida como síndrome de Pseudo-Budd-Chiari fue descrita por primera vez en 19777. A diferencia del síndrome de Budd-Chiari, caracterizado por la presencia de trombosis de venas suprahepáticas, este síndrome presenta hallazgos clínicos e imagenológicos muy similares, pero en biopsias o autopsias no se logra demostrar la presencia de trombosis de las venas suprahepáticas, ni hallazgos histopatológicos hepáticos compatibles con el síndrome7.
Janssen y colaboradores, en el estudio que realizaron en 2002, describieron tres casos de pacientes con enfermedad hepática alcohólica descompensada que contaban con ecografías de Doppler venoso con una disminución del flujo de las venas suprahepáticas, pero con angiografías directas sin trombos en su luz; finalmente, estos pacientes fueron sometidos a una biopsia hepática sin hallazgos histopatológicas congestivos debido a una probable asociación con un síndrome de Budd-Chiari relacionado con el diagnóstico inicialmente planteado9.
Resultados similares fueron encontrados por Robles-Medranda y colaboradores, quienes en el estudio que realizaron en 2006, basado en el síndrome de Pseudo-Budd-Chiari asociado a esteatohepatitis alcohólica y cirrosis hepática, concluyeron que las imágenes en las que se encontraba una disminución del flujo a nivel de las venas suprahepáticas, probablemente relacionada con el síndrome de Budd-Chiari, eran producidas por una compresión extrínseca de su luz asociada al parénquima hepático aumentado de volumen como consecuencia de un patrón inflamatorio vasto debido a la esteatohepatitis alcohólica y no por la presencia de trombos intraluminales; por esta razón, no se consideró la anticoagulación dentro de la terapia prescrita10.
De igual manera, Sheth y colaboradores, en el estudio que realizaron en 2014, reportaron un caso de esteatohepatitis alcohólica enmascarada por un probable síndrome de Budd-Chiari. Tras la biopsia hepática, concluyeron que la compresión mecánica que ejerce el mismo parénquima hepático sobre las venas suprahepáticas está asociada al vasto infiltrado inflamatorio a base neutrófilos y demás células inflamatorias, por lo que se destaca una potencial reversibilidad de este cuadro con tratamiento médico basado en la administración de corticoides, sin necesidad de anticoagulación11.
Por último, hay que resaltar que recientemente en el consenso de Baveno VII, realizado en 2021 y publicado en 2022, se considera esta entidad como síndrome de Budd-Chiari secundario debido a que el mecanismo de acción de la obstrucción venosa está asociado a una compresión extrínseca, como se ha mencionado anteriormente, la cual puede darse, por ejemplo, por un tumor benigno o maligno. Sin embargo, podemos extrapolar esta denominación a casos en los cuales la compresión extrínseca se dé por causas compresivas como un parénquima hepático inflamado severamente, como puede ocurrir en casos de hepatitis alcohólica severa8.
Conclusión
En el caso presentado, la hepatitis alcohólica severa está asociada a características de imágenes sugestivas de síndrome de Budd-Chiari, lo que crea una confusión en el diagnóstico y posterior manejo del paciente. Llegar al diagnóstico de un síndrome de Budd-Chiari secundario requiere, en casos como el presente, acceder a métodos de mayor complejidad o invasivos tales como la biopsia hepática. Por esta razón, es necesaria mayor evidencia científica en miras de diferenciar oportunamente ambas entidades y esclarecer con base científica la mejor conducta diagnóstica y terapéutica en este tipo de pacientes.
REFERENCIAS
1. Singal A, Bataller R, Ahn J, Kamath P, Shah V. ACG Clinical Guideline: Alcoholic Liver Disease. Am J Gastroenterol. 2018;113(2):175-94. https://doi.org/10.1038/ajg.2017.469 [ Links ]
2. Arab J, Roblero J, Altamirano J, Bessone F, Chaves-Araujo R, Higuera-De la Tijera F, et al. Alcohol-related liver disease: Clinical practice guidelines by the Latin American Association for the Study of the Liver (ALEH). Ann Hepatol. 2019;18(3):518-35. https://doi.org/10.1016/j.aohep.2019.04.005 [ Links ]
3. European Association for the Study of the liver. EASL Clinical Practice Guidelines: Management of alcohol-related liver disease. J Hepatol. 2018;69(1):154-81. https://doi.org/10.1016/j.jhep.2018.03.018 [ Links ]
4. Shin N, Kim Y, Xu H, Shi H, Zhang Q, Colon-Pons J, et al. Redefining Budd-Chiari syndrome: A systematic review. World J Hepatol 2016;8(16):691-702. https://doi.org/10.4254/wjh.v8.i16.691 [ Links ]
5. European Association for the Study of the liver. EASL Clinical Practical Guidelines: Vascular diseases of the liver. J Hepatol. 2016;64(1):179-202. https://doi.org/10.1016/j.jhep.2015.07.040 [ Links ]
6. Gupta P, Bansal V, Kumar-M P, Sinha SK, Samanta J, Mandavdhare H, et al. Diagnostic accuracy of Doppler ultrasound, CT and MRI in Budd Chiari syndrome: systematic review and meta-analysis. Br J Radiol. 2020;93(1109):20190847. https://doi.org/10.1259/bjr.20190847 [ Links ]
7. Dhawan V, Sziklas J, Spencer R. Pseudo-Budd-Chiari Syndrome. Clin Nucl Med. 1978;3(1):30-1. https://doi.org/10.1097/00003072-197801000-00009 [ Links ]
8. de Franchis R, Bosch J, Garcia-Tsao G, Reiberger T, Ripoll C; Baveno VII Faculty. Baveno VII - Renewing consensus in portal hypertension. J Hepatol. 2022;76(4):959-74. https://doi.org/10.1016/j.jhep.2021.12.022 [ Links ]
9. Janssen H, Tan A, Tilanus H, Metselaar H, Zondervan P, Schalm S. Pseudo-Budd-Chiari Syndrome: decompensated alcoholic liver disease mimicking hepatic venous outflow obstruction. Hepatogastroenterology. 2002;49(45):810-2. [ Links ]
10. Robles-Medranda C, Lukashok H, Biccas B, Pannain V, Fogaça H. Budd-Chiari like syndrome in decompensated alcoholic steatohepatitis and liver cirrhosis. World J Gastroenterol. 2006;12(40):6564-66. https://doi.org/10.3748/wjg.v12.i40.6564 [ Links ]
11. Sheth S, Shah A, Alkhateeb A, Patel R, Baddoura W, Dacosta T. Alcoholic Hepatitis Masquerading as Budd-Chiari Syndrome. Am J of Gastro. 2014;109:S168-S169. https://doi.org/10.14309/00000434-201410002-00576 [ Links ]
Citación: Díaz-Rodríguez JJ, Quiroz-Leyva JJ. Síndrome de Budd-Chiari secundario asociado a hepatitis alcohólica grave: reporte de caso. Revista. colomb. Gastroenterol. 2022;37(4):489-494. https://doi.org/10.22516/25007440.846
Recibido: 09 de Noviembre de 2021; Aprobado: 08 de Abril de 2022











 texto en
texto en 



