Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista colombiana de Gastroenterología
Print version ISSN 0120-9957On-line version ISSN 2500-7440
Rev. colomb. Gastroenterol. vol.38 no.1 Bogotá Jan./Mar. 2023 Epub June 06, 2023
https://doi.org/10.22516/25007440.929
Trabajos originales
Mutación del gen KRAS en pacientes llevados a resecciones hepáticas por cáncer colorrectal. ¿Hay ventaja en las resecciones anatómicas?
1General Surgeon, Specialist in Training in Oncological Surgery, Instituto Nacional de Cancerología (National Cancer Institute). Bogotá, Colombia.
2Specialist in Gastrointestinal Surgery and Digestive Endoscopy, National Cancer Institute. Bogotá, Colombia.
3Specialist in Hepatobiliary Surgery, National Cancer Institute. Full professor, Universidad Nacional de Colombia. Bogotá, Colombia.
Introducción:
se han descrito varios factores para realizar una evaluación pronóstica de los pacientes con metástasis hepáticas por cáncer colorrectal y definir el beneficio en el manejo quirúrgico del compromiso metastásico; uno de estos factores es el estado del gen KRAS, debido a que su mutación está relacionada con peores desenlaces. El objetivo de este estudio es describir los desenlaces para una serie retrospectiva de pacientes después de resecciones hepáticas por metástasis de cáncer colorrectal en relación con el estado del gen KRAS.
Metodología:
cohorte retrospectiva de pacientes llevados a metastasectomía hepática por cáncer colorrectal con estudio de mutación KRAS durante el período 2009-2013, en el Instituto Nacional de Cancerología en Colombia. Se realizaron análisis de supervivencia a 5 años (global y libre de enfermedad) según el estado de mutación KRAS y según el tipo de resección hepática realizada mediante el método de Kaplan-Meier.
Resultados:
se analizaron a 35 pacientes llevados a metastasectomía hepática, de los cuales el 42,8% presentaba mutación del gen KRAS. La supervivencia global media fue de 34,2 meses para los pacientes con KRAS mutado y de 46,5 para los no mutados. La supervivencia media para los pacientes con KRAS mutado con resecciones anatómicas fue de 43,5 meses frente a 23,5 meses en los que se realizaron resecciones no anatómicas.
Conclusiones:
realizar resecciones anatómicas durante la metastasectomía hepática en los pacientes con KRAS mutado podría estar asociado con una mejoría en la supervivencia global. Se requiere continuar en la construcción de la evidencia que permita una adecuada toma de decisiones de los pacientes con KRAS mutado que serán llevados a resecciones hepáticas.
Palabras clave: Cáncer colorrectal; metástasis hepáticas; metastasectomía; mutación KRAS
Introduction:
Several factors have been described to make a prognostic assessment of patients with liver metastases due to colorectal cancer and to define the benefit of the surgical management of metastatic involvement; one of these factors is the status of the KRAS gene since its mutation is associated with worse outcomes. This study aims to describe the outcomes for a retrospective series of patients after liver resections for metastatic colorectal cancer concerning KRAS gene status.
Materials and methods:
The study involves a retrospective cohort of patients undergoing liver metastasectomy for colorectal cancer with KRAS mutation study from 2009-2013 at the National Institute of Cancerology in Colombia. Five-year survival analyses (overall and disease-free) were performed according to KRAS mutation status and the type of liver resection performed using the Kaplan-Meier estimate.
Results:
35 patients undergoing liver metastasectomy were analyzed, of which 42.8% had KRAS gene mutation. Median overall survival was 34.2 months for patients with KRAS- mutant and 46.5 for non-mutant. The median survival for KRAS-mutant patients with anatomic resections was 43.5 months versus 23.5 months for nonanatomic resections.
Conclusions:
Performing anatomic resections during liver metastasectomy in patients with KRAS mutants could be associated with an improvement in overall survival. It is necessary to continue building the evidence for adequate decision-making in patients with KRAS mutants who will undergo liver resections.
Keywords: Colorectal cancer; liver metastases; metastasectomy; KRAS mutation
Introducción
El cáncer colorrectal para 2020 ocupó el tercer lugar en incidencia, con un 9,5% de los nuevos casos por cáncer, y el cuarto en mortalidad a nivel mundial1. Entre el 20% y el 25% de los pacientes con cáncer colorrectal tienen enfermedad metastásica hepática al momento del diagnóstico y otro 50% la desarrolla en un escenario metacrónico2,3; para estos pacientes, la media de supervivencia raramente excede de un año, con un rango entre 3,8 y 21 meses sin tratamiento2.
La metastasectomía hepática asociada, en algunas ocasiones, a técnicas de ablación, es el único tratamiento que ofrece una posibilidad de curación, con una mediana de supervivencia de 3,6 años y tasas de supervivencia a 5 y 10 años del 40% y 25%, respectivamente4. Se ha observado que solo entre el 10% y 20% de los pacientes con compromiso hepático llega a cumplir criterios para resección quirúrgica5; sin embargo, el desarrollo de nuevos abordajes asociado al uso de terapia sistémica perioperatoria ha aumentado la cantidad de pacientes (30%) potencialmente elegibles para cirugía3,6.
Se han descrito varios factores para realizar una evaluación pronóstica de estos pacientes y definir el beneficio de un manejo quirúrgico del compromiso metastásico7; una mayor comprensión de la biología tumoral del cáncer colorrectal ha permitido integrar biomarcadores moleculares como la mutación del gen KRAS en la aplicación de escalas pronósticas. Este gen ha sido ampliamente estudiado y se ha reportado una mutación en hasta el 50% del cáncer colorrectal3, que se asocia a resistencia al tratamiento con anticuerpos monoclonales contra el receptor del factor de crecimiento epidérmico (EGFR). La mutación del gen KRAS se presenta hasta en una tercera parte de los pacientes con metástasis hepáticas de cáncer colorrectal resecables, con impacto pronóstico negativo dado por mayor frecuencia de metástasis extrahepáticas, peor respuesta a la terapia sistémica y menor supervivencia global después de la resección3,8. Algunos trabajos incluso recomiendan la metastasectomía hepática, siempre que sea posible, en los pacientes sin mutación KRAS e individualizar la decisión junto con la evaluación de otros factores pronósticos en los mutados3,9.
La cirugía continúa ofreciendo el mejor potencial de curación en los pacientes con cáncer de colon y metástasis hepáticas; una tendencia al uso liberal de la cirugía preservadora de parénquima ha permitido aumentar la posibilidad de resecciones múltiples sincrónicas o en el escenario de la recaída10,11; sin embargo, la preservación de parénquima no excluye la necesidad de resecciones con margen adecuado que garanticen la seguridad oncológica del procedimiento. A pesar de algunas publicaciones que reportan unos desenlaces similares en pacientes llevados a resecciones con márgenes subcentimétricos comparadas con el estándar de 1 centímetro descrito inicialmente12,13, actualmente se considera que existen factores como la biología molecular incluida el estado del KRAS, que deben ser evaluados para determinar el mejor margen de resección en estos casos14.
El objetivo de esta publicación es describir los desenlaces para una serie retrospectiva de pacientes llevados a resecciones hepáticas por metástasis de cáncer colorrectal en relación con el estado del gen KRAS manejados en una institución de referencia para el manejo del cáncer en Colombia; así mismo, evaluar las resecciones hepáticas anatómicas en los pacientes con KRAS mutado en cáncer colorrectal.
Materiales y métodos
Estudio de cohorte retrospectivo que incluyó a pacientes mayores de 18 años que fueron llevados a cirugía de metastasectomía hepática (resecciones anatómicas y no anatómicas) por cáncer colorrectal a quienes se les había realizado un estudio de mutación KRAS entre el 1 de enero de 2009 y el 31 de diciembre de 2013 en el Instituto Nacional de Cancerología, Colombia. Se excluyeron pacientes con pérdida del seguimiento que generara datos incompletos en el análisis.
La información se obtuvo de la revisión de las historias clínicas institucionales con un posterior registro en el programa RedCap. El análisis estadístico inicial de las variables cualitativas y cuantitativas se presenta en frecuencias absolutas y relativas, medidas de tendencia central, dispersión o de posición acordes a cada tipo de variable. Se realizó la estimación de las medianas de supervivencia a 5 años (global y libre de enfermedad) por grupos con datos univariados para pacientes con KRAS mutado y no mutado o wild type mediante el método de Kaplan-Meier. Así mismo, estos desenlaces se analizaron según el tipo de resección hepática realizada (anatómicas y no anatómicas), asociado a una comparación de estas gráficas mediante la prueba de Logrank con el software R-Project, versión 3.6.2.
Resultados
Se encontraron 54 pacientes a quienes se les realizaron resecciones hepáticas por cáncer colorrectal en el período de estudio; sin embargo, solo 35 pacientes tenían estudio para el gen KRAS (Figura 1). La edad media fue de 63 años (rango: 42-82) con una distribución similar entre hombres y mujeres (57,1% frente a 42,9%), el sitio de localización del tumor primario más frecuente fue el recto en el 40% de los pacientes, seguido por el colon sigmoide en 31,4% y con una menor frecuencia de los tumores en el colon derecho (11,4%). La mayoría de los pacientes tenía un grado moderado de diferenciación histológica (85,7%). En esta serie de pacientes, el 54,3% se presentó como un estadio IV, con compromiso metastásico hepático aislado en un 84,2% y asociado a otros órganos en un 15,8%. El antígeno carcinoembrionario (ACE) se encontró elevado previo a la metastasectomía en un valor superior a 5 ng/dL en el 82% de los pacientes, con una media de 7 ng/dL para todos los pacientes, sin diferencias entre mutados y no mutados (Tabla 1).
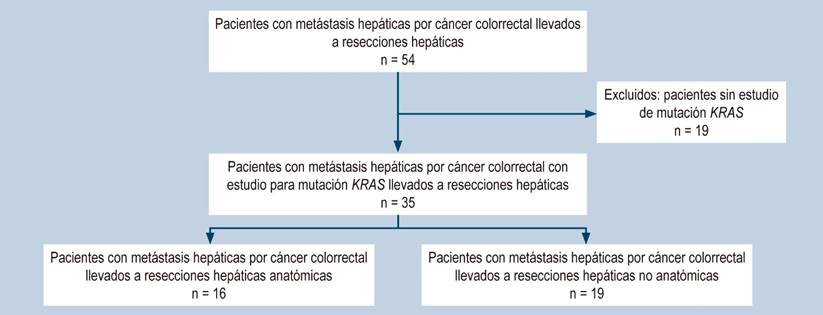
Figura 1 Diagrama de flujo de los pacientes con resecciones hepáticas por cáncer colorrectal 2009-2013. Elaborada por los autores.
Tabla 1 Características clínicas de los pacientes llevados a resecciones hepáticas por cáncer colorrectal
| Característica | Estadística, n (%) |
|---|---|
| Edad (años cumplidos) | |
| Mediana (mín.-máx.) | 63 (42-82) |
| Sexo | |
| Hombre | 20 (57,14) |
| Mujer | 15 (42,86) |
| Tumor primario | |
| Colon derecho | 6 (17,14) |
| Colon izquierdo | 15 (42,86) |
| Recto | 14 (40) |
| Quimioterapia neoadyuvante | |
| No | 23 (65,71) |
| Sí | 11 (31,43) |
| Sin dato | 1 (2,86) |
| Metástasis sincrónica | |
| No | 16 (45,71) |
| Sí | 19 (54,29) |
| Sitio de la metástasis | |
| Hígado | 16 (84,21) |
| Hígado + otros | 1 (15,78) |
| Metastasectomía hepática y primaria en un tiempo quirúrgico | |
| No | 17 (89,47) |
| Sí | 2 (10,53) |
| Tratamiento para metástasis diferente a cirugía | |
| No | 16 (94,12) |
| Sí | 1 (5,88) |
| Grado de diferenciación del tumor primario | |
| Bien diferenciado | 4 (11,43) |
| Mal diferenciado | 1 (2,86) |
| Moderadamente diferenciado | 30 (85,71) |
| Estadio clínico | |
| II | 5 (14,29) |
| III | 10 (28,58) |
| IV | 19 (54,28) |
| No hay dato | 1 (2,86) |
| Presenta recaída en otro sitio diferente al hígado | |
| No | 31 (88,57) |
| Sí | 4 (11,43) |
| Sitio diferente al hígado de recaída | |
| Pulmón | 4 (100) |
| Quimioterapia neoadyuvante a la metastasectomía | |
| No | 31 (88,57) |
| Sí | 4 (11,43) |
| Marcador tumoral previo a la metastasectomía | |
| Mediana (mín.-máx.) | 7,03 (1,33-88,5) |
| Mutación del gen KRAS | |
| No | 20 (57,14) |
| Sí | 15 (42,86) |
Elaborada por los autores.
Mutación del gen KRAS
Se analizaron a 15 pacientes con mutación del gen KRAS (42,8% del total de resecciones hepáticas), el 40% tenía un tumor primario en el colon izquierdo (descendente o sigmoide), 26,7% en el recto y 33,3% en el colon derecho. El 60% de estos pacientes se presentaron en el escenario sincrónico. El 73,3% presentaron recaída durante el seguimiento, con el 19,2% de estas recaídas de localización hepática exclusiva, y el 81,8% asociadas a otro sitio (pulmón). La media de lesiones metastásicas hepáticas fue de 4 y la media del tamaño fue de 4 cm.
De los 20 pacientes con KRAS wild type (57,1% del total de resecciones hepáticas), el 45% tenía localización del tumor primario en el colon izquierdo, 40% en el recto y solo 15% en el colon derecho. Este grupo de pacientes se presentó en el escenario sincrónico y metacrónico en igual proporción. Para estos pacientes, la media de lesiones metastásicas hepáticas fue de 4 y la media del tamaño fue de 2,7 cm. En este grupo, el 70% presentó recaída, con el 64,3% a nivel hepático y en un 50% asociada a otro sitio (pulmón, ganglios, peritoneo o huesos) (Tabla 2).
Tabla 2 Características clínicas y desenlaces de los pacientes con KRAS mutados y wild type
| Característica | KRAS mutados | KRAS wild type |
|---|---|---|
| Edad (años cumplidos) | ||
| Mediana (mín.-máx.) | 66 (45-82) | 59 (42-77) |
| Sexo, n (%) | ||
| Hombre | 7 (46,67) | 13 (65) |
| Mujer | 8 (53,33) | 7 (35) |
| Tumor primario, n (%) | ||
| Colon derecho | 5 (33,33) | 1 (5) |
| Colon izquierdo | 4 (26,67) | 12 (55) |
| Recto | 5 (40) | 8 (40) |
| Quimioterapia neoadyuvante, n (%) | 9 (60) | |
| No | 5 (33,33) | 14 (70) |
| Sí | 1 (6,67) | 6 (30) |
| Estadio clínico, n (%) | ||
| II | 1 (6,67) | 4 (20) |
| III | 5 (33,34) | 4 (25) |
| IV | 9 (60) | 8 (40) |
| No hay dato | - | 1 (5) |
| Marcador tumoral previo a la metastasectomía | ||
| Mediana (mín.-máx.) | 6,98 (2,8-42,8) | 8 (1,33-88,5) |
| Número de lesiones hepáticas | ||
| Mediana (mín.-máx.) | 4 (1-12) | 4(1-7) |
| Tipo de cirugía para la resección de metástasis hepática, n (%) | ||
| Hepatectomía derecha o izquierda | 1 (6,67) | 2 (10) |
| Otra resección anatómica combinada | 2 (13,33) | 3 (15) |
| Resección segmentaria no anatómica | 8 (53,33) | 10 (50) |
| Segmentectomía anatómica | 4 (26,67) | 5 (25) |
| Medida de mayor metástasis hepática (cm) | ||
| Mediana (mín.-máx.) | 4 (0,7-8) | 2,7 (1-12) |
| Estado de resección en la metastasectomía, n (%) | ||
| R0 | 12 (80) | 10 (50) |
| R1 | 3 (20) | 8 (40) |
| R2 | - | 2 (10) |
| Supervivencia libre de progresión, meses | ||
| Mediana (mín.-máx.) | 11,5 (0-24,8) | 19,1 (1,9-46,2) |
| Estado al último contacto, n (%) | ||
| Muerto por enfermedad | 9 (60) | 10 (50) |
| Muerto por otra causa | 1 (6,67) | 1 (5) |
| Vivo con enfermedad | 4 (26,67) | 6 (30) |
| Vivo sin enfermedad | 1 (6,67) | 3 (15) |
| Supervivencia global, meses | ||
| Mediana (mín.-máx.) | 34,1 (0,5-82,6) | 46,4 (2,7-152,4) |
Elaborada por los autores.
Quimioterapia y radioterapia
En relación con otros tipos de terapias recibidas, el 31,43% de los pacientes recibieron quimioterapia en neoadyuvancia (para el tumor primario), y es más frecuente la dupleta de 5-fluorouracilo más leucovorina en un 60% de los pacientes (teniendo en cuenta que corresponden a los tumores rectales incluidos en esta serie). El 85,2% de los pacientes recibieron adyuvancia (posterior a la resección del tumor primario), la mayoría de ellos (63,3%) con regímenes basados en 5-fluorouracilo, leucovorina y oxaliplatino; solo un 16% de los pacientes recibieron terapia dirigida (75% anti-VGFR y 25% anti-EGFR). Del 45,7% de los pacientes que se presentaron en el escenario metacrónico, el 11,4% recibió algún régimen de quimioterapia adicional previo a ser llevado a la cirugía de resección hepática, con regímenes basados en 5-fluorouracilo e irinotecán; sin embargo, en los casos de segunda recaída hepática el 100% recibió terapia sistémica previa a la resección.
En el análisis de pacientes según el estado del KRAS, el 33,3% y 30% de los pacientes con KRAS mutado y no mutado, respectivamente, recibió quimioterapia previa a la resección hepática; sin embargo, el 85% y 87% recibieron terapia sistémica adyuvante. Adicionalmente, el 28,6% de los pacientes recibieron radioterapia como parte del manejo locorregional del primario (tumores rectales).
Resección hepática
De los pacientes que se presentaron en escenario sincrónico, solo al 10,5% se les realizó resección hepática en el mismo tiempo de la cirugía del tumor primario. Las resecciones segmentarias no anatómicas se realizaron en 54,3% (n = 19) de los pacientes; dentro de las resecciones anatómicas, la más frecuente fue la segmentectomía en el 25,7%, seguida por las resecciones combinadas (anatómicas de varios segmentos o asociadas a otra resección no anatómica) en el 14,3% y la hepatectomía derecha o izquierda en el 5,7% y 2,9%, respectivamente.
Se describió resección R0 en el 62,9% de los pacientes, R1 en el 31,4% y en dos pacientes se realizó la resección quirúrgica asociada a otras terapias locales de las lesiones residuales. Todos los pacientes en quienes se realizó una segunda resección hepática se consideraron R0.
Las resecciones anatómicas se realizaron en el 46,6% (n = 16) de los pacientes con KRAS mutado, con un 13,3% de resecciones combinadas, y se logró una resección R0 en el 80% de los pacientes de este grupo. En los pacientes con KRAS wild type se realizaron resecciones anatómicas en el 50% y las más frecuentes son las segmentectomías y las resecciones combinadas. En este grupo se consideraron R0 el 50% de las resecciones, R1 el 40% y solo el 10% fueron considerados R2 (Tabla 3).
Tabla 3 Características de las resecciones hepáticas en todos los pacientes
| Características de las resecciones hepáticas | n (%) |
|---|---|
| Número de lesiones hepáticas | |
| Mediana (mín.-máx.) | 4,5 (1-12) |
| Cirugía para la resección de metástasis hepática | |
| Hepatectomía derecha o izquierda | 3 (8,57) |
| Otras resecciones anatómicas combinadas | 5 (14,29) |
| Resección segmentaria no anatómica | 18 (51,43) |
| Segmentectomía anatómica | 9 (25,71) |
| Medida de mayor metástasis hepática (cm) | |
| Mediana (mín.-máx.) | 3 (0,7- 12) |
| Estado de resección en la metastasectomía | |
| R0 | 22 (62,86) |
| R1 | 11 (31,43) |
| R2 | 2 (5,71) |
| Quimioterapia adyuvante a la metastasectomía | |
| No | 4 (11,43) |
| Sí | 29 (82,86) |
| Sin dato | 2 (5,71) |
| Manejo no quirúrgico de las metástasis hepáticas, n (%) | |
| Otro | 4 (11,4) |
| Radioablación | 2 (5,7) |
Elaborada por los autores.
Desenlaces
La mediana de seguimiento fue de 39 meses, el 54,3% falleció a causa de su enfermedad oncológica, y el 5,7% falleció por otra causa. Del 40% de los pacientes sobrevivientes al momento de finalizar el estudio, solo el 28,5% se consideraron libres de enfermedad, sin ningún tratamiento activo (Tabla 4).
Tabla 4 Desenlaces de los pacientes llevados a resecciones hepáticas por cáncer colorrectal
| Desenlaces pacientes general | Estadística |
|---|---|
| Supervivencia libre de progresión (meses) | |
| Mediana (mín.-máx.) | 15,6 (0-46,2) |
| Estado al último contacto, n (%) | |
| Muerto por enfermedad | 19 (54,29) |
| Muerto por otra causa | 2 (5,71) |
| Vivo con enfermedad | 10 (28,57) |
| Vivo sin enfermedad | 4 (11,43) |
| Supervivencia global (meses) | |
| Mediana (mín.-máx.) | 37,1 (0,5-152,4) |
Elaborada por los autores.
En el análisis por subgrupos según el estado del gen KRAS, se encontró que para los pacientes con mutación KRAS el 60% presentó mortalidad relacionada con el cáncer, 6,7% mortalidad por otra causa y, del 33% de los pacientes vivos al finalizar el seguimiento del estudio, el 80% tenía enfermedad activa; por otra parte, en los pacientes con KRAS wild type al finalizar el estudio, el 50% habían presentado mortalidad relacionada con el cáncer, y de los pacientes vivos, el 66% tenían enfermedad activa.
Al evaluar la supervivencia global, esta tuvo una mediana de 37,1 meses, con una mediana de 34,2 meses para los pacientes con KRAS mutado y de 46,5 para los wild type; así mismo, en el análisis según el tipo de resección realizada, se encontró que los pacientes con KRAS mutado a quienes se les realizaron resecciones anatómicas tuvieron una supervivencia mediana de 43,5 meses, en comparación con 23,5 meses en los que se realizaron resecciones no anatómicas. En el grupo de los pacientes wild type, la supervivencia mediana fue de 34,5 y 41,3 meses para las resecciones no anatómicas y anatómicas, respectivamente.
Discusión
El cáncer colorrectal metastásico es un escenario heterogéneo con amplia variabilidad biológica y actualmente se considera que las posibilidades de ofrecer un manejo locorregional y sistémico deben ser analizadas de manera individualizada15. En el caso de las metástasis hepáticas por cáncer colorrectal, varios estudios han analizado múltiples factores patológicos y clínicos como determinantes en el beneficio y el pronóstico de los pacientes sometidos a resecciones hepáticas, incluso se han diseñado algunos sistemas de puntuación preoperatoria con el objetivo de tener un mayor soporte en la elección de los candidatos a una cirugía de resección hepática7,16.
Dentro de los marcadores biológicos que se han analizado en las últimas décadas están las mutaciones para el gen KRAS y NRAS, varios autores han encontrado que estas mutaciones están relacionadas con la resistencia al manejo con anticuerpos monoclonales contra el EGFR en el escenario de la enfermedad metastásica17,18; del mismo modo, se ha demostrado una menor tasa de respuesta a las líneas de manejo convencionales, progresión rápida y desenlaces de supervivencia inferiores19.
Una mutación oncogénica en KRAS conduce a la activación de la vía de señalización RAS/RAF dependiente de activación de EGFR mediante la unión al receptor; esta activación resulta en una estimulación constante de la proliferación, angiogénesis, resistencia a la apoptosis y aumento de la capacidad metastásica20,21. De esta manera, podríamos entender que los inhibidores del EGFR que actúan en un escalón superior a la activación de la vía KRAS no sean útiles en pacientes con una mutación que mantiene la vía activa.
Muchos estudios han analizado específicamente el impacto del estado del gen KRAS en los desenlaces de los pacientes con metástasis hepáticas por cáncer colorrectal llevados a resección hepática; sin embargo, los resultados de las diferentes series no han sido del todo unánimes en reportar un efecto negativo para estos pacientes22-25; sin embargo, en el metaanálisis publicado recientemente por Passiglia, los resultados son contundentes en demostrar peores desenlaces de recurrencia y supervivencia en los pacientes con KRAS mutado3.
Recientemente, algunos autores se han centrado entonces en reportar los desenlaces específicos para los pacientes con KRAS mutado cuando se ofrece un mejor control local quirúrgico con resecciones anatómicas, lo que abre una alternativa que ofrece a estos pacientes tasas de supervivencia que superan a las que se obtienen solo con terapias sistémicas sin un control local del compromiso metastásico; sin embargo, los resultados son contradictorios (Tabla 5)26-28.
Tabla 5 Estudios que reportan desenlaces oncológicos según el tipo de resección hepática en relación con el estado del gen KRAS en pacientes con metástasis hepáticas por cáncer colorrectal
| Estudio | Margonis y colaboradores | Choi M y colaboradores | Kwai T y colaboradores | Acevedo y colaboradores |
| Pacientes | 389 pacientes | 250 pacientes | 290 pacientes | 35 pacientes |
| Año | 2017 | 2022 | 2022 | 2022 |
| Desenlaces oncológicos | SLE KRASmut anatómica: 33.8 meses No anatómica: 10,5 meses | SLE KRASmut Anatómica: 11 meses No anatómica: 9 meses | SG a 5 años KRASmut Anatómica: 55% No anatómica: 53% KRASwt Anatómicas: 81% No anatómica: 58% | SG media KRASmut Anatómicas: 43,5 meses No anatómicas: 23,5 meses KRASwt Anatómicas: 34,5 meses No anatómicas: 41,3 meses |
| Comentario | Las resecciones no anatómicas se asocian con una peor SLE en pacientes con tumores con mutación KRAS | La presencia o ausencia de la mutación KRAS no mostró una asociación significativa con la SLE, independientemente del tipo de resección y no se consideró un factor pronóstico significativo | La resección anatómica fue un factor pronóstico independiente de la SLE y la SG en los pacientes con KRASwt. Por el contrario, la resección anatómica no se asoció con la SLE o la SG en los pacientes con mutación de KRAS | La resección anatómica fue un factor asociado a mejor supervivencia en los pacientes con KRAS mutado |
KRASmut: Mutación del gen KRAS; KRASwt: estado salvaje o sin mutación del gen KRAS; SG: supervivencia global; SLE: supervivencia libre de enfermedad. Elaborada por los autores.
En nuestra serie de casos, las resecciones anatómicas se realizaron en el 46,6% y 50% de los pacientes con mutación KRAS y wild type, respectivamente, previa planeación según la localización y la cantidad de las lesiones metastásicas, sin tener en cuenta para ese momento el estado de la mutación en la elección del tipo de resección; encontramos que en el grupo de los pacientes con KRAS mutado la supervivencia media fue un 85% superior cuando se realizaron resecciones anatómicas (43,5 frente a 23,5 meses) (Figura 2).
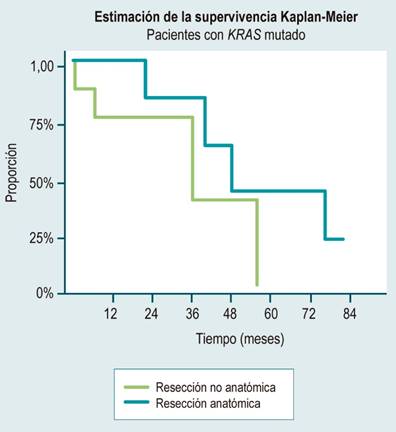
Figura 2 Supervivencia global de los pacientes con mutación KRAS según el tipo de resección. Elaborada por los autores.
Diferentes publicaciones han demostrado un mayor beneficio en la supervivencia de los pacientes con metástasis hepáticas por cáncer colorrectal con el manejo quirúrgico, comparado con el manejo sistémico29-31 y, a pesar de describirse un peor pronóstico para los pacientes con estado mutado del KRAS, este beneficio se mantiene para este grupo de pacientes, y se ha reportado en la literatura una supervivencia media de 34 a 40 meses comparado con 10,6 meses si se recibe solo manejo sistémico con quimioterapia32-34. En este estudio, la supervivencia entre los pacientes con resecciones anatómicas es similar en ambos subgrupos (KRAS mutado y wild type) con una media de 43,5 y 41,5 meses, respectivamente, mientras que en los pacientes con KRAS mutado, la supervivencia es notablemente inferior en los llevados a resecciones no anatómicas (23,5 frente a 34,5 meses).
Existen actualmente poco estudios que describan o soporten la recomendación de resecciones anatómicas específicamente en los pacientes con estado mutado del gen KRAS26-28, con resultados heterogéneos en relación con la supervivencia global y libre de enfermedad; sin embargo, dada la mayor frecuencia de micrometástasis y resecciones R134,35 en este grupo de pacientes, es esperable una mayor dificultad en el control local con las resecciones hepáticas ahorradoras de parénquima en este escenario.
Ciertamente, esta publicación tiene limitaciones al ser un estudio retrospectivo con una cantidad relativamente baja de pacientes; sin embargo, los resultados coinciden con los reportados por otros autores, en los que se obtienen mejores desenlaces en supervivencia para los pacientes con KRAS mutados cuando se realizan resecciones hepáticas con mayor margen o anatómicas; aunque aún la evidencia es poca, los resultados de esta serie retrospectiva son valiosos y abren el espacio para continuar con la construcción de la evidencia que permita una adecuada toma de decisiones de los pacientes con KRAS mutado que serán llevados a resecciones hepáticas, quienes tienen ya un pronóstico desfavorable en los diferentes desenlaces oncológicos.
Agradecimientos
El grupo de autores de esta publicación agradece al Dr. Jorge Mesa y al grupo de patología del Instituto Nacional de Cancerología, sin ellos muchos de los proyectos no podrían llevarse a cabo.
REFERENCIAS
1. Cancer Today. Data visualization tools for exploring the global cancer burden in 2020 [Internet]. Lyon: IARC; 2020 [consultado el 16 de octubre de 2020]. Disponible en: Disponible en: https://gco.iarc.fr/today [ Links ]
2. Jones RP, Jackson R, Dunne DF, Malik HZ, Fenwick SW, Poston GJ, et al. Systematic review and meta-analysis of follow-up after hepatectomy for colorectal liver metastases. Br J Surg. 2012;99(4):477-86. https://doi.org/10.1002/bjs.8667 [ Links ]
3. Passiglia F, Bronte G, Bazan V, Galvano A, Vincenzi B, Russo A. Can KRAS and BRAF mutations limit the benefit of liver resection in metastatic colorectal cancer patients? A systematic review and meta-analysis. Crit Rev Oncol Hematol. 2016;99:150-7. https://doi.org/10.1016/j.critrevonc.2015.12.015 [ Links ]
4. Kanas GP, Taylor A, Primrose JN, Langeberg WJ, Kelsh MA, Mowat FS, et al. Survival after liver resection in metastatic colorectal cancer: review and meta-analysis of prognostic factors. Clin Epidemiol. 2012;4:283-301. https://doi.org/10.2147/CLEP.S34285 [ Links ]
5. Adam R, Vinet E. Regional treatment of metastasis: Surgery of colorectal liver metastases. Ann Oncol. 2004;15(Suppl 4):103-106. https://doi.org/10.1093/annonc/mdh912 [ Links ]
6. Chow FCL, Chok KSH. Colorectal liver metastases: An update on multidisciplinary approach. World J Hepatol. 2019;11(2):150-172. https://doi.org/10.4254/wjh.v11.i2.150 [ Links ]
7. Fong Y, Fortner J, Sun RL, Brennan MF, Blumgart LH. Clinical score for predicting recurrence after hepatic resection for metastatic colorectal cancer: analysis of 1001 consecutive cases. Ann Surg. 1999;230(3):309-18. https://doi.org/10.1097/00000658-199909000-00004 [ Links ]
8. Karagkounis G, Torbenson MS, Daniel HD, Azad NS, Diaz LA Jr, Donehower RC, et al. Incidence and prognostic impact of KRAS and BRAF mutation in patients undergoing liver surgery for colorectal metastases. Cancer. 2013;119(23):4137-44. https://doi.org/10.1002/cncr.28347 [ Links ]
9. Brudvik KW, Kopetz SE, Li L, Conrad C, Aloia TA, Vauthey JN. Meta-analysis of KRAS mutations and survival after resection of colorectal liver metastases. Br J Surg. 2015;102(10):1175-83. https://doi.org/10.1002/bjs.9870 [ Links ]
10. Mise Y, Aloia TA, Brudvik KW, Schwarz L, Vauthey JN, Conrad C. Parenchymal-sparing Hepatectomy in Colorectal Liver Metastasis Improves Salvageability and Survival. Ann Surg. 2016;263(1):146-52. https://doi.org/10.1097/SLA.0000000000001194 [ Links ]
11. Gold JS, Are C, Kornprat P, Jarnagin WR, Gönen M, Fong Y, et al. Increased use of parenchymal-sparing surgery for bilateral liver metastases from colorectal cancer is associated with improved mortality without change in oncologic outcome: trends in treatment over time in 440 patients. Ann Surg. 2008;247(1):109-17. https://doi.org/10.1097/SLA.0b013e3181557e47 [ Links ]
12. Sadot E, Groot Koerkamp B, Leal JN, Shia J, Gonen M, Allen PJ, et al. Resection margin and survival in 2368 patients undergoing hepatic resection for metastatic colorectal cancer: surgical technique or biologic surrogate? Ann Surg. 2015;262(3):476-85. https://doi.org/10.1097/SLA.0000000000001427 [ Links ]
13. Cady B, Jenkins RL, Steele GD Jr, Lewis WD, Stone MD, McDermott WV, et al. Surgical margin in hepatic resection for colorectal metastasis: a critical and improvable determinant of outcome. Ann Surg. 1998;227(4):566-71. https://doi.org/10.1097/00000658-199804000-00019 [ Links ]
14. Margonis GA, Sasaki K, Andreatos N, Kim Y, Merath K, Wagner D, et al. KRAS Mutation Status Dictates Optimal Surgical Margin Width in Patients Undergoing Resection of Colorectal Liver Metastases. Ann Surg Oncol. 2017;24(1):264-271. https://doi.org/10.1245/s10434-016-5609-1 [ Links ]
15. Bronte G, Rolfo C, Peeters M, Russo A. How to find the Ariadne’s thread in the labyrinth of salvage treatment options for metastatic colorectal cancer? Expert Opin Biol Ther. 2014;14(6):743-8. https://doi.org/10.1517/14712598.2014.902926 [ Links ]
16. Nagashima I, Takada T, Nagawa H, Muto T, Okinaga K. Proposal of a new and simple staging system of colorectal liver metastasis. World J Gastroenterol. 2006;12(43):6961-5. https://doi.org/10.3748/wjg.v12.i43.6961 [ Links ]
17. Bokemeyer C, Van Cutsem E, Rougier P, Ciardiello F, Heeger S, Schlichting M, et al. Addition of cetuximab to chemotherapy as first-line treatment for KRAS wild-type metastatic colorectal cancer: pooled analysis of the CRYSTAL and OPUS randomised clinical trials. Eur J Cancer. 2012;48(10):1466-75. https://doi.org/10.1016/j.ejca.2012.02.057 [ Links ]
18. Bokemeyer C, Köhne CH, Ciardiello F, Lenz HJ, Heinemann V, Klinkhardt U, et al. FOLFOX4 plus cetuximab treatment and RAS mutations in colorectal cancer. Eur J Cancer. 2015;51(10):1243-52. https://doi.org/10.1016/j.ejca.2015.04.007 [ Links ]
19. Rizzo S, Bronte G, Fanale D, Corsini L, Silvestris N, Santini D, et al. Prognostic vs predictive molecular biomarkers in colorectal cancer: is KRAS and BRAF wild type status required for anti-EGFR therapy? Cancer Treat Rev. 2010;36 Suppl 3:S56-61. https://doi.org/10.1016/S0305-7372(10)70021-9 [ Links ]
20. Knijn N, Mekenkamp LJ, Klomp M, Vink-Börger ME, Tol J, Teerenstra S, et al. KRAS mutation analysis: a comparison between primary tumours and matched liver metastases in 305 colorectal cancer patients. Br J Cancer. 2011;104(6):1020-6. https://doi.org/10.1038/bjc.2011.26 [ Links ]
21. Benvenuti S, Sartore-Bianchi A, Di Nicolantonio F, Zanon C, Moroni M, Veronese S, et al. Oncogenic activation of the RAS/RAF signaling pathway impairs the response of metastatic colorectal cancers to anti-epidermal growth factor receptor antibody therapies. Cancer Res. 2007;67(6):2643-8. https://doi.org/10.1158/0008-5472.CAN-06-4158 [ Links ]
22. Kemeny NE, Chou JF, Capanu M, Gewirtz AN, Cercek A, Kingham TP, et al. KRAS mutation influences recurrence patterns in patients undergoing hepatic resection of colorectal metastases. Cancer. 2014;120(24):3965-71. https://doi.org/10.1002/cncr.28954 [ Links ]
23. Schirripa M, Bergamo F, Cremolini C, Casagrande M, Lonardi S, Aprile G, et al. BRAF and RAS mutations as prognostic factors in metastatic colorectal cancer patients undergoing liver resection. Br J Cancer. 2015;112(12):1921-8. https://doi.org/10.1038/bjc.2015.142 [ Links ]
24. Stremitzer S, Stift J, Gruenberger B, Tamandl D, Aschacher T, Wolf B, et al. KRAS status and outcome of liver resection after neoadjuvant chemotherapy including bevacizumab. Br J Surg. 2012;99(11):1575-82. https://doi.org/10.1002/bjs.8909 [ Links ]
25. Vauthey JN, Zimmitti G, Kopetz SE, Shindoh J, Chen SS, Andreou A, et al. RAS mutation status predicts survival and patterns of recurrence in patients undergoing hepatectomy for colorectal liver metastases. Ann Surg. 2013;258(4):619-26. https://doi.org/10.1097/SLA.0b013e3182a5025a [ Links ]
26. Margonis GA, Buettner S, Andreatos N, Sasaki K, Ijzermans JNM, van Vugt JLA, et al. Anatomical Resections Improve Disease-free Survival in Patients With KRAS-mutated Colorectal Liver Metastases. Ann Surg. 2017;266(4):641-649. https://doi.org/10.1097/SLA.0000000000002367 [ Links ]
27. Choi M, Han DH, Choi JS, Choi GH. Can the presence of KRAS mutations guide the type of liver resection during simultaneous resection of colorectal liver metastasis? Ann Hepatobiliary Pancreat Surg. 2022;26(2):125-132. https://doi.org/10.14701/ahbps.21-127 [ Links ]
28. Kawai T, Ishii T, Uchida Y, Sato A, Naito S, Kitaguchi K, et al. Impact of anatomical liver resection on patient survival in KRAS-wildtype colorectal liver metastasis: A multicenter retrospective study; Surgery. 2022;172(4):1133-1140. https://doi.org/10.1016/j.surg.2022.05.014 [ Links ]
29. Teng H-W, Huang Y-C, Lin J-K, Chen W-S, Lin T-C, Jiang J-K, et al. BRAF mutation is a prognostic biomarker for colorectal liver metastasectomy. J Surg Oncol. 2012;106(2):123-129. https://doi.org/10.1002/jso.23063 [ Links ]
30. Tosi F, Magni E, Amatu A, Mauri G, Bencardino K, Truini M, et al. Effect of KRAS and BRAF mutations on survival of metastatic colorectal cancer after liver resection: a systematic review and meta-analysis. Clin Colorectal Cancer. 2017;16(3):e153-e163. https://doi.org/10.1016/j.clcc.2017.01.004 [ Links ]
31. Javed S, Benoist S, Devos P, Truant S, Guimbaud R, Lièvre A, et al. Prognostic factors of BRAF V600E colorectal cancer with liver metastases: a retrospective multicentric study. World J Surg Oncol. 2022;20(1):131. https://doi.org/10.1186/s12957-022-02594-2 [ Links ]
32. Johnson B, Jin Z, Truty MJ, Smoot RL, Nagorney DM, Kendrick ML, et al. Impact of metastasectomy in the multimodality approach for BRAF V600E metastatic colorectal cancer: the mayo clinic experience. Oncologist. 2018;23(1):128-134. https://doi.org/10.1634/theoncologist.2017-0230 [ Links ]
33. Gagnière J, Dupré A, Gholami SS, Pezet D, Boerner T, Gönen M, et al. Is Hepatectomy Justified for BRAF Mutant Colorectal Liver Metastases?: A Multi-institutional Analysis of 1497 Patients. Ann Surg. 2020;271(1):147-154. https://doi.org/10.1097/SLA.0000000000002968 [ Links ]
34. Zhang Q, Peng J, Ye M, Weng W, Tan C, Ni S, et al. KRAS Mutation Predicted More Mirometastases and Closer Resection Margins in Patients with Colorectal Cancer Liver Metastases. Ann Surg Oncol. 2020;27(4):1164-1173. https://doi.org/10.1245/s10434-019-08065-5 [ Links ]
35. Margonis GA, Sasaki K, Kim Y, Samaha M, Buettner S, Amini N, et al. Tumor Biology Rather Than Surgical Technique Dictates Prognosis in Colorectal Cancer Liver Metastases. J Gastrointest Surg. 2016;20(11):1821-1829. https://doi.org/10.1007/s11605-016-3198-8 [ Links ]
Citación:
3Guerrero S, Acevedo JJ, Facundo-Navia H, Guevara-Cruz OA. Mutación del gen KRAS en pacientes llevados a resecciones hepáticas por cáncer colorrectal. ¿Hay ventaja en las resecciones anatómicas?. Revista. colomb. Gastroenterol. 2023;38(1):19-27. https://doi.org/10.22516/25007440.929
Recibido: 18 de Junio de 2022; Aprobado: 15 de Noviembre de 2022











 text in
text in 


