Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista colombiana de Gastroenterología
versión impresa ISSN 0120-9957versión On-line ISSN 2500-7440
Rev. colomb. Gastroenterol. vol.38 no.1 Bogotá ene./mar. 2023 Epub 08-Jun-2023
https://doi.org/10.22516/25007440.903
Reporte de caso
Carcinoma adenoneuroendocrino mixto en la ampolla de Váter: reporte de caso
1Pathology Service, Fundación Universitaria de Ciencias de la Salud, Hospital San José. Bogotá, Colombia.
2General Surgery Service, Fundación Universitaria de Ciencias de la Salud, Hospital San José. Bogotá, Colombia.
3Medical Student, Talent Promotion Center of Pathology and General Surgery. Fundación Universitaria de Ciencias de la Salud, Bogotá, Colombia.
La neoplasia neuroendocrina no neuroendocrina mixta es una neoplasia mixta con un componente neuroendocrino combinado con un componente no neuroendocrino. Esta presenta una incidencia baja y estudios limitados, pero con evidencia de ser una entidad agresiva asociada a una pobre supervivencia. Presentamos el caso de una mujer de 58 años que ingresó por un cuadro clínico de dolor abdominal en el hipocondrio izquierdo asociado a ictericia generalizada y picos febriles con diagnóstico imagenológico de dilatación de la vía biliar secundaria a coledocolitiasis distal, por lo que se realizó una colangiopancreatografía retrógrada endoscópica (CPRE) en la que se encontró una papila mayor de aspecto neoplásico a la cual se le realizó una biopsia analizada histopatológicamente y se confirmó el diagnóstico de carcinoma mixto con componente de carcinoma neuroendocrino pobremente diferenciado de alto grado y componente de carcinoma mucinoso, por lo cual se decidió programar una pancreatoduodenectomía.
Palabras clave: Carcinoma adenoneuroendocrino; ampolla de Váter; MINEN; MANEC
A mixed non-neuroendocrine neuroendocrine neoplasm is a mixed neoplasm with a neuroendocrine component combined with a non-neuroendocrine component. It has a low incidence and limited studies, but with evidence of being an aggressive entity associated with poor survival. We present the case of a 58-year-old woman admitted with clinical symptoms of abdominal pain in the left hypochondrium associated with generalized jaundice and feverish spikes with an imaging diagnosis of bile duct dilation secondary to distal choledocholithiasis. Endoscopic retrograde cholangiopancreatography (ERCP) was performed, finding a significant papilla with a neoplastic appearance, which was biopsied and histopathologically analyzed. The diagnosis of mixed carcinoma with a component of high-grade poorly differentiated neuroendocrine carcinoma and a component of mucinous carcinoma was confirmed. Therefore, we decided to schedule a pancreaticoduodenectomy.
Keywords: Adenoneuroendocrine carcinoma; ampulla of Vater; MINEN; MANEC
Introducción
Las neoplasias mixtas fueron descritas por primera vez en 1924 por Cordier como neoplasias en el tracto gastrointestinal con dos componentes: uno neuroendocrino y otro adenocarcinoma1. A partir del año 1967 se propuso diferenciar por Levine esta entidad neoplásica como independiente de otras neoplasias neuroendocrinas1. Desde entonces se han utilizado múltiples términos para este diagnóstico, como carcinoma mixto compuesto glandular-neuroendocrino , adenocarcinoma compuesto carcinoide , carcinoide productor de mucina , adenocarcinoma carcinoide de células ex caliciformes, entre otros2; lo que da lugar a inconsistencias en los datos publicados sobre esta patología3.
Capella y colaboradores en el 2000 propusieron por primera vez la estandarización de la terminología para proporcionar una clasificación pronóstica de las neoplasias mixtas del tracto digestivo1. En 2010, la Organización Mundial de la Salud (OMS) clasificó las neoplasias mixtas del tracto gastroenteropancreático que contienen un componente neuroendocrino y otro exocrino, y cada una de ellas debe representar al menos el 30% de la masa neoplásica4.
Posteriormente, el término neoplasia mixta exocrina-endocrina fue sustituido por neoplasia mixta adenoneuroendocrina (MANEC), y esta es una patología infrecuente que se compone de un grupo de células neoplásicas neuroendocrinas y exocrinas. Sin embargo, se cree que el término MiNEN ( mixed neuroendocrine non-neuroendocrine neoplasms ), propuesto en 2016 por La Rosa y colaboradores, aborda mejor el espectro heterogéneo de posibles combinaciones entre elementos neuroendocrinos y no neuroendocrinos, y la variabilidad de las morfologías, que están determinadas en gran medida por el sitio de origen1. En 2019, la OMS estableció que las neoplasias neuroendocrinas (NET) mixtas están agrupadas en la categoría conceptual de MiNEN5.
Epidemiológicamente, la incidencia de MiNEN es inferior a 0,01/100,000 casos por año; la rareza de este diagnóstico, la calidad limitada de los datos publicados, el uso de terminología inconsistente y la epidemiología el tratamiento terapéutico de los pacientes con MiNEN sigue siendo poco específico6,7. Sin embargo, según la evidencia disponible, esta neoplasia es una entidad agresiva con un componente neuroendocrino de alto grado en la mayoría de los casos, y se asocia con resultados de supervivencia pobres, cercanos a los de carcinomas neuroendocrinos puros8.
La patogenia de los MiNEN representa un tema de debate entre patólogos y clínicos, en la cual se han propuesto tres teorías principales: la primera teoría sugiere que los componentes neuroendocrinos y no neuroendocrinos surgen independientemente, de manera sincrónica, a partir de células precursoras distintas y para fusionarse posteriormente; la segunda plantea que los dos componentes derivan de un progenitor pluripotente, que adquiere una diferenciación bifenotípica durante la carcinogénesis; y una tercera teoría supone un origen monoclonal común de los dos componentes, pero la diferenciación neuroendocrina ocurre en un fenotipo no neuroendocrino luego de la acumulación de aberraciones moleculares9,10. Esta última teoría está fundamentada en que las neoplasias no neuroendocrinas en el tracto gastrointestinal generalmente se localizan superficialmente cerca a la mucosa, mientras que las neoplasias neuroendocrinas se ubican en un área más profunda10.
Las principales aberraciones genéticas y epigenéticas que subyacen a las MiNEN han tratado de ser caracterizadas por varios estudios, y surgen como posibles desencadenantes de MiNEN las mutaciones en genes asociados a tumores, incluidos TP53, BRAF y KRAS, y la inestabilidad de microsatélites. Sin embargo, hasta la fecha no están claramente establecidas10.
Caso clínico
Se trata de una mujer de 58 años de edad con un antecedente de hipertensión arterial y diabetes mellitus no insulinorrequiriente que consultó por un cuadro clínico de 20 días de evolución consistente en dolor abdominal en el hipocondrio izquierdo tipo punzada irradiado al epigastrio de intensidad 6/10 en la escala análoga del dolor asociado a tinte ictérico generalizado, acolia, coluria y picos febriles cuantificados de hasta 39 ºC; se realizaron estudios de laboratorio en los que se evidenció hiperbilirrubinemia a expensas de bilirrubina directa y elevación de transaminasas. La ecografía mostró una esteatosis hepática, la vesícula biliar sin cálculos en su interior asociado a vía biliar intra- y extrahepática dilatada con un colédoco de 12 mm, sin encontrar una causa de la obstrucción. Se realizó una tomografía axial computarizada (TAC) y colangiorresonancia (Figura 1), en la cual se evidenció una dilatación de la vía biliar secundaria a coledocolitiasis distal, decidieron llevar a la paciente a colangiopancreatografía retrógrada endoscópica (CPRE) para realizar el manejo de síndrome biliar obstructivo de probable origen biliar; sin embargo, como hallazgo quirúrgico se encuentra una papila mayor de aspecto neoplásico de 3 centímetros de diámetro mayor sin lograr la canalización de la vía biliar. Se realizó una biopsia y resonancia magnética con doble contraste (Figura 2), en la cual se reportó coledocolitiasis, dilatación de la vía biliar intra- y extrahepática, y dilatación del conducto intrapancreático por una probable neoplasia periampular.
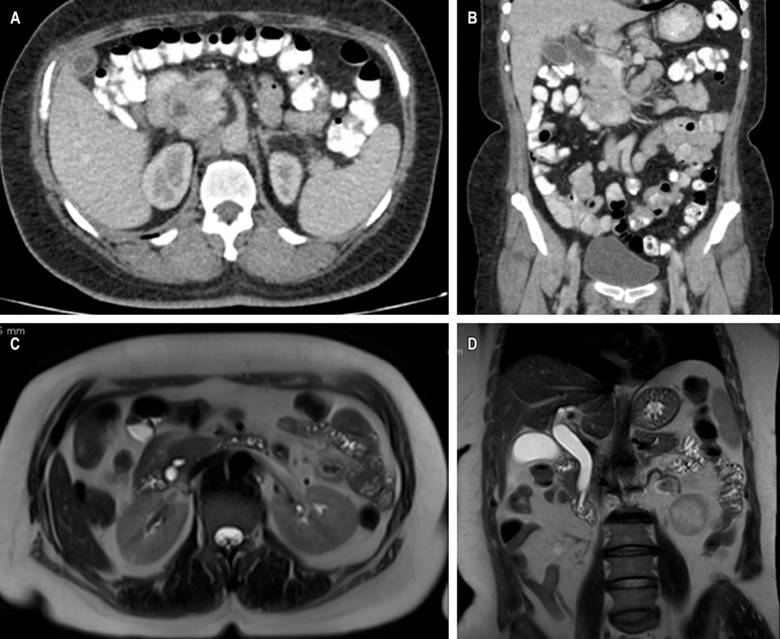
Figura 1 TAC con evidencia de dilatación de la vía biliar intra- y extrahepática (A) y corte axial (B), corte coronal. La colangiorresonancia muestra la dilatación de la vía biliar secundaria a coledocolitiasis (C) en corte axial y (D) corte coronal. Fuente: archivo de los autores.
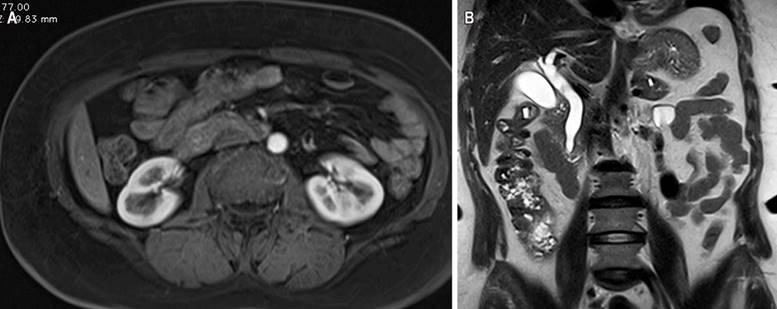
Figura 2 Resonancia magnética contrastada con evidencia de dilatación en la vía biliar intra- y extrahepática secundaria a lesión periampular (A) en corte axial y (B) corte coronal. Fuente: archivo de los autores.
La biopsia evidenció un adenoma velloso con displasia de bajo grado. Al no obtener una correlación clínico-patológica, el servicio tratante procedió a realizar tratamiento quirúrgico, y por hallazgos intraoperatorios de la vía biliar se realizó una derivación biliopancreática más pancreatectomía proximal a la vía abierta. Al realizar el estudio microscópico se observó una neoplasia mixta caracterizada por un carcinoma neuroendocrino, un adenocarcinoma mucinoso y un adenoma velloso con displasia de bajo grado, este último como posible precursor del adenocarcinoma mucinoso (Figura 3).
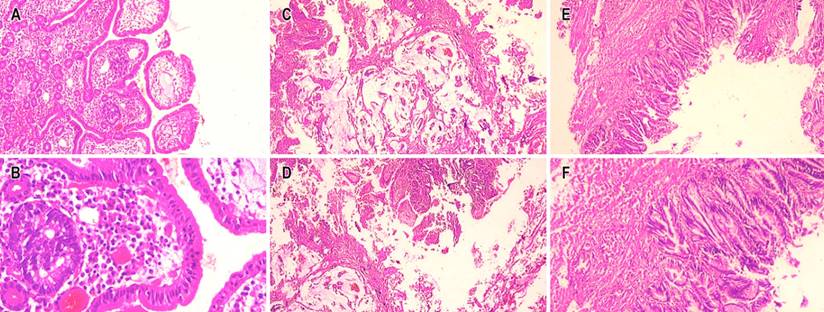
Figura 3 Visión microscópica con hematoxilina y eosina (H/E) 4x. Tumor adenoneuroendocrino mixto. A. 10x componente de carcinoma neuroendocrino. B. 40x componente de carcinoma neuroendocrino. C y D. 40x componente de adenocarcinoma mucinoso. E y F. 40x adenoma velloso con displasia de bajo grado. Fuente: archivo de los autores.
Se realizó un estudio de inmunohistoquímica en el que se observó marcación positiva en las células neoplásicas del carcinoma neuroendocrino para cromogranina A, sinaptofisina, citoqueratina 7, citoqueratina 17, factor de transcripción tiroidea 1 (TTF-1), un índice de proliferación del 98%; negatividad para citoqueratina 20, proteína caudal homeobox 2 (CDX2) y receptor 2 del factor de crecimiento epidérmico humano (HER2) grado 0. Adicionalmente, se evidenció positividad en las células del carcinoma mucinoso para citoqueratina 7 e índice de proliferación celular del 90%, y negatividad para cromogranina A, sinaptofisina, citoqueratina 20, TTF1, CDX2 y HER2 grado 0 (Figuras 4 y 5). Los marcadores de inestabilidad microsatelital están conservados. Estos hallazgos confirman carcinoma neuroendocrino de alto grado asociado a un componente de carcinoma mucinoso.
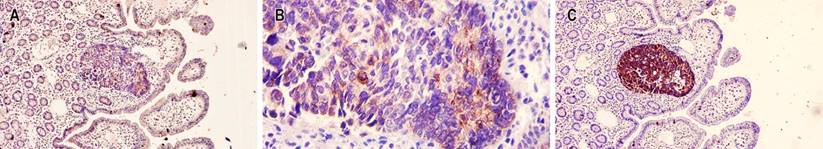
Figura 4 Tinción de inmunohistoquímica en el carcinoma neuroendocrino. A. 10x tinción de inmunohistoquímica débil para cromogranina A. B. 100x tinción de inmunohistoquímica débil para cromogranina A. C. 10x tinción de inmunohistoquímica con fuerte positividad para cromogranina A. Fuente: archivo de los autores.
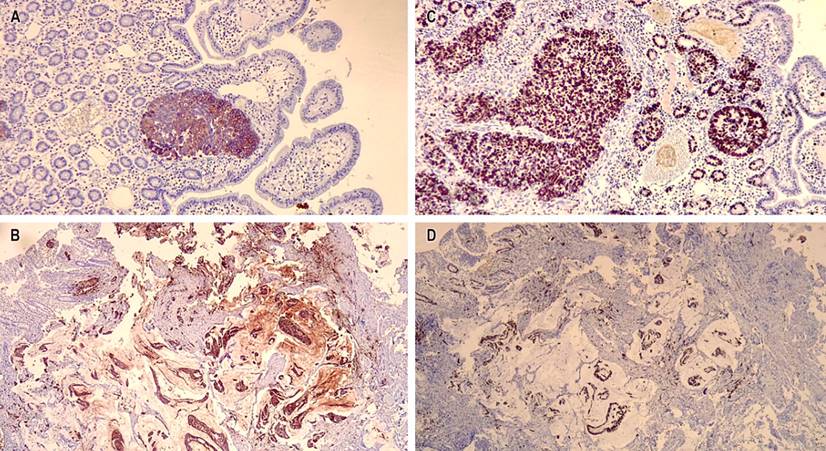
Figura 5 A. 10x tinción de inmunohistoquímica positiva para citoqueratina 7 en el componente de adenocarcinoma neuroendocrino. B. 10x tinción de inmunohistoquímica positiva para citoqueratina 7 en el componente de adenocarcinoma mucinoso. C. 10x índice de proliferación celular del carcinoma neuroendocrino del 98. D. 10x índice de proliferación celular positivo para la mayoría de células neoplásicas epiteliales. Fuente: archivo de los autores.
Discusión
Los carcinomas adenoneuroendocrinos mixtos (MiNEN) son carcinomas bifásicos constituidos por un epitelio glandular y células neuroendocrinas. Según la OMS en 2019, para su denominación se requiere que cada componente represente al menos el 30% de la constitución del carcinoma4,5. Es una neoplasia rara, los casos que se presentan en la ampolla de Váter son poco comunes, solo se han reportado 19 casos en esta ubicación. En el tracto gastrointestinal, es más común en el estómago y colon11.
En el caso presentado se realizó el diagnóstico definitivo en múltiples cortes histológicos de parafina y estudios complementarios de inmunohistoquímica en los que se documentó el compromiso por un carcinoma adenoneuroendocrino mixto de la ampolla de Váter, compuesto por un carcinoma neuroendocrino (40%) y un adenocarcinoma mucinoso (60%), lo que confirmó el diagnóstico de MiNEN según la OMS, 20195.
Los síntomas usualmente son poco específicos y pueden ser generalizados; se presenta frecuentemente con dolor abdominal, en algunas ocasiones asociado a episodios eméticos. En el caso presentado, los síntomas principales fueron ictericia, acolia, coluria y picos febriles. Debido a la inespecificidad de los síntomas obstructivos que se presentan en estos casos, es de suma trascendencia realizar una correlación clínico-radiológica con la patología.
Esta neoplasia con ubicación en la ampolla de Váter, como lo mencionamos previamente, es un carcinoma raro y usualmente su comportamiento es agresivo y de mal pronóstico, por lo que su tratamiento es quirúrgico, como se propuso en este caso; la pancreatoduodenectomía es el procedimiento más usado en estos casos y este tipo de tratamiento debe ser asociado a radioterapia o quimioterapia6,11.
Conclusión
Las neoplasias adenoneuroendocrinas mixtas son neoplasias raras y de mal pronóstico, su diagnóstico no es tan fácil de realizar debido a que los síntomas son poco específicos y su diagnóstico definitivo requiere confirmación por histología y complemento con estudios de inmunohistoquímica.
REFERENCIAS
1. Elpek GO. Mixed neuroendocrine-nonneuroendocrine neoplasms of the gastrointestinal system: An update. World J Gastroenterol. 2022;28(8):794-810. https://doi.org/10.3748/wjg.v28.i8.794 [ Links ]
2. Roy P, Chetty R. Goblet cell carcinoid tumors of the appendix: an overview. World J Gastrointest Oncol. 2010;2(6):251-8. https://doi.org/10.4251/wjgo.v2.i6.251 [ Links ]
3. La Rosa SL, Sessa F, Uccella S. Mixed neuroendocrine-nonneuroendocrine neoplasms (MiNENs): unifying the concept of a heterogeneous group of neoplasms. Endocr Pathol. 2016;27(4):284-311. https://doi.org/10.1007/s12022-016-9432-9 [ Links ]
4. Rindi G, Arnold R, Bosman FT, et al. Nomenclature and classification of neuroendocrine neoplasms of the digestive system. En: Bosman TF, Carneiro F, Hruban RH, Theise ND (editores). WHO Classification Tumours of the Digestive System, 4.a edición. Lyon: IARC; 2010. p. 13-14. [ Links ]
5. WHO Classification of Tumours Editorial Board. Digestive System Tumours. WHO Classification of Tumours. 5.a edición. WHO; 2019. [ Links ]
6. Frizziero M, Chakrabarty B, Nagy B, Lamarca A, Hubner RA, Valle JW, McNamara MG. Mixed Neuroendocrine Non-Neuroendocrine Neoplasms: A Systematic Review of a Controversial and Underestimated Diagnosis. J Clin Med. 2020;9(1):273. https://doi.org/10.3390/jcm9010273 [ Links ]
7. Wang J, He A, Feng Q, Hou P, Wu J, Huang Z, et al. Gastrointestinal mixed adenoneuroendocrine carcinoma: a population level analysis of epidemiological trends. J Transl Med. 2020;18(1):128. https://doi.org/10.1186/s12967-020-02293-0 [ Links ]
8. La Rosa S, Marando A, Furlan D, Sahnane N, Capella C. Colorectal poorly differentiated neuroendocrine carcinomas and mixed adenoneuroendocrine carcinomas: insights into the diagnostic immunophenotype, assessment of methylation profile, and search for prognostic markers. Am J Surg Pathol. 2012;36(4):601-11. https://doi.org/10.1097/PAS.0b013e318242e21c [ Links ]
9. Bazerbachi F, Kermanshahi TR, Monteiro C. Early precursor of mixed endocrine-exocrine tumors of the gastrointestinal tract: histologic and molecular correlations. Ochsner J. 2015;15(1):97-101. [ Links ]
10. Yeo MK, Yoon N, Bae GE. Clinicopathologic and Molecular Characteristics of Gastrointestinal MiNENs. Front Oncol. 2021;11:709097. https://doi.org/10.3389/fonc.2021.709097 [ Links ]
11. Paredes C, Velasco A, Wong-Achi X. Carcinoma adenoneuroendocrino mixto de la ampolla de Váter: reporte de caso. Rev Cir. 2019;71(3):261-5. https://doi.org/10.4067/s2452-45492019000300261 [ Links ]
Citación:
3Gutiérrez V, Benavides M, Márquez G, Gutiérrez AM, Polo F, Millán C, Gallo D. Carcinoma adenoneuroendocrino mixto en la ampolla de Váter: reporte de caso. Revista. colomb. Gastroenterol. 2023;38(1):100-105. https://doi.org/10.22516/25007440.903
Fuente de financiación
Recibido: 22 de Abril de 2022; Aprobado: 23 de Septiembre de 2022











 texto en
texto en 



