Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista colombiana de Gastroenterología
Print version ISSN 0120-9957On-line version ISSN 2500-7440
Rev. colomb. Gastroenterol. vol.38 no.1 Bogotá Jan./Mar. 2023 Epub June 08, 2023
https://doi.org/10.22516/25007440.908
Reporte de caso
Neumatosis quística intestinal con neumoperitoneo encapsulado no quirúrgico: presentación de caso y revisión de la literatura
1Specialist in Gastrointestinal Surgery and Digestive Endoscopy, Videoendoscopy Unit of Restrepo Ltda., Uniendoscopia.com. Bogotá, Colombia
2Specialist in Gastroenterology and Digestive Endoscopy, Center for Hepatic and Digestive Diseases CEHYD SAS. Bogotá, Colombia
Introducción:
la neumatosis quística intestinal es una entidad infrecuente, caracterizada por la presencia de quistes o burbujas de aire en la pared intestinal, usualmente asintomática. Sus formas no complicadas son manejadas conservadoramente y las graves requieren intervención quirúrgica. La presencia de neumoperitoneo es un hallazgo radiológico inquietante, pero no es indicador de intervención quirúrgica.
Caso clínico:
hombre de 23 años con pérdida de peso, diarrea y rectorragia, la colonoscopia mostró múltiples quistes violáceos localizados en el sigmoide y descendente que colapsaron tras la punción y biopsias, la tomografía axial computarizada (TAC) confirmó el diagnóstico y la presencia de un neumoperitoneo encapsulado. La ausencia de signos de potencial letalidad permitió un tratamiento conservador con remisión clínica durante los primeros 8 meses de seguimiento.
Discusión:
la fisiopatología de la neumatosis quística intestinal no está bien definida. En el paciente presentado el diagnóstico se realizó de forma incidental al realizar una colonoscopia por una rectorragia. El neumoperitoneo asintomático encapsulado debe interpretarse como un signo importante pero no determinante de intervención quirúrgica y su presencia junto con los antecedentes médicos, examen físico, bioquímico, endoscópico e imagenológico puede evitar cirugías innecesarias.
Palabras clave: Neumatosis cistoide intestinal; neumoperitoneo; intestino grueso; colonoscopia; observación
Introduction:
Pneumatosis cystoides intestinalis (PCI) is a rare entity characterized by cysts or air bubbles in the intestinal wall, usually asymptomatic. Its uncomplicated forms are managed conservatively, and the severe ones require surgical intervention. The presence of pneumoperitoneum is a disturbing radiological finding but not an indicator of surgical intervention.
Clinical case:
A 23-year-old man presented with weight loss, diarrhea, and rectal bleeding; a colonoscopy showed multiple violaceous cysts in the sigmoid and descending colon that collapsed after puncture and biopsies. Computed tomography (CT) confirmed the diagnosis and the presence of an encapsulated pneumoperitoneum. The absence of signs of potential lethality allowed conservative treatment with clinical remission during the first eight months of follow-up.
Discussion:
The pathophysiology of PCI is not well defined. Our patient’s diagnosis was incidental when performing a colonoscopy for rectal bleeding. Asymptomatic encapsulated pneumoperitoneum should be interpreted as an important but not decisive sign of surgical intervention. Its presence, along with the medical history and physical, biochemical, endoscopic, and imaging examination, can prevent unnecessary surgery.
Keywords: Pneumatosis cystoides intestinalis; pneumoperitoneum; large intestine; colonoscopy; observation
Introducción
La neumatosis quística intestinal (NQI) o neumatosis cystioides intestinalis (PCI) fue descrita por Du Vernoy en 17301, es una entidad clinicopatológica poco frecuente, pero bien identificada por la presencia de bulas o quistes aéreos en la subserosa del intestino delgado y en la submucosa del colon2, especialmente transverso, descendente y sigmoide, con mayor proporción en hombres (2,4:1)3. Usualmente es asintomática o con síntomas inespecíficos como dolor abdominal, diarrea, rectorragia, obstrucción, flatulencia y tenesmo rectal4, y puede ser un hallazgo incidental en colonoscopias y en estudios radiológicos. Histopatológicamente se caracteriza por presentar estructuras quísticas revestidas de histiocitos y células gigantes con reacción inflamatoria granulomatosa con eosinófilos y elastosis5.
Etiológicamente puede ser primaria o idiopática (15%) y secundaria, asociada a otras enfermedades (85%)3,6; de acuerdo con su gravedad clínica, se clasifica en neumatosis intestinal potencialmente letal (LTPI) y neumatosis intestinal benigna (BPI)4. La ruptura de los quistes puede causar neumoperitoneo, aire en el epiplón o neumorretroperitoneo en menos del 3% de los casos7, condiciones que obligan a decidir entre un manejo conservador o quirúrgico.
Se presenta el caso de un paciente de 23 años con cuatro meses de diarrea y rectorragia intermitente a quien en la colonoscopia se le encontró neumatosis quística que comprometía el sigmoide y descendente, asociada a colitis aguda infecciosa; la tomografía axial computarizada (TAC) de abdomen confirmó PCI y neumoperitoneo encapsulado. Se realizó un tratamiento conservador con antibiótico y presentó mejoría sin necesidad de cirugía luego de 8 meses de seguimiento.
Caso clínico
Se trata de un paciente masculino de 23 años, de procedencia urbana, con cuatro meses de episodios de tres días de duración, consistentes en incremento de la frecuencia en las deposiciones a tres al día y una en la noche, de consistencia líquida, con moco y sangre, asociados a distensión abdominal, flatulencia, pujo y tenesmo rectal, además de pérdida de 7 kg de peso. Tenía antecedente de tratamiento con isotretinoína por acné durante 4 años y vacuna para la enfermedad por coronavirus de 2019 (COVID-19) con la primera dosis de la vacuna de Pfizer; el coproscópico informó blastocystis hominis, Sudán III en materia fecal negativa y sangre oculta positiva; fue tratado como colitis amebiana con metronidazol y probiótico, con una mejoría rápida de la diarrea, pero con recaída sintomática a los 8 días.
En el examen físico los signos vitales fueron normales. Tenía peso de 67 kg, talla de 1,78 m e índice de masa corporal (IMC) de 21,15 kg/m2, sin hallazgos relevantes. Los laboratorios informaron proteína C-reactiva (PCR < 6,0), virus de la inmunodeficiencia humana (VIH) no reactivo, calprotectina fecal < 15 y antígeno carcinoembrionario < 0,5, con perfil hepático y renal normales. Con diagnóstico de diarrea prolongada y rectorragia en estudio, se realizó una endoscopia digestiva alta con la que se diagnosticó gastritis aguda erosiva y gastritis crónica difusa corporoantral, Helicobacter pylori (-) y biopsias de duodeno que descartaron enfermedad celíaca. En la colonoscopia, la mucosa rectal y del colon entre el ángulo esplénico y el íleon terminal fueron normales, pero en el sigmoide y descendente se encontraron múltiples lesiones quísticas, redondeadas, rojizas oscuras, confluentes, de hasta 1,5 cm, con mucosa suprayacente erosionada y blandas a la palpación con pinza (Figuras 1A y B). Ante la duda por el contenido líquido o aéreo de los quistes, se realizó una punción con aguja fina en uno de los de mayor tamaño, sin salida de líquido y con colapso completo del quiste (Figuras1C y D); igual situación se dio al tomar una biopsia de la pared de otro de los quistes, el cual también tenía colapso (Figura1E y F), hallazgos compatibles con neumatosis quística colónica asociada a colitis aguda erosiva de probable etiología infecciosa o parasitaria. No hubo dolor ni distensión abdominal u otro síntoma al final de la colonoscopia.
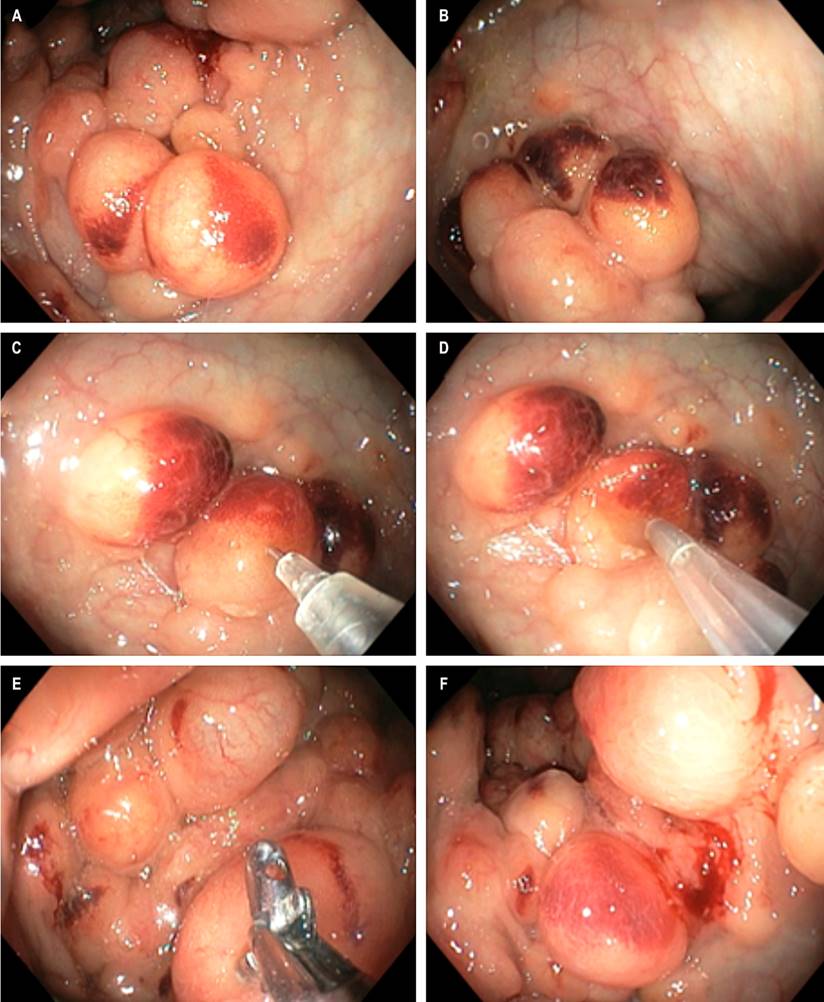
Figura 1 Colonoscopia. A y B. Múltiples imágenes quísticas en racimo en el sigmoide y descendente, con mucosa erosionada suprayacente por colitis aguda. C y D. Punción con aguja fina y succión de aire, sin salida de líquido, con colapso completo de la burbuja. E y F. Biopsia de la pared del quiste con colapso de la burbuja. Fuente: archivo de los autores.
La TAC de abdomen con contraste mostró múltiples burbujas de aire de paredes delgadas, sin extravasación de medio de contraste, predominantemente de distribución perihepática y, en menor grado, subfrénica izquierda (Figuras 2A y B), con múltiples burbujas de aire extraluminales, localizadas especialmente en las paredes de colon descendente y sigmoide (Figuras 2C y D), algunas de ellas en racimos, adheridas y adyacentes a una “cámara de neumoperitoneo encapsulada” de aproximadamente 160 mm de diámetro mayor en vecindad con el ángulo esplénico (Figuras 2E y F), compatibles con los hallazgos endoscópicos de PCI.
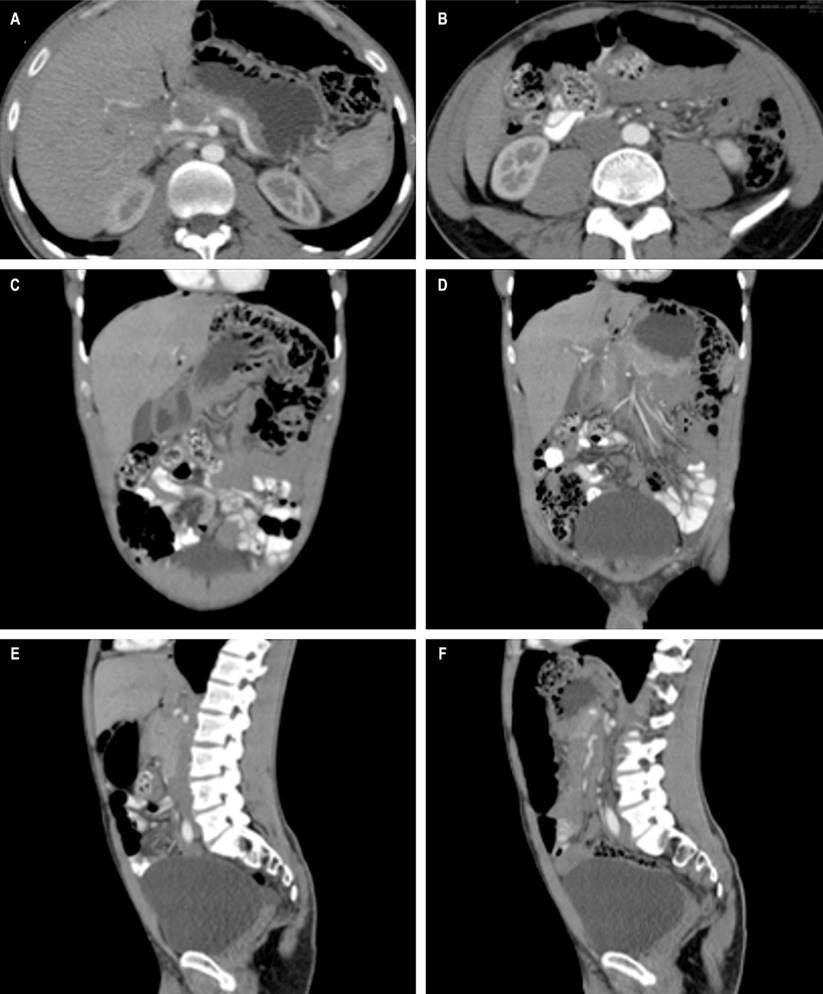
Figura 2 TAC de abdomen. A y B. Corte sagital. Neumatosis quística colónica en racimo, con múltiples burbujas de aire de paredes delgadas, sin extravasación del medio de contraste. C y D. Corte coronal. Múltiples burbujas de aire extraluminales, localizadas en las paredes del colon descendente y sigmoide. E y F. Corte axial. Neumoperitoneo en el abdomen anterior, de 16 cm de diámetro en vecindad con el hígado y en continuidad con las burbujas del ángulo esplénico del colon. Fuente: archivo de los autores.
La histopatología de la pared quística informó un proceso inflamatorio crónico hemorrágico con erosión focal, proliferación fibroblástica con angiectasias y neovascularizaciones reactivas multifocales. El análisis multidisciplinario integral de PCI con neumoperitoneo asintomático orientó a un tratamiento conservador con tinidazol 500 mg dos veces al día por 15 días, rifaximina 550 mg dos veces al día por 15 días, pinaverio/dimeticona 100/200 mg dos veces al día por 30 días, esomeprazol 40 mg/día por 30 días y fibra no soluble 20 mg/día por 30 días, con una marcada mejoría sintomática y desaparición de la diarrea y la rectorragia, que se mantuvo hasta el seguimiento realizado durante 8 meses.
Discusión
La neumatosis cystioides intestinalis se caracteriza por la presencia de quistes con gas en la submucosa o subserosa intestinal, ocurre en el intestino grueso en el 46% de los casos (especialmente en el sigmoide), el intestino delgado (27%), el estómago (5%), el intestino delgado y colon (7%), y muy ocasionalmente en el duodeno y recto3,8.
Dentro de los mecanismos fisiopatológicos atribuidos, se incluyen inflamación, daño físico de la mucosa intestinal, desequilibrio nutricional, disbiosis, dismotilidad gastrointestinal y disfunción inmunológica, asociados a factores predisponentes como cirugías con anastomosis intestinales, quimioterapia (rituximab, cetuximab), esclerodermia, enfermedades del tejido conectivo, enfermedad pulmonar, uso de medicamentos para la diabetes (voglibosa, acarbosa), o uso de tricloroetileno e inhibidores de tirosina-cinasa (sinutinib)8.
Su etiología es imprecisa e incluye teorías como la “mecánica” debido a que la obstrucción intestinal aumenta la presión intraluminal y promueve la formación de quistes; “pulmonar”, por enfermedades pulmonares obstructivas crónicas (EPOC, asma) en donde la ruptura de alvéolos y el neumomediastino subsecuente causan una disección aérea a lo largo de la aorta y de los vasos mesentéricos, terminando el aire en la pared intestinal; “bacteriana”, por el gas producido por las bacterias intestinales que atraviesan la mucosa y llegan hasta la submucosa; “deficiencia química y nutricional”, por fermentación bacteriana de los carbohidratos con producción aumentada de gas que penetra a la pared intestinal; “inmunológica” o por toxicidad intestinal (uso de quimioterapia y terapia hormonal) que genera paso de aire por disfunción funcional y orgánica de la pared intestinal9.
El diagnóstico se puede sospechar ante el hallazgo por colonoscopia óptica (CO) de quistes intramurales en racimos de color violáceo, que por la inflamación de la mucosa suprayacente simulan un contenido líquido; así como por la punción con aguja fina, en la cual se observa el colapso del quiste sin salida de líquido, o al apreciar la salida de burbujas del quiste al tomar biopsias bajo el agua6.
La colonoscopia virtual y la TAC de abdomen son los exámenes confirmatorios del diagnóstico mediante el hallazgo de quistes como racimos de uvas o en panal de abejas localizados en la pared intestinal y que en reconstrucciones con ventana de pulmón evidencian contenido gaseoso. En casos asociados a formas graves de PCI se puede observar dilatación intestinal, oclusión arterial o venosa, ascitis y gas venoso portohepático o portomesentérico4,9.
La PCI usualmente es asintomática (incluso con neumoperitoneo), o puede presentar síntomas inespecíficos; en estos casos el tratamiento puede ser conservador mediante observación y seguimiento4,6,8, oxigenoterapia hiperbárica10, antibióticos (metronidazol, tinidazol, rifaximina, quinolonas), probióticos tipo Bifidobacterium, terapia endoscópica como aspiración con aguja fina6,11 o resección electroquirúrgica de alta frecuencia de las paredes quísticas o escleroterapia, sin recomendarse el uso de argón plasma debido a la posible explosión por metano8, y cambio de quimioterapéuticos (tipo citostáticos o terapias moleculares dirigidas e inhibidores de tirosina-cinasa para patología tumoral metastásica esofágica, pulmonar, renal o de otro tipo)12.
En estos pacientes, el neumoperitoneo debe considerarse un signo incidental, y se deben descartar otras etiologías de neumoperitoneo no quirúrgico como aire posoperatorio retenido o causas torácicas, ginecológicas o abdominales, que en pacientes asintomáticos se pueden resolver espontáneamente, de modo que se evitan cirugías innecesarias13.
En pacientes sintomáticos con dolor abdominal, obstrucción intestinal, sangrado, irritación peritoneal, acidosis, gas portal y neumoperitoneo, debe considerarse la intervención quirúrgica dada la potencialidad de colitis isquémica, necrosis u obstrucción intestinal en curso2,14. La decisión de cirugía debe basarse en la presencia de condiciones asociadas de riesgo, un examen físico que sugiera peritonitis, predictores analíticos de mal pronóstico (pH < 7,3, bicarbonato < 20 mL/L, lactato > 2 mmol/L, amilasa sérica > 200 U/L) o la presencia de gas venoso portal15. El neumoperitoneo por sí solo no es ni predictor de gravedad ni indicador de cirugía de urgencia13.
Quirúrgicamente se puede encontrar una PCI en el sigmoide con un vólvulo crónico causante de la obstrucción parcial intermitente o perforación con peritonitis, que requerirá sigmoidectomía14,16. Si no se encuentra perforación visceral, peritonitis o indicación de resección intestinal, se puede terminar la cirugía y continuar con el manejo conservador según la causa etiológica13.
No existen guías de manejo para la PCI y en la mayoría de los casos se realiza de forma conservadora. En este paciente, el hallazgo incidental de neumoperitoneo con ausencia de síntomas, con un examen físico y paraclínicos normales, sin sospecha de peritonitis, permitió un tratamiento no quirúrgico basado en antibióticos para la colitis aguda infecciosa asociado, y se obtuvo una remisión sintomática hasta el octavo mes de seguimiento. Se realizará seguimiento colonoscópico, histopatológico y tomográfico al año del diagnóstico.
Conclusiones
En pacientes con un hallazgo incidental de PCI, las decisiones diagnósticas y terapéuticas deben ser rápidas, basadas en el análisis multidisciplinario de los antecedentes, el examen físico y el análisis bioquímico, endoscópico, histopatológico e imagenológico.
El hallazgo de neumoperitoneo en estos pacientes debe ser un signo de alarma, pero no un indicador absoluto de intervención quirúrgica.
REFERENCIAS
1. Du Vernoy JG. Aer intestinorum tam sub extima quam intima tunica inclusus: observationes anatomicae Acad. Acient Imp Petropol. 1730;5:213-25. [ Links ]
2. Rodríguez García R, Ramos Grande T, Muñoz Bellvís L. Pneumatosis cystoides intestinalis: a rare cause of acute abdomen. Rev Esp Enferm Dig. 2020;112(10):813-814. https://doi.org/10.17235/reed.2020.6906/2020 [ Links ]
3. Wu LL, Yang YS, Dou Y, Liu QS. A systematic analysis of pneumatosis cystoids intestinalis. World J Gastroenterol. 2013;19(30):4973-8. https://doi.org/10.3748/wjg.v19.i30.4973 [ Links ]
4. Di Pietropaolo M, Trinci M, Giangregorio C, Galluzzo M, Miele V. Pneumatosis cystoides intestinalis: case report and review of literature. Clin J Gastroenterol. 2020;13(1):31-36. https://doi.org/10.1007/s12328-019-00999-3 [ Links ]
5. Miwa W, Hiratsuka T, Sato K, Kato Y. Pneumatosis cystoides intestinalis lesions changing into yellowish plaque-like elastosis lesions during healing. Clin J Gastroenterol. 2020;13(6):1165-1172. https://doi.org/10.1007/s12328-020-01130-7 [ Links ]
6. Ling F, Guo D, Zhu L. Pneumatosis cystoides intestinalis: a case report and literature review. BMC Gastroenterol. 2019;19(1):176. https://doi.org/10.1186/s12876-019-1087-9 [ Links ]
7. Dawe N, Akhtar S. Pneumatosis intestinalis presenting with a pneumoperitoneum in a patient with chronic bronchiectasis: a delayed diagnosis of superior mesenteric artery ischaemia. BMJ Case Rep. 2010;2010:bcr0120102622. https://doi.org/10.1136/bcr.01.2010.2622 [ Links ]
8. Wang YJ, Wang YM, Zheng YM, Jiang HQ, Zhang J. Pneumatosis cystoides intestinalis: six case reports and a review of the literature. BMC Gastroenterol. 2018;18(1):100. https://doi.org/10.1186/s12876-018-0794-y [ Links ]
9. Brighi M, Vaccari S, Lauro A, D’Andrea V, Pagano N, Marino IR, et al. “Cystamatic” Review: Is Surgery Mandatory for Pneumatosis Cystoides Intestinalis? Dig Dis Sci. 2019;64(10):2769-2775. https://doi.org/10.1007/s10620-019-05767-4 [ Links ]
10. Nakatani K, Kato T, Okada S, Matsumoto R, Nishida K, Komuro H, et al. Successful treatment with hyperbaric oxygen therapy for pneumatosis cystoides intestinalis as a complication of granulomatosis with polyangiitis: a case report. J Med Case Rep. 2017;11(1):263. https://doi.org/10.1186/s13256-017-1421-1 [ Links ]
11. Takahashi K, Fujiya M, Ueno N, Ando K, Kashima S, Moriichi K, et al. Endoscopic Fine-Needle Aspiration Is Useful for the Treatment of Pneumatosis Cystoides Intestinalis With Intussusception. Am J Gastroenterol. 2019;114(1):13. https://doi.org/10.14309/ajg.0000000000000069 [ Links ]
12. de la Serna S, Luna A, de la Rosa H. Intestinal pneumatosis and pneumoperitoneum in an oncological scenario: a change of attitude. Rev Esp Enferm Dig. 2018;110(1):68-69. https://doi.org/10.17235/reed.2017.5333/2017 [ Links ]
13. Ribolla M, Conti L, Baldini E, Palmieri G, Grassi C, Banchini F, et al. Asymptomatic pneumoperitoneum in pneumatosis coli: A misleading operative indication. Int J Surg Case Rep. 2020;69:92-95. https://doi.org/10.1016/j.ijscr.2020.03.042 [ Links ]
14. Nishimura JM, Farzaneh T, Pigazzi A. Pneumatosis coli causing pneumoperitoneum. J Surg Case Rep. 2017;2017(1):rjw233. https://doi.org/10.1093/jscr/rjw233 [ Links ]
15. DuBose JJ, Lissauer M, Maung AA, Piper GL, O’Callaghan TA, Luo-Owen X, et al. Pneumatosis Intestinalis Predictive Evaluation Study (PIPES): a multicenter epidemiologic study of the Eastern Association for the Surgery of Trauma. J Trauma Acute Care Surg. 2013;75(1):15-23. https://doi.org/10.1097/TA.0b013e318298486e [ Links ]
16. Camargo González NE, Benavides González MA, Parra Medina R, Pérez Hernández CJ. Neumatosis quística intestinal en un adulto joven sin antecedentes clínicos: reporte de caso. Revista colombiana de Gastroenterología. 2021;36(Supl. 1):47-51. https://doi.org/10.22516/25007440.530 [ Links ]
Citación:
5Blanco-Avellaneda CJ, Prieto-Ortiz RG. Neumatosis quística intestinal con neumoperitoneo encapsulado no quirúrgico: presentación de caso y revisión de la literatura. Revista. colomb. Gastroenterol. 2023;38(1):111-116. https://doi.org/10.22516/25007440.908
Consentimiento informado
6Se obtuvo consentimiento informado por escrito del paciente para la publicación del caso y de sus imágenes adjuntas
Fuente de financiación
Recibido: 31 de Mayo de 2022; Aprobado: 16 de Diciembre de 2022











 text in
text in 



