Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista colombiana de Gastroenterología
versión impresa ISSN 0120-9957versión On-line ISSN 2500-7440
Rev. colomb. Gastroenterol. vol.38 no.2 Bogotá abr./jun. 2023 Epub 05-Sep-2023
https://doi.org/10.22516/25007440.970
Trabajos originales
Efectividad y seguridad de la miotomía de Heller laparoscópica para el tratamiento de la acalasia
1General and minimally invasive surgery specialist, Universidad de Antioquia, Hospital Universitario San Vicente Fundación. Professor, UdeA. Medellín, Colombia.
2General surgeon, assistant surgeon in the Transplant Unit, Hospital Universitario San Vicente Fundación. Rionegro, Antioquia, Colombia.
3Gastrointestinal surgery and digestive endoscopy specialist, Hospital Universitario de San Vicente Fundación. Medellín, Colombia.
Introducción:
la miotomía de Heller laparoscópica (MHL) se considera el tratamiento quirúrgico estándar en acalasia esofágica. A nivel local se desconocen las características clínicas de los pacientes y los resultados de la intervención.
Metodología:
estudio retrospectivo que incluye pacientes llevados a MHL durante un periodo de 8 años. Se analizaron variables demográficas, operatorias y posoperatorias. Mediante el puntaje de Eckardt se compararon síntomas antes y después de la intervención. Las variables continuas se expresan en promedios.
Resultados:
27 de 39 pacientes cumplieron los criterios de inclusión. El 51% fueron hombres y el promedio de edad fue de 48 años. La presión promedio del esfínter esofágico inferior fue de 36 mm Hg. El promedio de tiempo operatorio y sangrado fue de 133 minutos y 34 mL, respectivamente. La longitud promedio de la miotomía fue de 8,3 cm. Se adicionó funduplicatura parcial en todos los casos y en el 88% se realizó una endoscopia intraoperatoria. Se presentaron 2 perforaciones intraoperatorias de la mucosa. El promedio de estancia hospitalaria fue 2,7 días. Hubo una complicación médica y ninguna mortalidad. La disfagia mejoró en el 95% y el promedio del puntaje de Eckardt disminuyó de 7,7 a 1,2 luego de cirugía (p < 0,001). El seguimiento fue de 24 meses en promedio.
Conclusión:
la MHL con funduplicatura parcial es un procedimiento efectivo y seguro para el tratamiento de la acalasia. Se asocia a resolución de la disfagia en el 95% de los casos, su morbilidad es mínima y debe considerarse el tratamiento definitivo de elección.
Palabras clave: Acalasia del esófago; trastornos de la deglución; disfagia; aperistalsis esofágica; miotomía de Heller
Introduction:
Laparoscopic Heller myotomy (LHM) is widely recognized as the standard surgical treatment for esophageal achalasia. However, there is a lack of local data regarding the clinical characteristics of patients and the outcomes of this intervention.
Methodology:
This retrospective study analyzed patients who underwent LHM over an eight-year period. Demographic, operative, and postoperative variables were assessed. The Eckardt score was used to compare symptoms before and after the intervention. Continuous variables were presented as means.
Results:
Among the 39 patients assessed, 27 met the inclusion criteria. Of these, 51% were male, with an average age of 48 years. The average lower esophageal sphincter pressure was 36 mmHg. The mean operative time and bleeding were 133 minutes and 34 mL, respectively. The average length of the myotomy was 8.3 cm. Partial fundoplication was performed in all cases, and intraoperative endoscopy was conducted in 88% of the cases. Two intraoperative mucosal perforations occurred. The average length of hospital stay was 2.7 days. There was one medical complication but no mortality. Dysphagia significantly improved by 95%, and the mean Eckardt score decreased from 7.7 to 1.2 after surgery (p < 0.001). The average follow-up period was 24 months.
Conclusion:
LHM with partial fundoplication proves to be an effective and safe procedure for treating achalasia. It results in the resolution of dysphagia in 95% of cases and carries minimal morbidity. Therefore, LHM should be considered the definitive treatment of choice for achalasia.
Keywords: Esophageal achalasia; swallowing disorders; dysphagia; esophageal aperistalsis; Heller myotomy
Introducción
La acalasia esofágica es una entidad rara con una incidencia de 1 y prevalencia de 10 por cada 100 000 habitantes en Estados Unidos1. Se caracteriza principalmente por disfagia y dolor retroesternal, pero tiene otros síntomas asociados como regurgitación y pérdida de peso. El mecanismo fisiopatológico no es claramente entendido, aunque los síntomas se atribuyen a la ausencia de la peristalsis del cuerpo esofágico y a la falta de relajación del esfínter esofágico inferior (EEI)2. Es por esto que el término acalasia proviene del prefijo a- y el vocablo griego khalasis, que significa “sin relajación”.
Se requiere un alto índice de sospecha para el diagnóstico, pues hasta el 40% de los pacientes con acalasia pueden tener esofagogastroduodenoscopia (EGD) normal3. La radiografía de esófago con contraste (esofagograma) clásicamente muestra dilatación del esófago y estenosis en la unión esofagogástrica con el signo de terminación en “pico de ave”4. Sin embargo, el esofagograma puede tener hasta un 30% de falsos negativos. En enfermedad avanzada puede encontrarse un esófago gravemente dilatado, angulado y tortuoso, e incluso puede tener una forma sigmoidea (megaesófago)5.
La manometría esofágica confirma el diagnóstico4. En la práctica clínica existen dos técnicas para realizar la manometría: la de tipo convencional y la de alta resolución (AR)6. Esta última tiene una mayor precisión y permite identificar el tipo de acalasia (I, II o III), lo cual a su vez puede definir el pronóstico durante el tratamiento7,8. Se ha podido concluir que el tipo II responde mejor a cualquier forma de tratamiento y el tipo III es un predictor de respuesta negativa9.
Guías internacionales y artículos de expertos han propuesto algoritmos lógicos de tratamiento10,11. La terapia farmacológica con nitratos y antagonistas del calcio es la opción menos efectiva y se reserva para pacientes que por su condición clínica no son candidatos a terapias invasivas2. Otras opciones de manejo son la inyección endoscópica de toxina botulínica y la dilatación neumática endoscópica. La toxina botulínica se aplica en el EEI y su efectividad para el control de la disfagia es del 50% a un año12. Las dilataciones neumáticas con balón de acalasia tienen una efectividad temprana muy similar a la cirugía, pero con el tiempo su efecto disminuye. Se estima que casi el 50% de los pacientes requiere de una nueva dilatación en el seguimiento a 5 años13. La miotomía endoscópica transoral (POEM) es la más reciente estrategia de manejo, que consiste en la realización de una miotomía esofagogástrica por vía endoscópica con resultados iniciales alentadores14.
El manejo quirúrgico con miotomía de Heller es en la actualidad el estándar para el tratamiento definitivo de la acalasia. La mayoría de los estudios demuestra que la cirugía tiene un rendimiento superior al resto de alternativas y, gracias al abordaje laparoscópico, la morbilidad posoperatoria es muy baja15. En nuestro medio se desconocen las características clínicas de los pacientes con acalasia y los resultados del tratamiento quirúrgico. Los objetivos de esta investigación son determinar el grado de mejoría sintomática luego de la miotomía de Heller laparoscópica (MHL) y conocer la morbilidad del procedimiento.
Materiales y métodos
Tipo de estudio y pacientes
Se realizó un estudio de tipo descriptivo retrospectivo. Se estudiaron pacientes adultos con diagnóstico de acalasia remitidos a MHL en dos instituciones de alta complejidad en un período de 8 años. La información se obtuvo a través de la revisión de las historias clínicas y entrevista telefónica con los pacientes.
Se excluyeron a los pacientes operados por vía abierta o mediante abordaje torácico, a aquellos que no se podían contactar por medio alguno y los que tenían una miotomía previa. Las variables exploradas fueron las características demográficas y clínicas, hallazgos operatorios, complicaciones posoperatorias y seguimiento.
La evaluación sintomática se realizó mediante la escala de síntomas de Eckardt, un instrumento validado en la literatura que incluye los síntomas más relevantes de los pacientes con acalasia (disfagia, dolor retroesternal, regurgitación y pérdida de peso)16. La escala califica la gravedad de 0 a 3, según la ausencia del síntoma (0) o su presencia de forma ocasional (1), diaria (2) o constante (3). La puntuación total es de 0 a 12, y clasifica la enfermedad en estadios: puntaje de 0 a 1: estadio 0, puntaje de 2 a 3: estadio I, puntaje de 4 a 6: estadio II, y puntaje > 6: estadio III. Los estadios 0 y I posintervención se definen como remisión17.
Descripción del procedimiento
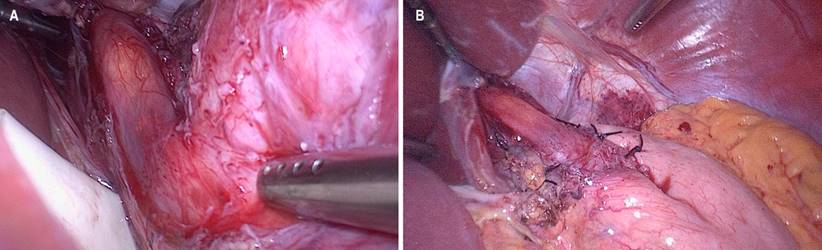
Se empleó una técnica quirúrgica americana de 5 puertos con el paciente en decúbito supino y con inclinación de la cama de cirugía en posición de Trendelenburg reverso. Se inició la disección en el lado izquierdo seccionando los vasos gástricos cortos con bisturí ultrasónico hasta identificar el pilar izquierdo del diafragma. Se libera la pars flaccida, se conserva la arteria gástrica izquierda y hepática accesoria si es el caso, se hace la liberación de la membrana frenoesofágica, de ambas cruras y del espacio retroesofágico. Una vez hay una disección circunferencial, se realiza una tracción del esófago de forma atraumática (con un dren de Penrose) y se libera su tercio distal en 360 grados. Luego se realiza una marcación del sitio de la miotomía en la cara anterior del esófago respetando el tronco principal izquierdo del nervio vago. Se procede luego a realizar la miotomía, la cual en la mayoría de los casos se realiza de manera roma con la ayuda de dos pinzas atraumáticas, y en otros casos con cauterio. La longitud es en promedio de 6 cm en el esófago y de 2 cm en el estómago. Se realiza una endoscopia intraoperatoria para verificar la integridad de la mucosa, la longitud de la miotomía y la apertura completa del cardias con la insuflación del endoscopio (Figura 1A). Se termina el procedimiento con una funduplicatura parcial posterior (Toupet) o parcial anterior (Dor) de acuerdo con el criterio del cirujano (Figura 1B). No se usan drenes y se realiza un cierre convencional de los sitios de los puertos. Se permite al paciente iniciar líquidos orales claros al día siguiente y luego continúa una dieta licuada por dos semanas.
Consideraciones éticas
El presente estudio cumplió con la normativa vigente de los comités de ética e investigación de las instituciones prestadoras de salud, además del comité de investigación y bioética de la Universidad de Antioquia. Se garantizó la confidencialidad de los datos obtenidos ya que solo los investigadores tuvieron acceso a los instrumentos de investigación.
Análisis estadístico
Las variables continuas se describieron con promedios y rangos, mientras que las variables categóricas se describieron como frecuencias y proporciones. Para la comparación de variables continuas se usó la t de Student. Todos los análisis estadísticos se realizaron con los programas Stata V. 14 y GraphPad Prism 7.
Resultados
Se identificó un total de 39 pacientes elegibles de los cuales se excluyeron 11 por no disponer de información suficiente y 1 por ser una reintervención; por tanto, se incluyó un total de 27 pacientes en el análisis. El 51% fueron hombres y el promedio de edad fue de 48 años. El 53,5% de los pacientes tenían comorbilidades. El tiempo de duración de los síntomas de acalasia previo a cirugía tuvo un promedio de 3,7 años (Tabla 1). Al total de los pacientes se les realizó EGD, esofagograma y manometría esofágica para el diagnóstico. Nueve pacientes tuvieron manometría AR. La presión basal del EEI tuvo un promedio de 36 mm Hg. Tres pacientes tuvieron tratamiento endoscópico o médico previo.
Tabla 1 Características demográficas y preoperatorias
| Variable | Frecuencia/promedio | Porcentaje/rango |
|---|---|---|
| Sexo | ||
| Femenino | 13 | 48,1% |
| Masculino | 14 | 51,8% |
| Edad (años) | 48 | 18-76 |
| Enfermedad cardiovascular | 8 | 29,6% |
| Enfermedad pulmonar | 2 | 7,4% |
| Enfermedad metabólica | 3 | 11,1% |
| Duración de los síntomas antes de la cirugía (años) | 3,7 | 1-20 |
| Tipo de acalasia | ||
| Tipo I | 2 | 7,4% |
| Tipo II | 7 | 25,9% |
| No reportado | 18 | 66,6% |
| Presión basal del EEI (mm Hg) | 36 | 20-58 |
EEI: esfínter esofágico inferior. Tabla elaborada por los autores.
El tiempo operatorio tuvo un promedio de 133 minutos, el promedio de la longitud de la miotomía fue de 8,3 cm y el promedio del sangrado fue de 34 mL (Tabla 2). En 25 pacientes se hizo funduplicatura tipo Toupet. Se presentaron 2 perforaciones intraoperatorias de la mucosa esofágica que se repararon con puntos separados de sutura absorbible 4-0 y en ambos casos se adicionó una funduplicatura tipo Dor. Estos dos pacientes tuvieron una evolución posoperatoria satisfactoria. En el intraoperatorio se realizó EGD a 25 pacientes. Las dos perforaciones mucosas se confirmaron por este medio.
Tabla 2 Variables operatorias
| Variable | Frecuencia/promedio | Porcentaje/rango |
|---|---|---|
| Tiempo quirúrgico (minutos) | 133 | 72-165 |
| Longitud de la miotomía (cm) | 8,3 | 6-10,5 |
| Sangrado intraoperatorio (mL) | 34 | 1-200 |
| Tipo de funduplicatura: | ||
| Toupet | 25 | 92,5% |
| Dor | 2 | 7,4% |
| Perforación mucosa | 2 | 7,4% |
| EGD intraoperatoria | 24 | 88,8% |
EGD: esofagogastroduodenoscopia. Tabla elaborada por los autores.
En el posoperatorio inmediato se realizó un esofagograma a 22 pacientes (88%) sin reportar fugas u otras complicaciones. El promedio de hospitalización posoperatoria fue de 2,7 días (1-14). Se presentó una complicación correspondiente a infección asociada a dispositivos intravasculares (flebitis). Este paciente tuvo una hospitalización de 14 días para el tratamiento antibiótico intravenoso. No se presentó ninguna mortalidad en esta serie.
La escala de Eckardt se obtuvo en 21 pacientes. El promedio de puntaje total preoperatorio fue de 7,7 frente a 1,2 del posoperatorio (p < 0,001). La disfagia tuvo promedios pre- y posoperatorios de 2,5 y 0,2, respectivamente (p < 0,001), y mejoró en el 95% de los pacientes. Resultados similares se presentaron con dolor retroesternal y regurgitación. La pérdida de peso mejoró en el 100% de los pacientes (p < 0,001) (Figura 2). En cuanto a la gravedad de la enfermedad, se obtuvo que en el preoperatorio 6 pacientes estaban en estadio 2 (28,5%) y 15 en estadio 3 (71,4%). Después de la intervención, 13 pacientes pasaron a estadio 0 (61,9%) y 8 pacientes pasaron a estadio 1 (38%).
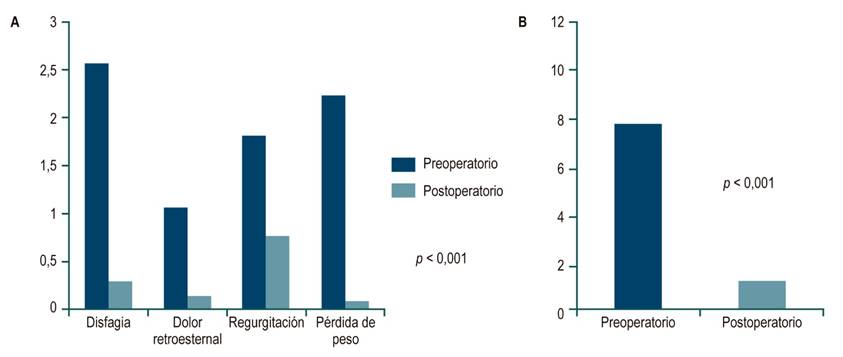
Figura 2 Comparación de síntomas por escala de Eckardt pre y postoperatoria. A. Comparación de promedios por tipo de síntoma. B. Comparación de promedios del puntaje total. p: t de Student. Imágenes propiedad de los autores.
El promedio de seguimiento posoperatorio fue de 24 meses (1-87). A 6 pacientes se les realizó un esofagograma y EGD de control al completar el año de la intervención. No se reportaron otras complicaciones o recurrencia. En cuanto al reflujo gastroesofágico (RGE), 5 pacientes (18,5%) reportaron pirosis después de la cirugía y fue percibida como leve.
Discusión
En la última década se han publicado artículos locales sobre acalasia; sin embargo, no se dispone de información precisa sobre los resultados del manejo quirúrgico en nuestra población5,18,19. El presente estudio es el primero que describe las características demográficas de los pacientes, las características relacionadas con el procedimiento y los resultados clínicos de la intervención en el seguimiento a mediano plazo.
Los pacientes tuvieron una distribución según el sexo y edad similar a la encontrada en la literatura20,21, con un tiempo de duración de los síntomas menor a lo reportado22. La frecuencia de los síntomas presentó hallazgos similares a otros estudios, y la disfagia fue el síntoma principal21,23,24.
La longitud de la miotomía fue muy similar a otros reportes con rangos de 6-8 cm25,26. Creemos que una miotomía de 6 cm en el esófago y de 2 cm en el estómago es suficiente para aliviar la obstrucción sin aumentar el riesgo de perforación mucosa o sangrado. Se presentó una perforación de la mucosa en 2 pacientes (7%), hallazgo que se encuentra dentro de la tasa reportada (6,9%-7,8%)27-29. Por fortuna, los pacientes con perforaciones de la mucosa detectadas y reparadas en el mismo acto operatorio tienen un curso posoperatorio similar a los demás pacientes, tal y como se observó en el presente estudio. Al 88% de los pacientes se les realizó EGD intraoperatoria con el fin de evaluar más objetivamente la miotomía y confirmar la integridad de la mucosa. Este estudio intraoperatorio es clave para garantizar mejores resultados clínicos según las recomendaciones de los expertos30.
Se estima que la incidencia de RGE es hasta del 47,6% en pacientes con cirugía de Heller sin funduplicatura frente a 9,1% cuando se adiciona una funduplicatura31. En este estudio, al 92,5% se le realizó una funduplicatura tipo Toupet y al 7,4% restante fue de tipo Dor. La recomendación clara es que la funduplicatura debe ser parcial ya que con la total (tipo Nissen) existe mayor riesgo de disfagia. Aunque no existen grandes diferencias en realizar un parcial anterior (Dor) o un parcial posterior (Toupet)32,33, nos inclinamos más por la funduplicatura tipo Toupet, que en cierto modo mantiene abiertos los bordes de la miotomía y podría prevenir la formación de fibrosis anterior y, en consecuencia, la recurrencia de la disfagia. Reservamos la funduplicatura tipo Dor para aquellos pacientes que presentan perforación de la mucosa y en quienes resulta más lógico cubrir la línea de sutura con el fondo gástrico.
El tiempo quirúrgico se determina por la experiencia del cirujano y fue similar al de otros estudios25,26,31. El tiempo de hospitalización fue menor a lo mencionado en otros reportes26,31. En este estudio solo se presentó una complicación posoperatoria de tipo médico y no relacionada directamente con el procedimiento. No hubo ninguna mortalidad en la serie. Lo anterior confirma que la miotomía de Heller laparoscópica en manos expertas es un procedimiento extremadamente seguro y asociado a una morbilidad casi nula.
Existe evidencia sustancial que demuestra la efectividad de la MHL. Cuatro metaanálisis, demostraron que el manejo más apropiado para pacientes con acalasia es el tratamiento quirúrgico, pues se asocia a la resolución de la disfagia en promedio al 100% en 1 año y 77% en 5 años15,28,34,35. En esta serie, la mejoría de la disfagia fue de 95% con un promedio de seguimiento de 24 meses, además de que el 100% de los pacientes terminaron en estadio 0 o 1 en el puntaje de Eckardt, que los ubica en la categoría de remisión de la enfermedad.
El POEM es una reciente alternativa terapéutica que se encuentra disponible principalmente en centros de endoscopia de referencia a nivel internacional36. En nuestro país se publicó una experiencia inicial en 4 pacientes con buenos resultados37. La efectividad de esta técnica podría ser comparable con la MHL, pero aún no hay información robusta ni seguimiento a largo plazo38. Sus principales desventajas son que requiere de anestesia general, requiere instrumental endoscópico especializado, la curva de aprendizaje es larga y, además, carece de la posibilidad de adicionar un procedimiento antirreflujo, lo cual podría resultar en RGE de novo hasta en el 40% de los pacientes34.
Se identificaron algunas limitaciones en el estudio. Primero, no se hizo manometría de control para evaluar el impacto de la intervención sobre la presión del EEI. Esto puede deberse a limitaciones propias de nuestro sistema de salud o a la percepción del paciente que, luego de que mejoran sus síntomas, considera innecesaria la realización de más estudios. Sin embargo, se ha demostrado que los valores de puntaje Eckardt < 4 o estadios < 1 se correlacionan con manometrías o esofagogramas que muestran una adecuada función esofágica39. Debido a que no hay actualmente una recomendación clara sobre los estudios rutinarios de control como EGD, esofagograma, manometría o pHmetría, creemos que estos se deben realizar dependiendo de la sintomatología del paciente.
Otra limitante importante es su naturaleza retrospectiva y la baja cantidad de pacientes, debido principalmente a la baja prevalencia de la enfermedad. Así mismo, hubo pérdida de seguimiento de algunos pacientes, lo cual disminuyó la información disponible para el análisis. Sin embargo, este estudio puede ser el punto de partida para nuevas investigaciones que hagan una valoración más objetiva y completa de los resultados de la MHL mediante estudios de anatomía y fisiología esofágica. Esto permitiría medir cambios importantes en la evolución de la enfermedad, como el diámetro del esófago, la presión del EEI y la exposición a reflujo ácido, entre otros.
Conclusión
La miotomía de Heller laparoscópica (MHL) es un procedimiento efectivo y seguro para el tratamiento de acalasia. Esta modalidad continúa siendo el estándar de manejo, pues resulta en una mejoría a mediano plazo de la disfagia en el 95% de los casos y en una mejoría sintomática global en todos los pacientes. Se asocia a una corta estancia hospitalaria y mínima morbilidad.
REFERENCIAS
1. Pandolfino JE, Gawron AJ. Achalasia. JAMA. 2015;313(18):1841. https://doi.org/10.1001/jama.2015.2996 [ Links ]
2. Pandolfino JE, Kahrilas PJ. Presentation, Diagnosis, and Management of Achalasia. Clinical Gastroenterology and Hepatology. 2013;11(8):887-97. https://doi.org/10.1016/j.cgh.2013.01.032 [ Links ]
3. Vaezi M, Krill J, Naik R. Clinical management of achalasia: current state of the art. Clin Exp Gastroenterol. 2016;9:71-82. https://doi.org/10.2147/CEG.S84019 [ Links ]
4. Tuason J, Inoue H. Current status of achalasia management: a review on diagnosis and treatment. J Gastroenterol. 2017;52(4):401-6. https://doi.org/10.1007/s00535-017-1314-5 [ Links ]
5. Rondón-Carvajal J, Ardila Hani C, Hani de Ardila AC, Vargas Rubio RD, Leguízamo Naranjo AM, Cañadas Garrido RA, et al. Megaesófago como complicación de acalasia: Reporte de caso y revisión narrativa de la literatura. Rev Colomb Gastroenterol. 2020;35(4):551-7. https://doi.org/10.22516/25007440.460 [ Links ]
6. Spechler SJ, Talley N, Robson K. Achalasia: Pathogenesis, clinical manifestations, and diagnosis [Internet]. UpToDate; 2019 [consultado el 15 de enero de 2020]. Disponible en: Disponible en: https://www.uptodate.com/contents/achalasia-pathogenesis-clinical-manifestations-and-diagnosis [ Links ]
7. Pandolfino JE, Kwiatek MA, Nealis T, Bulsiewicz W, Post J, Kahrilas PJ. Achalasia: A New Clinically Relevant Classification by High-Resolution Manometry. Gastroenterology. 2008;135(5):1526-33. https://doi.org/10.1053/j.gastro.2008.07.022 [ Links ]
8. Yadlapati R, Kahrilas PJ, Fox MR, Bredenoord AJ, Prakash Gyawali C, Roman S, et al. Esophageal motility disorders on high‐resolution manometry: Chicago classification version 4.0? Neurogastroenterol Motil. 2021;33(1):e14053. https://doi.org/10.1111/nmo.14053 [ Links ]
9. Pandolfino JE, Ghosh SK, Rice J, Clarke JO, Kwiatek MA, Kahrilas PJ. Classifying Esophageal Motility by Pressure Topography Characteristics: A Study of 400 Patients and 75 Controls. Am J Gastroenterol. 2008;103(1):27-37. https://doi.org/10.1111/j.1572-0241.2007.01532.x [ Links ]
10. Schlottmann F, Herbella F, Allaix ME, Patti MG. Modern management of esophageal achalasia: From pathophysiology to treatment. Curr Probl Surg. 2018;55(1):10-37. https://doi.org/10.1067/j.cpsurg.2018.01.001 [ Links ]
11. Vaezi MF, Pandolfino JE, Yadlapati RH, Greer KB, Kavitt RT. ACG Clinical Guidelines: Diagnosis and Management of Achalasia. American Journal of Gastroenterology. 2020;115(9):1393-411. https://doi.org/10.14309/ajg.0000000000000731 [ Links ]
12. Eckardt AJ, Eckardt VF. Treatment and surveillance strategies in achalasia: an update. Nat Rev Gastroenterol Hepatol. 2011;8(6):311-9. https://doi.org/10.1038/nrgastro.2011.68 [ Links ]
13. Boeckxstaens GE, Annese V, des Varannes SB, Chaussade S, Costantini M, Cuttitta A, et al. Pneumatic Dilation versus Laparoscopic Heller’s Myotomy for Idiopathic Achalasia. N Engl J Med. 2011;364(19):1807-16. https://doi.org/10.1056/NEJMoa1010502 [ Links ]
14. Zaninotto G, Bennett C, Boeckxstaens G, Costantini M, Ferguson MK, Pandolfino JE, et al. The 2018 ISDE achalasia guidelines. Dis Esophagus. 2018;31(9). https://doi.org/10.1093/dote/doy071 [ Links ]
15. Wang L, Li YM, Li L. Meta-Analysis of Randomized and Controlled Treatment Trials for Achalasia. Dig Dis Sci. 2009;54(11):2303-11. https://doi.org/10.1007/s10620-008-0637-8 [ Links ]
16. Eckardt VF, Aignherr C, Bernhard G. Predictors of outcome in patients with achalasia treated by pneumatic dilation. Gastroenterology. 1992;103(6):1732-8. https://doi.org/10.1016/0016-5085(92)91428-7 [ Links ]
17. Taft TH, Carlson DA, Triggs J, Craft J, Starkey K, Yadlapati R, et al. Evaluating the reliability and construct validity of the Eckardt symptom score as a measure of achalasia severity. Neurogastroenterol Motil. 2018;30(6):e13287. https://doi.org/10.1111/nmo.13287 [ Links ]
18. Prieto RG, Prieto JE, Casas F, Ballén H. Acalasia, una visión actual. Rev Colomb Cir. 2019;34(2):171-8. https://doi.org/10.30944/20117582.111 [ Links ]
19. Borráez B, Patti M. Miotomía de Heller por vía laparoscópica: un procedimiento seguro. Rev Colomb Cir. 2014;29(3):182-7. [ Links ]
20. Vaezi MF, Richter JE. Diagnosis and Management of Achalasia. Am J Gastroenterol. 1999;94(12):3406-12. https://doi.org/10.1111/j.1572-0241.1999.01639.x [ Links ]
21. Fisichella PM, Raz D, Palazzo F, Niponmick I, Patti MG. Clinical, Radiological, and Manometric Profile in 145 Patients with Untreated Achalasia. World J Surg. 2008;32(9):1974-9. https://doi.org/10.1007/s00268-008-9656-z [ Links ]
22. Vaezi MF. The American College ofGastroenterology ’s New Guidelines on Achalasia: What Clinicians Need to Know. Curr Gastroenterol Rep. 2013;15(12):358. https://doi.org/10.1007/s11894-013-0358-9 [ Links ]
23. Vela MF, RJE. Management of achalasia at a tertiary center-a complicated disease. Gastroenterology . 2003;4(124):p.A236. https://doi.org/10.1016/S0016-5085(03)81186-1 [ Links ]
24. Tsuboi K, Hoshino M, Srinivasan A, Yano F, Hinder RA, DeMeester TR, et al. Insights Gained from Symptom Evaluation of Esophageal Motility Disorders: A Review of 4,215 Patients. Digestion. 2012;85(3):236-42. https://doi.org/10.1159/000336072 [ Links ]
25. Nau P, Rattner D. Laparoscopic Heller Myotomy as the Gold Standard for Treatment of Achalasia. J Gastrointest Surg. 2014;18(12):2201-7. https://doi.org/10.1007/s11605-014-2655-5 [ Links ]
26. Ursut B, Alecu L, Tulin A, Enciu O. Laparoscopic treatment in achalasia of the cardia. Chirurgia (Bucur). 2014;109(5):604-7. [ Links ]
27. Agrusa A, Romano G, Bonventre S, Salamone G, Cocorullo G, Gulotta G. Laparoscopic treatment for esophageal achalasia: experience at a single center. G Chir. 2013;34(7-8):220-3. https://doi.org/10.11138/gchir/2013.34.7.220 [ Links ]
28. Campos GM, Vittinghoff E, Rabl C, Takata M, Gadenstätter M, Lin F, et al. Endoscopic and Surgical Treatments for Achalasia. Ann Surg. 2009;249(1):45-57. https://doi.org/10.1097/SLA.0b013e31818e43ab [ Links ]
29. Illés A, Farkas N, Hegyi P, Garami A, Szabó I, Solymár M, et al. Is Heller Myotomy Better than Balloon Dilation? A Meta-Analysis. Journal of Gastrointestinal and Liver Diseases. 2017;26(2):121-7. https://doi.org/10.15403/jgld.2014.1121.262.myo [ Links ]
30. Stefanidis D, Richardson W, Farrell TM, Kohn GP, Augenstein V, Fanelli RD. SAGES guidelines for the surgical treatment of esophageal achalasia. Surg Endosc. 2012;26(2):296-311. https://doi.org/10.1007/s00464-011-2017-2 [ Links ]
31. Zonca P, Cambal M, Labas P, Hrbaty B, Jacobi CA. The role of laparoscopic Heller myotomy in the treatment of achalasia. Bratisl Lek Listy. 2014;115(3):156-60. https://doi.org/10.4149/BLL_2014_033 [ Links ]
32. Richards WO, Torquati A, Holzman MD, Khaitan L, Byrne D, Lutfi R, et al. Heller Myotomy Versus Heller Myotomy With Dor Fundoplication for Achalasia. Ann Surg. 2004;240(3):405-15. https://doi.org/10.1097/01.sla.0000136940.32255.51 [ Links ]
33. Rawlings A, Soper NJ, Oelschlager B, Swanstrom L, Matthews BD, Pellegrini C, et al. Laparoscopic Dor versus Toupet fundoplication following Heller myotomy for achalasia: results of a multicenter, prospective, randomized-controlled trial. Surg Endosc. 2012;26(1):18-26. https://doi.org/10.1007/s00464-011-1822-y [ Links ]
34. Wang L, Li YM, Li L, Yu CH. A systematic review and meta-analysis of the Chinese literature for the treatment of achalasia. World J Gastroenterol. 2008;14(38):5900. https://doi.org/10.3748/wjg.14.5900 [ Links ]
35. Yaghoobi M, Mayrand S, Martel M, Roshan-Afshar I, Bijarchi R, Barkun A. Laparoscopic Heller’s myotomy versus pneumatic dilation in the treatment of idiopathic achalasia: a meta-analysis of randomized, controlled trials. Gastrointest Endosc. 2013;78(3):468-75. https://doi.org/10.1016/j.gie.2013.03.1335 [ Links ]
36. Moonen AJ, Boeckxstaens GE. Management of Achalasia. Gastroenterol Clin North Am. 2013;42(1):45-55. https://doi.org/10.1016/j.gtc.2012.11.009 [ Links ]
37. Rodríguez-Fajardo JA, Mantilla-Gaviria HJ, Pineda-Ovalle LF, Jalal-Espitia AA, Escobar-Cruz HJ, Arbelaez-Méndez VH, et al. Miotomía endoscópica por vía oral (POEM) para el tratamiento de Acalasia: nuestras primeras experiencias. Rev Colomb Gastroenterol . 2018;33(3):228. https://doi.org/10.22516/25007440.197 [ Links ]
38. Hungness ES, Teitelbaum EN, Santos BF, Arafat FO, Pandolfino JE, Kahrilas PJ, et al. Comparison of Perioperative Outcomes Between Peroral Esophageal Myotomy (POEM) and Laparoscopic Heller Myotomy. Journal of Gastrointestinal Surgery. 2013;17(2):228-35. https://doi.org/10.1007/s11605-012-2030-3 [ Links ]
39. Krieger‐Grübel C, Tutuian R, Borovicka J. Correlation of esophageal clearance and dysphagia symptom assessment after treatment for achalasia. United European Gastroenterol J. 2016;4(1):55-61. https://doi.org/10.1177/2050640615584732 [ Links ]
Citación: Toro JP, Muñoz-García CL, Escobar-Pérez RM. Efectividad y seguridad de la miotomía de Heller laparoscópica para el tratamiento de la acalasia. Revista. colomb. Gastroenterol. 2023;38(2):131-137. https://doi.org/10.22516/25007440.970
Recibido: 20 de Septiembre de 2022; Aprobado: 17 de Noviembre de 2022











 texto en
texto en