Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista colombiana de Gastroenterología
versión impresa ISSN 0120-9957versión On-line ISSN 2500-7440
Rev. colomb. Gastroenterol. vol.38 no.2 Bogotá abr./jun. 2023 Epub 06-Sep-2023
https://doi.org/10.22516/25007440.997
Artículo de revisión
Trastornos de la interacción cerebro-intestino (trastornos funcionales digestivos), racionalidad para el uso de la neuromodulación
1Gastroenterologist and clinical epidemiologist, Gut Médica, Digestive Health Institute. Bogotá, Colombia.
2Internal medicine, gastroenterology, and epidemiology Specialist. Director, Gut Médica, Digestive Health Institute. Bogotá, Colombia.
3Internal medicine and gastroenterology specialist, Gastromedicall, Clínica de la Colina, Gut Médica, Digestive Health Institute. Bogotá, Colombia.
4Physician and surgeon, internal medicine, gastroenterology, and epidemiology specialist. Head of gastroenterology, Clínica El Country. Bogotá, Colombia.
En el amplio espectro de las opciones terapéuticas para el manejo de los trastornos funcionales digestivos, que se han redefinido por la Fundación Roma en los criterios Roma IV como trastornos de la interacción cerebro-intestino (TICI), algunos medicamentos con efectos antidepresivos, ansiolíticos o antipsicóticos se utilizan con mayor frecuencia. Estos medicamentos, que actúan en la disfunción neurogastroenterológica de estos trastornos, también han sido renombrados por la Fundación Roma como neuromoduladores, para que ahora puedan aprovecharse sus beneficios terapéuticos en este ámbito clínico, debido a su utilización como medicamentos psiquiátricos.
Esta revisión narrativa tiene por objeto actualizar y precisar las indicaciones de los neuromoduladores en los principales TICI, y en esta primera sección se aborda la racionalidad y justificación para su utilización.
Palabras clave: Trastornos funcionales digestivos; neuromodulación; antidepresivos
Within the broad range of therapeutic options for managing functional gastrointestinal disorders, recently redefined as Disorders of Gut-Brain Interaction (DGBI) by the Rome Foundation in the Rome IV criteria, certain medications with antidepressant, anxiolytic, or antipsychotic effects are commonly employed. These drugs, now referred to as neuromodulators by the Rome Foundation, target the neurogastroenterological dysfunction associated with these disorders. Consequently, their clinical utility as psychiatric medications can now be leveraged to benefit patients with DGBI.
This narrative review aims to provide an updated and specific overview of the indications for neuromodulators in the primary DGBI. The first section of this review focuses on the rationale and justification for their use.
Keywords: Functional gastrointestinal disorders; neuromodulation; antidepressants
Introducción
Los trastornos funcionales digestivos han sido redefinidos por la Fundación Roma en los criterios Roma IV con una nueva terminología denominada trastornos de la interacción cerebro-intestino (TICI)1, y estos son los diagnósticos más comunes en gastroenterología. Estas condiciones tienen una alta prevalencia y afectan hasta al 40% de las personas en un momento dado, y dos tercios de estas personas tendrán síntomas crónicos y fluctuantes y algunos de gran intensidad1. Dado el amplio espectro de posibilidades terapéuticas con que se abordan los TICI, el concepto de neuromodulación, con medicamentos que actúan en la disfunción neurogastroenterológica de estos trastornos, que se extiende desde el sistema nervioso central (SNC) hasta el sistema nervioso entérico (SNE), también han sido renombrados por la Fundación Roma2 desde su utilización como medicamentos psiquiátricos para alejarlos de su estigmatización, con el fin de aprovechar sus beneficios terapéuticos.
Esta revisión tiene por objeto actualizar y precisar las indicaciones de los neuromoduladores en los principales TICI, y en esta primera sección se abordan las razones para su utilización.
Racionalidad
Eje cerebro-intestino, sus bases
El tracto gastrointestinal tiene una importante función de permitir la adquisición de los nutrientes por sus funciones motoras, secretoras y absortivas, y a su vez constituye una barrera para el contenido luminal que protege frente a sustancias o sustratos potencialmente patogénicos y antigénicos de lo ingerido o de la propia microbiota3. Todo lo anterior requiere de una capacidad de monitorizar eventos en la pared intestinal y dentro de la luz intestinal para poder orquestar los reflejos que provocan patrones apropiados de motilidad, absorción, secreción y flujo sanguíneo para digerir y absorber o para diluir y expulsar el contenido gastrointestinal. Los mecanismos del SNE e inmune juegan un papel fundamental en la activación de estos reflejos mediante la transmisión de información sensorial a los circuitos reflejos entéricos, que proporcionan control local y, luego, a través de las vías aferentes, informar al SNC para proporcionar una respuesta eferente3-5.
Sistema nervioso entérico
Es conocido universalmente como el cerebro intestinal, tiene una organización neural jerárquica cuyo objetivo es regular momento a momento la actividad de glándulas, musculatura y circulación gastrointestinal, de tal manera que se generen patrones de secreción y motilidad durante los diferentes estados y fases de la digestión y durante los períodos interprandiales6,7. El SNE tiene conexiones sinápticas entre las neuronas sensoriales, las interneuronas y las neuronas motoras. Las interneuronas están interconectadas sinápticamente en redes neuronales, que procesan información sobre el estado del intestino y contienen una “biblioteca” de programas para diferentes patrones de comportamiento. Las neuronas motoras inervan el músculo, glándulas secretoras y vasos sanguíneos. Las neuronas musculomotoras inician o inhiben la actividad contráctil de la musculatura y determina su fuerza de contracción minuto a minuto. Las neuronas motoras secretoras estimulan las glándulas secretoras para que secreten cloruro, bicarbonato y moco, y determinar la osmolaridad y el contenido líquido del lumen6,7.
La interacción del SNE con las células intersticiales de Cajal (CIC) es un factor determinante de cada uno de los programas de motilidad almacenados en su biblioteca. Las CIC son células marcapasos no neuronales que también se conectan entre sí para formar redes eléctricas sincitiales que se extienden alrededor de la circunferencia y en todo el eje longitudinal del intestino delgado y grueso. Las redes CIC generan potenciales eléctricos de marcapasos (también llamados ondas eléctricas lentas) que se diseminan a través de uniones comunicantes en el músculo circular o longitudinal intestinal, donde despolarizan el músculo al potencial de acción umbral y, por tanto, desencadenar contracciones8. En general, un SNE normal es esencial para un intestino sano y la ausencia de síntomas irritantes, como los asociados con los criterios de diagnóstico de cualquier TICI. Cualquier cambio neuropático en el SNE muy probablemente resultará en un intestino sintomático. La motilidad propulsora funcional y su integración con funciones secretoras especializadas no puede trabajar en ausencia del SNE7. El dolor que se origina en el tracto gastrointestinal (GI) asciende al cerebro a través de las mismas vías trineuronales que transmiten estímulos nocivos somáticos (Figura 1).
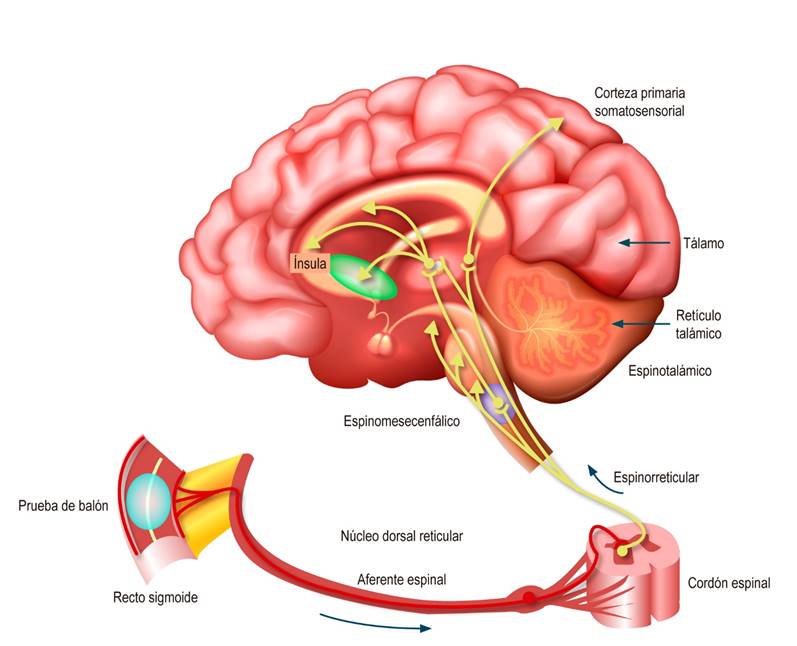
Figura 1 Vías neuronales aferentes en los TICI2. Modificado con permiso de: Drossman DA, et al. Gastroenterology. 2018;154(4):1140-1171.e1.
Procesamiento central vía centros y conectomas
Los estímulos viscerales provenientes de la periferia se transmiten hasta el asta dorsal de la médula espinal, donde se produce la primera sinapsis. La última sinapsis primaria ocurre en cuerpos celulares dentro del cerebro. Para el tracto espinotalámico, la neurona de tercer orden está dentro del tálamo, que actúa como el centro principal para la matriz del dolor central9. El tálamo está organizado anatómicamente de tal manera que las señales nocivas de la médula espinal se envían a regiones específicas de la corteza somatosensorial primaria para la localización de la señal. Por el contrario, la localización cortical del dolor visceral es típicamente menos preciso, ya que la señal ascendente de la médula espinal inerva en múltiples niveles y las fuentes de señales de dolor visceral y las fuentes somáticas pueden ser transmitidas por la médula y neuronas de segundo orden (convergencia viscerosomática). Dentro del centro matriz del dolor, el tálamo envía señales a las regiones del cerebro que procesan el componente emocional de la señal de dolor, como la amígdala, ínsula, corteza del cíngulo anterior, hipocampo y núcleo accumbens. En condiciones normales, la activación de la matriz del dolor central proporciona las respuestas conductuales apropiadas (emoción desagradable, vigilancia, o inmovilización del sitio afectado) para promover la recuperación y aprender a evitarlo para prevenir futuras lesiones3,9.
En la actualidad, la interconectividad de los núcleos y matrices de procesamiento del dolor, señales viscerales y somáticas buscan ser interpretadas bajo el concepto de conectomas10, que reúnen áreas funcionales y neuroanatómicas particulares responsables de dicha función, como se ha podido verificar a través de múltiples neuroimágenes11,12.
La respuesta eferente luego del procesamiento central se dirige por proyecciones descendentes de los núcleos del tronco encefálico, incluida la sustancia gris periacueductal, núcleos del rafe, locus cerúleo y médula ventral rostral lateral, al asta dorsal de la médula espinal, que modula la transmisión de dolor aferente a nivel de la primera sinapsis. Estas vías descendentes son controladas de arriba hacia abajo por las regiones del cerebro, en particular por la amígdala y la corteza del cíngulo anterior perigenual. Es muy importante señalar que estas proyecciones son principalmente de naturaleza opioide, noradrenérgica y serotoninérgica; como se observa adelante, los antidepresivos pueden interferir profundamente con estos procesos moduladores (Figura 2)3.
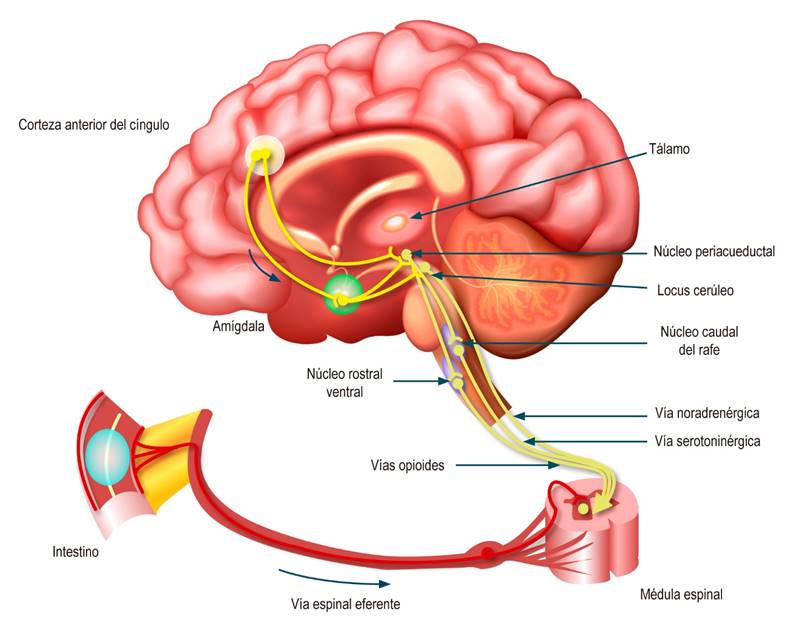
Figura 2 Vías neuronales eferentes en los TICI2. Modificado con permiso de: Drossman DA, et al. Gastroenterology. 2018;154(4):1140-1171.e1.
Hipersensibilidad: sensibilización periférica y central
Después de un fenómeno inflamatorio o una lesión gastrointestinal, las neuronas sensoriales expresan una gran variedad de receptores que son activados por mediadores liberados de varias células fuentes dentro de la pared intestinal. Las neurotrofinas, por ejemplo, pueden jugar un papel en la conducción y la remodelación de los axones de la inervación sensorial después de la noxa. Tanto el factor de crecimiento nervioso como el factor neurotrófico derivado de la glía son importantes en la respuesta adaptativa a lesión nerviosa e inflamación13. Muchos otros mediadores son liberados durante la inflamación, la lesión o la isquemia, provenientes de vasos sanguíneos, músculo y neuronas, plaquetas, leucocitos, linfocitos, macrófagos, mastocitos, glías y fibroblastos. Algunos mediadores actúan directamente sobre las terminales nerviosas sensoriales y otros actúan indirectamente, lo que provoca la liberación de otros agentes de las células cercanas. Se ha denominado sopa inflamatoria sensibilizante, pues contiene aminas, purinas, prostanoides, proteasas, citocinas, entre otros, que actúan sobre las terminales nerviosas sensoriales para aumentar la sensibilidad tanto mecánica como química; esta actividad como neuromediadores junto con los neuropéptidos que prevalecen luego de la inflamación aguda finalmente inducen fenómenos conocidos como neuroplasticidad del SNE, que finalmente serían los responsables de la perpetuación de hipersensibilidad periférica (Figura 3)13.
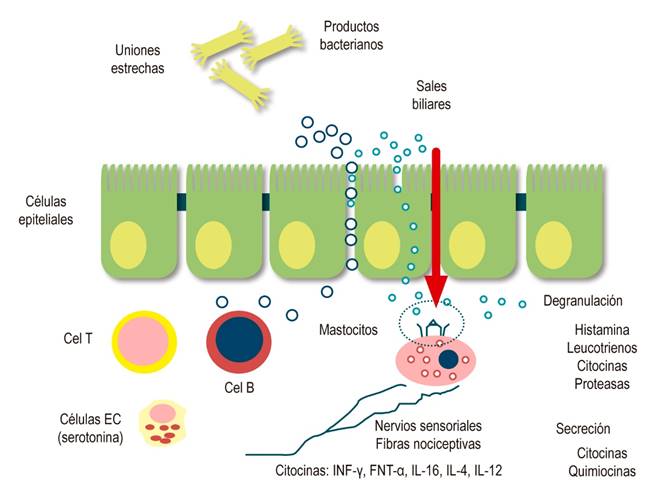
Figura 3 Sensibilización periférica: permeabilidad intestinal y respuesta inflamatoria local15. Modificado de: Boyer J, et al. Neurogastroenterol Motil. 2018;30(1).
Se ha propuesto también que la disfunción en la barrera y la permeabilidad intestinal permiten el paso de productos y antígenos provenientes de la microbiota gastrointestinal, producen un fenómeno de inflamación de bajo grado con múltiples interacciones neuroinmunes y pueden impulsar la señalización y sensibilización con hipersensibilidad14. Estos estímulos aferentes desencadenan reflejos que coordinan la función intestinal, de tal manera que la sensibilización también puede causar hiperreflexia o disreflexia, lo cual conduce a un tránsito alterado que puede resultar en diarrea o estreñimiento o ambos. La sensibilización periférica normalmente se desarrolla con rapidez y es de vida relativamente corta. Sin embargo, en presencia de lesión o inflamación persistentes, la sensibilización puede prolongarse y conducir a cambios en la expresión génica. Estos genes pueden alterar la expresión de canales, receptores o mediadores en las neuronas sensoriales que modifican la cantidad y patrón de los neurotransmisores liberados por las terminales nerviosas centrales en el cerebro y la médula espinal. Esto altera la forma en que las señales sensoriales se procesan dentro del SNC y contribuyen a la “sensibilización central”, y puede prolongar la hipersensibilidad más allá del período agudo de lesión o inflamación12,13.
Las neuronas sensoriales transmiten señales viscerales a las vías espinales ascendentes a través de las mareas de glutamato y neuropéptidos. Estos mecanismos transmisores están regulados al alza en respuesta a la inflamación o lesión y contribuyen a hipersensibilidad en el cerebro y la médula espinal, donde hay cambios neuroplásticos centrales denominados sensibilización central, que contribuyen al dolor crónico. Dentro del asta dorsal de la médula espinal hay 2 mecanismos que aumentan las señales de dolor que llegan al cerebro: el aumento de la transmisión sináptica a través del glutamato, péptido relacionado con el gen de la calcitonina y sustancia P en las vías excitatorias ascendentes, o la disminución de la modulación inhibitoria descendente3.
En el cerebro, la sensibilización puede ocurrir en las neuronas espinales de segundo orden, como el tálamo, el núcleo gris periacueductal (GPA), el núcleo parabraquial y el locus cerúleo. El aumento de la señalización de esos núcleos promueve la neuroplasticidad y luego promueve el procesamiento anormal del dolor dentro de la matriz de dolor extendida (corteza prefrontal [PFC], corteza del cíngulo anterior, amígdala, ínsula), que amplifica el malestar y las emociones negativas asociadas con el dolor visceral crónico o con una disminución del sistema inhibidor del dolor descendente a través del GPA y la médula rostral ventral4. Es importante destacar que la amígdala es un núcleo clave que integra señales viscerales nocivas con conductas de ansiedad/miedo y su hiperactivación podría influir no solo en múltiples núcleos de la matriz del dolor central, sino también en los núcleos del tronco encefálico descendente que modulan la función gastrointestinal. Múltiples estudios de neuroimágenes también han mostrado diferencias en la función, la conectividad y la estructura entre pacientes con síndrome del intestino irritable (SII) y los controles sanos. De este modo, la sensibilización central puede promover el dolor abdominal crónico en SII a través de la remodelación de las conexiones tanto dentro del cerebro como en la médula espinal16,17.
El eje cerebro-intestino es el sistema de comunicación neurohumoral bidireccional entre el cerebro y el intestino, el cual envía señales continuamente sobre la información homeostática y la condición fisiológica del sistema digestivo al cerebro a través de nervios aferentes (espinal y vagal) y humoral del SNE o “cerebrointestinal”. En condiciones normales fisiológicas, la mayoría de estas señales intestinales no se perciben conscientemente, pero la experiencia subjetiva del dolor visceral resulta de la percepción consciente de señales dirigidas intestino-cerebro que han sido inducidas por estímulos nocivos y que indican una amenaza potencial para la homeostasis, lo cual requiere una respuesta conductual18.
La percepción del dolor visceral no muestra un patrón lineal, sino que más bien surge de un proceso psicobiológico complejo mediante el cual se procesa la intensidad de la entrada aferente periférica y es continuamente modulada por circuitos cognitivos y afectivos en el cerebro y también a través de moduladores descendentes. Estos mecanismos ayudan a entender la influencia de los procesos cognitivos y afectivos sobre la percepción de síntomas gastrointestinales en pacientes con TICI, así como el efecto terapéutico de las intervenciones dirigidas a estos procesos que constituyen la base para entender los TICI como un modelo de trastornos de la señalización cerebrointestinal. Además, la disfunción de estos sistemas moduladores podría permitir que los estímulos fisiológicos no nocivos se perciban como dolorosos o desagradables (hipersensibilidad visceral) y esto puede conducir a dolor visceral crónico o molestias, sello de los síntomas de los TICI18.
Aspectos de un modelo biopsicosocial
La racionalidad de uso de neuromoduladores tiene un contexto aún más amplio cuando se aprecian los diferentes factores que contribuyen al desarrollo de los trastornos digestivos funcionales (TFD)-TICI; destacamos aquí algunos de los más relevantes: aunque se cuenta con evidencia sobre el aporte de componentes genéticos, epigenéticos y culturales, se ha propuesto como los de mayor peso los eventos estresantes de la vida (incluidos abusos sexuales, maltratos físicos y abuso emocional, en particular en la infancia), en comparación con los controles. Los pacientes con SII informan una mayor prevalencia de este tipo de eventos adversos y, en general, dicha historia está relacionada con una mayor gravedad de los trastornos funcionales gastrointestinales (TFGI) con peores desenlaces, con estrés clínico y afectación del funcionamiento diario y su calidad de vida (Figura 4)18,19.
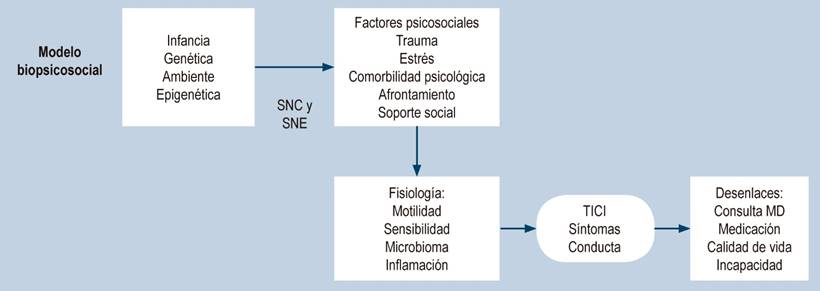
Figura 4 Modelo biopsicosocial para los TICI2. Modificado con permiso de: Drossman DA, et al. Gastroenterology. 2018;154(4):1140-1171.e1.
Trastornos de la afectividad
La superposición entre la depresión y TICI es alrededor del 30% en entornos de atención primaria y ligeramente mayor en atención terciaria. La depresión puede afectar la cantidad de síntomas gastrointestinales funcionales experimentados o la cantidad de diagnósticos de TICI. La ideación suicida está presente entre el 15% y 38% de los pacientes con SII, y se ha relacionado con desesperanza asociada con la percepción de la gravedad de los síntomas, la afectación de la calidad de la vida y la variable y a veces pobre respuesta al tratamiento. Igualmente, la comorbilidad de la depresión se ha relacionado con malos resultados, mayor uso de servicios médicos y costo de la atención médica, deterioro funcional, mala calidad de vida y compromiso deficiente con los resultados del tratamiento20.
Trastornos de ansiedad
Son la comorbilidad psiquiátrica más común, que ocurre en el 30%-50% de pacientes con TICI. Pueden iniciar o perpetuar los síntomas por su asociación a la excitación en respuesta al estrés y alterar la sensibilidad gastrointestinal y la función motora, como también la sensibilidad a la ansiedad misma, la hipervigilancia del cuerpo y la capacidad de tolerar la incomodidad y el dolor20.
Trastornos de síntomas somáticos
El Manual Diagnóstico de los Trastornos Mentales, 5.ª edición, modificó el concepto de somatización a favor de trastornos de síntomas somáticos. En la nueva categoría diagnóstica, los síntomas somáticos pueden o no tener una explicación médica, pero son angustiosos e incapacitantes y están asociados con pensamientos excesivos y desproporcionados, sentimientos y comportamientos durante más de 6 meses. Este enfoque, controversial por demás, cambia la experiencia de síntomas médicamente inexplicables como manifestaciones (inconscientes) de trastornos psicológicos, hacia los procesos afectivos cognitivos anormales (p. ej., preocupación excesiva por la enfermedad, preocupación por el cuerpo e hipocondriasis), como contribuyentes y consecuencia de síntomas21.
La somatización se asocia con procesos sensoriomotores gastrointestinales, en particular el dolor, incluidos la sensibilidad y el vaciamiento gástricos, la gravedad de los síntomas, el deterioro de la calidad de vida en la dispepsia funcional y en el SII, y también se asocia con la frecuencia de uso de la atención médica y predice una mala respuesta o adherencia al tratamiento. Por tanto, evaluar la somatización comprobando la gravedad de múltiples síntomas somáticos sigue siendo clínicamente útil. La somatización explica los frecuentes síntomas extraintestinales del SII, y la alta coocurrencia entre TICI y otros trastornos de síntomas somáticos (TSS), incluidos la cistitis intersticial, dolor pélvico, dolores de cabeza y fibromialgia18.
Procesos cognitivos-afectivos
Algunos procesos psicológicos pueden estar superpuestos; por ejemplo, cuando incluyen ansiedad por la salud (especialmente gastrointestinal), ansiedad específica por otros síntomas, sesgo atencional como la hipervigilancia de los síntomas y el catastrofismo se han vinculado a TICI independientemente de la comorbilidad psiquiátrica, y son objetivos de tratamiento importantes para la terapia cognitiva-conductual (TCC)22.
REFERENCIAS
1. Drossman DA, Hasler WL. Rome IV-Functional GI Disorders: Disorders of Gut-Brain Interaction. Gastroenterology. 2016;150(6):1257-61. https://doi.org/10.1053/j.gastro.2016.03.035 [ Links ]
2. Drossman DA, Tack J, Ford AC, Szigethy E, Törnblom H, van Oudenhove L. Neuromodulators for Functional Gastrointestinal Disorders (Disorders of Gut-Brain Interaction): A Rome Foundation Working Team Report. Gastroenterology . 2018;154(4):1140-1171.e1. https://doi.org/10.1053/j.gastro.2017.11.279 [ Links ]
3. Vanner SJ, Greenwood-Van Meerveld B, Mawe GM, Shea-Donohue T, Verdu EF, Wood J, et al. Fundamentals of Neurogastroenterology: Basic Science. Gastroenterology . 2016;150(6):1280-91. https://doi.org/10.1053/j.gastro.2016.02.018 [ Links ]
4. Abdullah N, Defaye M, Altier C. Neural control of gut homeostasis. Am J Physiol Gastrointest Liver Physiol. 2020;319(6):G718-G732. https://doi.org/10.1152/ajpgi.00293.2020 [ Links ]
5. Jin P, Jan LY, Jan YN. Mechanosensitive Ion Channels: Structural Features Relevant to Mechanotransduction Mechanisms. Annu Rev Neurosci. 2020;43:207-29. https://doi.org/10.1146/annurev-neuro-070918-050509 [ Links ]
6. Kiela PR, Ghishan FK. Physiology of Intestinal Absorption and Secretion. Best Pract Res Clin Gastroenterol. 2016;30(2):145-59. https://doi.org/10.1016/j.bpg.2016.02.007 [ Links ]
7. Spencer NJ, Hu H. Enteric nervous system: sensory transduction, neural circuits and gastrointestinal motility. Nat Rev Gastroenterol Hepatol. 2020;17(6):338-51. https://doi.org/10.1038/s41575-020-0271-2 [ Links ]
8. Foong D, Zhou J, Zarrouk A, Ho V, O’Connor MD. Understanding the Biology of Human Interstitial Cells of Cajal in Gastrointestinal Motility. Int J Mol Sci. 2020;21(12):1-18. https://doi.org/10.3390/ijms21124540 [ Links ]
9. Greenwood-Van Meerveld B, Johnson AC. Stress-Induced Chronic Visceral Pain of Gastrointestinal Origin. Frontiers in Systems Neuroscience. 2017;11:86. https://doi.org/10.3389/fnsys.2017.00086 [ Links ]
10. Elam JS, Glasser MF, Harms MP, Sotiropoulos SN, Andersson JLR, Burgess GC, et al. The Human Connectome Project: A retrospective. Neuroimage. 2021;244:118543. https://doi.org/10.1016/j.neuroimage.2021.118543 [ Links ]
11. Kano M, Grinsvall C, Ran Q, Dupont P, Morishita J, Muratsubaki T, et al. Resting state functional connectivity of the pain matrix and default mode network in irritable bowel syndrome: a graph theoretical analysis. Scientific Reports. 2020;10(1):11015. https://doi.org/10.1038/s41598-020-67048-9 [ Links ]
12. Turkiewicz J, Bhatt RR, Wang H, Vora P, Krause B, Sauk JS, et al. Altered brain structural connectivity in patients with longstanding gut inflammation is correlated with psychological symptoms and disease duration. Neuroimage Clin. 2021;30:102613. https://doi.org/10.1016/j.nicl.2021.102613 [ Links ]
13. Vergnolle N. Postinflammatory visceral sensitivity and pain mechanisms. Neurogastroenterol Motil. 2008;20 (Suppl 1):73-80. https://doi.org/10.1111/j.1365-2982.2008.01110.x [ Links ]
14. Piche T. Tight junctions and IBS--the link between epithelial permeability, low-grade inflammation, and symptom generation? Neurogastroenterol Motil. 2014;26(3):296-302. https://doi.org/10.1111/nmo.12315 [ Links ]
15. Boyer J, Saint-Paul MC, Dadone B, Patouraux S, Vivinus MH, Ouvrier D, et al. Inflammatory cell distribution in colon mucosa as a new tool for diagnosis of irritable bowel syndrome: A promising pilot study. Neurogastroenterol Motil . 2018;30(1). https://doi.org/10.1111/nmo.13223 [ Links ]
16. Hong JY, Labus JS, Jiang Z, Ashe-Mcnalley C, Dinov I, Gupta A, et al. Regional neuroplastic brain changes in patients with chronic inflammatory and non-inflammatory visceral pain. PLoS One. 2014;9(1):e84564. https://doi.org/10.1371/journal.pone.0084564 [ Links ]
17. Mills EP, Keay KA, Henderson LA. Brainstem Pain-Modulation Circuitry and Its Plasticity in Neuropathic Pain: Insights From Human Brain Imaging Investigations. Frontiers in pain research (Lausanne, Switzerland). 2021;2:705345. https://doi.org/10.3389/fpain.2021.705345 [ Links ]
18. van Oudenhove L, Crowell MD, Drossman DA, Halpert AD, Keefer L, Lackner JM, et al. Biopsychosocial Aspects of Functional Gastrointestinal Disorders. Gastroenterology . 2016;150(6):1355-1367.e2. https://doi.org/10.1053/j.gastro.2016.02.027 [ Links ]
19. Drossman DA. Abuse, trauma, and GI illness: is there a link? Am J Gastroenterol. 2011;106(1):14-25. https://doi.org/10.1038/ajg.2010.453 [ Links ]
20. Bouchoucha M, Hejnar M, Devroede G, Babba T, Bon C, Benamouzig R. Anxiety and depression as markers of multiplicity of sites of functional gastrointestinal disorders: a gender issue? Clin Res Hepatol Gastroenterol. 2013;37(4):422-30. https://doi.org/10.1016/j.clinre.2012.10.011 [ Links ]
21. Dimsdale JE, Creed F, Escobar J, Sharpe M, Wulsin L, Barsky A, et al. Somatic symptom disorder: an important change in DSM. J Psychosom Res. 2013;75(3):223-8. https://doi.org/10.1016/j.jpsychores.2013.06.033 [ Links ]
22. Radu M, Moldovan R, Pintea S, Băban A, Dumitrașcu D. Predictors of outcome in cognitive and behavioural interventions for irritable bowel syndrome. A meta-analysis. J Gastrointestin Liver Dis. 2018;27(3):257-63. https://doi.org/10.15403/jgld.2014.1121.273.bab [ Links ]
Citación: Páramo-Hernández DB, Pineda-Ovalle LF, Moya-Valenzuela LM, Concha-Mejía A. Trastornos de la interacción cerebro-intestino (trastornos funcionales digestivos), racionalidad para el uso de la neuromodulación. Revista. colomb. Gastroenterol. 2023;38(2):180-187. https://doi.org/10.22516/25007440.997
Recibido: 08 de Diciembre de 2022; Aprobado: 01 de Marzo de 2023











 texto en
texto en 



