Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista colombiana de Gastroenterología
versión impresa ISSN 0120-9957versión On-line ISSN 2500-7440
Rev. colomb. Gastroenterol. vol.38 no.2 Bogotá abr./jun. 2023 Epub 08-Sep-2023
https://doi.org/10.22516/25007440.942
Reporte de caso
Tuberculosis intestinal y talasemia: una asociación inusual. A propósito de un caso
1General practitioner, internal medicine resident, Hospital Universitario San Ignacio. Bogotá, Colombia.
2General practitioner, pathology resident, Hospital Universitario San Ignacio. Bogotá, Colombia.
3Internist and gastroenterologist, Hospital Universitario San Ignacio. Bogotá, Colombia.
4Internist, gastroenterology, and endoscopy fellow, Hospital Universitario San Ignacio. Bogotá, Colombia.
Introducción:
la tuberculosis es una enfermedad infecciosa prevenible y curable asociada a una alta morbimortalidad, la presentación de tuberculosis diseminada es poco frecuente y está asociada a patologías que comprometen el sistema inmunitario. En la actualidad hay pocos informes sobre tuberculosis diseminada y trastornos congénitos subyacentes.
Caso clínico:
paciente con antecedente de talasemia β que ingresó al servicio de urgencias por dolor abdominal y síntomas constitucionales con diagnóstico final de tuberculosis diseminada. Es un caso de especial interés debido a la presentación atípica, la sospecha diagnóstica inicial de malignidad y el amplio compromiso de la enfermedad a pesar de que el paciente no tenía antecedentes de inmunosupresión.
Conclusiones:
la tuberculosis diseminada en el paciente inmunocompetente es una presentación poco frecuente asociada a desenlaces adversos. El antecedente de talasemia β podría ser un factor de riesgo para tener en cuenta con base en las vías metabólicas involucradas en la fisiopatología de ambas enfermedades.
Palabras clave: Tuberculosis; talasemia; glutatión; hierro; reporte de caso
Introduction:
Tuberculosis is an infectious disease that can be prevented and cured, but it is still associated with high morbidity and mortality rates. Disseminated tuberculosis, although rare, can occur in individuals with underlying pathologies that affect the immune system. Currently, there are limited reports on disseminated tuberculosis in individuals with congenital disorders.
Clinical case:
We present a case of a patient with a history of β thalassemia who was admitted to the emergency department with symptoms of abdominal pain and constitutional symptoms. The final diagnosis was disseminated tuberculosis. This case is of particular interest due to its atypical presentation, the initial suspicion of malignancy, and the extensive involvement of the disease despite the patient’s absence of immunosuppression history.
Conclusions:
Disseminated tuberculosis in immunocompetent patients is a rare presentation associated with poor outcomes. The history of β thalassemia may be a risk factor to consider based on the metabolic pathways involved in the pathophysiology of both diseases.
Keywords: Tuberculosis; thalassemia; glutathione; iron; case report
Introducción
La tuberculosis (TB) es una enfermedad infecciosa prevenible y curable asociada a una alta morbimortalidad en el mundo, declarada por la Organización Mundial de la Salud (OMS) en 1993 como una emergencia en salud pública1,2. Su principal compromiso clínico es el pulmón, denominado como TB pulmonar; sin embargo, puede presentarse en otros órganos como pleura, nódulos linfáticos, abdomen, tracto genitourinario, articulaciones, entre otros, y en conjunto se denomina TB extrapulmonar3. Para el 2020 se habían documentado 9,9 millones casos de TB con una incidencia calculada de 127 casos por 100 000 personas, con una mortalidad aproximada de 1,2 millones de personas al año en pacientes sin coinfección por virus de la inmunodeficiencia humana (VIH) y de 214 000 personas al año en pacientes con coinfección por VIH4. Se ha reportado que los pacientes con múltiples comorbilidades pueden verse afectados por la infección por TB5. Sin embargo, hay pocos informes sobre pacientes con trastornos congénitos subyacentes. Presentamos el caso de un paciente de 31 años con antecedente de talasemia que ingresó por dolor abdominal y síntomas constitucionales, en el que se sospechó de compromiso neoplásico en el abordaje inicial, y durante el proceso diagnóstico se documentó TB intestinal. Se aportaron los estudios realizados para la caracterización de la enfermedad.
Presentación del caso
Se trata de un paciente masculino de 31 años que se desempeñaba como ganadero, presentaba un cuadro clínico de dos años de evolución consistente en dolor abdominal tipo cólico intermitente en el hipocondrio derecho, de intensidad moderada, deposiciones de consistencia Bristol 6 con frecuencia de hasta 4-5 deposiciones al día, sin presencia de moco o sangre. Refirió la asociación con astenia, adinamia, pérdida cuantificada de peso de siete kilogramos en las últimas seis semanas y diaforesis nocturna desde hace dos semanas. Presentó un aumento en la intensidad del dolor abdominal en los últimos cinco días asociado a proctalgia y hematoquecia, motivo por el cual decidió asistir a urgencias en nuestra institución. A la revisión por sistemas presentó síntomas respiratorios que iniciaron ocho días previos al ingreso, dados por tos seca y disnea mMRC (modified Medical Research Council) 3/4, asociado a la aparición de lesiones ulceradas a nivel de la región anal. Tenía antecedentes de talasemia β con hepatoesplenomegalia, por lo que recibió suplencia con ácido fólico y transfusiones sanguíneas a necesidad; también tenía antecedente de infección por hepatitis A y antecedente familiar de cáncer de colon en la madre diagnosticado a los 52 años. En el examen físico de ingreso se encontraba con taquicardia, dolor a la palpación abdominal difusa y hepatomegalia palpable sobre el reborde costal derecho. Las adenomegalias en la cadena inguinal derecha no estaban adheridas a planos profundos y no eran dolorosas a la palpación. A la inspección anal se evidenció una lesión ulcerada hacia las tres y nueve según el sentido horario de bordes regulares sin sangrado.
Se consideró una clínica de neoplasia gastrointestinal teniendo en cuenta el antecedente familiar, se solicitó una tomografía de abdomen con contraste en el que se identificó un engrosamiento concéntrico de la pared del colon ascendente con leve realce, múltiples adenopatías mesentéricas y retroperitoneales (Figura 1). En los paraclínicos solicitados al ingreso se documentó anemia normocítica normocrómica, linfopenia, trombocitopenia leve, elevación de fosfatasa alcalina e hipoalbuminemia.
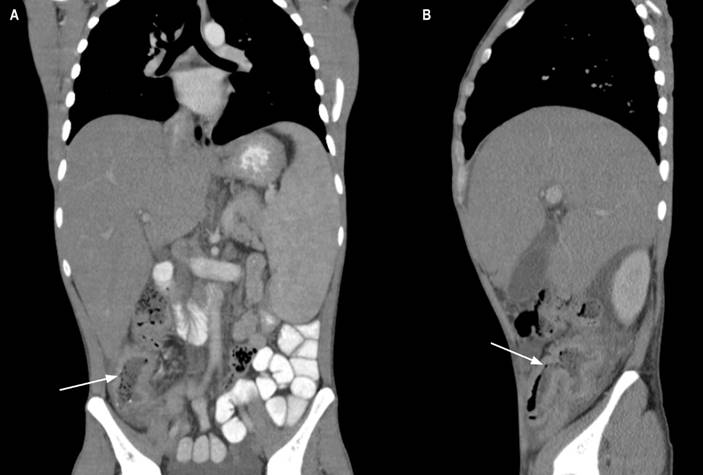
Figura 1 Tomografía computada de abdomen con contraste corte coronal y sagital. A. Engrosamiento concéntrico de la pared del colon ascendente con leve realce (flecha). B. Engrosamiento del íleon distal y válvula ileocecal (flecha). Fuente: historia clínica del paciente.
Se realizó una colonoscopia, la cual evidenció múltiples úlceras de 5 mm con bordes eritematosos elevados y definidos a nivel del recto, colon sigmoide, descendente y transverso, a nivel del ángulo hepático la mucosa edematizada cubierta por fibrina y eritema que disminuye luz friable al paso del equipo y área de estenosis concéntrica de aspecto inflamatorio, por lo que se consideró dentro de los posibles diagnósticos una colitis de etiología infecciosa o inflamatoria. Se tomaron biopsias de las áreas en mención y se documentaron hallazgos compatibles con colitis granulomatosa (Figura 2), se realizó la identificación por una prueba rápida de reacción en cadena de la polimerasa para la identificación de Mycobacterium tuberculosis y sensibilidad a rifampicina (GeneXpert MTB/RIF) en el tejido obtenido en la biopsia de colon, con un resultado positivo para M. tuberculosis (Tabla 1). Por los síntomas respiratorios se solicitó una tomografía de tórax que reportó micronódulos de distribución aleatoria bilaterales, algunos configuraron un patrón de árbol en gemación y predominaron en el lóbulo superior izquierdo (Figura 3), las baciloscopias seriadas con hallazgos de bacilo resistente al ácido-alcohol (BAAR) y prueba de GeneXpert MTB/RIF que confirmó el diagnóstico de TB y compromiso pulmonar con sensibilidad a rifampicina.
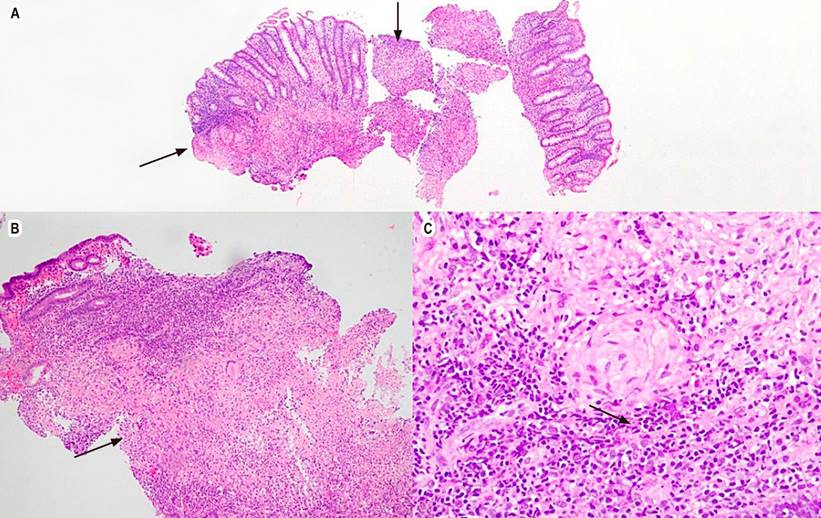
Figura 2 Colitis granulomatosa con hematoxilina y eosina. A. 4x, mucosa colónica, las flechas señalan granulomas. B. 10x, en la lámina propia se observa la formación de granulomas bien delimitados y algunos abscesos de neutrófilos. C. 40x, granuloma epitelioide. Fuente: historia clínica del paciente.
Tabla 1 Resumen de exámenes y resultados realizados al paciente
| Muestras de colonoscopia | |
|---|---|
| Biopsia de colon transverso y derecho | Negativo para malignidad Hallazgos compatibles con colitis granulomatosa |
| PCR en biopsia rectal* | Muestra positiva para las micobacterias del complejo tuberculoso |
| Esputo | |
| Coloración para BAAR | Positivo 1-9 BAAR en 100 campos observados |
| PCR en muestra de esputo | Identificación de M. tuberculosis por PCR: detectado Resistencia a rifampicina no detectado |
| Cultivo Lowenstein-Jensen | M. tuberculosis |
| Cultivo de medio líquido MGITTM | Cultivo positivo para complejo M. tuberculosis |
| Pruebas de sensibilidad*** | |
| Isoniazida | 0.1 µg/mL sensible (S) |
| Rifampicina | 0,5 µg/mL sensible (S) |
| Pirazinamida | 100 µg/mL sensible (S) |
| Líquido peritoneal | |
| Tinción de Gram en líquido ascítico | No se observan gérmenes |
| Cultivo de líquido ascítico | Negativo a las 72 horas de cultivo |
| Citológico | |
| Aspecto | Límpido |
| Color | Amarillo |
| Leucocitos | 234 células/mm3 |
| Linfocitos | 74% |
| Monocitos | 8% |
| Neutrófilos | 18% |
| Macrófagos | 118 en 100 leucocitos contados |
| Hematíes | 786 células/mm3 |
| Citoquímico | |
| Glucosa | 98,19 mg/dL |
| Proteínas | 3,38 g/dL |
| Albumina | 1,5 g/dL |
| Gradiente albúmina en suero/ascitis | 1,1 |
| Microbiología | |
| Hemocultivo aerobio #2 | Negativo a los 5 días de cultivo |
| Hemocultivo anaerobio #1 | Negativo a los 5 días de cultivo |
| Prueba de VIH**** | 0,06 s/CO; NO reactivo |
*PCR en tiempo real empleando sondas Taqman para la región repetitiva IS6110 de las micobacterias del complejo tuberculoso.
**PCR en tiempo real, anidada, semicuantitativa y detección del pico de fusión. Detección de ADN (IS1081-IS6110) del complejo M. tuberculosis (MTB) y detección de mutaciones del gen rpoB asociadas a resistencia a rifampicina.
***Método automatizado BACTEC MGIT 960.
****Inmunoanálisis quimioluminiscente de micropartículas (CMIA).
Fuente: elaboración propia con datos de la historia clínica del paciente.
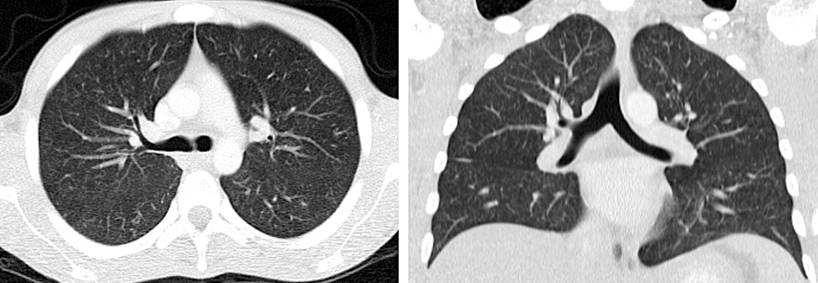
Figura 3 TAC de tórax de alta resolución de corte transversal y coronal. Micronódulos de distribución aleatoria bilaterales, algunos configuran un patrón de árbol en gemación. Fuente: historia clínica del paciente.
Se solicitó el concepto por oftalmología para el inicio de tetraconjugado, y en la valoración se evidenció como hallazgo incidental en el ojo izquierdo una lesión de apariencia subretinal granulomatosa concordante con compromiso oftálmico de TB. Se consideró un paciente con diagnóstico de TB diseminada, compromiso pulmonar, intestinal, linfático y de retina con pruebas de sensibilidad que confirmaron una sensibilidad a isoniazida y rifampicina, por lo cual se inició el manejo tetraconjugado con rifampicina 150 mg, isoniazida 75 mg, pirazinamida 400 mg y etambutol 275 mg, cada dosis ajustada al peso; la primera fase fue de 56 dosis, y se adicionó el manejo con piridoxina una tableta al día. Se dio egreso hospitalario.
Ingresó nuevamente a nuestra institución a los 20 días de egreso por un cuadro clínico compatible con obstrucción intestinal, por lo cual se tomó una radiografía de abdomen con hallazgo de niveles hidroaéreos escalonados y ausencia de gas distal, se indicó el manejo médico con sonda nasogástrica y analgesia, y se solicitó una tomografía de abdomen con un nuevo hallazgo de ascitis, por lo cual se solicitó una paracentesis en la que se obtuvieron 200 mL de líquido cetrino, y en el estudio citológico hubo un hallazgo de leucocitosis a expensas de linfocitos. Además, el gradiente de albúmina sérica-ascitis (GASA) confirmó un líquido no hipertensivo (Tabla 1), que por sus características en citoquímico, citológico y antecedente de TB diseminada se consideró un líquido ascítico concordante con TB peritoneal. La paciente tuvo resolución del cuadro obstructivo y mejoría del dolor abdominal, por lo cual se le dio egreso hospitalario.
Discusión
La TB diseminada se define como la presencia de infección por TB en dos o más sitios no contiguos que resulta de la diseminación linfohematógena del M. tuberculosis, que ocurre como resultado de una infección primaria o reactivación de un foco latente6,7. La prevalencia se ha reportado entre 4,9% y 19,6% de casos de pacientes con diagnóstico de TB, y los pacientes con coinfección por VIH son la población con mayor probabilidad de presentar compromiso diseminado (27,8%)8-10.
Entre los factores de riesgo independientes descritos para el desarrollo de TB diseminada se encuentra el uso de medicamentos inmunosupresores, coinfección con VIH, insuficiencia hepática o cirrosis, tiempo de los síntomas ≥ 12 semanas, compromiso pulmonar bilateral, pérdida de peso, diaforesis nocturna y ausencia de hemoptisis y disnea10. Entre las manifestaciones clínicas más frecuentes se encuentran los síntomas constitucionales como fiebre, diaforesis nocturna y los hallazgos anormales en el laboratorio como hipoalbuminemia (74,7%), elevación de γ-glutamil transferasa (71,0%), fosfatasa alcalina (66,4%), hiponatremia (58,9%) y anemia (43,9%)11. La mortalidad de la TB diseminada se ha reportado en alrededor del 21% de pacientes seguidos por 6 meses y se han correlacionado los niveles de albúmina, bilirrubinas totales, creatinina y tiempo de inicio de tratamiento antituberculoso como factores pronósticos independientes10,11.
Las talasemias son un grupo de hemoglobinopatías en las que la proporción normal de producción de globina alfa y globina beta se ve interrumpida debido a una variante genética. Esta proporción anormal de cadena alfa a cadena beta hace que las cadenas no apareadas se precipiten, lo que conduce a la destrucción de los precursores de glóbulos rojos en la médula ósea que conduce a eritropoyesis ineficaz y a hemolisis12.
En muchas áreas donde la TB es endémica también hay una alta incidencia de talasemia, especialmente en el sudeste asiático13,14. Sriwijitalai y colaboradores15 realizaron un análisis bioinformático de las vías biológicas relacionadas con el sistema antioxidante en la TB y la talasemia e identificaron la vía común que se observa tanto en la TB como en la talasemia a través del glutatión; una molécula antioxidante pleiotrópica muestra efectos antimicobacterianos y de mejora inmunológica. Se ha evidenciado la importancia de la vía antioxidante en la TB. Cao y colaboradores16 observaron una disminución significativa en los niveles de glutatión intracelular en macrófagos infectados con M. tuberculosis en comparación con los macrófagos no infectados, lo que indica que la infección por M. tuberculosis puede causar el agotamiento de glutatión intracelular, y a su vez puede promover la supervivencia y replicación de M. tuberculosis dentro de las células huésped. En cuanto a la talasemia, también se puede ver la importancia clínica del sistema de vías antioxidantes. Se sabe que la talasemia β causa estrés oxidativo inducido por la sobrecarga de hierro, y que el sistema de glutatión es el principal antioxidante endógeno que protege a las células animales del daño oxidativo17.
Bajo estrés oxidativo, el glutatión (GSH) dona equivalentes reductores a las enzimas captadoras de radicales libres, incluidos el glutatión peroxidasa (GPx) y el glutatión-S-transferasa (GST), y se convierte en su forma oxidada, disulfuro de glutatión (GSSG). Este GSSG puede reconvertirse en GSH mediante una reacción catalizada por el glutatión reductasa (GR); por tanto, una proporción más baja de glutatión reducido a oxidado (GSH/GSSG) puede indicar un mayor estrés oxidativo en las células. Kalpravidh y colaboradores18 evidenciaron en pacientes con talasemia β una reducción del 90% en la relación GSH/GSSG en comparación con los controles, lo que sugiere una menor disponibilidad de GSH y una mayor acumulación de GSSG. El aumento notable de GSSG en pacientes talasémicos probablemente se debió a la sobreutilización de GSH celular, respaldado por aumentos de 123% y 93% en las actividades de GST y GPx, respectivamente. La enzima GST desintoxica los xenobióticos, incluidos los metabolitos de las reacciones oxidativas, al conjugarse con GSH, mientras que GPx es una enzima antioxidante que reduce el peróxido de hidrógeno a agua usando GSH como equivalente reductor.
Se ha informado ampliamente que los pacientes con una marcada deficiencia en la producción de GSH tenían respuestas efectoras granulomatosas alteradas contra la infección por M. tuberculosis. Los pacientes con talasemia son propensos a desarrollar TB, lo cual se explica por la vía del GSH19. Adicionalmente, las funciones de la sobrecarga de hierro y la susceptibilidad a la infección se han descrito previamente20-24. Sin embargo, las publicaciones sobre el modelo para la talasemia han sido limitadas. La mayoría de los estudios han utilizado la hemocromatosis como modelo de enfermedad para la sobrecarga de hierro.
Ghozali y colaboradores25 informaron sobre los tipos de variaciones de un transportador de metales a través de la membrana del fagosoma, la proteína de macrófagos 1 asociada a la resistencia natural (NRAMP1), en pacientes pediátricos con talasemia con y sin infección de TB, y evidenciaron que los polimorfismos en NRAMP1 juegan un papel importante en la regulación del hierro, que también es necesario para MTB. El aumento de hierro en pacientes con talasemia puede tener un mayor riesgo potencial de TB26.
El caso clínico que presentamos tiene varios puntos importantes a resaltar, el principal es la presentación de TB diseminada en un paciente aparentemente inmunocompetente, tenía antecedente de talasemia β, lo cual previamente no se había considerado como un factor de riesgo para esta manifestación; sin embargo, en la revisión de la literatura encontramos plausibilidad biológica en la alteración en la vía de GSH, lo que confiere riesgo a pacientes con talasemia de desarrollar TB por alteración en la respuesta efectora granulomatosa. Otro punto importante a considerar es la presencia de factores de riesgo previamente descritos para presentar la enfermedad, los cuales se identificaron en nuestro paciente como presentación de síntomas ≥ 12 semanas, síntomas constitucionales dados por pérdida de peso y diaforesis nocturna, y presencia de compromiso pulmonar bilateral, lo cual supone una progresión de la enfermedad local que puede preceder el compromiso sistémico. Adicionalmente, los hallazgos anormales en los laboratorios de nuestro paciente como hipoalbuminemia y anemia se han correlacionado con mortalidad; sin embargo, durante el seguimiento de nuestro paciente solo ha presentado un reingreso hospitalario y fue a raíz de la obstrucción intestinal favorecida por el proceso inflamatorio a nivel colónico por TB, lo cual se resolvió con manejo médico.
Se revisaron casos descritos en la literatura colombiana, y se encontró una presentación extrapulmonar con compromiso en el sistema nervioso central27, pericardio con taponamiento cardíaco como primera manifestación28, esternón29 en población pediátrica y un caso de un paciente con diabetes mellitus y talasemia e infección por TB pulmonar con múltiples coinfecciones asociadas30. En nuestro conocimiento, el caso presentado es el primer reporte de paciente con talasemia y TB diseminada, consideramos que se sienta un precedente relevante para futuras investigaciones, así como la ampliación de diagnósticos diferenciales en casos similares.
Conclusiones
La TB diseminada en el paciente inmunocompetente es una presentación poco frecuente asociada a desenlaces adversos, por lo que se requiere un diagnóstico oportuno para reducir la morbimortalidad asociada a la enfermedad. El presente caso permite concluir que en pacientes con antecedente de talasemia β, dada su predisposición inmunológica, se debe realizar una búsqueda activa y sospecha diagnóstica similar, aunque en los pacientes inmunocomprometidos se requieren más estudios para definir estrategias de cribado.
REFERENCIAS
1. WHO Global Tuberculosis Programme. TB: a global emergency, WHO report on the TB epidemic [Internet]. Geneva: World Health Organization; 1994 [consultado el 11 de julio de 2022]. Disponible en: Disponible en: https://apps.who.int/iris/handle/10665/58749 [ Links ]
2. Furin J, Cox H, Pai M. Tuberculosis. Lancet. 2019;393(10181):1642-56. https://doi.org/10.1016/S0140-6736(19)30308-3 [ Links ]
3. Natarajan A, Beena PM, Devnikar AV, Mali S. A systemic review on tuberculosis. Indian J Tuberculosis. 2020;67(3):295-311. https://doi.org/10.1016/j.ijtb.2020.02.005 [ Links ]
4. World Health Organization. Global tuberculosis report 2021 [Internet]. Geneva: World Health Organization ; 2021 [onsultado el 11 de julio de 2022]. Disponible en: Disponible en: https://apps.who.int/iris/handle/10665/346387 [ Links ]
5. Ugarte-Gil C, Carrillo-Larco RM, Kirwan DE. Latent tuberculosis infection and non-infectious co-morbidities: Diabetes mellitus type 2, chronic kidney disease and rheumatoid arthritis. International J Infect Dis. 2019;80:S29-31. https://doi.org/10.1016/j.ijid.2019.02.018 [ Links ]
6. Khan FY. Review of literature on disseminated tuberculosis with emphasis on the focused diagnostic workup. J Family Community Med. 2019;26(2):83-91. https://doi.org/10.4103/jfcm.JFCM_106_18 [ Links ]
7. Baby J, Poovathingal S, Valsalan P, Sunila E. Atypical Presentation of Disseminated Tuberculosis. Journal of the Royal College of Physicians of Edinburgh. 2020;50(4):405-7. https://doi.org/10.4997/jrcpe.2020.411 [ Links ]
8. García-Rodríguez JF, Álvarez-Díaz H, Lorenzo-García MV, Mariño-Callejo A, Fernández-Rial Á, Sesma-Sánchez P. Extrapulmonary tuberculosis: epidemiology and risk factors. Enfermedades Infecciosas y Microbiología Clínica. 2011;29(7):502-9. https://doi.org/10.1016/j.eimc.2011.03.005 [ Links ]
9. Pang Y, An J, Shu W, Huo F, Chu N, Gao M, et al. Epidemiology of Extrapulmonary Tuberculosis among Inpatients, China, 2008-2017. Emerging Infectious Diseases. 2019;25(3):457-64. https://doi.org/10.3201/eid2503.180572 [ Links ]
10. Meira L, Chaves C, Araújo D, Almeida L, Boaventura R, Ramos A, et al. Predictors and outcomes of disseminated tuberculosis in an intermediate burden setting. Pulmonology. 2019;25(6):320-7. https://doi.org/10.1016/j.pulmoe.2018.11.001 [ Links ]
11. Wang JY, Hsueh PR, Wang SK, Jan IS, Lee LN, Liaw YS, et al. Disseminated Tuberculosis. Medicine. 2007;86(1):39-46. https://doi.org/10.1097/MD.0b013e318030b605 [ Links ]
12. Taher AT, Musallam KM, Cappellini MD. β-Thalassemias. New Eng J Med. 2021;384(8):727-43. https://doi.org/10.1056/NEJMra2021838 [ Links ]
13. Wise J. WHO identifies 16 countries struggling to control tuberculosis. BMJ. 1998;316(7136):957. https://doi.org/10.1136/bmj.316.7136.955e [ Links ]
14. Fucharoen S, Winichagoon P. Haemoglobinopathies in southeast Asia. Indian J Med Res. 2011;134(4):498-506. http://www.ncbi.nlm.nih.gov/pubmed/22089614 [ Links ]
15. Sriwijitalai W, Wiwanitkit V. Tuberculosis in patients with underlying thalassemia: a consideration of common antioxidative pathway − an expressional analysis. Egyptian Journal of Chest Disease and Tuberculosis. 2021;70(1):38-9. https://doi.org/10.4103/ejcdt.ejcdt_159_19 [ Links ]
16. Ruoqiong C, Garrett T, Hicret I, Rachel A, Shalok M, Karo G, et al. Characterizing the Effects of Glutathione as an Immunoadjuvant in the Treatment of Tuberculosis. Antimicrobial Agents and Chemotherapy. 2018;62(11):e01132-18. https://doi.org/10.1128/AAC.01132-18 [ Links ]
17. Chakraborty I, Mitra S, Gachhui R, Kar M. Non-haem iron-mediated oxidative stress in haemoglobin E beta-thalassaemia. Ann Acad Med Singap. 2010;39(1):13-6. http://www.ncbi.nlm.nih.gov/pubmed/20126808 [ Links ]
18. Kalpravidh RW, Tangjaidee T, Hatairaktham S, Charoensakdi R, Panichkul N, Siritanaratkul N, et al. Glutathione redox system in β -thalassemia/Hb E patients. ScientificWorldJournal. 2013;2013:543973. https://doi.org/10.1155/2013/543973 [ Links ]
19. Gluba-Brzózka A, Franczyk B, Rysz-Górzyńska M, Rokicki R, Koziarska-Rościszewska M, Rysz J. Pathomechanisms of Immunological Disturbances in β-Thalassemia. International Journal of Molecular Sciences. 2021;22(18):9677. https://doi.org/10.3390/ijms22189677 [ Links ]
20. Khan FA, Fisher MA, Khakoo RA. Association of hemochromatosis with infectious diseases: expanding spectrum. International Journal of Infectious Diseases. 2007;11(6):482-7. https://doi.org/10.1016/j.ijid.2007.04.007 [ Links ]
21. Gangaidzo IT, Moyo VM, Mvundura E, Aggrey G, Murphree NL, Khumalo H, et al. Association of Pulmonary Tuberculosis with Increased Dietary Iron. The Journal of Infectious Diseases. 2001;184(7):936-9. https://doi.org/10.1086/323203 [ Links ]
22. Centers for Disease Control and Prevention. US Department of Health and Human Services, Centers for Disease Control and Prevention, National Center for HIV/AIDS, Viral Hepatitis, STD, and TB Prevention, Division of Tuberculosis Elimination Atlanta, Georgia, 2020. Latent Tuberculosis Infection: a Guide for Primary Health Care Providers.[Consultado el 11 de julio de 2022]. Disponible en:Disponible en:https://www.cdc.gov/tb/publications/ltbi/pdf/LTBIbooklet508.pdf [ Links ]
23. Ottenhoff THM, Verreck FAW, Hoeve MA, van de Vosse E. Control of human host immunity to mycobacteria. Tuberculosis. 2005;85(1-2):53-64. https://doi.org/10.1016/j.tube.2004.09.011 [ Links ]
24. Lounis N, Truffot-Pernot C, Grosset J, Gordeuk VR, Boelaert JR. Iron and Mycobacterium tuberculosis infection. Journal of Clinical Virology. 2001;20(3):123-6. https://doi.org/10.1016/S1386-6532(00)00136-0 [ Links ]
25. Ghozali M, Dewi SP, Ghrahani R, Maskoen AM, Reniarti L, Sahiratmadja E, et al. Natural resistance-associated macrophage protein 1 gene polymorphisms in thalassemia patients with tuberculosis infection. Paediatr Indones. 2016;56(2):84-9. https://doi.org/10.14238/pi56.2.2016.84-9 [ Links ]
26. Agrawal A, Shrivastava J, Singh A. Multidrug-resistant tubercular liver abscess in β-thalassemia. Indian Pediatr. 2014;51(5):401-2. [ Links ]
27. Hanafiah M, Mukhari SAM, Mustapha AM, Mumin NA. Intraventricular tuberculosis abscess in an immunocompromised patient: clinical vignette. Asian Biomedicine. 2021;15(6):293-7. https://doi.org/10.2478/abm-2021-0036 [ Links ]
28. Harahap S, Pramudita A, Lusiani. Cardiac tamponade as a manifestation of extrapulmonary tuberculosis in β thalassemia major patient. IOP Conference Series. 2018;125: 012120.https://doi.org/10.1088/1755-1315/125/1/012120 [ Links ]
29. Kataria SP, Avasthi R. Sternal tuberculosis in combination with thalassmia. J Assoc Physicians India. 1993;41(7):472. [ Links ]
30. Chit Yee D, Aung HKK, Mg Mg B, Htun WPP, Janurian N, Bancone G, et al. Case Report: A case report of multiple co-infections (melioidosis, paragonimiasis, Covid-19 and tuberculosis) in a patient with diabetes mellitus and thalassemia-trait in Myanmar. Wellcome Open Research. 2022;7:160. https://doi.org/10.12688/wellcomeopenres.17881.1 [ Links ]
Citación: Téllez-Castillo N, Tovar-Sánchez CV, Vélez-Bohórquez A, Roa-Ballestas PA, González-Mendoza IE. Tuberculosis intestinal y talasemia: una asociación inusual. A propósito de un caso. Revista. colomb. Gastroenterol. 2023;38(2):221-228. https://doi.org/10.22516/25007440.942
Recibido: 20 de Julio de 2022; Aprobado: 20 de Enero de 2023











 texto en
texto en 



