Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Revista colombiana de Gastroenterología
versão impressa ISSN 0120-9957versão On-line ISSN 2500-7440
Rev. colomb. Gastroenterol. vol.38 no.3 Bogotá jul./set. 2023 Epub 18-Dez-2023
https://doi.org/10.22516/25007440.1061
Trabajos originales
Factores de riesgo para fibrosis hepática en pacientes diabéticos con enfermedad renal crónica terminal
1Physician, PhD. Assistant professor, Universidad de Cartagena. Cartagena, Colombia.
2Internist, Clínica San Rafael. Pereira, Colombia.
3Nephrology internist, MSc, PhD. Professor, Universidad de Cartagena. Cartagena, Colombia.
Introducción:
la cirrosis hepática es la cuarta causa de muerte en el mundo. Actualmente, la enfermedad hepática por depósito de grasa es la causa más frecuente de hepatopatía crónica en la mayoría de los países. La identificación de factores de riesgo para la presencia de fibrosis hepática en una población con enfermedad renal crónica terminal puede facilitar el diagnóstico temprano de esta complicación y permitir la activación de protocolos de seguimiento para disminuir la morbimortalidad en estos pacientes.
Metodología:
se realizó un estudio de corte transversal y analítico. Se incluyeron pacientes en hemodiálisis, mayores de 18 años con diagnóstico de diabetes mellitus y de enfermedad renal crónica terminal. El contraste de hipótesis se realizó a través de la prueba de chi cuadrado y la T de Student, según correspondiera. La significación estadística se estableció con un valor p = 0,05.
Resultados:
se observó una prevalencia de fibrosis hepática significativa y cirrosis del 17%. Los factores asociados a la presencia de fibrosis hepática fueron los antecedentes de enfermedad cerebrovascular, la enfermedad vascular periférica, el índice de masa corporal (IMC), el colesterol total, la hemoglobina glicosilada, el sodio y el aspartato-aminotransferasa (AST). No se observó relación entre el puntaje de NAFLD (enfermedad del hígado graso no alcohólico), el índice APRI (AST to Platelet Ratio Index) y la presencia de fibrosis.
Conclusión:
la prevalencia de fibrosis hepática significativa en pacientes con diabetes y ERCT es similar a la reportada en otras poblaciones de pacientes con diabetes. Sin embargo, algunos factores, como el IMC, podrían comportarse de forma diferente y favorecer la aparición de lesión hepática con grados menores de obesidad a los reportados previamente en la literatura.
Palabras clave: Cirrosis hepática; insuficiencia renal crónica; diálisis; diabetes mellitus; diagnóstico por imagen de elasticidad
Introduction:
Liver cirrhosis is the fourth cause of death in the world. Fatty liver disease is the most common cause of chronic liver disease (CKD) in most countries. Identifying risk factors for liver fibrosis in a population with end-stage renal disease (ESRD) may facilitate early diagnosis of this complication and allow the activation of follow-up protocols to reduce morbidity and mortality in these patients.
Materials and methods:
A cross-sectional and analytical study was carried out. Patients on hemodialysis, older than 18 years with a diagnosis of diabetes mellitus and ESRD were included. The hypotheses were contrasted through the chi-square test and Student’s T-test, as appropriate. Statistical significance was established at a p-value = 0.05.
Results:
A prevalence of significant liver fibrosis and cirrhosis of 17% was found. Factors associated with liver fibrosis were a history of cerebrovascular disease, peripheral vascular disease, body mass index (BMI), total cholesterol, glycosylated hemoglobin, sodium, and aspartate aminotransferase (AST). No relationship was observed between the NAFLD (non-alcoholic fatty liver disease) score, the APRI index (AST to Platelet Ratio Index), and fibrosis.
Conclusion:
The prevalence of significant liver fibrosis in patients with diabetes and ESRD is similar to that reported in other populations of patients with diabetes. However, some factors, such as BMI, could behave differently and favor the appearance of liver injury with lower degrees of obesity than previously reported in the literature.
Keywords: Liver cirrhosis; chronic renal failure; dialysis; diabetes mellitus; elasticity imaging
Introducción
La cirrosis hepática es la cuarta causa de muerte en el mundo. Los pacientes con cirrosis descompensada tienen un riesgo de muerte diez veces mayor en comparación con la población en general1. Actualmente, la enfermedad hepática por depósito de grasa (EHDG) es la causa más frecuente de hepatopatía crónica en la mayoría de los países de Occidente1-3.
La diabetes mellitus tipo 2 (DMT2), la obesidad, la hiperlipidemia y la hipertensión arterial (HTA) se consideran factores de riesgo para el desarrollo de EHDG y se considera que este subgrupo de pacientes es el que presenta mayor riesgo de fibrosis hepática avanzada, hepatocarcinoma y cirrosis2,3. A la vez, la EHDG es un factor de riesgo independiente para eventos cardiovasculares4.
Se ha descrito que la ERCT y la EHDG tienen vías de fisiopatología comunes y el diagnóstico de síndrome metabólico se ha asociado a la progresión de ambas patologías3. De hecho, algunos estudios han señalado un incremento de la prevalencia (odds ratio [OR]: 2,1; intervalo de confianza [IC] del 95%: 1,69-2,66) y la incidencia de enfermedad renal crónica terminal (ERCT) (1,79; IC 95%: 1,65-1,95) en pacientes con EHDG3,5. Un estudio reciente que incluyó a 1992 pacientes con diabetes encontró una relación bidireccional entre la aparición de EHDG y la enfermedad renal crónica, e incluso señaló algunas vías a través de las cuales estas dos entidades pueden influir mutuamente en su riesgo de presentación6.
En los pacientes con cirrosis, la presencia de enfermedad renal crónica (ERC) se asocia a un mayor riesgo de desenlaces adversos renales, hospitalarios y a una disminución de la supervivencia7. Por otra parte, los pacientes con cirrosis por EHDG en lista de trasplante enfrentan retos únicos y requieren trasplante simultáneo de hígado y riñón en mayor cantidad en comparación con otras etiologías8-10.
La elastografía transitoria (Fibroscan) es una técnica no invasiva utilizada para estimar la presencia de fibrosis hepática11, estimando la dureza del órgano a través de la medición de la velocidad a la cual una onda vibratoria atraviesa el parénquima hepático. Además de evitar todos los riesgos inherentes a la realización de la biopsia, el procedimiento incorpora algunos criterios de calidad12,13 que permiten determinar al pie de la cama la solidez de los resultados obtenidos. La elastografía ha demostrado ser una herramienta válida para estimar el grado de fibrosis hepática en la EHDG y en otras patologías14.
Aunque los factores de riesgo para fibrosis hepática y cirrosis han sido bien caracterizados en pacientes con EHDG15,16, paradójicamente los estudios realizados excluyen a pacientes en diálisis en los que frecuentemente coexisten muchos de estos factores y en los que el diagnóstico de una enfermedad hepática crónica puede tener importantes implicaciones pronósticas17.
La identificación de factores de riesgo para la presencia de fibrosis hepática en una población con ERCT puede facilitar el diagnóstico temprano de esta complicación y permite la activación de protocolos de seguimiento que han demostrado disminuir la morbimortalidad asociada a la enfermedad hepática crónica18,19.
El objetivo de este estudio es describir los factores asociados a presentar fibrosis hepática avanzada en pacientes diabéticos con ERCT en hemodiálisis.
METODOLOGÍA
Diseño del estudio y población
Se realizó un estudio de corte transversal en el que se identificó a los pacientes diabéticos en hemodiálisis de la base de datos de una unidad de hemodiálisis en la ciudad de Cartagena hasta el 12 de noviembre de 2019. Estos pacientes asisten semanalmente a 3 sesiones de hemodiálisis y son evaluados a través de un protocolo de seguimiento que incluye la valoración por médico nefrólogo y la realización de un conjunto exámenes de laboratorio. Los antecedentes médicos, los datos sociodemográficos, antropométricos y analíticos se obtuvieron de las historias clínicas de cada uno de los pacientes. Se incluyeron pacientes en hemodiálisis, mayores de 18 años con diagnóstico de diabetes mellitus y de ERCT definida como TFG por fórmula Cockcroft-Gault < 15 mL/min/1,73 m2.
La elastografía transitoria y la estimación de esteatosis se realizó aprovechando la asistencia de los pacientes a sus sesiones de hemodiálisis y la información de las historias clínicas se recopiló de forma simultánea el mismo día del procedimiento. Para el cálculo del puntaje NAFLD (para EHDG) y el puntaje APRI (índice de relación AST a plaquetas), se utilizaron los resultados de las historias clínicas y ninguno tenía una antigüedad superior a 1 mes en el momento del cálculo.
Elastografía transitoria y parámetro controlado de atenuación
Se utilizó el equipo Fibroscan touch compact 530. Todos los pacientes tenían al menos 6 horas de ayuno previo al estudio. Se utilizaron las sondas M o XL, según correspondiera. El resultado se expresó como el valor mediano de 10 mediciones válidas expresadas en kilopascales (kPa). Los criterios de calidad del fabricante se utilizaron para validar la solidez de los resultados (rango intercuartílico [RIC] ≤ 30% y tasa de éxito ≥ 60%). Un punto de cohorte de 8,2 kPa y 13,6 kPa se utilizaron para el diagnóstico de fibrosis hepática significativa y cirrosis, respectivamente13. Un valor de parámetro controlado de atenuación (CAP) ≥ 302 dB/m se utilizó como punto de cohorte para el diagnóstico de esteatosis hepática13.
Se consideró que la falla técnica ocurría cuando no era posible obtener ninguna medición válida. Solamente se incluyeron para el análisis los resultados que cumplieran con los criterios de calidad del fabricante12-14.
Puntaje NAFLD
El puntaje NAFLD se calculó con la siguiente fórmula:
-1,675 + (0,037 * edad [años]) + (0,094 * IMC [kg/m2]) + (1,13 * intolerancia a los carbohidratos/diabetes [sí = 1, no = 0]) + (0,99 * AST/ALT radio) - (0,013 * conteo de plaquetas [×109/L]) - (0,66 * albúmina [g/dL]).
ALT: alanina-aminotransferasa; AST: aspartato-aminotransferasa; IMC: índice de masa corporal.
Se identificaron 3 categorías según un rango de valores de la siguiente manera:
< -1,455: riesgo bajo de fibrosis hepática (sensibilidad: 77%, especificidad: 71%, valor predictivo positivo [VPP]: 52%, valor predictivo negativo [VPN]: 88%).
≥ -1,455 a 0,676: riesgo indeterminado.
> 0,676: alto riesgo de fibrosis hepática (sensibilidad: 43%, especificidad: 96%, VPP: 82%, VPN: 80%, LR +: 11)20.
Índice de relación aspartato-aminotransferasa a plaquetas
El puntaje APRI se calculó con la siguiente fórmula:
(AST en IU/L) / (AST límite superior normal en IU/L) / (plaquetas en 109/L)
Un punto de corte de 0,7 se utilizó para la discriminación de fibrosis (sensibilidad de 65% y especificidad de 72%)21.
Bioimpedanciometría
La bioimpedanciometría es una técnica no invasiva que se utiliza para hacer estimaciones precisas del agua corporal total (ACT) y, por asunciones basadas en las constantes de hidratación de los tejidos, se obtiene la masa libre de grasa (MLG) y la masa grasa (MG). Estos datos sirven para el ajuste de la terapia de reemplazo renal22.
Análisis estadístico
La media (DE) y los porcentajes se utilizaron para la descripción de variables cuantitativas y categóricas, respectivamente. El contraste de hipótesis se realizó a través de la prueba de chi cuadrado y la T de Student, según correspondiera. Para estimar la magnitud de las asociaciones se utilizaron OR (IC 95%) y diferencias de media. La significación estadística se estableció con un valor p = 0,05. Los datos se analizaron con el paquete estadístico Paquete Estadístico para las Ciencias Sociales (SPSS) versión 15.
Resultados
Descripción clínica y sociodemográfica de la población de estudio
Ochenta pacientes se incluyeron en el estudio, de los cuales se excluyeron 16 por no poder obtener una medición elastográfica confiable (7 no cumplían los criterios de calidad y 9 por falla técnica) (Figura 1). De los 64 pacientes incluidos, el 56% presentaban obesidad o sobrepeso. Las características basales de la población pueden observarse en la Tabla 1.
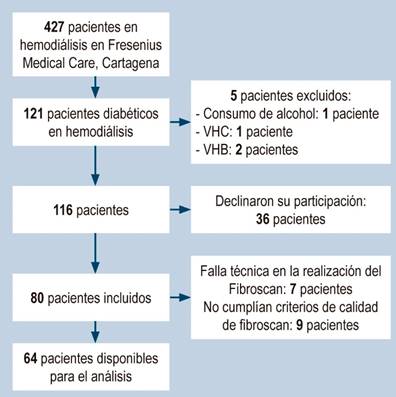
Figura 1 Diagrama de flujo del estudio. Se excluyó un total de 57 pacientes. Imagen propiedad de los autores.
Tabla 1 Características basales de los pacientes del estudio*
| Variable | (n,%) |
|---|---|
| Edad (años) | 63,5 (9,2) |
| Sexo masculino | 34 (53) |
| Hipertensión arterial | 62 (96,9) |
| HTA > 10 años | 62 (96,9) |
| DM > 10 años | 63 (98,4) |
| Enfermedad cerebrovascular | 3 (4,7) |
| Infarto del miocardio | 4 (6,3) |
| Enfermedad vascular periférica | 7 (10,9) |
| Insuficiencia cardíaca | 13 (20,3) |
| Fibrilación auricular | 1 (1,6) |
| Retinopatía | 7 (10,9) |
| Causa ERC | |
| Hipertensión y diabetes | 46 (71,9) |
| Hipertensión | 7 (10,9) |
| Diabetes | 9 (14,1) |
| Otras | 2 (3,1) |
| Tiempo en diálisis (años) | 5 (3,3) |
| Peso (kg) | 66,6 (13) |
| Talla (m) | 1,61 (0,07) |
| IMC (kg/m2) | 25,57 (5) |
| Clasificación según IMC | |
| Normal | 28 (43,8) |
| Sobrepeso | 22 (34,4) |
| Obesidad | 12 (18,8) |
| Bajo peso | 2 (3,1) |
| Perímetro de cintura (cm) | 94,2 (10,7) |
| Síndrome metabólico | 33 (51,6) |
| Hemoglobina (g/dL) | 10,6 (1,5) |
| Plaquetas x 109/L | 213 196 (83 915) |
| LDL (mg/dL) | 88,1 (33) |
| Colesterol total (mg/dL) | 155,6 (41,1) |
| HDL (mg/dL) | 32,6 (9,1) |
| Triglicéridos (mg/dL) | 174,3 (91,7) |
| Hemoglobina glicosilada (%) | 6,5 (2) |
| Creatinina (mg/dL) | 9,1 (3) |
| Nitrógeno ureico (mg/dL) | 48 (15,1) |
| Potasio (mEq/L) | 5 (0,8) |
| Sodio (mEq/L) | 139,2 (2,4) |
| Fósforo (mEq/L) | 4,1 (1,3) |
| Paratohormona (pg/mL) | 372 (372) |
| Calcio (mEq/L) | 8,5 (0,6) |
| AST (UI/L) | 14,7 (6,7) |
| ALT (UI/L) | 14 (10,6) |
| Albúmina (g/dL) | 4 (0,4) |
| Fosfatasa alcalina (UI/L) | 137,3 (95) |
| Fibroscan (kPa) | 7,2 (5,6) |
| RIC (kPa) | 0,15 (0,05) |
| CAP (dB-m) | 244,1 (54,6) |
| Puntaje APRI (> 0,7) | 17 (26,6) |
| Puntaje NAFLD | |
| Riesgo bajo | 3 (47) |
| Indeterminado | 46 (71,9) |
| Riesgo alto | 15 (23,4) |
| Esteatosis hepática | 7 (10,9) |
| Fibrosis hepática | 11 (17,2) |
| Cirrosis hepática | 7 (10,9) |
*Las variables cuantitativas se expresan en forma de media y desviación estándar (DE) y las categóricas en frecuencias absolutas y porcentajes (%). APRI: índice de relación AST a plaquetas; ARA: antagonistas de los receptores de angiotensina; CAP: parámetro de atenuación controlado; DM: diabetes mellitus; ERC: enfermedad renal crónica; HDL: lipoproteínas de alta densidad; HTA: hipertensión arterial; IECA: inhibidor de la enzima convertidora de angiotensina; LDL: lipoproteínas de baja densidad; Puntaje NAFLD: puntaje para la enfermedad hepática por depósito de grasa; RIC: rango intercuartílico. Tabla elaborada por los autores.
La edad media de la población fue de 63,5 años, se observó una proporción similar entre ambos sexos y un 77% pertenecían a los estratos 1 y 2. La presencia de síndrome metabólico se observó en 33 pacientes (52%). Sesenta y dos pacientes (96,9%) eran hipertensos, 33 pacientes eran dislipidémicos (50%) y 41 pacientes tenían un perímetro abdominal por encima de lo recomendado para su sexo (64%).
En función de los valores del IMC, un 3% se encuentran en infrapeso, 43% en normopeso, 34% en sobrepeso 18% en obesidad. El promedio de índice de tejido graso fue de 17,7 kg/m2 y el índice de tejido magro de 12,1 kg/m2. Se encontró esteatosis hepática en un 13,8% de los pacientes según las mediciones de CAP.
A pesar de tratarse de una cohorte de pacientes diabéticos con ERCT, se encontró que el 100% tenía un valor de triglicéridos y el 77%, un valor de hemoglobina glicosilada A1c (HbA1c) dentro de las metas establecidas; sin embargo, solamente un 17% presentaron un adecuado control de los niveles de LDL y un 63% de las cifras de presión arterial.
Las complicaciones crónicas secundarias de la diabetes, al margen de la insuficiencia renal crónica, más frecuentemente observadas fueron la insuficiencia cardíaca (20%), la retinopatía (11%), la enfermedad vascular periférica (11%), el infarto agudo de miocardio (6%) y la enfermedad cerebrovascular (5%).
La principal causa de ERC es la combinación de nefropatía diabética e hipertensiva (72%), seguida de la diabetes (14%) o de la hipertensión arterial (11%) de forma independiente. La cohorte de pacientes estudiados tenía una media de tiempo en diálisis de 5 años; de estos, el 67% de los pacientes recibe algún tratamiento antihipertensivo; los más frecuentemente usados fueron los antagonistas del calcio, la clonidina y los inhibidores de la enzima convertidora de la angiotensina (IECA) o antagonistas del receptor de la angiotensina II (ARA-II).
El 84% de los pacientes recibía tratamiento con análogos de la eritropoyetina y un 60% con hierro parenteral. Únicamente 18 pacientes presentan niveles de hemoglobina por debajo de los valores esperados. Las alteraciones en el metabolismo mineral y óseo también están presentes en los pacientes del estudio, de los que 43% recibía tratamiento con carbonato de calcio, 34% con calcitriol y para el tratamiento del hiperparatiroidismo se encontró que 11 pacientes recibían tratamiento con sevelamer (Renvela-Renagel) y 6 con cinacalcet (Mimpara-Sensipar).
Con respecto a los marcadores indirectos de lesión hepática, las aminotransferasas y la albúmina se encuentran dentro de los valores normales en un 89% y 84% de los pacientes, respectivamente. Las escalas de valoración de riesgo para fibrosis hepática señalaron que 10 (19%) pacientes se encuentran en riesgo alto para presentar fibrosis hepática según el puntaje NAFLD y 12 (23%) según el puntaje APRI.
Análisis descriptivo de la población con fibrosis hepática significativa
Se encontraron 11 (17%) pacientes con fibrosis hepática significativa, dentro de los cuales 7 (63%) presentaban valores elastográficos compatibles con la presencia de cirrosis hepática establecida en el momento de su evaluación y ninguno de los que presentaba un diagnóstico previo de enfermedad hepática crónica.
Todos los pacientes tenían un tiempo de evolución superior a 10 años de la HTA y DM. Las complicaciones más frecuentes de la diabetes fueron insuficiencia cardíaca (36,4%), enfermedad vascular periférica (27,3%), eventos cerebrovasculares (18%), retinopatía (18%) e infarto de miocardio (9%). Se encontró que el 54% de los pacientes presentan normopeso, 36% sobrepeso y 9% bajo peso (Tabla 2).
Tabla 2 Características de los pacientes con fibrosis*
| Variable | Fibrosis n (%) |
|---|---|
| Sexo masculino | 8 (72,7) |
| Edad | 67,9 (8) |
| Régimen de salud | |
| Subsidiado | 5 (45,5) |
| Contributivo | 5 (45,5) |
| Especial | 1 (9,1) |
| HTA | 11 (100) |
| HTA > 10 años | 11 (100) |
| DM > 10 años | 11 (100) |
| Enfermedad cerebrovascular | 2 (18,2) |
| Infarto del miocardio | 1 (9,1) |
| Enfermedad vascular periférica | 3 (27,3) |
| Insuficiencia cardíaca | 4 (36,4) |
| Fibrilación auricular | 0 (0) |
| Retinopatía | 2 (18,2) |
| Causa ERC | |
| Hipertensión y diabetes | 5 (45,5) |
| Hipertensión | 3 (27,3) |
| Diabetes | 3 (27,3) |
| Clasificación del IMC | |
| Normal | 6 (54,5) |
| Sobrepeso | 4 (36,4) |
| Obesidad | 0 (0) |
| Bajo peso | 1 (9,1) |
| Síndrome metabólico | 4 (36,4) |
| Tratamiento | |
| IECA o ARA | 3 (27,3) |
| Bloqueantes β | 4 (36,4) |
| Clonidina | 6 (54,5) |
| Antagonista del calcio | 10 (90,9) |
| Minoxidil | 2 (18,2) |
| Eritropoyetina | 8 (72,7) |
| Hierro parenteral | 5 (45,5) |
| Calcitriol | 3 (27,3) |
| Carbonato de calcio | 4 (36,4) |
| Hidróxido de aluminio | 1 (9,1) |
| Paracalcitiol | 1 (9,1) |
| Cinacalcet | 1 (9,1) |
| Sevelamer | 2 (18,2) |
| Puntaje NAFLD | |
| Riesgo bajo | 1 (9) |
| Indeterminado | 5 (45,5) |
| Riesgo alto | 5 (45,5) |
| APRI | |
| Riesgo bajo | 6 (55) |
| Riesgo alto | 5 (45) |
*Las variables cuantitativas se expresan en forma de media y DE y las categóricas en frecuencias absolutas y porcentajes (%). APRI: índice de relación AST a plaquetas; ARA: antagonistas de los receptores de angiotensina; CAP: parámetro de atenuación controlado; DM: diabetes mellitus; ERC: enfermedad renal crónica; HDL: lipoproteínas de alta densidad; HTA: hipertensión arterial; IECA: inhibidor de la enzima convertidora de angiotensina; LDL: lipoproteínas de baja densidad; puntaje NAFLD: puntaje para la enfermedad hepática por depósito de grasa; RIC: rango intercuartílico. Tabla elaborada por los autores.
El puntaje NAFLD identificó solamente a un 45% de los pacientes con fibrosis dentro del grupo de alto riesgo, incluso uno de los 11 pacientes fue clasificado dentro del grupo de bajo riesgo y los 5 restantes dentro del grupo de riesgo indeterminado. El puntaje APRI clasificó correctamente al 45% dentro del grupo de alto riesgo (Tabla 3).
Tabla 3 Clasificación de los pacientes según los puntajes NAFLD y APRI en los pacientes con y sin fibrosis
| Variable | Sin fibrosis n (%) | Fibrosis n (%) | p |
|---|---|---|---|
| NAFLD | 0,1 | ||
| Riesgo bajo | 2 (4) | 1 (9) | |
| Indeterminado | 41 (77) | 5 (45,5) | |
| Riesgo alto | 10 (19) | 5 (45,5) | |
| APRI | 0,1 | ||
| Riesgo bajo | 41 (77) | 6 (55) | |
| Riesgo alto | 12 (23) | 5 (45) |
APRI: índice de relación AST a plaquetas; puntaje NAFLD: puntaje para la enfermedad hepática por depósito de grasa. Tabla elaborada por los autores.
Factores asociados a la presencia de fibrosis hepática significativa
Los factores asociados a la presencia de fibrosis hepática fueron los antecedentes de enfermedad cerebrovascular (p = 0,02), la enfermedad vascular periférica (p = 0,05), el IMC (p = 0,05), el colesterol total (p = 0,05), la HbA1c (p = 0,01), el sodio (p = 0,001) y la AST (p = 0,02) (Tablas 4 y 5).
Tabla 4 Análisis bivariado de las variables continuas y comparación de medias entre los pacientes con y sin fibrosis*
| Variable | Fibrosis (media, DE) | No fibrosis (media, DE) | Diferencia de medias | IC 95% | p |
|---|---|---|---|---|---|
| Edad (años) | 67,9 (8) | 63,4 (9,2) | 4,4 | (-10,4)-3 | 0,14 |
| Tiempo en diálisis (años) | 6,4 (2,4) | 4,6 (3,3) | 1,6 | (-3,9)-0,6 | 0,15 |
| Peso (kg) | 61,9 (13,4) | 67,8 (12,8) | 6 | (-2,3)-14,4 | 0,15 |
| Talla (m) | 1,6 (0,03) | 1,6 (0,08) | 0,02 | (-0,05)-0,007 | 0,13 |
| IMC (m/m2) | 23,3 (4,5) | 26,3 (5) | 3,2 | (-0,01)-1,6 | 0,05 |
| Perímetro de la cintura (cm) | 91,9 (12,8) | 96,1 (10,5) | 5 | (-2,1)-12,2 | 0,16 |
| Presión arterial sistólica (mm Hg) | 151,6 (32,8) | 151,9 (27,8) | 1,2 | (-19)-9,3 | 0,89 |
| Presión arterial diastólica (mm Hg) | 64,1 (10,9) | 75,6 (13,2) | 8,9 | 0,3-17,5 | 0,42 |
| Índice de tejido magro (kg/m2) | 14,9 (8,8) | 11,3 (5,7) | 4 | (-10)-2,7 | 0,17 |
| Índice de tejido graso (kg/m2) | 21,6 (16,5) | 16,9 (8,9) | 5,5 | (-16)-5 | 0,29 |
| Estado de hidratación (L) | 30 (6) | 29 (7,2) | 0,8 | (-5,4)-2,3 | 0,73 |
| Hemoglobina (g/dL) | 10,9 (2,3) | 10,3 (1,7) | 0,1 | (-1,3)-0,5 | 0,72 |
| Plaquetas x 109/L | 197(106) | 222 (83) | 24626 | (-31858)-81110 | 0,38 |
| Ferritina (ng/mL) | 964 (649) | 666 (472) | 155,7 | (-492)-180,8 | 0,35 |
| Índice de saturación de transferrina (%) | 37 (24,6) | 27,3 (14,6) | 6,4 | (-22,6)-9,7 | 0,4 |
| LDL (mg/dL) | 66,5 (19,7) | 88,5 (35,9) | 20,6 | (-2,1)-11,4 | 0,75 |
| Colesterol total (mg/dL) | 124,2 (26,6) | 156,2 (50) | 31,5 | 0,0004-63 | 0,05 |
| HDL (mg/dL) | 29,3 (11,1) | 32,7 (10,8) | 3,7 | (-3,3)-10,8 | 0,29 |
| Triglicéridos (mg/dL) | 141,7 (75,5) | 175 (99) | 35,9 | (-27,2)-99,1 | 0,26 |
| HbA1c (%) | 7,2 (1,1) | 5,6 (2,8) | 1,4 | (-0,2)-(-2,5) | 0,01 |
| Creatinina (mg/dL) | 8,8 (3) | 8,5 (3,1) | 0,06 | (-2,1)-2 | 0,95 |
| Nitrógeno ureico (mg/dL) | 45,4 (15,1) | 47,1 (14,9) | 3,2 | (-7,1)-13,5 | 0,5 |
| Potasio (mEq/L) | 5,1 (1,1) | 4,9 (0,7) | 0,1 | (-0,6)-0,3 | 0,5 |
| Sodio (mEq/L) | 136,9 (2,1) | 139,3 (2,4) | 2,7 | 1,1-4,4 | 0,001 |
| Fósforo (mEq/L) | 3,6 (1,5) | 4,2 (1,2) | 0,39 | (-0,4)-1,2 | 0,37 |
| Paratohormona (pg/mL) | 140 (88,1) | 381 (366) | 153 | (-85)-391 | 0,2 |
| Calcio (mEq/L) | 8,6 (0,4) | 8,6 (0,6) | 0,06 | (-0,4)-0,3 | 0,7 |
| AST (UI/L) | 21,3 (10,8) | 13 (5,7) | 8,5 | (-15,7)-(-1,3) | 0,02 |
| ALT (UI/L) | 22,3 (14) | 11,9 (9) | 8,3 | (-17,6)-0,9 | 0,07 |
| Albúmina (g/dL) | 3,8 (0,7) | 3,9 (0,4) | 0,1 | (-0,1)-0,4 | 0,3 |
| Fosfatasa alcalina (UI/L) | 119 (26,7) | 146 (119,7) | 11 | (-16)-(-7) | 0 |
*Las variables cuantitativas se expresan en forma de media y desviación estándar (DE). Tabla elaborada por los autores.
Tabla 5 Análisis bivariado de las características sociodemográficas y de los antecedentes de la población y la presencia o no de fibrosis hepática*
| Variable | Fibrosis n (%) | Sin fibrosis n (%) | OR | IC 95% | p |
|---|---|---|---|---|---|
| Sexo femenino | 3 (27) | 27 (51) | 2,8 | 0,6-11,5 | 0,15 |
| Residencia urbana | 9 (82) | 49 (92) | 2,7 | 0,4-17,1 | 0,27 |
| Estratos socioeconómicos 1 y 2 | 11 (100) | 53 (82) | 0,28 | 0,03-2,3 | 0,21 |
| Régimen subsidiado | 5 (45) | 29 (54) | 1,4 | 0,3-5,3 | 0,57 |
| Raza mestiza | 8 (72) | 47 (89) | 2,9 | 0,6-14,1 | 0,16 |
| Hipertensión arterial | 11 (100) | 51 (96) | 1,2 | 1-1,3 | 0,51 |
| HTA > 10 años | 11 (100) | 51 (96) | 1,2 | 1-1,3 | 0,51 |
| DM > 10 años | 11 (100) | 52 (98) | 1,2 | 1-1,3 | 0,64 |
| Enfermedad cerebrovascular | 2 (18) | 1 (1,9) | 11,5 | 0,9-141 | 0,02 |
| Infarto del miocardio | 1 (9) | 3 (6) | 1,6 | 0,1-17,7 | 0,66 |
| Enfermedad vascular periférica | 3 (27) | 4 (7) | 4,5 | 0,8-24 | 0,05 |
| Insuficiencia cardíaca | 4 (36) | 9 (17) | 2,7 | 0,6-11,5 | 0,14 |
| Fibrilación auricular | 0 (0) | 1 (2) | 0,8 | 0,7-0,9 | 0,64 |
| Retinopatía | 2 (18) | 5 (9) | 2,1 | 0,3-0,1 | 0,39 |
| Sobrepeso y obesidad | 5 (45) | 31 (58) | 0,5 | 0,1-2,1 | 0,42 |
| Síndrome metabólico | 4 (36) | 23 (36) | 0,4 | 0,1-1,7 | 0,24 |
DM: diabetes mellitus; HTA: hipertensión arterial. Tabla elaborada por los autores.
No se observó relación entre los puntajes NAFLD y APRI y la presencia de fibrosis (p = 0,1). Entre los pacientes sin fibrosis, el 19% se encontró en el grupo de alto riesgo y el 77% dentro del grupo indeterminado cuando se utilizó la puntuación NAFLD; para el puntaje APRI, el 77% del grupo sin fibrosis se encontraba en el grupo de riesgo bajo (Tabla 3).
Discusión
En este estudio se observó una prevalencia de fibrosis hepática significativa y cirrosis de 17%, de los cuales más del 50% presentaban cirrosis hepática, lo que puede tener importantes implicaciones pronósticas en la evolución de la historia natural de estas dos patologías. Estos resultados son similares a los reportados previamente en los que se ha encontrado una prevalencia de fibrosis significativa de entre el 13% y el 21% en poblaciones de pacientes diabéticos17,23-25.
La relación entre el tiempo de evolución de la diabetes y el control de la glucemia con el riesgo de lesión de órgano blanco ha quedado plenamente establecida en otros escenarios clínicos15,26-28. El hecho de que el 100% de los pacientes con fibrosis tuviese una evolución de la diabetes superior a 10 años y un peor control glucémico (HbA1c 7,6% frente a 5,6%) podría explicar en parte la elevada prevalencia de cirrosis hepática dentro de este grupo de pacientes diabéticos29,30.
Los pacientes de esta cohorte tienen una elevada prevalencia de factores de riesgo cardiovasculares como la edad, el sexo masculino, menor tasa de filtración glomerular (TFG), dislipidemia y HTA, que son factores de riesgo sinérgicos conocidos para el desarrollo de fibrosis hepática15,16.
Sin embargo, a pesar de la presencia de DMT2 y factores de riesgo cardiovascular en este grupo, la presencia de esteatosis hepática por CAP fue baja, aproximadamente un 14%. Este hallazgo aparentemente contradictorio podría explicarse por la baja prevalencia de obesidad en esta muestra (18%). Es posible que las intensas intervenciones de carácter multidisciplinario dirigidas a disminuir los factores de riesgo cardiovascular que reciben estos pacientes cuando son incluidos en un programa de diálisis hayan tenido un efecto positivo en el control del peso y de la esteatosis en el momento de la evaluación. Por otra parte, algunos estudios también señalan que en pacientes con cirrosis por EHDG en estadios avanzados pueden no presentar hallazgos histológicos de esteatosis aun a pesar de la presencia de múltiples factores de riesgo para síndrome metabólico31. A pesar de que no se han dilucidado claramente las vías por las que se produce este fenómeno, se ha especulado sobre el efecto de cambios en el flujo sanguíneo hepático, la exposición a la insulina y la liberación de glucosa y lipoproteínas desde el hepatocito como los responsables de la disminución de la grasa en hígados cirróticos por EHDG31.
En varios estudios se ha observado que un IMC > 30 kg/m2 se asocia con la presencia de fibrosis en pacientes diabéticos15,18; paradójicamente, ninguno de nuestros pacientes con fibrosis superó este punto de corte, aunque el IMC sí se asoció con la presencia de lesión hepática, lo que sugiere la posibilidad de que el daño hepático en pacientes con ERCT inicie con niveles de peso inferiores a lo que se observa en otras poblaciones. También es posible que las intervenciones que reciben los pacientes en un programa estructurado de diálisis hayan mejorado el control del peso y que los grados mayores de obesidad se hayan presentado antes de su ingreso a terapia de reemplazo renal, lo que confunde la relación observada entre el grado de sobrepeso y la presencia de fibrosis y que esta última ya se encontrara presente en el momento en el que los pacientes ingresaron al programa19,32.
Un estudio reciente realizado en una cohorte de pacientes diabéticos cuyo objetivo era identificar factores de riesgo comunes para EHDG y ERC, además de posibles vías a través de las cuales estas dos patologías pudieran interrelacionarse, encontró que el IMC y el ácido úrico parecen actuar como mediadores del incremento del riesgo de enfermedad renal crónica en pacientes diabéticos con EHDG, lo que señala nuevamente el papel del sobrepeso como un factor de riesgo para la progresión de ambas enfermedades6.
La enfermedad cardiovascular establecida y, entre estos, la enfermedad cerebrovascular y la enfermedad vascular periférica se asociaron significativamente con la presencia de fibrosis hepática avanzada19,33; sin embargo, la presencia de estos no se ha descrito en otros estudios, pero es plausible especular que esta asociación refleje una enfermedad metabólica más grave con mayor probabilidad de lesión de órgano diana y, asimismo, con un mayor riesgo de progresión de la enfermedad hepática.
En nuestro estudio, los niveles de AST se asociaron con la presencia de fibrosis hepática y se encontraron niveles más altos de AST comparados con los pacientes sin fibrosis, con una diferencia de medias de 8,5 UI/L. La AST se ha asociado de forma recurrente a la fibrosis en este tipo de pacientes y hace parte de la mayor parte de los modelos predictivos no invasivos de fibrosis como los puntajes NAFLD, APRI, Fibrometer, índice de Lok y BARD20,21,34-36. Sin embargo y a pesar de encontrarse una asociación de la fibrosis con la AST en nuestros pacientes, ni los puntajes NAFLD ni APRI clasificaron adecuadamente a los sujetos en función de la presencia de fibrosis; una posible explicación a este hecho puede ser que la presencia de ERCT tenga un efecto modificador sobre los factores que tradicionalmente se han asociado a lesión hepática crónica en esta población37-40.
La hiponatremia dilucional característica de los pacientes con cirrosis se ha descrito como un predictor de mortalidad en pacientes con enfermedad descompensada27,33. Sin embargo, a pesar de que los pacientes con fibrosis no presentaban hiponatremia, pudo observarse que presentaban niveles inferiores de sodio al compararlos con su contraparte (136 mEq/L frente a 139 mEq/L; p = 0,001), lo que sugiere que podría corresponder a un marcador temprano de una enfermedad hepática más avanzada en este grupo de pacientes.
Los valores elastográficos utilizados para determinar la presencia de fibrosis hepática y cirrosis fueron 8,2 kPa (sensibilidad: 71%, especificidad: 70%) y 13,6 kPa (sensibilidad: 85%, especificidad: 79%), respectivamente, fueron validados en un estudio multicéntrico que incluyó a 383 pacientes con sospecha de EHDG en el Reino Unido11. Sin embargo, en nuestro estudio, 10 de los 11 pacientes con fibrosis tuvieron valores elastográficos ≥ 10,3 kPa, la guía estadounidense de EHDG señala que los valores ≥ 9,9 kPa tienen una sensibilidad de 95% y una especificidad del 77%3, lo que sumado al cumplimiento de los criterios de calidad establecidos por el fabricante y los niveles de transaminasas normales en la gran mayoría de los pacientes disminuyen el riesgo de que se hubieran presentado falsos positivos en nuestro estudio.
La falla técnica se observó en un 14% (n = 7) de los pacientes y no se lograron alcanzar los criterios de calidad del fabricante en el 10,9% (n = 9) de los casos, esta última circunstancia es muy similar a lo descrito en la literatura donde se reporta aproximadamente un 15% de pacientes en los que no se logran mediciones adecuadas12-14. La falla técnica es similar con otros estudios en los que su frecuencia oscila entre 1% y 41,7%14. Los factores asociados a la falla técnica más importantes son un IMC > 30 kg/m2, una experiencia del operador menor de 500 exámenes, raza hispana, una edad mayor de 52 años, el diámetro de la cadera y la DMT241-43; es posible que incluir solamente pacientes diabéticos entre los cuales más del 50% tenía sobrepeso u obesidad con un 96% de los pacientes con un diámetro de la cadera por encima de los valores permitidos haya influido en estas diferencias.
La ERCT es una complicación microvascular de la DM; en nuestro estudio, el 72% de los pacientes con fibrosis hepática tienen daño renal debido a la diabetes, lo que apoya el concepto de que entre estas dos enfermedades existe una relación sinérgica44,45. Además, un dato epidemiológico que apoya la relación entre el trinomio diabetes, enfermedad hepática crónica y ERCT se encuentra en el hecho de que los pacientes con EHDG, que se considera el estadio inicial de la enfermedad hepática por diabetes, tienen una mayor incidencia de ERC46,47.
Los pacientes con cirrosis hepática tienen mayor riesgo de presentar lesión renal aguda y progresión de la enfermedad renal, por lo que su diagnóstico oportuno puede tener importantes implicaciones pronósticas48,49. En nuestro estudio, un 63% de los pacientes con fibrosis hepática se encontraban en estadio cirrótico y en ningún caso se había identificado esta enfermedad previamente. Es posible que la falta de familiaridad en las unidades de diálisis con las complicaciones hepáticas de la diabetes esté provocando un subdiagnóstico de la enfermedad y que se requiera realizar una búsqueda activa en estos pacientes para intentar disminuir la morbimortalidad asociada a la sinergia de estas dos complicaciones.
Además, la presencia de enfermedad hepática crónica podría llevar a un aumento en la necesidad de trasplante combinado de riñón e hígado y actualmente este procedimiento representa el 10% de todos los trasplantes que se realizan en Estados Unidos50.
El uso de marcadores no invasivos en los últimos años ha desplazado el uso de la biopsia hepática para determinar fibrosis avanzada. Se han reportado valores predictivos positivos (VPP) para el puntaje NAFLD de 90% para detectar los casos de fibrosis avanzada20,51,52; sin embargo, en este estudio, el valor predictivo positivo y negativo del puntaje NAFLD fue de 33% y 66%, respectivamente, lo que podría sugerir que estos pacientes pueden poseer características únicas que requieran la validación de los puntajes en este subgrupo de pacientes antes de poder recomendar su uso generalizado en esta población. Igualmente, el puntaje APRI en este estudio mostró un VPP de 41% y VPN de 87%, y clasificó de forma errónea a más del 50% de los pacientes.
En nuestro conocimiento, este es el primer estudio que estima la presencia de fibrosis hepática en pacientes diabéticos con ERCT en diálisis. La fibrosis hepática es un predictor independiente de mortalidad, por lo que su determinación en este grupo de pacientes es fundamental18, su búsqueda activa en esta población podría llevar a implementar estrategias que ralenticen la progresión de ambas enfermedades, mejoren la calidad de vida de los pacientes, disminuyan la cantidad de complicaciones e incrementen su supervivencia. Sin embargo, se necesitan estudios prospectivos que permitan conocer mejor la evolución natural de los pacientes con ERCT y fibrosis hepática avanzada.
Conclusión
La prevalencia de fibrosis hepática significativa en pacientes con diabetes y ERCT es similar a la reportada en otras poblaciones de pacientes con diabetes. Sin embargo, algunos factores como el sobrepeso podrían comportarse de forma diferente, lo que favorece la aparición de lesión hepática con grados menores de obesidad a los reportados previamente en la literatura.
REFERENCIAS
1. Byass P. The global burden of liver disease: A challenge for methods and for public health. BMC Med. 2014;12(1):159. https://doi.org/10.1186/s12916-014-0159-5 [ Links ]
2. Pappachan JM, Babu S, Krishnan B, Ravindran NC. Non-alcoholic Fatty Liver Disease: A Clinical Update. J Clin Transl Hepatol. 2017;5(4):384-393. https://doi.org/10.14218/JCTH.2017.00013 [ Links ]
3. European Association for the Study of the Liver (EASL); European Association for the Study of Diabetes (EASD); European Association for the Study of Obesity (EASO). EASL-EASD-EASO Clinical Practice Guidelines for the management of non-alcoholic fatty liver disease. J Hepatol. 2016;64(6):1388-402. https://doi.org/10.1016/j.jhep.2015.11.004 [ Links ]
4. Önnerhag K, Dreja K, Nilsson PM, Lindgren S. Increased mortality in non-alcoholic fatty liver disease with chronic kidney disease is explained by metabolic comorbidities. Clin Res Hepatol Gastroenterol. 2019;43(5):542-50. https://doi.org/10.1016/j.clinre.2019.02.004 [ Links ]
5. Silvariño R, Gadola L, Ríos P. Obesidad y Enfermedad Renal Crónica. Rev. Urug.Med. Interna.2020;2(3):3-23. Disponible en: https://revistamedicinainterna.uy/index.php/smiu/article/view/55 [ Links ]
6. Lee YJ, Wang CP, Hung WC, Tang WH, Chang YH, Hu DW, et al. Common and unique factors and the bidirectional relationship between chronic kidney disease and nonalcoholic fatty liver in type 2 diabetes patients. Diabetes, Metab Syndr Obes Targets Ther. 2020;13:1203-14. https://doi.org/10.2147/DMSO.S237700 [ Links ]
7. Chinnadurai R, Ritchie J, Green D, Kalra PA. Non-alcoholic fatty liver disease and clinical outcomes in chronic kidney disease. Nephrol Dial Transplant. 2019;34(3):449-57. https://doi.org/10.1093/ndt/gfx381 [ Links ]
8. Wong F, Reddy KR, O›Leary JG, Tandon P, Biggins SW, Garcia-Tsao G, et al. Impact of Chronic Kidney Disease on Outcomes in Cirrhosis. Liver Transplant. 2019;25(6):870-80. https://doi.org/10.1002/lt.25454 [ Links ]
9. Vanegas CM, Restrepo C, Vargas N, Marín AE. Caracterización de pacientes con enfermedad del hígado graso no alcohólica en un hospital de alta complejidad en 2013. Rev Colomb Gastroenterol. 2014;29(4):342-6. https://doi.org/10.22516/25007440.421 [ Links ]
10. Rafael J, Ángel M, Salcedo Ó, Wady D, Felipe J, Quijano CA, et al. Hígado graso no alcohólico en consulta de gastroenterología. Repertorio de Medicina y Cirugía. 2016;5(4):210-8. [ Links ]
11. Sandrin L, Fourquet B, Hasquenoph JM, Yon S, Fournier C, Mal F, et al. Transient elastography: A new noninvasive method for assessment of hepatic fibrosis. Ultrasound Med Biol. 2003;29(12):1705-13. https://doi.org/10.1016/j.ultrasmedbio.2003.07.001 [ Links ]
12. Castéra L, Foucher J, Bernard PH, Carvalho F, Allaix D, Merrouche W, et al. Pitfalls of liver stiffness measurement: A 5-year prospective study of 13,369 examinations. Hepatology. 2010;51(3):828-35. https://doi.org/10.1002/hep.23425 [ Links ]
13. Eddowes PJ, Sasso M, Allison M, Tsochatzis E, Anstee QM, Sheridan D, et al. Accuracy of FibroScan Controlled Attenuation Parameter and Liver Stiffness Measurement in Assessing Steatosis and Fibrosis in Patients With Nonalcoholic Fatty Liver Disease. Gastroenterology. 2019;156(6):1717-30. https://doi.org/10.1053/j.gastro.2019.01.042 [ Links ]
14. Siddiqui MS, Vuppalanchi R, Van Natta ML, Hallinan E, et al. Vibration-controlled Transient Elastography to Assess Fibrosis and Steatosis in Patients With Nonalcoholic Fatty Liver Disease. Clin Gastroenterol Hepatol. 2019;17(1):156-163.e2. https://doi.org/10.1016/j.cgh.2018.04.043 [ Links ]
15. Björkström K, Franzén S, Eliasson B, Miftaraj M, Gudbjörnsdottir S, Trolle-Lagerros Y, et al. Risk Factors for Severe Liver Disease in Patients With Type 2 Diabetes. Clin Gastroenterol Hepatol. 2019;17(13):2769-2775.e4. https://doi.org/10.1016/j.cgh.2019.04.038 [ Links ]
16. Pimpin L, Cortez-Pinto H, Negro F, Corbould E, Lazarus JV, Webber L, et al. Burden of liver disease in Europe: Epidemiology and analysis of risk factors to identify prevention policies. J Hepatol. 2018;69(3):718-35. https://doi.org/10.1016/j.jhep.2018.05.011 [ Links ]
17. Ekstedt M, Hagström H, Nasr P, Fredrikson M, Stål P, Kechagias S, et al. Fibrosis stage is the strongest predictor for disease-specific mortality in NAFLD after up to 33 years of follow-up. Hepatology. 2015;61(5):1547-54. ttps://doi.org/10.1002/hep.27368 [ Links ]
18. Li X, Jiao Y, Xing Y, Gao P. Diabetes Mellitus and Risk of Hepatic Fibrosis/Cirrhosis. Biomed Res Int. 2019;2019: 5308308. https://doi.org/10.1155/2019/5308308 [ Links ]
19. Moreno-del Castillo MC, Sánchez-Rodriguez A, Hernández-Buen Abad JJ, Aguirre-Valadez J, Ruiz I, Garcia-Buen Abad R, et al. Importance of Evaluating Cardiovascular Risk and Hepatic Fibrosis in Patients With Newly Diagnosed Nonalcoholic Fatty Liver Disease. Clin Gastroenterol Hepatol. 2019;17(5):997-9. https://doi.org/10.1016/j.cgh.2018.07.039 [ Links ]
20. Angulo P, Hui JM, Marchesini G, Bugianesi E, George J, Farrell GC, et al. The NAFLD fibrosis score: A noninvasive system that identifies liver fibrosis in patients with NAFLD. Hepatology. 2007;45(4):846-854. https://doi.org/10.1002/hep.21496 [ Links ]
21. Wong VWS, Adams LA, de Lédinghen V, Wong GLH, Sookoian S. Noninvasive biomarkers in NAFLD and NASH - current progress and future promise. Nat Rev Gastroenterol Hepatol. 2018;15(8):461-78. https://doi.org/10.1038/s41575-018-0014-9 [ Links ]
22. Alvero-Cruz JR, Correas L, Ronconi M, Férnandez R, Porta J. La bioimpedanciometría eléctrica como método de estimación de la composición corporal, normas prácticas de utilización. Rev Andal Med Deporte. 2011;4(4):167-74. [ Links ]
23. Tuong TTK, Tran DK, Phu PQT, Hong TND, Dinh TC, Chu DT. Non-alcoholic fatty liver disease in patients with type 2 diabetes: Evaluation of hepatic fibrosis and steatosis using fibroscan. Diagnostics. 2020;10(3):159. https://doi.org/10.3390/diagnostics10030159 [ Links ]
24. Lai LL, Wan Yusoff WNI, Vethakkan SR, Nik Mustapha NR, Mahadeva S, Chan WK. Screening for non-alcoholic fatty liver disease in patients with type 2 diabetes mellitus using transient elastography. J Gastroenterol Hepatol. 2019;34(8):1396-403. https://doi.org/10.1111/jgh.14577 [ Links ]
25. George ES, Roberts SK, Nicoll AJ, Reddy A, Paris T, Itsiopoulos C, et al. Non alcoholic fatty liver disease patients attending two metropolitan hospitals in Melbourne, Australia; high risk status and low prevalence. Intern Med J. 2018;48(11):1369-1376. https://doi.org/10.1111/imj.13973 [ Links ]
26. de Marco R, Locatelli F, Zoppini G, Verlato G, Bonora E, Muggeo M. Cause-specific mortality in type 2 diabetes. The Verona Diabetes Study. Diabetes Care. 1999;22(5):756‐761. https://doi.org/10.2337/diacare.22.5.756 [ Links ]
27. Vora JP, Leese GP, Peters JR, Owens DR. Longitudinal evaluation of renal function in non-insulin-dependent diabetic patients with early nephropathy: effects of angiotensin-converting enzyme inhibition. J Diabetes Complications. 1996;10(2):88-93. https://doi.org/10.1016/1056-8727(95)00003-8 [ Links ]
28. Klein R, Klein BE, Moss SE, Davis MD, DeMets DL. The Wisconsin epidemiologic study of diabetic retinopathy. III. Prevalence and risk of diabetic retinopathy when age at diagnosis is 30 or more years. Arch Ophthalmol 1984;102(4):527-532. https://doi.org/10.1001/archopht.1984.01040030405011 [ Links ]
29. Tsalamandris C, Allen TJ, Gilbert RE, Sinha A, Panagiotopoulos S, Cooper ME, et al. Progressive decline in renal function in diabetic patients with and without albuminuria. Diabetes. 1994;43(5):649-55. https://doi.org/10.2337/diabetes.43.5.649 [ Links ]
30. American Diabetes Association. 6. Glycemic Targets: Standards of Medical Care in Diabetes-2020. Diabetes Care. 2020;43(Suppl 1):S66-S76. https://doi.org/10.2337/dc20-S006 [ Links ]
31. Caldwell SH, Lee VD, Kleiner DE, Al-Osaimi AMS, Argo CK, Northup PG, et al. NASH and cryptogenic cirrhosis: A histological analysis. Ann Hepatol. 2009;8(4):346-52. https://doi.org/10.1016/S1665-2681(19)31748-X [ Links ]
32. Hamed AE, Elsahar M, Elwan NM, El-Nakeep S, Naguib M, Soliman HH, et al . Managing diabetes and liver disease association. Arab J Gastroenterol. 2018;19(4):166-79. https://doi.org/10.1016/j.ajg.2018.08.003 [ Links ]
33. Scaglione S, Kliethermes S, Cao G, Shoham D, Durazo R, Luke A, et al. The epidemiology of cirrhosis in the United States a population-based study. J Clin Gastroenterol. 2015;49(8):690-6. https://doi.org/10.1097/MCG.0000000000000208 [ Links ]
34. Calès P, Boursier J, Oberti F, Hubert I, Gallois Y, Rousselet MC, et al. FibroMeters: a family of blood tests for liver fibrosis. Gastroenterol Clin Biol. 2008;32(6 Suppl 1):40-51. https://doi.org/10.1016/S0399-8320(08)73992-7 [ Links ]
35. Wai Ch, Greenson J, Fontana R, Kalbfleisch J, Marrero J, Conjeevaram HS, et al. A simple noninvasive index can predict both significant fibrosis and cirrhosis in patients with chronic hepatitis C. Hepatology. 2003;38(2):518-526. https://doi.org/10.1053/jhep.2003.50346 [ Links ]
36. Harrison SA, Oliver D, Arnold HL, Gogia S, Neuschwander-Tetri BA. Development and validation of a simple NAFLD clinical scoring system for identifying patients without advanced disease. Gut. 2008;57(10):1441‐1447. https://doi.org/10.1136/gut.2007.146019 [ Links ]
37. Henry ZH, Argo CK. How to Identify the Patient with Nonalcoholic Steatohepatitis Who Will Progress to Cirrhosis. Gastroenterol Clin North Am. 2020;49(1):45-62. https://doi.org/10.1016/j.gtc.2019.09.002 [ Links ]
38. Leise M, Cárdenas A. Hyponatremia in Cirrhosis: Implications for Liver Transplantation. Liver Transplant. 2018;24(11):1612-21. https://doi.org/10.1002/lt.25327 [ Links ]
39. Patel K, Sebastiani G. Limitations of non-invasive tests for assessment of liver fibrosis. JHEP Reports. 2020;2(2):100067. https://doi.org/10.1016/j.jhepr.2020.100067 [ Links ]
40. Mofrad P, Contos MJ, Haque M, Sargeant C, Fisher RA, Luketic VA, et al. Clinical and histologic spectrum of nonalcoholic fatty liver disease associated with normal ALT values. Hepatology. 2003;37(6):1286-92. https://doi.org/10.1053/jhep.2003.50229 [ Links ]
41. Pais R, Charlotte F, Fedchuk L, Bedossa P, Lebray P, Poynard T, et al. A systematic review of follow-up biopsies reveals disease progression in patients with non-alcoholic fatty liver. J Hepatol. 2013;59(3):550-6. https://doi.org/10.1016/j.jhep.2013.04.027 [ Links ]
42. Vuppalanchi R, Siddiqui MS, Van Natta ML, Hallinan E, Brandman D, Kowdley K, et al. Performance characteristics of vibration-controlled transient elastography for evaluation of nonalcoholic fatty liver disease. Hepatology. 2018;67(1):134-44. https://doi.org/10.1002/hep.29489 [ Links ]
43. Sporea I, Mare R, Popescu A, Nistorescu S, Baldea V, Sirli R, et al. Screening for Liver Fibrosis and Steatosis in a Large Cohort of Patients with Type 2 Diabetes Using Vibration Controlled Transient Elastography and Controlled Attenuation Parameter in a Single-Center Real-Life Experience. J Clin Med. 2020;9(4):1032. https://doi.org/10.3390/jcm9041032 [ Links ]
44. Chen PC, Kao WY, Cheng YL, Wang YJ, Hou MC, Wu JC, et al. The correlation between fatty liver disease and chronic kidney disease. J Formos Med Assoc. 2020;119(1P1):42-50. https://doi.org/10.1016/j.jfma.2019.02.010 [ Links ]
45. Han E, Lee Y. Non-Alcoholic Fatty Liver Disease: The Emerging Burden in Cardiometabolic and Renal Diseases. Diabetes Metab J. 2017;41(6):430-7. https://doi.org/10.4093/dmj.2017.41.6.430 [ Links ]
46. Mikolasevic I, Racki S, Bubic I, Jelic I, Stimac D, Orlic L. Chronic kidney disease and nonalcoholic fatty liver disease proven by transient elastography. Kidney Blood Press Res. 2013;37(4-5):305-10. https://doi.org/10.1159/000350158 [ Links ]
47. Targher G, Byrne CD. Non-alcoholic fatty liver disease: An emerging driving force in chronic kidney disease. Nat Rev Nephrol. 2017;13(5):297-310. https://doi.org/10.1038/nrneph.2017.16 [ Links ]
48. Kiapidou S, Liava C, Kalogirou M, Akriviadis E, Sinakos E. Chronic kidney disease in patients with non-alcoholic fatty liver disease: What the Hepatologist should know? Ann Hepatol. 2020;19(2):134-44. https://doi.org/10.1016/j.aohep.2019.07.013 [ Links ]
49. Bassegoda O, Huelin P, Ariza X, Solé C, Juanola A, Gratacós-Ginès J, et al. Development of chronic kidney disease after acute kidney injury in patients with cirrhosis is common and impairs clinical outcomes. J Hepatol. 2020 Jun;72(6):1132-1139. https://doi.org/10.1016/j.jhep.2019.12.020 [ Links ]
50. Ekser B, Contreras AG, Andraus W, Taner T. Current status of combined liver-kidney transplantation. Int J Surg. 2020;82S:149-154. https://doi.org/10.1016/j.ijsu.2020.02.008 [ Links ]
51. Zhou JH, She ZG, Li HL, Cai JJ. Noninvasive evaluation of nonalcoholic fatty liver disease: Current evidence and practice. World J Gastroenterol. 2019;25(11):1307-26. https://doi.org/10.3748/wjg.v25.i11.1307 [ Links ]
52. Vilar-Gomez E, Chalasani N. Non-invasive assessment of non-alcoholic fatty liver disease: Clinical prediction rules and blood-based biomarkers. J Hepatol. 2018;68(2):305-15. https://doi.org/10.1016/j.jhep.2017.11.013 [ Links ]
Citación: Yepes-Barreto I, Romero D, Coronado-Daza J. Factores de riesgo para fibrosis hepática en pacientes diabéticos con enfermedad renal crónica terminal. Revista. colomb. Gastroenterol. 2023;38(3):278-289. https://doi.org/10.22516/25007440.1061
Recibido: 27 de Marzo de 2023; Aprobado: 20 de Abril de 2023











 texto em
texto em 



