Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista colombiana de Gastroenterología
Print version ISSN 0120-9957On-line version ISSN 2500-7440
Rev. colomb. Gastroenterol. vol.38 no.3 Bogotá July/Sept. 2023 Epub Jan 15, 2024
https://doi.org/10.22516/25007440.983
Trabajos originales
Frecuencia de la infección por Helicobacter pylori en pacientes que requirieron endoscopia digestiva en siete unidades de tres subregiones de Antioquia
1Bacteriologist and clinical laboratory technician. Lecturer and researcher, Universidad de Antioquia. Medellín, Colombia.
2Physician, postdoctoral fellow, McGovern Medical School. Texas, Houston, USA.
3Health information systems manager. Researcher, Bacteria & Cancer Group, Medicine School, Universidad de Antioquia. Medellín, Colombia.
4Medical student. Researcher, Bacteria & Cancer Group, Medicine School, Universidad de Antioquia. Medellín, Colombia.
5Bacteriologist and clinical laboratory technician, MS in Basic Biomedical Sciences. Co-researcher and lecturer, Bacteria & Cancer Group, Medicine School, Universidad de Antioquia. Medellín, Colombia.
6MSc, PhD, postdoctoral degree in Molecular Biology. Coordinator, Bacteria & Cancer Group. Head of the Microbiology and Parasitology Department, Universidad de Antioquia. Medellín, Colombia.
Objetivo:
determinar la frecuencia de Helicobacter pylori y la presencia de factores sociodemográficos, hábitos de vida y antecedentes personales y familiares de enfermedades gastroduodenales en pacientes que requirieron y fueron llevados a endoscopia digestiva (sintomáticos o por tamización) en siete unidades de endoscopia de tres subregiones de Antioquia.
Materiales y métodos:
estudio transversal realizado entre 2016 y 2018 que incluyó a 272 participantes. Los factores sociodemográficos, hábitos de vida, antecedentes personales y familiares se relacionaron con la infección por H. pylori. Se realizó estadística descriptiva y análisis bivariado para establecer la asociación entre las variables y el análisis multivariado (regresión binomial) para ajustar las razones de prevalencia de los factores asociados. Un valor p ≤ 0,05 se consideró estadísticamente significativo.
Resultados:
la frecuencia de infección por H. pylori fue de 55,9%, con diferencias por subregión (área metropolitana del Valle de Aburrá: 54,3%, oriente: 64% y Urabá: 79,2%). Los factores asociados a la infección por H. pylori fueron sexo masculino (razón de prevalencia ajustada [RPA] = 1,26; intervalo de confianza [IC] del 95% = 1,04-1,52), edad de 18-55 años (RPA = 1,62; IC 95% = 1,22-2,16), ausencia de agua potable (RPA = 1,40; IC 95%: 1,15-1,72) y nivel educativo inferior al universitario (RPA = 1,73; IC 95% = 1,26-2,38).
Conclusión:
la frecuencia de H. pylori fue mayor que en otros estudios recientes porque se emplearon diferentes pruebas diagnósticas para su detección y se demostraron diferencias en la frecuencia de la infección por región, lo cual se explica por la heterogeneidad en las poblaciones analizadas. Este estudio sugiere la necesidad de mejorar las condiciones de vida de la población para reducir la infección por H. pylori y dirigir medidas de prevención primaria de la infección especialmente en los grupos familiares, en hombres, individuos entre 18 y 55 años, sin agua potable y con un nivel educativo inferior al universitario.
Palabras clave: Helicobacter pylori; epidemiología; enfermedades gastroduodenales; pruebas diagnósticas
Aim:
To determine the frequency of Helicobacter pylori and sociodemographic factors, life habits, and personal and family history of gastroduodenal diseases in patients who required and were taken to GI endoscopy (symptomatic or by screening) in seven endoscopy units in three Antioquia subregions.
Materials and methods:
A cross-sectional study conducted between 2016 and 2018 included 272 participants. Sociodemographic factors, life habits, and personal and family history were related to H. pylori infection. Descriptive statistics and bivariate analysis were performed to establish the association between the variables, and multivariate analysis (binomial regression) was used to adjust the prevalence ratios of the associated factors. A p-value ≤ 0.05 was considered statistically significant.
Results:
The frequency of H. pylori infection was 55.9%, with differences by subregion (Valle de Aburrá metropolitan area: 54.3%, Oriente: 64%, and Urabá: 79.2%). Factors associated with H. pylori infection were male sex (adjusted prevalence ratio [APR] = 1.26; 95% confidence interval [CI] = 1.04-1.52), age 18-55 years (APR = 1.62; CI 95% = 1.22-2.16), absence of drinking water (APR = 1.40; 95% CI: 1.15-1.72) and educational level below university (APR = 1.73; 95% CI% = 1.26-2.38).
Conclusion:
The frequency of H. pylori was higher than in other recent studies because different diagnostic tests were used for its detection, and differences were found in the frequency of infection by region, which is explained by the heterogeneity in the populations analyzed. This study suggests the need to improve the population’s living conditions to reduce H. pylori and direct measures of primary prevention of the infection, especially in family groups, men, individuals between 18 and 55 years old without drinking water, and with an educational level lower than university.
Keywords: Helicobacter pylori; epidemiology; gastroduodenal diseases; diagnostic tests
Introducción
La infección por Helicobacter pylori es un problema de salud pública porque afecta a más de la mitad de la población mundial, se transmite vía oral-oral, gástrica-oral y fecal-oral por contacto estrecho o intrafamiliar, aunque existen otras posibles rutas1. La transmisión se asocia con bajas condiciones socioeconómicas, bajo nivel educativo, hacinamiento, malas prácticas higiénicas, madre infectada con H. pylori y consumo de agua no potable, entre otros1,2. La prevalencia de la infección varía de acuerdo con la región geográfica y oscila desde el 20% en países de medianos y altos ingresos hasta más del 79% en los de bajos ingresos. Las regiones de mayor prevalencia son África (79,1%), Suramérica (63,4%) y Asia (54,7%), y las de menor prevalencia son Oceanía (24,4%), Europa occidental (47%) y Norteamérica (37,1%)3.
H. pylori produce enfermedades gastroduodenales como resultado de un proceso multifactorial que involucra factores del microorganismo, características genéticas y epidemiológicas del hospedero y factores ambientales o socioculturales1,4. En el 80% de los pacientes la infección es crónica, persistente y asintomática, el resto desarrollan enfermedades como úlcera péptica, cáncer gástrico (CG) y linfoma de células B del tejido linfoide asociado a mucosa (MALT). La Agencia Internacional de Investigación sobre Cáncer (IARC) en 1994 clasificó a H. pylori como un carcinógeno de grado I5; además, el 89% de CG no cardial está asociado con la infección bacteriana6. Según el Observatorio Global del Cáncer (GLOBOCAN) de 2020, en el mundo, el CG ocupó el quinto lugar en incidencia (1 089 103) y el tercero en mortalidad (768 793); mientras que en Colombia fue el cuarto en incidencia (8214) y el primero en mortalidad (6451)7.
Los datos de mortalidad del CG en Colombia varían geográficamente, son mayores en las regiones montañosas en comparación con las zonas costeras4,8. De acuerdo con los datos del Departamento Administrativo Nacional de Estadística (DANE) para 2019 en Antioquia, la mortalidad por CG muestra diferencias por subregión. De los 749 casos del departamento (11,4/100 000 habitantes) se observa que la mortalidad fue más alta (114 muertes, 16,7/100 000) en la subregión montañosa de oriente (1900-2600 metros sobre el nivel del mar [msnm]; media: 484 muertes, 12,2/100 000) en el área metropolitana del Valle de Aburrá (AMVA) (1150-1700 msnm) y baja (30 muertes, 5,8/100 000) en la subregión costera de Urabá (30-919 msnm)9. Estas variaciones se explican por la heterogeneidad genética de la población, la diversidad sociocultural y las diferencias geográficas8,10,11.
La prevalencia regional de H. pylori no se registra de manera sistemática, especialmente en países de bajos ingresos. Los estudios de prevalencia de la infección presentan variaciones en los métodos diagnósticos, muestras estudiadas, criterios de selección, grupos de edad y condición clínica de los pacientes, lo que genera dificultades en la interpretación de la representatividad de los datos en la población general3,12,13. En Colombia, los estudios de prevalencia regionales no son extrapolables a la población general y no hay datos consolidados; sin embargo, las cifras disponibles estiman prevalencias mayores del 70%12,13.
La prevención del CG está encaminada a identificar población de alto riesgo y los factores relacionados con la infección por H. pylori, porque al eliminar la infección se reduce el riesgo de desarrollar CG6,11,14. Estudios previos demuestran que estas medidas disminuyen la incidencia de CG en poblaciones de alto riesgo11,14-16. En Colombia, el CG es una enfermedad de mal pronóstico y con supervivencia < 20% a 5 años17,18. Con base en lo anterior, el objetivo de este estudio fue determinar la relación de la infección por H. pylori con características clínicas, epidemiológicas, ambientales y socioculturales en pacientes consultantes y requirentes de procedimientos endoscópicos de siete servicios de gastroenterología de tres subregiones de Antioquia, Colombia.
Materiales y métodos
Población de estudio y criterios de selección
Es un estudio transversal analítico aprobado por el comité de ética de la Facultad de Medicina de la Universidad de Antioquia (Acta 013-2016). La población de estudio estaba constituida por voluntarios mayores de 18 años de edad atendidos en el servicio de endoscopia digestiva superior (EDS) de siete instituciones de salud de tres subregiones de Antioquia: AMVA, Oriente y Urabá, Colombia, entre 2016 y 2018 quienes aceptaron y firmaron el consentimiento. Se excluyeron a los pacientes con tratamiento de inhibidores de la bomba de protones (IBP) en los 15 días previos a la EDS, antagonistas del receptor H2 de histamina en los 15 días previos a la EDS o antibióticos en el último mes, también se excluyeron a individuos con hemorragia gastrointestinal superior, tratamiento anticoagulante, trastornos de coagulación, mujeres embarazadas, cirugía previa del tracto digestivo superior, diagnóstico de enfermedades crónicas graves (riñón, hígado, insuficiencia cardíaca descompensada y diabetes mellitus descompensada) o radioquimioterapia.
Tamaño de la muestra
El tamaño muestral se calculó con base en la cantidad de pacientes atendidos en un periodo de cuatro meses en los servicios de EDS de las instituciones participantes (n = 4024 individuos); se estimó empleando el software Epidat versión 3.1 con un intervalo de confianza (IC) del 95%, potencia del 80% y precisión del 5,8%. En total se incluyeron a 265 individuos distribuidos de la siguiente manera: 63,8% (n = 169) provenían del AMVA, 27,5% (n = 73) del oriente y 8,7% (n = 23) de Urabá.
Encuesta
Los participantes respondieron una encuesta estructurada supervisada por personal del proyecto previamente entrenado. La información incluía datos sociodemográficos, condiciones de la vivienda, características socioeconómicas, hábitos de vida y antecedentes clínicos personales y familiares de enfermedades gastroduodenales.
Diagnóstico de H. pylori
Los pacientes tenían ayuno de 7 horas antes de la EDS y se tomaron nueve biopsias del estómago para realizar el diagnóstico bacteriano. Cinco muestras de cada paciente se destinaron para estudio histopatológico, se almacenaron en tubos con formol tamponado al 10% (Protokimica S. A. S.®) y se transportaron a la unidad de citología y anatomía patológica de la Clínica las Vegas para su procesamiento y lectura. Dos muestras de antro y dos de cuerpo se depositaron en un medio de transporte caldo Brucella con glicerol al 20% y se llevaron al laboratorio de la Facultad de Medicina de la Universidad de Antioquia para el posterior cultivo microbiológico, detección de la enzima ureasa y estudio por biología molecular. El diagnóstico de la infección por H. pylori se estableció como positivo cuando al menos dos de las pruebas eran positivas.
Cultivo microbiológico
Una muestra de antro y otra de cuerpo se sembraron en agar Brucella suplementado y se incubaron en condiciones microaerofílicas (5%-10% de oxígeno [O2], 10% de dióxido de carbono [CO2] y 80%-90% de humedad). Las colonias compatibles se identificaron hasta la especie por pruebas bioquímicas y moleculares. Los cultivos negativos se siguieron por 15 días, al cabo de este tiempo, si presentaban crecimiento, se realizaba la identificación y criopreservación en caldo Brucella con glicerol al 20% y en los que no se observó crecimiento se reportaron como negativos. Los aislados de H. pylori se criopreservaron en caldo Brucella con glicerol.
Prueba de ureasa
Una biopsia de antro se depositó en caldo con agar urea base (BD and Company, Sparks, MD, Estados Unidos) suplementado con urea (Carlo Erba Reagents S. A. S., Italia). La prueba era positiva cuando se observó un cambio de color instantáneo de amarillo a rosa. Las muestras inicialmente negativas se incubaron en atmósfera aerobia, 21% de O2 a 37 °C por 2 horas para confirmar los resultados. Posteriormente, la biopsia de antro se depositó en caldo Brucella con glicerol y se criopreservó para la realización de pruebas moleculares.
Diagnóstico histopatológico y molecular
La metodología histopatológica se realizó como se describió previamente19. Para el diagnóstico molecular, una muestra de antro y una de cuerpo se procesaron con el Dneasy blood & tissue kit (Qiagen, Hilden, Alemania) según las recomendaciones del fabricante. La concentración del ADN genómico se determinó con NanoDropOne-2000 (Thermo Fisher Scientific, Estados Unidos). Los genes ureA y vacA (alelos s1, s2, m1 y m2) se amplificaron por medio de una reacción en cadena de la polimerasa (PCR) estándar con cebadores previamente descritos20-22. La PCR se realizó en un termociclador Multigene® (Labnet International, Inc. NJ, Estados Unidos) y como controles positivos se emplearon las cepas de H. pylori ATCC 43504, NCTC 11637, NCTC 11638, la cepa clínica 3062 y como control negativo se empleó Escherichia coli ATCC 25922. Los amplificados se corrieron en geles de agarosa al 1,5% y se revelaron con Hydragreen (Piscataway, NJ). Los fragmentos se visualizaron con un transiluminador (Molecular Imager® Gel Doc™ XR System. BioRad Laboratories, Inc. Hercules, CA, Estados Unidos). Para determinar el tamaño de los amplificados se utilizó el marcador de peso molecular de 100 pb (New England Biolabs, Inc.).
Análisis estadístico
Una base de datos en Microsoft Office, Access 2016, se construyó y se sometió a control de calidad externo. Los datos se analizaron usando el software SPSS versión 25.0 (SPSS Armonk, NY, Estados Unidos: IBM Corporation). Los programas Epidat versión 4.2 y Stata Corp versión 15 se emplearon para obtener las medias ± desviación estándar (DE) para las variables continuas; las variables categóricas se presentan como frecuencias y porcentajes. Para identificar los factores de riesgo asociados a la frecuencia de H. pylori se realizó un análisis bivariado con la prueba de chi cuadrado (χ2). Para el análisis multivariado se realizó regresión binomial. Se estimaron razones de prevalencia crudas y ajustadas con intervalos de confianza del 95% (IC 95%). Al modelo multivariado ingresaron las variables con p < 0,25 (criterio de Hosmer-Lemeshow) y un valor p < 0,05 se aceptó como estadísticamente significativo.
Resultados
Descripción de la población de estudio
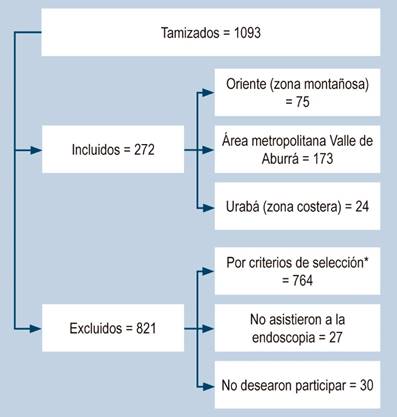
El total de pacientes tamizado fue de 1093; de estos, 764 no se aceptaron por los criterios de exclusión y 57 por otras causas (Figura 1). Se incluyeron en total a 272 participantes, de los cuales 271 se recolectaron por EDS y uno por gastrectomía.
Características sociodemográficas
El 65,1% (177) eran mujeres. El promedio de edad fue de 48,9 ± 15,6 años, y 45,3% (123) de los participantes estaban entre los 36 y 55 años. El 95,6% (260) de la población de estudio fueron mestizos y 3,4% (12) se autodenominaron afrocolombianos, indígenas y gitano/ROM. Los pacientes residentes de Urabá presentaron características socioeconómicas desfavorables al compararlas con las otras subregiones. En Urabá se encontró una mayor proporción de personas afiliadas al régimen subsidiado (66,7%), bajo nivel de escolaridad (primaria completa o inferior) (45,8%), mayor proporción de desempleo (8,3%), empleo informal (29,2%), ingresos mensuales mayores o iguales a un salario mínimo (52,2%) y bajo estrato socioeconómico (87,4%) (Tabla 1).
Tabla 1 Características sociodemográficas de la población discriminadas por subregión
| Variable | Subregión | |||||||
|---|---|---|---|---|---|---|---|---|
| Área metropolitana n = 173 | Oriente (montañoso) n = 75 | Urabá (costero) n = 24 | Total n = 272 | |||||
| n | % | n | % | n | % | n | % | |
| Sexo | ||||||||
| - Mujer | 115 | 66,5 | 46 | 61,3 | 16 | 66,7 | 177 | 65,1 |
| - Hombre | 58 | 33,5 | 29 | 38,7 | 8 | 33,3 | 95 | 34,9 |
| Edad | ||||||||
| - 18 a 25 | 14 | 8,1 | 5 | 6,7 | 1 | 4,2 | 20 | 7,4 |
| - 26 a 35 | 24 | 13,9 | 12 | 16,0 | 4 | 16,7 | 40 | 14,7 |
| - 36 a 45 | 35 | 20,2 | 17 | 22,7 | 5 | 20,8 | 57 | 21,0 |
| - 46 a 55 | 45 | 26,0 | 16 | 21,3 | 5 | 20,8 | 66 | 24,3 |
| - 56 a 65 | 32 | 18,5 | 13 | 17,3 | 5 | 20,8 | 50 | 18,4 |
| - 66 a 75 | 13 | 7,5 | 8 | 10,7 | 1 | 4,2 | 22 | 8,1 |
| - 76 a 86 | 10 | 5,8 | 4 | 5,3 | 3 | 12,5 | 17 | 6,3 |
| Seguridad social | ||||||||
| - Contributivo1 | 159 | 91,9 | 62 | 82,7 | 8 | 33,3 | 229 | 84,2 |
| - Subsidiado2 | 11 | 6,4 | 11 | 14,7 | 16 | 66,7 | 38 | 14,0 |
| - Especial3 | 2 | 1,2 | 1 | 1,3 | 0 | 0,0 | 3 | 1,1 |
| - Sin afiliación | 1 | 0,6 | 1 | 1,3 | 0 | 0,0 | 2 | 0,7 |
| Escolaridad | ||||||||
| - Primaria | 28 | 16,2 | 28 | 37,3 | 7 | 29,2 | 63 | 23,1 |
| - Secundaria | 54 | 31,2 | 18 | 24,0 | 7 | 29,2 | 79 | 29,0 |
| - Técnico-tecnológico | 25 | 14,4 | 13 | 17,3 | 2 | 8,3 | 40 | 14,7 |
| - Universitario | 64 | 37,0 | 15 | 20,0 | 4 | 16,6 | 83 | 30,6 |
| - Ninguno | 2 | 1,2 | 1 | 1,3 | 4 | 16,7 | 7 | 2,6 |
| Ocupación | ||||||||
| - Empleado | 65 | 37,6 | 32 | 42,7 | 2 | 8,3 | 99 | 36,4 |
| - Ama de casa | 44 | 25,4 | 19 | 25,3 | 8 | 33,3 | 71 | 26,1 |
| - Subempleado4 | 2 | 1,2 | 1 | 1,3 | 2 | 8,3 | 5 | 1,8 |
| - Informal5 | 4 | 2,3 | 5 | 6,7 | 7 | 29,2 | 16 | 5,9 |
| - Desempleado | 4 | 2,3 | 3 | 4,0 | 2 | 8,3 | 9 | 3,3 |
| - Independiente6 | 20 | 11,6 | 7 | 9,3 | 3 | 12,5 | 30 | 11,0 |
| - Pensionado | 21 | 12,1 | 8 | 10,7 | 0 | 0,0 | 29 | 10,7 |
| Ocupación | ||||||||
| - Estudiante | 8 | 4,6 | 0 | 0,0 | 0 | 0,0 | 8 | 2,9 |
| - Población privada de la libertad | 5 | 2,9 | 0 | 0,0 | 0 | 0,0 | 5 | 1,8 |
| Salario | ||||||||
| - Menos de 1 SMLV | 12 | 7,2 | 18 | 24,0 | 12 | 52,2 | 42 | 15,8 |
| - 1-2 SMLV | 32 | 19,2 | 22 | 29,3 | 6 | 26,1 | 60 | 22,6 |
| - > 2 SMLV | 123 | 73,7 | 35 | 46,7 | 5 | 21,7 | 163 | 61,5 |
| Estrato socioeconómico7 | ||||||||
| - 1-2 | 58 | 34,6 | 28 | 37,8 | 21 | 87,4 | 107 | 40,2 |
| - 3-4 | 84 | 50,0 | 43 | 58,1 | 3 | 12,5 | 130 | 48,9 |
| - 5-6 | 26 | 15,5 | 3 | 4,1 | 0 | 0,0 | 29 | 10,9 |
1Contributivo: vinculación al sistema de salud a través del pago de una cotización individual, familiar por el afiliado o en concurrencia entre este y su empleador. 2Subsidiado: mecanismo mediante el cual la población más pobre del país, sin capacidad de pago, tiene acceso a los servicios de salud a través de un subsidio que ofrece el Estado. 3Especial: personas que pertenecen a las fuerzas militares, policía, docentes y trabajadores del Estado. 4Subempleado: empleo en el cual se subutilizan las capacidades del trabajador, labora menos horas y recibe baja remuneración. 5Informal: persona que realiza alguna actividad económica sin contrato laboral, al margen del control tributario, con bajos ingresos y sin protección social. 6Independiente: persona que trabaja por cuenta propia sin estar vinculada por un contrato de trabajo y realiza por sí mismo los pagos al sistema de seguridad social. 7Estrato socioeconómico: Clases o grupos en que se divide la población de acuerdo con el poder adquisitivo y nivel socioeconómico, (1 salario mínimo equivale a 277.19 USD en el año 2021 en Colombia). SMLV: salario mínimo legal vigente. Tabla elaborada por los autores.
Características de la vivienda, condiciones y hábitos de vida
El 84,2% (229/272) de la población vivía en zona urbana. En el AMVA se encuentra el mayor porcentaje con 93,6% (162/173) y la subregión de oriente concentró la mayor cantidad de individuos de zona rural con 28/75 (37,3%). En relación con los servicios públicos, el 100% de los participantes tenía energía eléctrica en el hogar. En cuanto al acceso a acueducto domiciliario se observaron diferencias: de los participantes, 9,5% (26/272) empleó agua no tratada para el consumo (Tabla 2). De la población, 1,5% (4/272) vivía en condición de hacinamiento y en relación con los estilos de vida, 10,3% de los pacientes (28/272) tenían el hábito de tabaquismo. De estos últimos, 21,4% (6/28) eran fumadores pesados (> 15 cigarrillos/día) de acuerdo con la clasificación de la Organización Mundial del al Salud (OMS)23.
Tabla 2 Características de la vivienda y hábitos de vida de la población estudiada
| Variable | Subregión | |||||||
|---|---|---|---|---|---|---|---|---|
| Área metropolitana n = 173 | Oriente (montañoso) n = 75 | Urabá (costero) n = 24 | Total n = 272 | |||||
| n | % | n | % | n | % | n | % | |
| Tipo de vivienda | ||||||||
| - Casa | 88 | 50,9 | 59 | 78,7 | 19 | 79,2 | 166 | 61,0 |
| - Apartamento | 79 | 45,7 | 14 | 18,7 | 3 | 12,5 | 96 | 35,3 |
| - Cuarto | 0 | 0,0 | 1 | 1,3 | 1 | 4,2 | 2 | 0,7 |
| - Otro1 | 6 | 3,5 | 1 | 1,3 | 1 | 4,2 | 8 | 2,9 |
| Agua de consumo | ||||||||
| - Acueducto regulado | 171 | 98,8 | 44 | 58,7 | 6 | 25,0 | 221 | 81,3 |
| - Acueducto no regulado | ||||||||
| - Acueducto rural | 2 | 1,2 | 12 | 16,0 | 0 | 0,0 | 14 | 5,1 |
| - Agua lluvia | 0 | 0,0 | 0 | 0,0 | 6 | 25,0 | 6 | 2,2 |
| - Carrotanque | 0 | 0,0 | 0 | 0,0 | 1 | 4,2 | 1 | 0,4 |
| - Río o quebrada | 0 | 0,0 | 5 | 6,7 | 0 | 0,0 | 5 | 1,8 |
| - Otro2 | 0 | 0,0 | 14 | 18,7 | 11 | 45,8 | 25 | 9,2 |
| Come por fuera de la casa (veces por semana) | ||||||||
| - 1-2 veces | 53 | 54,6 | 26 | 72,2 | 6 | 50,0 | 85 | 58,6 |
| - 3-4 veces | 16 | 16,5 | 3 | 8,3 | 5 | 41,7 | 24 | 16,6 |
| - > 5 veces | 28 | 28,9 | 7 | 19,4 | 1 | 8,3 | 36 | 24,8 |
| Hierve el agua | ||||||||
| - Sí | 3 | 1,7 | 33 | 44,0 | 5 | 20,8 | 41 | 15,1 |
| - No | 4 | 2,3 | 26 | 34,7 | 10 | 41,7 | 40 | 14,7 |
| - No aplica3 | 166 | 96,0 | 16 | 21,3 | 9 | 37,5 | 191 | 70,2 |
| Otros aspectos | ||||||||
| - Tiene gas | 159 | 91,9 | 67 | 89,3 | 19 | 79,2 | 245 | 90,1 |
| - Tiene alcantarillado | 173 | 100 | 66 | 88,0 | 17 | 70,8 | 256 | 94,1 |
| - Tiene acueducto | 172 | 99,4 | 64 | 85,3 | 14 | 58,3 | 250 | 91,9 |
| - Hacinamiento | 0 | 0,0 | 1 | 1,3 | 3 | 12,5 | 4 | 1,50 |
| - Fumador actual/previo | 47 | 29,0 | 20 | 28,4 | 8 | 36,7 | 75 | 29,6 |
| - Toma alcohol | 73 | 42,2 | 32 | 42,7 | 6 | 25,0 | 111 | 40,8 |
| - Café diario | 105 | 60,7 | 48 | 64,0 | 12 | 50,0 | 165 | 60,7 |
| - Añade sal | 36 | 20,8 | 18 | 24,0 | 4 | 16,7 | 58 | 21,3 |
1Otro: hogar de paso, inquilinato, orfanato, hogar geriátrico, centro de reclusión. 2Otro: pozo, agua embotellada, agua filtrada. 3No aplica: para los que tienen acueducto y no hierven el agua. Tabla elaborada por los autores.
Antecedentes personales y familiares
Los síntomas referidos con mayor frecuencia fueron dolor epigástrico (61,8%) y distensión abdominal (61%), y los menos frecuentes fueron vómito (17,3%) y hematemesis (5,9%). El 50% de los pacientes presentaron antecedentes de enfermedades del tracto gastroduodenal; 80% refirieron episodios previos de gastritis, 19% úlcera péptica, 12% hernia hiatal, 10% esofagitis, 6% reflujo gastroesofágico y 1,5% CG. En el 3% de los casos se presentaron otros diagnósticos (duodenitis, esófago de Barret, esófago invertido o hipertrofia pilórica). El porcentaje de pacientes con antecedentes de anemia por deficiencia de hierro fue de 18,3% (50/272). En relación con los antecedentes clínicos familiares se encontró que los más comunes eran gastritis (65,3%), infección por H. pylori (30%) y CG (26%). De estos últimos, el 37,7% correspondían a familiares en primer grado de consanguinidad (Tabla 3).
Tabla 3 Antecedentes personales y familiares de enfermedades gastroduodenales y diagnóstico de H. pylori en la población de estudio
| Variable | Región | |||||||
|---|---|---|---|---|---|---|---|---|
| Área metropolitana n = 173 | Oriente (montañoso) n = 75 | Urabá (costero) n = 24 | Total n = 272 | |||||
| n | % | n | % | n | % | n | % | |
| Signos y síntomas | ||||||||
| - Epigastralgia | 107 | 61,8 | 40 | 53,3 | 21 | 87,5 | 168 | 61,8 |
| - Náuseas | 76 | 43,9 | 25 | 33,3 | 15 | 62,5 | 116 | 42,6 |
| - Vómito | 29 | 16,8 | 10 | 13,3 | 8 | 33,3 | 47 | 17,3 |
| - Disfagia | 46 | 26,6 | 11 | 14,7 | 10 | 41,7 | 67 | 24,6 |
| - Sensación de masa | 64 | 37,0 | 19 | 25,3 | 13 | 54,2 | 96 | 35,3 |
| - Dispepsia | 90 | 52,0 | 32 | 42,7 | 15 | 62,5 | 137 | 50,4 |
| - Eructos | 81 | 46,8 | 41 | 54,7 | 14 | 58,3 | 136 | 50,0 |
| - Reflujo | 94 | 54,3 | 42 | 56,0 | 16 | 66,7 | 152 | 55,9 |
| - Inapetencia | 41 | 23,7 | 20 | 26,7 | 7 | 29,2 | 68 | 25,0 |
| - Pérdida de peso | 39 | 22,5 | 15 | 20,0 | 12 | 50,0 | 66 | 24,3 |
| - Hematemesis | 9 | 5,2 | 6 | 8,0 | 1 | 4,20 | 16 | 5,9 |
| - Melenas | 35 | 20,2 | 11 | 14,7 | 8 | 33,3 | 54 | 19,9 |
| - Distensión abdominal | 109 | 63,0 | 39 | 52,0 | 18 | 75,0 | 166 | 61,0 |
| Antecedentes personales | ||||||||
| - Diagnóstico de enfermedad gastroduodenal previa | 88 | 50,9 | 43 | 57,3 | 5 | 20,8 | 136 | 50,0 |
| - Endoscopia previa | 98 | 56,6 | 45 | 60,0 | 9 | 37,5 | 152 | 55,9 |
| - Infección previa por. H. pylori | 61 | 35,3 | 23 | 30,7 | 3 | 12,5 | 87 | 32,0 |
| - Recibió tratamiento | 55 | 88,7 | 20 | 83,3 | 2 | 66,7 | 77 | 86,5 |
| - Siguió indicaciones del tratamiento | 51 | 91,1 | 19 | 95,0 | 1 | 50,0 | 71 | 91,0 |
| - Diagnóstico de anemia | 27 | 15,6 | 14 | 18,7 | 9 | 37,5 | 50 | 18,4 |
| Antecedentes familiares | ||||||||
| - Gastritis | 109 | 63,0 | 55 | 73,3 | 13 | 56,5 | 177 | 65,3 |
| - Úlcera gástrica | 33 | 19,1 | 20 | 26,7 | 5 | 21,7 | 58 | 21,4 |
| - Metaplasia intestinal | 11 | 6,4 | 3 | 4,0 | 1 | 4,30 | 15 | 5,5 |
| - Cáncer de estómago | 45 | 26,0 | 23 | 31,5 | 2 | 8,70 | 70 | 26,0 |
| - Historia de H. pylori | 53 | 30,8 | 26 | 34,7 | 2 | 9,10 | 81 | 30,1 |
| Diagnóstico de infección | ||||||||
| - H. pylori positivo | 94 | 54,3 | 48 | 64,0 | 19 | 79,2 | 161 | 59,2 |
| - H. pylori negativo | 79 | 45,7 | 27 | 36,0 | 5 | 20,8 | 120 | 40,8 |
Tabla elaborada por los autores.
Diagnóstico de H. pylori y factores asociados con infección
El 54,3%, 64% y 79,2% de los pacientes estudiados en las subregiones de AMVA, oriente y Urabá, respectivamente, presentaron diagnóstico positivo para H. pylori por al menos dos de las pruebas utilizadas (Tabla 3). Al llevar a cabo el análisis bivariado, se observó que la frecuencia de H. pylori fue mayor en hombres, en personas entre 18 y 55 años, en pacientes del régimen subsidiado, con baja escolaridad, subempleados o con labores informales, con ingresos menores de 2 SMLV, de estrato socioeconómico bajo/medio, sin acueducto domiciliario, con signos de hematemesis y en pacientes sin adherencia al tratamiento (Tabla 4). Los resultados del análisis multivariado mostraron que los factores de riesgo asociados con la infección por H. pylori fueron el sexo masculino (p = 0,01), edad entre 18 y 35 años (p < 0,00) y 36-55 años (p = 0,01), no tener acueducto domiciliario (p < 0,00) y tener escolaridad menor de un título universitario (p < 0,00) (Tabla 5).
Tabla 4 Factores asociados con la presencia de H. pylori por análisis bivariado
| Variable | n/N | (%) | RP cruda | IC 95% | p |
|---|---|---|---|---|---|
| Sexo | |||||
| - Mujer | 97/177 | 54,8 | 1 | - | 0,044 |
| - Hombre | 64/95 | 67,4 | 1,229 | 1,013-1,492 | |
| Edad | |||||
| - 18-35 | 41/60 | 68,3 | 1,448 | 1,095-1,914 | 0,009 |
| - 36-55 | 78/123 | 63,4 | 1,343 | 1,038-1,738 | 0,025 |
| - 56-86 | 42/89 | 47 | 1 | - | |
| Seguridad social | |||||
| - Contributivo1 | 131/232 | 56,5 | 1 | 1,075-1,641 | 0,028 |
| - Subsidiado2 | 30/40 | 75 | 1,328 | ||
| Escolaridad | |||||
| - Primaria | 45/70 | 64,3 | 1,482 | 1,096-2,003 | 0,011 |
| - Secundaria | 52/79 | 65,8 | 1,517 | 1,132-2,033 | 0,005 |
| - Técnico-tecnológico | 28/40 | 70,0 | 1,613 | 1,173-2,219 | 0,003 |
| - Universitario incompleto o completo | 36/83 | 43,4 | 1 | - | |
| Ocupación | |||||
| - Empleado | 61/99 | 61,6 | 1,069 | 0,817-1,398 | 0,625 |
| - Ama de casa | 34/71 | 47,9 | 0,83 | 0,599-1,152 | 0,267 |
| - Subempleado3/informal4 | 17/21 | 81,0 | 1,404 | 1,039-1,899 | 0,027 |
| - Pensionado/independiente5 | 34/59 | 57,6 | 1 | - | |
| - Desempleado/estudiante/población privada de la libertad | 15/22 | 68,1 | 1,183 | 0,825-1,695 | 0,92 |
| Salario | |||||
| - Menos de 1 SMLV | 29/42 | 69,0 | 1,308 | 1,020-1,679 | 0,034 |
| - De 1-2 SMLV | 41/60 | 68,3 | 1,295 | 1,033-1,622 | 0,024 |
| - Más de 2 SMLV | 86/163 | 52,8 | 1 | - | |
| Estrato socioeconómico6 | |||||
| - Bajo (1-2) | 76/107 | 71,0 | 1,872 | 1,157-3,029 | 0,011 |
| - Medio (3-4) | 70/130 | 53,8 | 1,419 | 0,867-2,321 | 0,163 |
| - Alto (5-6) | 11/29 | 37,9 | 1 | - | |
| Ubicación de la casa | |||||
| - Rural/otro7 | 33/43 | 76,7 | 1,373 | 1,123-1,678 | 0,011 |
| - Urbano | 128/229 | 55,9 | 1 | - | |
| Acueducto | |||||
| - Sí | 141/250 | 56,4 | 1 | - | 0,002 |
| - No | 20/22 | 90,9 | 1,612 | 1,358-1,913 | |
| Heces negras | |||||
| - Sí | 40/54 | 74,1 | 1,335 | 1,095-1,626 | 0,013 |
| - No | 121/218 | 55,5 | 1 | - | |
| Diagnóstico de enfermedad gástrica | |||||
| - Sí | 59/136 | 43,38 | 0,578 | 0,466-0,717 | < 0,001 |
| - No | 102/136 | 75 | 1 | - | |
| Endoscopia previa | |||||
| - Sí | 65/152 | 42,76 | 0,535 | 0,436-0,656 | < 0,001 |
| - No | 96/120 | 80 | 1 | - | |
| Diagnóstico previo de infección por H. pylori | |||||
| - Sí | 26/87 | 29,9 | 0,41 | 0,293-0,572 | < 0,001 |
| - No | 135/185 | 73,0 | 1 | - | |
| Siguió las indicaciones de tratamiento para H. pylori | |||||
| - Sí | 18/71 | 25,4 | 1 | - | 0,021 |
| - No | 5/7 | 71,4 | 2,817 | 1,522-5,214 | |
El # 1 indica la categoría de referencia. SMLV: salario mínimo legal vigente. 1Contributivo: vinculación al sistema de salud a través del pago de una cotización individual, familiar por el afiliado o en concurrencia entre este y su empleador. 2Subsidiado: mecanismo mediante el cual la población más pobre del país, sin capacidad de pago, tiene acceso a los servicios de salud a través de un subsidio que ofrece el Estado. 3Subempleado: empleo en el cual se subutilizan las capacidades del trabajador, labora menos horas y recibe baja remuneración. 4Informal: persona que realiza alguna actividad económica sin contrato laboral, al margen del control tributario, con bajos ingresos y sin protección social. 5Independiente: persona que trabaja por cuenta propia sin estar vinculada por un contrato de trabajo y realiza por sí mismo los pagos al sistema de seguridad social. 6Estrato socioeconómico: clases o grupos en que se divide la población de acuerdo con el poder adquisitivo y nivel socioeconómico (1 salario mínimo equivale a 277,19 USD en el año 2021 en Colombia). 7Otro: Centros de reclusión. SMLV: salario mínimo legal vigente. Tabla elaborada por los autores.
Tabla 5 Variables asociadas con la prevalencia de H. pylori. Análisis bivariado (RPC) y multivariado (RP ajustada)
| Variable | RPC | IC 95% | p | RPA | IC 95% | p |
| Sexo masculino | 1,22 | 1,01-1,49 | 0,04 | 1,26 | 1,04-1,52 | 0,01 |
| Edad (18-35 años) | 1,44 | 1,09-1,91 | 0,00 | 1,62 | 1,22-2,16 | 0,00 |
| Edad (36-55 años) | 1,34 | 1,03-1,73 | 0,02 | 1,39 | 1,07-1,79 | 0,01 |
| Sin acueducto domiciliario | 1,61 | 1,35-1,91 | 0,00 | 1,40 | 1,15-1,72 | 0,00 |
| Primaria | 1,48 | 1,09-2,00 | 0,01 | 1,60 | 1,17-2,19 | 0,00 |
| Secundaria | 1,51 | 1,13-2,03 | 0,00 | 1,65 | 1,24-2,18 | 0,00 |
| Técnico-tecnológico | 1,61 | 1,17-2,21 | 0,00 | 1,73 | 1,26-2,38 | 0,00 |
RPA: razón de prevalencia ajustada; RPC: razón de prevalencia cruda. Tabla elaborada por los autores.
Discusión
En este estudio se encontró que la frecuencia de H. pylori en pacientes que acudieron a los siete servicios de endoscopia de las tres subregiones de Antioquia fue 59,2% con diferencias observadas así: 54,3% en AMVA, 64% en oriente y 79,2% en Urabá. También se observó relación entre la infección por H. pylori y algunos factores como el sexo masculino, las edades comprendidas entre los 18 y los 55 años, la falta de un sistema de suministro de agua potable y una educación inferior a nivel universitario.
Al contrastar nuestros hallazgos con otros estudios del AMVA o de Antioquia se encontró mayor frecuencia de la infección por H. pylori (59,2%) comparado con lo descrito por otros autores como Correa y colaboradores en 2016 (36,4%)24, Roldan y colaboradores en 2019 (44,2%)25 y Sánchez y colaboradores en 2022 (36,4%)26. La mayor frecuencia encontrada en este estudio podría explicarse por la inclusión de la muestra de pacientes que acudieron a los servicios de endoscopia de dos subregiones de Antioquia diferentes al AMVA con condiciones socioeconómicas menos favorables27,28. Otra explicación de la alta frecuencia hallada es atribuible a que la población captada incluyó pacientes consultantes y requirentes de procedimientos endoscópicos que acudieron a las siete instituciones de las tres subregiones; además, la mayoría correspondían a pacientes con síntomas gastroduodenales. Es de aclarar que los hallazgos encontrados en este estudio presentan limitaciones porque no es posible calcular información epidemiológica de las regiones y tampoco es posible obtener conclusiones que puedan extrapolarse a la población general.
Es de resaltar que en la subregión de Urabá el 74,6% de la población presenta necesidades básicas insatisfechas y 6,18% de los individuos viven en la miseria, cifras que superan las del departamento: 26,4% y 1,52%, respectivamente29. Además, el 14,3% de la población carece de servicios públicos básicos y solo el 48,5% posee agua potable28,29. En 2018, el 89,8% de las personas en Antioquia tenían acueducto domiciliario, pero en Urabá, solo el 68,9%30. La alta prevalencia de la infección por H. pylori en países en vías de desarrollo se asocia con problemas sanitarios y mala calidad del agua, por lo que se sugiere como una posible fuente importante de transmisión del microorganismo31. La bacteria sobrevive en agua clorada y tolera cambios de pH, pero es difícil de aislar de fuentes naturales de aguas, posiblemente por la baja carga bacteriana o por las dificultades en el aislamiento y cultivo32.
Por otro lado, la baja frecuencia de H. pylori en los pacientes que acudieron a los servicios de endoscopia de la subregión de AMVA se debe posiblemente a las mejores condiciones sanitarias como acceso a agua potable de calidad, disposición correcta de excretas y basuras, acceso a la educación, condiciones aceptables de infraestructura, entre otras33. Sin embargo; como se mencionó arriba, los hallazgos encontrados en este estudio presentan limitaciones porque no es posible calcular información epidemiológica de las regiones y tampoco es posible obtener conclusiones que puedan extrapolarse a la población general. Algunos estudios muestran que el nivel socioeconómico y educativo bajo, así como los estilos de vida son factores de riesgo para la infección por H. pylori34-38. Lo anterior muestra que la alta frecuencia de la bacteria refleja la necesidad de mejorar las condiciones de vida de la población reduciendo la exposición a factores de riesgo y la presentación de enfermedades asociadas a H. pylori.
Una limitante de este trabajo es la incapacidad para determinar el momento de la primoinfección, especialmente porque no se captó población pediátrica, en la que se presenta esta entidad. Varios estudios demuestran que la primoinfección se adquiere durante la primera infancia y la principal forma de transmisión ocurre de persona a persona en el entorno intrafamiliar39-46. Por tanto, son necesarias nuevas investigaciones en la población pediátrica en Antioquia para comparar los hallazgos obtenidos con otros estudios en infantes, porque no se descarta que la infección la hayan adquirido en su niñez o adolescencia, situación común en países en desarrollo como Colombia47-49.
Lo anterior refleja la importancia de aplicar medidas preventivas en la primera infancia, tales como la tamización y tratamiento en los casos que lo requieran para evitar la progresión en la edad adulta a enfermedades como el CG y la úlcera péptica. Así mismo, es fundamental la educación a madres y cuidadores en la primera infancia para evitar la infección y la diseminación de la bacteria a otros individuos46.
Por otro lado, los pacientes analizados pudieron estar expuestos a otros factores de riesgo desde su infancia diferentes a los evaluados en nuestra investigación. Teniendo en cuenta que el diseño de este estudio es transversal, no se realizó el seguimiento de los factores de riesgo ni su influencia a largo plazo en el desarrollo de lesiones preneoplásicas o enfermedades graves, como CG.
Esta es la primera investigación de H. pylori que incluye poblaciones diferentes al AMVA y evalúa la frecuencia de la infección por H. pylori en pacientes que requirieron endoscopia digestiva en siete unidades de tres subregiones de Antioquia. Una ventaja de este estudio es que los pacientes pertenecían a diversos estratos socioeconómicos y contaban con un tipo de afiliación a salud diferente; además, se captaron en siete servicios de endoscopia de tres subregiones de Antioquia con más de 200 000 habitantes, lo que refleja la heterogeneidad en las características geográficas, culturales, ambientales y socioeconómicas del departamento.
Finalmente, el estudio se hizo en Antioquia, departamento ubicado en el noroccidente del país que tiene región costera (Urabá), donde la mortalidad por CG es menos común, mientras que las regiones de media y alta montaña (AMVA y oriente) presentan más muertes por CG9. Estas cifras contrastan con las diferencias en las frecuencias encontradas en este estudio en relación con la infección por H. pylori; aunque ya se había descrito como “el enigma de los Andes” en el sur del país, no se había evaluado en poblaciones con mayor cantidad de habitantes ni en la zona costera de Antioquia4,50,51.
Conclusión
En conclusión, la frecuencia de H. pylori encontrada en pacientes que requirieron y fueron llevados a endoscopia digestiva (sintomáticos o por tamización) en siete unidades de endoscopia de tres subregiones de Antioquia fue mayor del 50% con diferencias importantes entre estas. Las variables relacionadas con mayor frecuencia de infección fueron sexo masculino, edad entre 18 y 55 años, nivel educativo inferior al universitario y en individuos sin acueducto domiciliario. Lo anterior sugiere la necesidad de implementar programas para mejorar las condiciones de vida de la población como el acceso a sistemas de abastecimiento de agua potable y continuar con la detección de H. pylori y los factores de riesgo asociados, lo cual podría impactar en la reducción de enfermedades gastroduodenales asociadas a la bacteria. Así mismo, es necesario dirigir medidas de prevención primaria de la infección especialmente en los grupos familiares para impactar la dinámica de transmisión de la bacteria. Por último, se debe tener en cuenta que los hallazgos encontrados en este estudio presentan limitaciones porque no es posible calcular información epidemiológica de las regiones y tampoco es posible obtener conclusiones que puedan extrapolarse a la población general.
Agradecimientos
Al Grupo Bacterias & Cáncer de la Facultad de Medicina de la Universidad de Antioquia y a las instituciones participantes en el estudio: Clínica Panamericana, Clínica CES, Hospital Alma Máter de Medellín, IPS Gastroriente, IPS Promedan, Instituto de Cancerología-Las Américas AUNA, Clínica Somer de Rionegro y a la Unidad de Citología y Patología de la Clínica las Vegas de Medellín.
REFERENCIAS
1. Kotilea K, Bontems P, Touati E. Epidemiology, Diagnosis and Risk Factors of Helicobacter pylori Infection. Adv Exp Med Biol. 2019;1149:17-33. https://doi.org/10.1007/5584_2019_357 [ Links ]
2. Crowe SE. Helicobacter pylori Infection. N Engl J Med. 2019;380(12):1158-65. https://doi.org/10.1056/NEJMcp1710945 [ Links ]
3. Hooi JKY, Lai WY, Ng WK, Suen MMY, Underwood FE, Tanyingoh D, et al. Global Prevalence of Helicobacter pylori Infection: Systematic Review and Meta-Analysis. Gastroenterology. 2017;153(2):420-9. https://doi.org/10.1053/j.gastro.2017.04.022 [ Links ]
4. Kodaman N, Pazos A, Schneider BG, Piazuelo MB, Mera R, Sobota RS, et al. Human and Helicobacter pylori coevolution shapes the risk of gastric disease. Proc Natl Acad Sci U S A. 2014;111(4):1455-60. https://doi.org/10.1073/pnas.1318093111 [ Links ]
5. IARC Publications. Schistosomes, liver flukes and Helicobacter pylori. IARC Monogr Eval Carcinog Risks Hum. 1994;61:1-241. [ Links ]
6. Abnet C, Asaka M, Choi IJ, Correa P, Ferreccio C, Gisbert J, et al. Helicobacter pylori eradication as a strategy for preventing gastric cancer [Internet]. IARC Working Group Reports; 2014;8 [consultado el 1 de octubre del 2022]. Disponible en: Disponible en: https://rb.gy/9v6qk [ Links ]
7. International Agency for Research on Cancer. WHO; 2021 [consultado el 12 de septiembre del 2022]. Disponible en: Disponible en: https://gco.iarc.fr/today/data/factsheets/populations/170-colombia-fact-sheets.pdf [ Links ]
8. Pardo C, De Vries E, Buitrago L, Gamboa Ó. Atlas de mortalidad por cáncer en Colombia [Internet]. 4.a edición. Instituto Nacional de Cancerología; 2017 [consultado el 26 de junio del 2022]. Disponible en: Disponible en: https://rb.gy/x91r5 [ Links ]
9. Departamento Administrativo Nacional de Estadística. Mortalidad por cáncer de estómago según subregión y municipio. DANE; 2021. Disponible en: https://dssa.gov.co/index.php/estadisticas-mortalidad/item/80-mortalidad-por-cancer-por-subregion-municipio-2005-2020 [ Links ]
10. Chaturvedi R, De Sablet T, Asim M, Piazuelo MB, Barry DP, Verriere TG, et al. Increased Helicobacter pylori-associated gastric cancer risk in the Andean region of Colombia is mediated by spermine oxidase. Oncogene. 2015;34(26):3429-40. https://doi.org/10.1038/onc.2014.273 [ Links ]
11. Mera R, Bravo L, Camargo MC, Bravo J, Delgado A, Romero-Gallo J, et al. Dynamics of Helicobacter pylori infection as a determinant of progression of gastric precancerous lesions: 16-year follow- up of an eradication trial. Physiol Behav. 2017;176(5):139-48. https://doi.org/10.1136/gutjnl-2016-311685 [ Links ]
12. Zamani M, Ebrahimtabar F, Zamani V, Miller WH, Alizadeh-Navaei R, Shokri-Shirvani J, et al. Systematic review with meta-analysis: the worldwide prevalence of Helicobacter pylori infection. Aliment Pharmacol Ther. 2018;47(7):868-76. https://doi.org/10.1111/apt.14561 [ Links ]
13. Ford AC, Yuan Y, Forman D, Hunt R, Moayyedi P. Helicobacter pylori eradication for the prevention of gastric neoplasia. Cochrane Database Syst Rev. 2020;84(6):525. https://doi.org/10.1002/14651858.CD005583.pub3 [ Links ]
14. Piazuelo MB, Bravo LE, Mera RM, Camargo MC, Bravo JC, Delgado AG, et al. The Colombian Chemoprevention Trial: 20-Year Follow-Up of a Cohort of Patients With Gastric Precancerous Lesions. Gastroenterology. 2021;160(4):1106-1117.e3. https://doi.org/10.1053/j.gastro.2020.11.017 [ Links ]
15. Liou J-M, Malfertheiner P, Lee Y-C, Sheu B-S, Sugano K, Cheng H-C, et al. Screening and eradication of Helicobacter pylori for gastric cancer prevention: the Taipei global consensus. Gut. 2020;69(12):2093-112. https://doi.org/10.1136/gutjnl-2020-322368 [ Links ]
16. Chiang TH, Chang WJ, Chen SLS, Yen AMF, Fann JCY, Chiu SYH, et al. Mass eradication of Helicobacter pylori to reduce gastric cancer incidence and mortality: A long-term cohort study on Matsu Islands. Gut. 2021;70(2):243-50. https://doi.org/10.1136/gutjnl-2020-322200 [ Links ]
17. Pardo C, de Vries E. Supervivencia global de pacientes con cáncer en el Instituto Nacional de Cancerología (INC). Rev Colomb Cancerol. 2017;21(1):12-8. https://doi.org/10.1016/j.rccan.2017.01.003 [ Links ]
18. Arias-Ortiz NE, de Vries E. Health inequities and cancer survival in Manizales, Colombia: a population-based study. Colomb Medica. 2018;49(1):63-72. https://doi.org/10.25100/cm.v49i1.3629 [ Links ]
19. Salazar BE, Pérez-Cala T, Gomez-Villegas SI, Cardona-Zapata L, Pazos-Bastidas S, Cardona-Estepa A, et al. The OLGA-OLGIM staging and the interobserver agreement for gastritis and preneoplastic lesion screening: a cross-sectional study. Virchows Arch. 2022;(0123456789). https://doi.org/10.1007/s00428-022-03286-8 [ Links ]
20. Atherton JC, Cao P, Peek RM, Tummuru MKR, Blaser MJ, Cover TL. Mosaicism in vacuolating cytotoxin alleles of helicobacter pylori. Association of specific vacA types with cytotoxin production and peptic ulceration. J Biol Chem. 1995;270(30):17771-7. https://doi.org/10.1074/jbc.270.30.17771 [ Links ]
21. Van Doorn LJ, Figueiredo C, Sanna R, Pena S, Midolo P, Ng EKW, et al. Expanding allelic diversity of Helicobacter pylori vacA. J Clin Microbiol. 1998;36(9):2597-603. https://doi.org/10.1128/JCM.36.9.2597-2603.1998 [ Links ]
22. Peek RM, Miller GG, Tham KT, Perez-Perez GI, Cover TL, Atherton JC, et al. Detection of Helicobacter pylori gene expression in human gastric mucosa. J Clin Microbiol. 1995;33(1):28-32. https://doi.org/10.1128/jcm.33.1.28-32.1995 [ Links ]
23. Organización Mundial de la Salud (OMS). Tabaquismo [Internet]. Who.int. [consultado el 13 de octubre del 2022]. Disponible en: Disponible en: https://www.who.int/es/health-topics/tobacco [ Links ]
24. Correa GS, Cardona AAF, Correa GT, Correa LLA, García GHI, Estrada MS. Prevalencia de Helicobacter pylori y características histopatológicas en biopsias gástricas de pacientes con síntomas dispépticos en un centro de referencia de Medellín. Rev Colomb Gastroenterol. 2016;31(1):9-15. https://doi.org/10.22516/25007440.67 [ Links ]
25. Roldán IJ, Castaño R, Navas MC. Mutaciones del gen ARN ribosómico 23S de Helicobacter pylori asociadas con resistencia a claritromicina en pacientes atendidos en una unidad de endoscopia de Medellín, Colombia. Biomedica. 2019;39(2):117-29. https://doi.org/10.7705/biomedica.v39i4.4377 [ Links ]
26. Sánchez Londoño S, Guevara Casallas G, Niño S, Arteta Cueto A, Marcelo Escobar R, Camilo Ricaurte J, et al. Patrones de detección de Helicobacter pylori y lesiones relacionadas mediante protocolo Sydney en una población de Antioquia, Colombia. Rev Gastroenterol del Perú. 2022;42(2):86-91. https://doi.org/10.47892/rgp.2022.422.1377 [ Links ]
27. Cámara de Comercio de Medellín. Perfiles socioeconómicos de las subregiones de Antioquia 2021. Cámara de Comercio de Medellín. Medellín; 2021. [consultado el 10 de octubre del 2022]. Disponible en: Disponible en: https://rb.gy/frwwg [ Links ]
28. Gobernación de Antioquia. Anuario estadístico de Antioquia. Perfiles socioeconómicos de las subregiones de Antioquia 2021. Cámara de Comercio de Medellín. Medellín; 2019 [consultado el 25 de febrero de 2022]. Disponible en: Disponible en: https://www.antioquiadatos.gov.co/index.php/geoportal/indicadores/ [ Links ]
29. Gobernación de Antioquia. Necesidades básicas insatisfechas [Internet]. Observatorio Metropolitano; 2017 [consultado el 25 de febrero de 2022]. Disponible en: Disponible en: https://antioquia.gov.co/necesidades-basicas-insatisfechas-nbi-vf [ Links ]
30. Gobernación de Antioquia. Anuario Estadístico de Antioquia 2018 - Portal [Internet]. AntioquiaDatos.gov.co; 2018 [ consultado el 30 de enero de 2022]. Disponible en: Disponible en: https://www.antioquiadatos.gov.co/index.php/biblioteca-estadistica/anuario-estadistico-de-antioquia/anuario-estadistico-de-antioquia-2018/ [ Links ]
31. Kayali S, Manfredi M, Gaiani F, Bianchi L, Bizzarri B, Leandro G, et al. Helicobacter pylori, transmission routes and recurrence of infection: state of the art. Acta Biomed. 2018;89(8-S):72-6. https://doi.org/10.23750/abm.v89i8-S.7947 [ Links ]
32. Vesga F-J, Moreno Y, Ferrús MA, Campos C, Trespalacios AA. Detection of Helicobacter pylori in drinking water treatment plants in Bogotá, Colombia, using cultural and molecular techniques. Int J Hyg Environ Health. 2018;221(4):595-601. https://doi.org/10.1016/j.ijheh.2018.04.010 [ Links ]
33. Oliveros R, Pinilla Morales RE, Facundo Navia H, Sánchez Pedraza R. Cáncer gástrico: una enfermedad prevenible. Estrategias para intervención en la historia natural. Rev Colomb Gastroenterol. 2019;34(2):177-89. https://doi.org/10.22516/25007440.394 [ Links ]
34. Wang W, Jiang W, Zhu S, Sun X, Li P, Liu K, et al. Assessment of prevalence and risk factors of helicobacter pylori infection in an oilfield Community in Hebei, China. BMC Gastroenterol. 2019;19(1):186. https://doi.org/10.1186/s12876-019-1108-8 [ Links ]
35. Razuka-Ebela D, Polaka I, Parshutin S, Santare D, Ebela I, Murillo R, et al. Sociodemographic, Lifestyle and Medical Factors Associated with Helicobacter Pylori Infection. J Gastrointest Liver Dis. 2020;29(3):319-27. https://doi.org/10.15403/jgld-870 [ Links ]
36. Nagy P, Johansson S, Molloy-Bland M. Systematic review of time trends in the prevalence of Helicobacter pylori infection in China and the USA. Gut Pathog. 2016;8(1). https://doi.org/10.1186/s13099-016-0091-7 [ Links ]
37. Ferrari F, Cantú E, Dutra G, Zanardi HC, Scolaro BL, Ferrari OM. ORIGINAL Time trends of Helicobacter pylori prevalence in Itajaí - SC : a retrospective study of 25 years based on endoscopic database. Arq Gastroenterol. 2019;56(1):10-14. https://doi.org/10.1590/s0004-2803.201900000-13 [ Links ]
38. Yu X, Yang X, Yang T, Dong Q, Wang L, Feng L. Decreasing prevalence of Helicobacter pylori according to birth cohorts in urban China. Turkish J Gastroenterol. 2017;28(2):94-7. https://doi.org/10.5152/tjg.2017.16557 [ Links ]
39. Konno M, Yokota S, Suga T, Takahashi M, Sato K, Fujii N. Predominance of mother-to-child transmission of Helicobacter pylori infection detected by random amplified polymorphic DNA fingerprinting analysis in Japanese families. Pediatr Infect Dis J. 2008;27(11):999-1003. https://doi.org/10.1097/INF.0b013e31817d756e [ Links ]
40. Yücel O, Sayan A, Yildiz M. The factors associated with asymptomatic carriage of Helicobacter pylori in children and their mothers living in three socio-economic settings. Jpn J Infect Dis. 2009;62(2):120-4. https://doi.org/10.7883/yoken.JJID.2009.120 [ Links ]
41. Kivi M, Johansson ALV, Reilly M, Tindberg Y. Helicobacter pylori status in family members as risk factors for infection in children. Epidemiol Infect. 2005;133(4):645-52. https://doi.org/10.1017/S0950268805003900 [ Links ]
42. Yilmaz E, Doğan Y, Gürgöze MK, Unal S. Seroprevalence of Helicobacter pylori infection among children and their parents in eastern Turkey. J Paediatr Child Health. 2002;38(2):183-6. https://doi.org/10.1046/j.1440-1754.2002.00735.x [ Links ]
43. Weyermann M, Rothenbacher D, Brenner H. Acquisition of helicobacter pylori infection in early childhood: Independent contributions of infected mothers, fathers, and siblings. Am J Gastroenterol. 2009;104(1):182-9. https://doi.org/10.1038/ajg.2008.61 [ Links ]
44. Urita Y, Watanabe T, Kawagoe N, Takemoto I, Tanaka H, Kijima S, et al. Role of infected grandmothers in transmission of Helicobacter pylori to children in a Japanese rural town. J Paediatr Child Health. 2013;49(5):394-8. https://doi.org/10.1111/jpc.12191 [ Links ]
45. Ertem D. Clinical Practice: Helicobacter pylori infection in childhood. Eur J Pediatr. 2013;172(11):1427-34. https://doi.org/10.1007/s00431-012-1823-4 [ Links ]
46. Yucel O. Prevention of Helicobacter pylori infection in childhood. World J Gastroenterol. 2014;20(30):10348-54. https://doi.org/10.3748/wjg.v20.i30.10348 [ Links ]
47. Hu J, Wang X, Chua EG, He Y, Shu Q, Zeng L, et al. Prevalence and risk factors of Helicobacter pylori infection among children in Kuichong Subdistrict of Shenzhen City, China. PeerJ. 2020;8:e8878. https://doi.org/10.7717/peerj.8878 [ Links ]
48. Bogiel T, Mikucka A, Szaflarska-Popławska A, Grzanka D. Usefulness of Molecular Methods for Helicobacter pylori Detection in Pediatric Patients and Their Correlation with Histopathological Sydney Classification. Int J Mol Sci. 2022;24(1):179. https://doi.org/10.3390/ijms24010179 [ Links ]
49. Sabbagh P, Javanian M, Koppolu V, Vasigala VR, Ebrahimpour S. Helicobacter pylori infection in children: an overview of diagnostic methods. Eur J Clin Microbiol Infect Dis. 2019;38(6):1035-45. https://doi.org/10.1007/s10096-019-03502-5 [ Links ]
50. Yang I, Woltemate S, Piazuelo MB, Bravo LE, Yepez MC, Romero-Gallo J, et al. Different gastric microbiota compositions in two human populations with high and low gastric cancer risk in Colombia. Sci Rep. 2016;6(1):18594. https://doi.org/10.1038/srep18594 [ Links ]
51. Whary MT, Avenia JMR, Bravo LE, Lofgren JL, Lertpiriyapong K, Mera-Giler R, et al. Contrasting serum biomarker profiles in two Colombian populations with different risks for progression of premalignant gastric lesions during chronic Helicobacter pylori infection. Cancer Epidemiol. 2020;67:101726. https://doi.org/10.1016/j.canep.2020.101726 [ Links ]
Citación: Salazar B, Gómez-Villegas SI, Vélez DE, Ramírez V, Pérez T, Martínez A. Frecuencia de la infección por Helicobacter pylori en pacientes que requirieron endoscopia digestiva en siete unidades de tres subregiones de Antioquia. Revista. colomb. Gastroenterol. 2023;38(3):290-303. https://doi.org/10.22516/25007440.983
Fuente de financiación Este estudio fue financiado por el Comité Para el Desarrollo de la Investigación (CODI), Convocatoria Programática de Salud 2014, proyecto 2014-1062, de la Universidad de Antioquia. Ministerio de Ciencias, tecnología e innovación (Minciencias) Proyecto 111577757202 contrato 644-2018 y Convocatoria de Doctorados Nacionales 617-2013
Recibido: 31 de Octubre de 2022; Aprobado: 05 de Mayo de 2023











 text in
text in