Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista colombiana de Gastroenterología
versión impresa ISSN 0120-9957versión On-line ISSN 2500-7440
Rev. colomb. Gastroenterol. vol.38 no.4 Bogotá oct./dic. 2023 Epub 26-Feb-2024
https://doi.org/10.22516/25007440.1048
Trabajos Originales
Uso de la anoscopia de alta resolución para la detección de displasia anal por papilomavirus en pacientes con enfermedad inflamatoria intestinal
1 Coloproctólogo, Instituto de Coloproctología (ICO). Medellín, Colombia.
2 Cirujano general, Instituto de Coloproctología (ICO). Medellín, Colombia.
3 Médico general, Instituto de Coloproctología (ICO). Medellín, Colombia.
Introducción:
El carcinoma anal de células escamosas es raro, pero su incidencia y mortalidad han ido en aumento globalmente. El 90% de los casos están relacionados con la infección por el virus del papiloma humano (VPH)1,2 y los pacientes con enfermedad inflamatoria intestinal (EII) tienen un mayor riesgo de infección por este virus; se ha identificado una incidencia de 5,5 por 100.000 pacientes en el grupo de EII frente a 1,8 en el grupo sin EII3.
Metodología:
Se realizó un estudio descriptivo de serie de casos en el que se incluyó a 21 pacientes con EII, sin síntomas perianales, entre enero y julio de 2022 en el Instituto de Coloproctología de Medellín, a quienes se les realizó citología anal, genotipificación del VPH y anoscopia de alta resolución, previa explicación y aceptación del procedimiento. Si se encontraban lesiones, se realizaba tratamiento ablativo.
Resultados:
El 23% de esta cohorte tenía lesiones escamosas de bajo grado, mientras que el 14,2% presentaba lesiones de alto grado con cambios de displasia al momento de la anoscopia. El 90,4% tenían genotipificación positiva para VPH, de los cuales el 76,1% eran de alto grado.
Conclusiones:
Nuestro estudio sugiere que esta serie de pacientes con EII se comporta como un grupo de alto riesgo para desarrollar lesiones premalignas en asociación con el VPH. La anoscopia de alta resolución es un método rentable, indoloro y asequible que, en manos expertas, puede impactar el diagnóstico y manejo de lesiones premalignas y disminuir la incidencia de cáncer anal en pacientes con EII.
Palabras clave: Virus del papiloma humano; enfermedad inflamatoria intestinal; displasia anal; cáncer anal; anoscopia de alta resolución
Introduction:
Anal squamous cell carcinoma is rare, but its incidence and mortality have been increasing globally; 90% of cases are related to human papillomavirus (HPV) infection(1,2). Patients with inflammatory bowel disease (IBD) have a higher risk of infection with this virus; an incidence of 5.5 per 100,000 patients has been identified in the IBD group compared to 1.8 in the non-IBD group(3).
Materials and methods:
A descriptive case series study was conducted with 21 patients with IBD and no perianal symptoms between January and July 2022 at the Institute of Coloproctology in Medellín. They underwent anal cytology, HPV genotyping, and high-resolution anoscopy after explanation and acceptance of the procedure. If lesions were found, ablative treatment was performed.
Results:
23% of this cohort had low-grade squamous lesions, while 14.2% had high-grade lesions with dysplasia changes during anoscopy. Besides, 90.4% had positive HPV genotyping, of which 76.1% were high-grade.
Conclusions:
Our study suggests that this series of patients with IBD behaves as a high-risk group for developing premalignant lesions in association with HPV. High-resolution anoscopy is a cost-effective, painless, and affordable method that, in expert hands, may impact the diagnosis and management of premalignant lesions and decrease the incidence of anal cancer in patients with IBD.
Keywords: Human papillomavirus; inflammatory bowel disease; anal dysplasia; anal cancer; high-resolution anoscopy
Introducción
La neoplasia intraepitelial anal (NIA), o lesión intraepitelial escamosa (SIL), es una lesión premaligna, precursora del carcinoma de células escamosas, fuertemente asociada con cepas oncogénicas del virus del papiloma humano (VPH), concretamente los subtipos 16 y 18, factores de riesgo por comportamientos asociados a la adquisición de este virus, como infección por virus de la inmunodeficiencia humana (VIH), tabaquismo, coito anal receptivo y antecedentes de neoplasia intraepitelial cervical (NIC)1.
El carcinoma anal de células escamosas es raro y, entre ciertas poblaciones de alto riesgo, la incidencia de este puede exceder la del cáncer de colon. Los pacientes con enfermedad inflamatoria intestinal (EII) tienen un mayor riesgo que la población general: se ha identificado una incidencia de 5,5 por 100.000 pacientes en el grupo con EII frente al 1,8 en el grupo sin EII2.
Es conocido que la prevalencia de NIA, así como su progresión a carcinoma del canal anal, es mayor en pacientes inmunosuprimidos y se asocia a un estado inflamatorio prolongado, que favorece la persistencia y disminuye la depuración viral del VPH en la zona de transición del canal anal, aumenta la posibilidad de desarrollar lesiones premalignas y, consecuentemente, cáncer anal. Asimismo, el manejo prolongado con antifactor de necrosis tumoral (anti-TNF) y esteroides genera la pérdida de regulación del ciclo celular, lo que altera el aclaramiento viral.
Es posible detectar las lesiones precursoras del cáncer anal principalmente a través de citología anal y anoscopia de alta resolución (HRA)3. Actualmente, no existen recomendaciones para el tamizaje del VPH del canal anal en pacientes con EII, por lo que realizamos un estudio con el propósito de confirmar la presencia de lesiones premalignas relacionadas con el VPH en esta zona que pudieran explicar el alto riesgo de generar un cáncer en estos pacientes y desarrollar un algoritmo de cribado en el que la anoscopia de alta resolución sea la piedra angular para el diagnóstico y tratamiento de las lesiones premalignas4.
Actualmente, los protocolos de vigilancia definen que la citología o HRA está restringida a hombres que tienen sexo con hombres (HSH), portadores del VIH, receptores de trasplantes de órganos sólidos y pacientes que usan medicamentos inmunosupresores tales como quimioterapéuticos, esteroides, entre otros5,6.
El propósito de este trabajo es dar a conocer la incidencia de la displasia y el cáncer escamoso de ano (CEA) en pacientes en una serie de casos, que padecen EII y que estarían en riesgo potencial de desarrollarlos7-9.
Métodos
Se realizó un estudio descriptivo de serie de casos en el que se incluyó a pacientes en seguimiento por EII, sin síntomas perianales, entre enero de 2022 y julio de 2022 en el Instituto de Coloproctología ICO S. A. S. de Medellín, a quienes se les realizó citología anal, genotipado de VPH y anoscopia de alta resolución, previa explicación y aceptación del procedimiento. Si se encontraban lesiones, se realizaba tratamiento ablativo.
Resultados
Se incluyó un total de 31 pacientes con colitis ulcerativa (CU; 10 mujeres [47%] y edad promedio de 35,2 años [19-58 años]) con una duración promedio de la enfermedad de 4,4 años (0,5-12 años) y una extensión de la colitis de acuerdo con la clasificación de Montreal: E1: 7 (17%), E2: 8 (18,5%) y E3: 6 (14,5%).
El 32% (10) de los pacientes estaban en control bajo terapia convencional (mesalazina, azatioprina). Cabe resaltar que 6 (19%) de los pacientes requirieron esteroides (prednisolona) en el último año, con una duración promedio de 6 semanas. El restante 68% (21) presentó falla de la primera línea de manejo y estaba bajo manejo con biológicos (20 con anti-TNF y 1 con vedolizumab).
La citología fue positiva en 23 pacientes (74,2%) para VPH y se encontraron células escamosas atípicas de significado indeterminado (ASCUS) en 10 (32,3%) pacientes, lesión escamosa intraepitelial de bajo grado (LSIL) en 8 (25,8%), lesión escamosa intraepitelial de alto grado (HSIL) en 5 (16,1), normal en 5 (16%) y no se realizó en 3 (1%). La genotipificación para VPH fue positiva en 28 (90,3%) pacientes, de los cuales el 76,1% eran de cepas de alto riesgo. En la anoscopia se encontró displasia en 11 pacientes (35,5%), condilomas en 5 pacientes (16,1%) y fue normal en 15 pacientes (48,4%).
Cuando los hallazgos anoscópicos fueron positivos para displasia/condilomas, se contrastó con la medicación concomitante y se encontró displasia y uso de anti-TNF en 9 (56%) pacientes, displasia y antecedentes de uso de esteroides en 8 (50%), condilomas y uso de anti-TNF en 5 (31,3%), y condilomas y antecedentes de uso de esteroides en 7 (44%). Cabe resaltar que no hubo ningún hallazgo anoscópico positivo en pacientes bajo terapia convencional ni con el uso de vedolizumab.
Entonces la pregunta que nos debemos hacer es: ¿deberíamos añadir un nuevo grupo de población de riesgo a la literatura?
Discusión
¿Cuál es la realidad del cáncer de ano?
En Colombia, no existe un registro nacional de neoplasias que permita describir la incidencia del carcinoma epidermoide anal, pero es una neoplasia infrecuente, que constituye menos de un 5% del total de cánceres gastrointestinales.
Según publicaciones recientes, se ha visto que en varones sanos pasó de 0,8 casos por 100.000 habitantes a principios de los años 90, a 1,3 casos por 100.000 habitantes para 2012. Además, hay un crecimiento proporcional mayor en mujeres que han padecido neoplasias cervicales. Según datos del Surveillance, Epidemiology, and End Results (SEER), programa del Instituto Nacional de Cáncer (NCI) en Estados Unidos para 2017, se presentaron unos 10.000 casos al año.
Actualmente, se calcula una incidencia global de 1,8 casos por 100.000 individuos, la cual ha ido en aumento junto con la mortalidad. El 90% de los casos están relacionados con la infección por VPH; de hecho, pocos médicos saben que el cáncer anal es más común en mujeres en la población general que en hombres. Si se analizan los grupos comúnmente llamados de alto riesgo, como los pacientes infectados por el VIH o los HSH, se observa que definitivamente las cifras del cáncer anal son exponencialmente mayores que en la población general (1,8/100.000). La incidencia de cáncer anal en HSH con VIH (-) es de 35/100.000, mientras que en HSH con VIH (+) es 131/100.00010.
¿Qué es el VPH y por qué es un oncogén?
El VPH es un papovavirus pequeño, sin envoltura, con doble cadena de ADN, cuya infección por transmisión sexual es la más común por patógenos en humanos11. Actualmente se reconoce que la infección por VPH es responsable de casi todos los cánceres de cuello uterino, el 95% de los cánceres de ano, el 65% de los cánceres de vagina, el 50% de los cánceres de vulva y el 35% de los cánceres de pene, así como una cantidad significativa de los cánceres de cabeza y cuello. Casi el 63% de los nuevos casos y el 61% de las muertes serán en mujeres1.
Hay unos 200 subtipos basados en la secuencia genética de la proteína L1 de la cápside externa. Aproximadamente, 40 subtipos se trasmiten por contacto entre epitelios mucosos y los subtipos 16, 18, 31, 33, 35, 52 y 45 son los de alto riesgo; representan el grupo carcinogénico más importante involucrado en el CEA: se aísla en el 91% de estos tumores, pero solo los serotipos 16 y 18 son responsables del 79% de los cánceres anales12.
El VPH infecta los queratinocitos e incorpora los oncogenes E6 y E7 en el genoma del huésped. Estos oncogenes posteriormente inducen la degradación de p53 y Rb, que son dos importantes proteínas supresoras de tumores que se encuentran normalmente en las células y la inactivación de productos de la familia del retinoblastoma, lo que en última instancia conduce a inestabilidad cromosómica o inestabilidad microsatelital. Si estos procesos en ausencia de estas proteínas no se controlan, las células normales pueden mutar a células cancerosas siguiendo una secuencia de displasia a neoplasia10.
Los Centros para el Control de Enfermedades (CDC) indican que “más del 80% de las personas sexualmente activas se infectarán al menos de un serotipo de VPH en algún momento de sus vidas”. De hecho, se estima que, a nivel mundial, diariamente un millón de personas se están infectando, con una prevalencia de 79 millones.
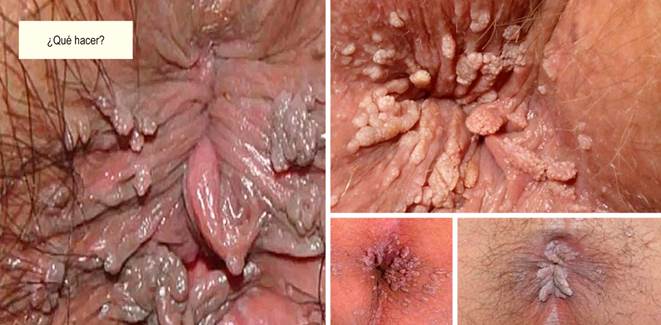
En la grandísima mayoría, el VPH es asintomático y la infección a menudo desaparece por sí sola gracias a los mecanismos de barrido y descamación celular, pero también puede ser subclínica, microscópicamente detectable (citología anal/anoscopia de alta resolución) o latente (es decir, una infección que se manifiesta clínicamente meses o años después de la exposición), pero también macroscópicamente evidente (condiloma) (Figura 1). La infección por el VPH también puede comenzar en una parte del cuerpo y luego migrar a otra parte (originalmente comienzan en los genitales y luego infectar el ano, sin que necesariamente hubiera habido penetración a este nivel).
En un estudio con 431 mujeres se encontró que el 42% eran positivas para el ADN del VPH anal al momento del enrolamiento, pero después de un seguimiento de 1,3 años, esa cantidad subió a un total del 70% y el 50% de estas desarrollaron infecciones anales por VPH durante este período, pero también el 58% despejó sus infecciones durante el período de seguimiento posterior13.
Por otra parte, el riesgo de cáncer anal en las mujeres va ligado a la presencia de otros tumores en la región anogenital, probablemente en relación con la exposición común al VPH por proximidad anatómica (tanto el cérvix como el canal anal actúan como reservorios que favorecerán la infección mutua por proximidad, independientemente de la localización anatómica inicial de la misma). Así, las pacientes que han presentado una neoplasia en esta región tendrán un riesgo considerablemente mayor al de la población general de presentar una segunda neoplasia en la región anogenital14.
Los factores de riesgo para la infección por VPH incluyen sexo con hombres no circuncidados, una pareja que haya tenido muchas parejas sexuales, y primer contacto sexual a temprana edad, así como también pacientes que hayan sido trasplantados de un órgano sólido (riñón, hígado, entre otros), estén sometidos a quimio- o radioterapia (leucemia, linfomas), uso de biológicos, consumidores crónicos de esteroides, diabéticos, entre otros, que por consiguiente siguen un tratamiento inmunosupresor. Concretamente, varios estudios han comunicado tasas de carcinoma anal hasta 10 veces mayor que la población general en pacientes con trasplantes renales15.
¿Qué es la displasia anal?
La NIA se define como células displásicas en el canal anal; pero, desde el punto de vista citológico, las células escamosas anormales del ano se clasifican como células escamosas atípicas de significado indeterminado (ASCUS), células escamosas atípicas (no se puede descartar una lesión intraepitelial escamosa de alto grado), lesión intraepitelial escamosa de bajo grado (LSIL) y lesión intraepitelial escamosa de alto grado (HSIL)10. También se ha confirmado que las lesiones clasificadas como displasia de bajo grado (DBG) pueden experimentar una regresión espontánea sin ningún tratamiento (50%-70%) o progresar hacia displasia de alto grado (DAG) (20%). Aproximadamente, el 10% de los pacientes con DAG pueden evolucionar a carcinoma epidermoide en un lapso que va hasta los 3 años luego de la detección de la lesión.
La Sociedad Estadounidense de Cirujanos de Colon y Recto recomienda usar el término lesiones intraepiteliales escamosas de bajo grado (LSIL), y el término que incluye enfermedad de Bowen, carcinoma in situ, NIA II, NIA III, displasia moderada y displasia de alto grado ahora se denomina colectivamente como lesiones intraepiteliales de células escamosas de alto grado (HSIL), y se consideran lesiones precursoras del cáncer o CEA16.
En un reporte de casos, Sha y colaboradores encontraron que un 5,3% de los pacientes con EII tenían VPH positivo con células escamosas atípicas de significado indeterminado. En esta cohorte no hubo casos de LSIL ni HSIL ni CEA17.
El patrón de oro para el diagnóstico de NIA es la biopsia anal guiada por HRA y en la actualidad se clasifica en DBG y DAG en función de la aparición de células displásicas que afecten al epitelio de menor a mayor profundidad, respectivamente.
Tanto la incidencia como la mortalidad por cáncer anal es cada vez más frecuente, con un aumento del 2,2% en casos nuevos cada año para la última década y un aumento del 3,75% en las tasas de mortalidad cada año desde las últimas dos décadas10. Por tanto, se debe considerar una vigilancia más cercana (de 3 a 4 meses) porque las HSIL han demostrado que recurren dentro de los 6 meses posteriores al tratamiento, y por tener una lesión de alto grado se debe considerar al paciente con mayor riesgo que la población general para el desarrollo de displasia anal adicional18.
¿Por qué la enfermedad inflamatoria intestinal es oncogénica?
La EII como tal es una entidad inflamatoria que favorece alteraciones en la inmunidad celular. En una revisión sistemática que incluyó 11 estudios de centros de referencia (1940 a 2005), la incidencia de CEA fue de 0,02 por 1000 años-paciente en pacientes con enfermedad de Crohn (EC) y 0,009 por 1000 pacientes-año en pacientes con CU; es decir, similar a la de la población general19.
Se conoce que en la EC existe una reducción de las defensinas humanas. Estas son proteínas que se encuentran en las células del sistema inmunitario en la mucosa genital ayudando contra las infecciones virales, ya que inhiben el VPH tanto cutáneo como mucoso, actuando como una barrera natural contra el VPH.
Se ha demostrado que las α-defensinas humanas 1, 2, 3 y 5 inhiben el VPH en la piel y las membranas mucosas, que puede explicar un mayor riesgo de infección por VPH en pacientes con EII2. La mayoría de los casos de CEA que se desarrollan en pacientes con EC se diagnostican en la presentación perianal de aparición temprana en la vida con una enfermedad de larga evolución (> 10 años)17,19.
¿Se aumenta el riesgo de cáncer cuando se asocia a VPH y EII?
Se cree que la patogénesis de los cánceres anales relacionados con la EII está asociada a mecanismos relacionados con la enfermedad que incluyen cambios locales y sistémicos, inflamación crónica, infección por VPH, disminución en la función de defensinas puntualmente en EC e inmunosupresión inducida por fármacos, lo que genera cambios en los procesos de proliferación, senescencia y muerte celular, así como en la mutación y metilación del ADN.
Existe una correlación entre la infección por el VPH y la EII: el VPH es más frecuente en pacientes con EII con un aumento de 3 a 5 veces de cambios en la citología cervicouterina de mujeres con EII en relación con la población general20. Hay varias explicaciones posibles para esta correlación. Es probable que el VPH sea un virus pasajero que se implante más frecuentemente en pacientes con EII debido al sistema inmunitario debilitado, que es característico de estos pacientes. Otra posibilidad es que la inflamación causada por la EII proporcione un ambiente hospitalario para que florezca el VPH. Interesantemente, un estudio basado en PCR demostró que todos los CEA de los pacientes que estaban inmunosuprimidos como resultado del tratamiento para EII dieron positivo para variantes de VPH de alto riesgo21.
En un estudio francés reciente se evaluaron 469 pacientes sometidos a procedimientos consecutivos (mediana de edad: 54 años, 52% mujeres), incluidos 112 que recibieron terapias inmunosupresoras y 101 con EII (70 con EC), se les realizaron colonoscopias rutinarias y se detectó ADN del VPH en tejidos anales en el 34% de los sujetos y serotipos de alto riesgo VPH en el 18%. El serotipo 16 fue el genotipo más prevalente (detectado en el 7%), seguido del 51, 52 y 39. Los serotipos de alto riesgo se detectaron en una proporción significativamente mayor de muestras de mujeres (23,1%) que de hombres (12,8%) (p = 0,0035) y en una proporción significativamente mayor de pacientes con EC (30,0%) que sin esta (18,1%) (p = 0,005). En general, 84/101 (83,2%) pacientes con EII estaban bajo terapia inmunosupresora en el momento del estudio (75,8% frente a 85,7% para pacientes con CU y EC respectivamente, p = 0,25); de estos, el 30,8% presentó infección por cepas de alto riesgo, frente al 16,6% de los pacientes no expuestos (p = 0,15)22.
En un estudio de 26 pacientes con EII, la mitad de estos tomando inmunomoduladores, se encontró que el 81% de los pacientes portaban VPH anal (el 80% tenía > 1 tipos de VPH de alto riesgo) y el 42% de los pacientes tenían una citología anal anormal. A todos los pacientes que tomaban una tiopurina se les detectó > 1 VPH anal de alto riesgo. Entre los pacientes a los que se les realizaron biopsias, el 38% tenía LSIL y el 15% HSIL. Del grupo con displasia (LSIL/HSIL), el 43% tomaban inmunosupresores.17.
El CEA en pacientes con EII tiene un mal pronóstico, con una supervivencia a 5 años del 37% según la única revisión sistemática disponible19; mientras que la tasa de supervivencia a 5 años después del diagnóstico de CEA supera el 60% en la población general23. Por tanto, los pacientes con EII deben someterse a pruebas de detección del VPH y, si son positivos, deben controlarse para detectar el desarrollo de cáncer, específicamente en pacientes con enfermedad perianal de larga duración19.
El pilar del tratamiento de la displasia anal por VPH ha sido tradicionalmente la escisión quirúrgica, aunque su eficacia puede ser limitada con una alta morbilidad y secuelas funcionales y anatómicas desastrosas, como estenosis anal o incontinencia fecal. Por lo anterior, el enfoque moderno y que se ha establecido como estándar de manejo en el Instituto de Coloproctología ICO S. A. S. se basa en dos abordajes: la terapia ablativa dirigida por anoscopia de alta resolución y la terapia médica ablativa basada en el uso de 5-fluorouracilo junto a metotrexato en un esquema de 5 días de aplicación activa dos veces al día, espaciados por 9 días de descanso para un total de 16 semanas.
Se ha demostrado que las vacunas contra el VPH, como Gardasil 4 o 9 y Cervarix, son eficaces para reducir las tasas de infección, pero no se ha estudiado su eficacia en personas con EII.
¿El tratamiento anti-EII favorece la infección por VPH?
El tratamiento de la EII, salvo los aminosalicilatos, está basado en la inmunomodulación (azatioprina, metotrexato y 6-mercaptopurina) o inmunosupresión con agentes biológicos tipo bloqueantes del factor de necrosis tumoral (anti-TNF) (infliximab, adalimumab, golimumab y certolizumab pegol). Estos fármacos alteran la inmunidad celular y se asocian con mayores tasas de infecciones virales, bacterianas y fúngicas, con mayor riesgo en quienes usan terapia combinada, lo que puede conducir a una mayor tasa de enfermedades asociadas con el VPH, incluidas las verrugas genitales, displasia, cáncer anogenital y hasta el orofaríngeo.
En una cohorte se encontró que la prevalencia global de ASCUS fue del 7% (8,8% en el grupo con EII frente al 2,6% en controles sanos). Esto es similar a la prevalencia en otras poblaciones de bajo riesgo (3,9%-10%), pero menor que la prevalencia de NIA informada en otras poblaciones de alto riesgo (19,6%-28%), como aquellas con displasia genital o antecedentes de trasplante17.
Según un metaanálisis reciente, la exposición prolongada a la terapia inmunosupresora en la EII podría promover la displasia y el cáncer de cuello uterino asociados con el VPH (odds ratio [OR] = 1,34, intervalo de confianza [IC] del 95%: 1,23-1,46)24. En otro estudio se documentó que el riesgo relativo para inducir cáncer de cuello uterino fue de 1,65 para el ácido 5-aminosalicílico (5-ASA) y de 3,45 para las tiopurinas (ambos con valor p > 0,05)25.
Sin embargo, hay datos controversiales, tal y como lo expresa un artículo en el que no se encontraron diferencias en alteraciones citológicas y presencia de VPH en el canal anal entre pacientes con EC y un grupo control de personas sanas. Por el contrario, en otras series de casos retrospectivas los autores concluyeron que las lesiones neoplásicas escamosas anales en la EII están asociadas con la infección por VPH y el CEA parece ser estar asociado a EC perianal11,26.
Un estudio prospectivo de 230 pacientes con EII demostró un aumento significativo de verrugas virales en el grupo que recibió AZA/6-MP en comparación con los que no recibieron inmunosupresión (17,2% frente a 3,3%, p = 0,004). Las pruebas de Papanicolaou anormales en mujeres con EII en comparación con controles (42% frente a 7%, p = 0,001) y también en mujeres con antecedentes de exposición a inmunosupresión respalda la recomendación de vacunación contra el VPH y exámenes ginecológicos regulares en mujeres11.
El TNF es la piedra angular en múltiples procesos celulares, como la regulación y mantenimiento de la homeostasis del sistema inmunitario, la inflamación y la defensa del huésped27-29. Un artículo investigó a los pacientes que usaban medicamentos anti-TNF-α y encontró que el 21,1% eran positivos para infección por VPH en la región genital30. En los últimos años ha habido un resurgimiento del interés en los paralelismos entre la inflamación crónica y el cáncer y, por tanto, no sorprende que el TNF-α se haya convertido en el foco de esta investigación.
Dado su estrecho desarrollo con los procesos inflamatorios y su participación en la señal de apoptosis, se ha visto su gran papel en la modulación de la infección por VPH dado que, en las células infectadas, ayuda a detener la replicación y la propagación del virus. Se ha observado un aumento de la expresión de TNF-α en relación con la infección por el VPH, tanto en los tejidos cervicales normales como en los cánceres cervicales, lo que respalda la importancia del TNF-α en la respuesta al VPH y en la posterior carcinogénesis31.
Sabemos que el TNF-α suprime la expresión de los oncogenes E6 y E7 a nivel de traducción en las células humanas infectadas por el VPH16 mediante la unión a su receptor tipo I31,32 e induce la apoptosis en las células normales e infectadas por el VPH16, y estimula la respuesta inflamatoria a través de la regulación de citocinas y de otros reguladores inflamatorios. Por tanto, el bloqueo del TNF-α puede aumentar el riesgo de reactivación del VPH y, en última instancia, conducir a la apoptosis de la célula huésped. Es por esto que el cribado y la vacunación de los pacientes sometidos a antagonistas del TNF-α son fundamentales31-34.
La asociación entre la displasia cervical y la terapia de bloqueo del TNF-α está bien documentada, dado el papel fundamental de este último en el control de la infección vírica, incluido el VPH. Por tanto, la inhibición terapéutica del TNF-α puede aumentar el riesgo de reactivación del VPH y provocar displasia y carcinoma cervical, como se evidencia en los pacientes con artritis reumatoide y EC. Wadstroem y colaboradores analizaron el riesgo de displasia cervical en pacientes con artritis reumatoide tratados con anti-TNF y descubrieron que tenían un mayor riesgo de displasia cervical de alto grado (cociente de riesgos instantáneos: 1,36; IC: 1,01 a 1,82) y de cáncer cervical invasivo (cociente de riesgos instantáneos: 2,10; IC: 1,04 a 4,23) en comparación con las mujeres sin tratamiento biológico35.
Otro estudio realizado por Kane y colaboradores incluyó a pacientes con EC expuestos a inmunomoduladores, incluyendo prednisona, análogos de las purinas, metotrexato e infliximab a quienes se les realizo frotis de Papanicolaou y se compararon sus citologías durante 2 años con las de una población de control. Las mujeres expuestas a la terapia inmunosupresora por más de 6 meses continuos eran más propensas a tener una citología anormal (p = 0,001) que la población de control36. Sin embargo, al examinar de cerca los estudios individuales, la evidencia con respecto a las anormalidades cervicales atribuible a las tiopurinas y al anti-TNF aún no es concluyente37.
Esto abre la puerta a cuestionarse si el uso de bloqueantes anti-TNF o inmunosupresores por largo tiempo en pacientes con EII puede aumentar el riesgo de cáncer anal teniendo en cuenta el estrecho vínculo con el aclaramiento del VPH. Sin embargo, debe reconocerse que la cohorte CESAME no demostró una asociación entre el uso de tiopurinas y el cáncer anal (ya sea adenocarcinoma o CEA) en pacientes con EII, aunque el riesgo bruto en el subgrupo de pacientes con EC perianal expuestos a tiopurinas fue de 0,42 por 1000 pacientes-año. Además, los registros TREAT y ENCORE no han demostrado un exceso de cánceres anales en pacientes tratados con infliximab38-40.
La declaración de consenso de la Organización Europea de Crohn y Colitis (ECCO) solo recomienda vacunación en mujeres que padecen EII para prevenir el cáncer de cuello uterino, pero lastimosamente no existen recomendaciones específicas para la profilaxis del VPH para la prevención del CEA en pacientes con EII41,42.
Dadas las similitudes bien establecidas entre las enfermedades relacionadas con el VPH cervical y anal, las directrices recientes de los Centros para el Control de Enfermedades han recomendado la vacunación contra el VPH para niños de ambos sexos a los 11 o 12 años, y para hombres y mujeres con alto riesgo de NIA o NIC, o cualquier persona no vacunada previamente menor de 26 años de edad43.
En estudios de HSH que son VIH negativos, la sensibilidad de la citología anal reportada en la literatura varía, oscilando entre 47% y 70% para la detección de la NIA de cualquier grado. La citología anal HSIL se correlaciona bien con NIA de alto grado (es decir, NIA II o III), por lo que se recomienda realizar un examen anal directo y una biopsia de tejido después de cualquier resultado anormal de citología anal44.
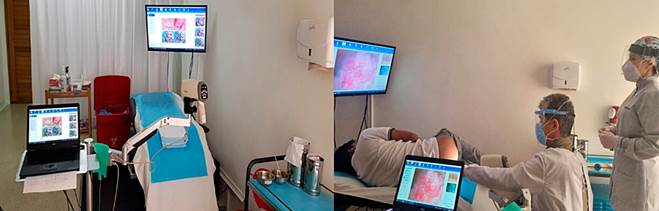
Si se detecta una citología anormal con un examen citológico anal, el siguiente paso en el manejo de la NIA es la anoscopia de alta resolución (HRA) para intentar localizar la fuente de células atípicas. La HRA consiste en examinar la unión escamocolumnar, el canal anal y la piel perianal con aumento mediante un colposcopio. Durante la anoscopia, se introduce un anoscopio lubricado con lidocaína a través del ano y luego se inserta un hisopo empapado en una solución de ácido acético al 3%-5% en el canal anal mientras se retira el anoscopio durante un minuto. El ácido acético provoca un “cambio acetoblanco” en áreas de epitelio transicional anormal, se inspecciona cuidadosamente la mucosa en busca de cambios característicos de la NIA, incluidas áreas planas o ligeramente elevadas de mucosa engrosada con o sin anomalías en el patrón vascular. Luego se aplica lugol de manera similar, pero en este caso las lesiones no se tiñen con yodo (negativo para tinción con lugol) porque el yodo es glucófilo y los tejidos displásicos carecen de glucógeno y aparecen de color mostaza espeso. A cualquier lesión sospechosa negativa para lugol, incluidos los condilomas, configuraciones superficiales atípicas, puntuaciones, mosaicismo o vasos atípicos, se le realiza biopsia bajo visualización directa (Figuras 2, 3 y 4).
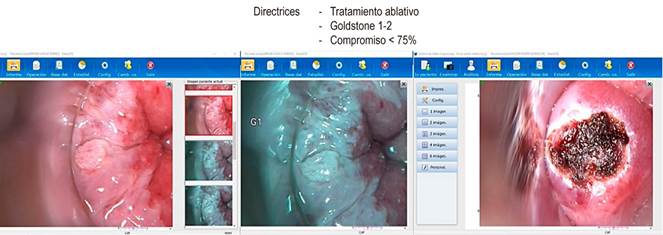
Fuente: archivo de los autores.
Figura 3 Tratamiento ablativo a través de la anoscopia de alta resolución.
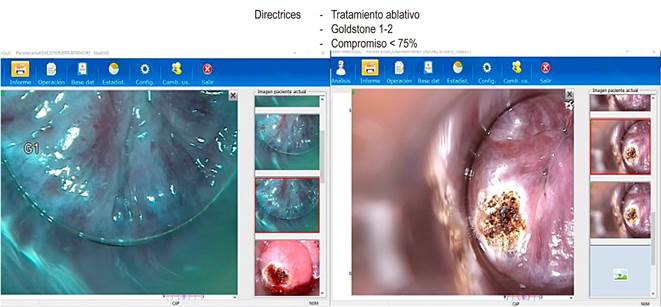
Fuente: archivo de los autores.
Figura 4 Tratamiento ablativo a través de la anoscopia de alta resolución.
La HRA se considera superior a la anoscopia estándar, como lo demostraron Camus y colaboradores, quienes informaron que en una población de 102 pacientes (68% hombres, 57,3% con VIH positivo; media: 1,6 lesiones) solo el 38,7% (65/168) de todas las lesiones observadas con HRA fueron visibles con anoscopia estándar45.
Aunque la HRA generalmente se considera segura para los pacientes y no es difícil de realizar para los médicos, se requiere un tiempo de entrenamiento considerable para reconocer las lesiones anales, especialmente aquellas que pueden tener una apariencia sutil. Debido a la cantidad limitada de pacientes con hallazgos atípicos asociados con la NIA en la población general, lo ideal es realizar la HRA en centros especializados46.
Estrategias para la disminución de infección por VPH
Los factores de comportamiento también tienen un papel en la prevención de la infección por VPH. Suspender el tabaquismo, además de fomentar y educar sobre prácticas sexuales más seguras puede disminuir la prevalencia de personas infectadas por el VPH y, a su vez, podría disminuir la incidencia del riesgo de cáncer anal provocado por el VPH en pacientes con EII.
La citología anal hecha por personal capacitado detecta lesiones precancerosas e intraepiteliales que eventualmente podrían conducir a un carcinoma anal invasivo. Como herramienta de cribado, es tan sensible para detectar anomalías citológicas anales en pacientes de alto riesgo como lo es para el cáncer de cuello uterino, y contribuye a la cuidadosa selección de pacientes para la anoscopia de alta resolución.
La NIA puede diagnosticarse con estrategias de tamizaje como la citología anal y anoscopia de alta resolución, evitando así la progresión a cáncer anal, con un costo aceptable y escasa morbilidad.
El riesgo de CEA no relacionado con fístula en pacientes con CU es el mismo que en la población general y no justifica un programa de detección de cáncer anal en pacientes con EII que no tienen un alto riesgo específico debido a la infección por VIH asociada o antecedentes personales de condiloma anogenital.
Conclusión
Nuestro estudio sugiere que la neoplasia escamosa anal en la EII está asociada con la infección por VPH y que el CEA parece estar asociado con la EC perianal. Además de un examen perianal cuidadoso, se podría considerar la detección del VPH anal en pacientes con EII, pero parece demasiado pronto para proporcionar recomendaciones claras para la detección de un subconjunto específico de pacientes. Se necesita un estudio prospectivo para confirmar estos hallazgos. Aunque se basa en pruebas de bajo nivel de estudios no controlados, se podría considerar el examen perianal anual con o sin citología anal en pacientes con EII con enfermedad fistulizante perianal de larga duración, estenosis anal o infección por VPH conocida.
Además, los pacientes con EII con otros factores de riesgo de infección por VPH, como antecedentes de relaciones sexuales anales receptivas, HSH, antecedentes de enfermedades de transmisión sexual (incluido el VIH), múltiples parejas sexuales y antecedentes de cáncer anogenital (cervicouterino, vulvar o vaginal) también deben ser examinados en un esfuerzo por prevenir el cáncer anal11.
Nuestro estudio demuestra que los pacientes con EII se comportan como un grupo de alto riesgo para desarrollar lesiones premalignas en asociación con el VPH, como displasia en el 35,5% y condilomas en el 16,1%. La vacunación reduce la tasa de neoplasia intraepitelial anal de alto grado relacionada con cepas de VPH de alto riesgo en un 75%. En pacientes con EII, la Organización Europea para la Enfermedad de Crohn y la Colitis recomienda la vacunación profiláctica rutinaria contra el VPH tanto para mujeres como para hombres, de acuerdo con las pautas nacionales47.
El estado inflamatorio persistente, el uso de esteroides y anti-TNF juegan un papel importante en la disminución del aclaramiento viral del VPH, por lo que se debe realizar un estudio más exhaustivo en pacientes con EII, establecer la frecuencia de lesiones y el perfil genético viral que pudiera estar relacionado con el desarrollo de cáncer anal.
La anoscopia de alta resolución es un método rentable, indoloro y asequible que, en manos expertas, puede diagnosticar y tratar de manera eficiente las lesiones premalignas y disminuir la incidencia de cáncer anal en pacientes con EII.
Hasta la fecha, a través del programa ICO Seguro, somos el primer programa diseñado y puesto en marcha en Colombia que garantiza de una manera integral la educación del personal de salud y pacientes, así como la detección, tratamiento y seguimiento de las poblaciones en riesgo de cáncer anal (Figura 5).

Fuente: archivo de los autores.
Figura 5 Equipo humano del Instituto de Coloproctología ICO especializado en la anoscopia de alta resolución.
Pero al final quedan más preguntas que respuestas: ¿existen especificidades en la prevalencia y distribución de serotipos de la infección por VPH en pacientes con EII compatibles con otros factores de riesgo establecidos de infección por VPH (tabaquismo, prácticas sexuales)?, ¿la terapia inmunosupresora aumenta el riesgo de CEA relacionado con el VPH y lesiones precursoras intraepiteliales en pacientes con EII e infección por VPH? , ¿el exceso de riesgo de CEA no relacionado con fístula en pacientes con EC está relacionado, al menos en parte, con la inflamación crónica local o sistémica?, ¿cuáles son la frecuencia y las modalidades óptimas de vigilancia entre examen digital, citología, anoscopia de alta resolución, entre otras?
REFERENCIAS
1. Roberts JR, Siekas LL, Kaz AM. Anal intraepithelial neoplasia: A review of diagnosis and management. World J Gastrointest Oncol. 2017;9(02):50-61. https://doi.org/10.4251/wjgo.v9.i2.50 [ Links ]
2. Savio MC, Svoboda Baldin RK, Nóbrega NL, Nicollelli GM, Brenner AS, Borges da Rocha P, et al. Prevalence of Anal Intraepithelial Lesions in Patients with Inflammatory Bowel Disease. J Coloproctol. 2021;41(3):222-227. https://doi.org/10.1055/s-0041-1730425 [ Links ]
3. Vuitton L, Jacquin E, Parmentier AL, Crochet E, Fein F, Dupont-Gossart AC, et al. High Prevalence of Anal Canal High-Risk Human Papillomavirus Infection in Patients With Crohn’s Disease. Clin Gastroenterol Hepatol. 2018;16(11):1768-1776.e5. https://doi.org/10.1016/j.cgh.2018.03.008 [ Links ]
4. Palefsky JM. Practising high-resolution anoscopy. Sex Health. 2012;9(6):580-6. https://doi.org/10.1071/SH12045 [ Links ]
5. Sendagorta E, Herranz P, Guadalajara H, Bernardino JI, Viguer JM, Beato MJ, et al. Prevalence of abnormal anal cytology and high-grade squamous intraepithelial lesions among a cohort of HIV-infected men who have sex with men. Dis Colon Rectum. 2014;57(04):475-481. https://doi.org/10.1097/DCR.0000000000000095 [ Links ]
6. Oon SF, Winter DC. Perianal condylomas, anal squamous intraepithelial neoplasms and screening: a review of the literature. J Med Screen. 2010;17(01):44-49. https://doi.org/10.1258/jms.2009.009058 [ Links ]
7. Cranston RD, Regueiro M, Hashash J, Baker JR, Richardson-Harman N, Janocko L, et al. A pilot study of the prevalence of anal human papillomavirus and dysplasia in a cohort of patients with IBD. Dis Colon Rectum. 2017;60(12):1307-1313. https://doi.org/10.1097/DCR.0000000000000878 [ Links ]
8. Richel O, Hallensleben ND, Kreuter A, van Noesel CJ, Prins JM, de Vries HJ. High-resolution anoscopy: clinical features of anal intraepithelial neoplasia in HIV-positive men. Dis Colon Rectum. 2013;56(11):1237-42. https://doi.org/10.1097/DCR.0b013e3182a53568 [ Links ]
9. Camus M, Lesage AC, Fléjou JF, Hoyeau N, Atienza P, Etienney I. Which lesions should be biopsied during high-resolution anoscopy? Prospective descriptive study of simple morphological criteria. J Low Genit Tract Dis. 2015;19(2):156-160. https://doi.org/10.1097/LGT.0000000000000064 [ Links ]
10. Limoges-Gonzalez M, Al-Juburi A. Anal Intraepithelial Neoplasia. J Clin Gastroenterol. 2017;51(3):203-207. https://doi.org/10.1097/MCG.0000000000000721 [ Links ]
11. Ruel J, Ko HM, Roda G, Patil N, Zhang D, Jharap B, et al. Anal Neoplasia in Inflammatory Bowel Disease Is Associated With HPV and Perianal Disease. Clin Transl Gastroenterol. 2016;7(3):e148. https://doi.org/10.1038/ctg.2016.8 [ Links ]
12. Poggio JL. Premalignant lesions of the anal canal and squamous cell carcinoma of the anal canal. Clin Colon Rectal Surg. 2011;24(3):177-192. https://doi.org/10.1055/s-0031-1286002 [ Links ]
13. Goodman MT, Shvetsov YB, McDuffie K, Wilkens LR, Zhu X, Ning L, et al. Acquisition of anal human papillomavirus (HPV) infection in women:the Hawaii HPV cohort study. J Infect Dis. 2008;197(7):957-966. https://doi.org/10.1086/529207 [ Links ]
14. Shvetsozv YB, Hernandez BY, McDuffie K, Wilkens LR, Zhu X, Ning L, et al. Duration and clearance of anal human papillomavirus (HPV) infection among women: The Hawaii HPV cohort study. Clin Infect Dis. 2009;48(5):536-546. https://doi.org/10.1086/596758 [ Links ]
15. Nyitray AG, Carvalho RJ, Baggio ML, Lu B, Smith D, Abrahamsen M, et al. Age-specific prevalence of and risk factors for anal human papillomavirus (HPV) among men who have sex with women and men who have sex with men: the HPV in men (HIM) study. J Infect Dis. 2011;203(1):49-57. https://doi.org/10.1093/infdis/jiq021 [ Links ]
16. Steele SR, Varma MG, Melton GB, et al. Practice parameters for anal squamous neoplasms. Dis Colon Rectum. 2012;55(7):735-49. https://doi.org/10.1097/DCR.0b013e318255815e [ Links ]
17. Shah SB, Pickham D, Araya H, Kamal A, Pineda CE, Ghole S, et al. Prevalence of anal dysplasia in patients with inflammatory bowel disease. Clin Gastro Hepatol. 2015;13(11):1955-1961. https://doi.org/10.1016/j.cgh.2015.05.031 [ Links ]
18. Messick CA, Rodriguez-Bigas MA. Anal Dysplasia. Surg Oncol Clin N Am. 2017;26(1):33-43. https://doi.org/10.1016/j.soc.2016.07.005 [ Links ]
19. Slesser AA, Bhangu A, Bower M, Goldin R, Tekkis PP. A systematic review of anal squamous cell carcinoma in inflammatory bowel disease. Surg Oncol. 2013;22(4):230-7. https://doi.org/10.1016/j.suronc.2013.08.002 [ Links ]
20. Bhatia J, Bratcher J, Korelitz B, Vakher K, Mannor S, Shevchuk M, et al. Abnormalities of uterine cervix in women with inflammatory bowel disease. World J Gastroenterol. 2006;12(38):6167-6171. https://doi.org/10.3748/wjg.v12.i38.6167 [ Links ]
21. Wong AK, Chan RC, Aggarwal N, Singh MK, Nichols WS, Bose S. Human papillomavirus genotypes in anal intraepithelial neoplasia and anal carcinoma as detected in tissue biopsies. Mod Pathol An Official J United States Can Acad Pathol Inc 2010;23(1):144e50. https://doi.org/10.1038/modpathol.2009.143 [ Links ]
22. Vuitton L, Jacquin E, Parmentier AL, Crochet E, Fein F, Dupont-Gossart AC, et al. High Prevalence of Anal Canal High-Risk Human Papillomavirus Infection in Patients With Crohn’s Disease. Clin Gastroenterol Hepatol. 2018;16(11):1768-1776.e5. https://doi.org/10.1016/j.cgh.2018.03.008 [ Links ]
23. Abramowitz L, Mathieu N, Roudot-Thoraval F, Lemarchand N, Bauer P, Hennequin C, et al. Epidermoid anal cancer prognosis comparison among HIV+ and HIV- patients. Aliment Pharmacol Ther. 2009;30(4):414-21. https://doi.org/10.1111/j.1365-2036.2009.04026.x [ Links ]
24. Allegretti JR, Barnes EL, Cameron A. Are patients with inflammatory bowel disease on chronic immunosuppressive therapy at increased risk of cervical high-grade dysplasia/cancer? A meta-analysis. Inflamm Bowel Dis 2015;21(5):1089-97. https://doi.org/10.1097/MIB.0000000000000338 [ Links ]
25. Hutfless S, Fireman B, Kane S, Herrinton LJ. Screening differences and risk of cervical cancer in inflammatory bowel disease. Aliment Pharmacol Ther. 2008;28(5):598-605. https://doi.org/10.1111/j.1365-2036.2008.03766.x [ Links ]
26. Guzela VR, Sobrado Junior CW, Nadal SR, Villa LL, Mota GR, Gonçalves AP, et al. Is there a higher frequency of anal dysplasia and infection by human papillomavirus in Crohn’s disease patients? Braz J Med Biol Res. 2022;55:e12141. https://doi.org/10.1590/1414-431x2022e12141 [ Links ]
27. Gaiotti D, Chung J, Iglesias M, Nees M, Baker PD, Evans CH, et al. Tumor necrosis factor-alpha promotes human papillomavirus (HPV) E6/E7 RNA expression and cyclin-dependent kinase activity in HPV-immortalized keratinocytes by a ras-dependent pathway. Mol Carcinog. 2000;27(2):97-109. https://doi.org/10.1002/(sici)1098-2744(200002)27:2<97::aid-mc5>3.0.co;2-v [ Links ]
28. Idriss HT, Naismith JH. TNFα and the TNF receptor superfamily: Structure-function relationship(s). Microsc Res Tech. 2000;50(3):184-95. https://doi.org/10.1002/1097-0029(20000801)50:3<184::AID-JEMT2>3.0.CO;2-H [ Links ]
29. Balkwill F. TNF-alpha in promotion and progression of cancer. Cancer Metastasis Rev. 2006;25(3):409-16. https://doi.org/10.1007/s10555-006-9005-3 [ Links ]
30. Handisurya A, Lázár S, Papay P, Primas C, Haitel A, Horvat R, et al. Anogenital human papillomavirus prevalence is unaffected by therapeutic tumour necrosis factor-alpha inhibition. Acta Derm Venereol. 2016;96(4):494-498. https://doi.org/10.2340/00015555-2298 [ Links ]
31. Ram A, Noël JC, Marmol V, Benhadou F. Occurrence of an invasive cervical epidermoid carcinoma in a patient receiving TNF-α blocking therapy for hidradenitis suppurativa. JAAD Case Reports. 2018;4(9):857-859. https://doi.org/10.1016/j.jdcr.2018.06.014 [ Links ]
32. Khodabandehlou N, Mostafaei S, Etemadi A, Ghasemi A, Payandeh M, Hadifar S, et al. Human papilloma virus and breast cancer: the role of inflammation and viral expressed proteins. BMC Cancer. 2019;19(1):61. https://doi.org/10.1186/s12885-019-5286-0 [ Links ]
33. Ali KS, Ali HY, Jubrael JM. Concentration levels of IL-10 and TNFα cytokines in patients with human papilloma virus (HPV) DNA and DNA cervical lesions. J Immunotoxicol. 2012;9(2):168-72. https://doi.org/10.3109/1547691X.2011.642419 [ Links ]
34. Jin L, Sturgis EM, Zhang J, Huang Z, Song X, Li C, et al. Association of tumor necrosis factor-alpha promoter variants with risk of HPV-associated oral squamous cell carcinoma. Mol Cancer. 2013;12:80. https://doi.org/10.1186/1476-4598-12-80 [ Links ]
35. Wadström H, Frisell T, Sparén P, Askling J; ARTIS study group. Do RA or TNF inhibitors increase the risk of cervical neoplasia or of recurrence of previous neoplasia? A nationwide study from Sweden. Ann Rheum Dis. 2016;75(7):1272-8. https://doi.org/10.1136/annrheumdis-2015-208263 [ Links ]
36. Kane S, Khatibi B, Reddy D. Higher incidence of abnormal Pap smears in women with inflammatory bowel disease. Am J Gastroenterol. 2008;103(3):631-636. https://doi.org/10.1111/j.1572-0241.2007.01582.x [ Links ]
37. Magro F, Peyrin-Biroulet L, Sokol H, Aldeger X, Costa A, Higgins PD, et al. Extra-intestinal malignancies in inflammatory bowel disease: results of the 3rd ECCO Pathogenesis Scientific Workshop (III). J Crohns Colitis. 2014;8(1):31-44. https://doi.org/10.1016/j.crohns.2013.04.006 [ Links ]
38. Beaugerie L. Inflammatory bowel disease therapies and cancer risk: where are we and where are we going? Gut. 2012;61(4):476-483. https://doi.org/10.1136/gutjnl-2011-301133 [ Links ]
39. Lichtenstein GR, Feagan BG, Cohen RD, Salzberg BA, Diamond RH, Chen DM, et al. Serious infections and mortality in association with therapies for Crohn›s disease: TREAT registry. Clin Gastroenterol Hepatol. 2006;4(5):621-630. https://doi.org/10.1016/j.cgh.2006.03.002 [ Links ]
40. Colombel J, Prantera C, Rutgeerts PJ, Panes J, Fleig WE, D›Haens G, et al. No new safety signals identified in Crohn›s disease patients treated with infliximab in an interim review of the ENCORE registry. Gastroenterology. 2008;134:A-472. https://doi.org/10.1016/S0016-5085(08)62209-X [ Links ]
41. Rahier JF, Ben-Horin S, Chowers Y, Conlon C, De Munter P, D›Haens G, et al. European evidence-based consensus on the prevention, diagnosis and management of opportunistic infections in inflammatory bowel disease. J Crohns Colitis. 2009;3(2):47-91. https://doi.org/10.1016/j.crohns.2009.02.010 [ Links ]
42. Gaidos JKJ, Bickston SJ. HPV infection and vaccination in patients with inflammatory bowel disease. Pract Gastroenterol. 2012;36(10):27-31. [ Links ]
43. Petrosky E, Bocchini JA, Hariri S, Chesson H, Curtis CR, Saraiya M, et al. Use of 9-valent human papillomavirus (HPV) vaccine: updated HPV vaccination recommendations of the advisory committee on immunization practices. MMWR Morb Mortal Wkly Rep. 2015;64(11):300-304. [ Links ]
44. Panther LA, Wagner K, Proper J, Fugelso DK, Chatis PA, Weeden W, et al. High resolution anoscopy findings for men who have sex with men: inaccuracy of anal cytology as a predictor of histologic high-grade anal intraepithelial neoplasia and the impact of HIV serostatus. Clin Infect Dis. 2004;38(10):1490-1492. https://doi.org/10.1086/383574 [ Links ]
45. Camus M, Lesage AC, Fléjou JF, Hoyeau N, Atienza P, Etienney I. Which lesions should be biopsied during high-resolution anoscopy? Prospective descriptive study of simple morphological criteria. J Low Genit Tract Dis. 2015;19(2):156-160. https://doi.org/10.1097/LGT.0000000000000064 [ Links ]
46. Albuquerque A. High-resolution anoscopy: Unchartered territory for gastroenterologists? World J Gastrointest Endosc. 2015;7(13):1083-1087. https://doi.org/10.4253/wjge.v7.i13.1083 [ Links ]
47. Rahier JF, Magro F, Abreu C, Armuzzi A, Ben-Horin S, Chowers Y, et al. Second European evidence-based consensus on the prevention, diagnosis and management of opportunistic infections in inflammatory bowel disease. J Crohns Colitis. 2014;8(6):443-68. https://doi.org/10.1016/j.crohns.2013.12.013 [ Links ]
Citación: Márquez JR, González PS, Miranda C, Muñoz M, Miranda-Ruiz LF. Uso de la anoscopia de alta resolución para la detección de displasia anal por papilomavirus en pacientes con enfermedad inflamatoria intestinal. Revista. colomb. Gastroenterol. 2023;38(4):419-429. https://doi.org/10.22516/25007440.1048
Recibido: 16 de Marzo de 2023; Aprobado: 24 de Agosto de 2023











 texto en
texto en