Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista colombiana de Gastroenterología
Print version ISSN 0120-9957On-line version ISSN 2500-7440
Rev. colomb. Gastroenterol. vol.38 no.4 Bogotá Oct./Dec. 2023 Epub Feb 26, 2024
https://doi.org/10.22516/25007440.971
Reporte de casos
Hipocalcemia grave como manifestación atípica de enfermedad celíaca seronegativa en un paciente con lupus eritematoso sistémico: reporte de un caso
1 Departamento de Medicina Interna, Facultad de Medicina, Universidad Libre de Colombia, Seccional Cali. Cali, Colombia.
2 Departamento de Gastroenterología, Clínica Farallones. Cali, Colombia.
3 Coordinadora de la especialización en Patología, Universidad ICESI, Fundación Valle de Lili. Cali, Colombia.
Objetivo:
Describir la presentación clínica y diagnóstico de un episodio de hipocalcemia grave en un paciente con lupus eritematoso sistémico (LES) en remisión, con diarrea crónica que condujo al diagnóstico de enfermedad celíaca (EC).
Presentación del caso:
Paciente de 22 años, con diagnóstico de LES a los 10 años, en remisión. Consultó por 2 meses de evolución de parestesias, espasmos musculares, mialgias y episodios de tetania en la semana previa, asociado a diarrea posprandial malabsortiva. Sus laboratorios mostraron hipocalcemia grave, déficit de vitamina D, hipomagnesemia grave e hipopotasemia leve. En el estudio para EC la serología reportó antitransglutaminasa tisular IgA, antigliadina IgA e IgG normales y niveles de IgA total bajos. La enteroscopia evidenció bulboduodenitis erosiva, con atrofia de las vellosidades y aumento de linfocitos intraepiteliales en la patología, que junto al estudio inmunohistoquímico permitieron concluir el diagnóstico de EC, tipo Marsh 3a. Se inició el manejo con una dieta libre de gluten, con una respuesta clínica positiva.
Conclusión:
La EC debe sospecharse en pacientes con LES que inicien con diarrea, dolor abdominal, náuseas/vómitos, aftosis oral recurrente y anemia. En los casos de EC seronegativa, los cuales son poco comunes, se deben descartar otras causas de atrofia de las vellosidades principalmente infecciosas, tóxicas e inmunitarias. Existe una asociación entre EC y LES, por lo cual el diagnóstico debe ser precoz y oportuno con el mejor esquema de pruebas disponible para lograr realizar un tratamiento efectivo antes de que se presenten las complicaciones.
Palabras clave: Enfermedad celíaca; lupus eritematoso sistémico; hipocalcemia; diarrea; tetania
Aim:
To describe the clinical picture and diagnosis of an episode of severe hypocalcemia in a patient with systemic lupus erythematosus (SLE) in remission, with chronic diarrhea that led to the diagnosis of celiac disease (CD).
Case presentation:
22-year-old patient, diagnosed with SLE at age 10, in remission. He consulted for a two-month history of paresthesias, muscle spasms, myalgias, and episodes of tetany in the previous week, associated with malabsorptive postprandial diarrhea. His laboratory tests showed severe hypocalcemia, vitamin D deficiency, severe hypomagnesemia, and mild hypokalemia. In the study for CD, serology reported normal anti-tissue transglutaminase IgA, antigliadin IgA, and IgG and low total IgA levels. Enteroscopy revealed erosive bulbo-duodenitis, with villous atrophy and increased intraepithelial lymphocytes in the pathology, which, together with the immunohistochemical study, allowed the diagnosis of CD, Marsh 3a type. Management was initiated with a gluten-free diet, with a positive clinical response.
Conclusion:
CD should be suspected in patients with SLE who present with diarrhea, abdominal pain, nausea/vomiting, recurrent oral aphthosis, and anemia. In rare seronegative CD cases, other causes of villous atrophy, mainly infectious, toxic, and immunological, must be ruled out. There is an association between CD and SLE, so diagnosis must be early and timely with the best testing scheme available to achieve effective treatment before complications occur.
Keywords: Celiac disease; systemic lupus erythematosus; hypocalcemia; diarrhea; tetany
Introducción
La enfermedad celíaca (EC) es una enteropatía crónica del intestino delgado inmunomediada por la exposición al gluten en la dieta. A nivel mundial, se ha reportado un aumento anual del 7,5% debido a un mayor reconocimiento de la enfermedad, métodos de cribado y mejoría en las técnicas de diagnóstico1. Su presentación es variada con signos y síntomas tanto gastrointestinales como extraintestinales, y la forma no clásica es la más común en más de la mitad de los casos, lo cual hace un reto su exploración2. Existe una asociación entre la EC y las enfermedades autoinmunes, las más comunes son la diabetes mellitus tipo I, la tiroiditis y la hepatitis autoinmune3. Se ha observado cómo los pacientes con lupus eritematoso sistémico (LES) tienen una prevalencia cuatro veces mayor que la población general y comparte la predisposición a ciertos genotipos específicos (DQ2, DQ8, B8 y DR3) y a factores ambientales4,5.
Según lo expresado, la EC tiene diversas formas de presentación clínica y puede ocurrir en coexistencia con enfermedades reumáticas autoinmunes sistémicas. En este caso, se describe el cuadro de una paciente con LES en remisión, en el que el estudio de una diarrea crónica llevó al diagnóstico de EC y se obtuvo una buena respuesta a la suspensión del gluten de la dieta.
Presentación del caso
Presentamos el caso de una paciente de 22 años, procedente del área urbana, estudiante de psicología, con historia de diagnóstico de LES a los 10 años, quien presentó manifestaciones cutáneas, hematológicas, inmunológicas y neuropsiquiátricas; se encontraba en remisión clínica bajo un seguimiento de reumatología de manera ambulatoria y en manejo con ciclosporina, rituximab y metilprednisolona oral. Previamente, presentó intolerancia a la hidroxicloroquina y eventos adversos con la azatioprina. Por otro lado, hace 7 años se atribuyó un cuadro de diarrea al uso de micofenolato mofetilo y se realizó una colonoscopia en ese momento más una biopsia que reportó ileítis y colitis con linfocitosis intraepitelial. A pesar de que el medicamento se suspendió en su momento, continuó presentando deposiciones diarreicas, de características malabsortivas, por lo que se diagnosticó síndrome de intestino irritable con predominio de diarrea, sin respuesta al manejo convencional.
Además, en los últimos años se había documentado una deficiencia de vitamina B12 y anemia ferropénica. Consultó al servicio de urgencias por un cuadro clínico de 2 meses de evolución de parestesias generalizadas, espasmos musculares, mialgias y episodios de tetania en la semana previa. En el ingreso al servicio de urgencias persistía con diarrea posprandial, de 5 a 6 deposiciones al día. En su evaluación inicial se encontraba en malas condiciones generales (estable hemodinámicamente, sin deshidratación, ansiosa, palidez mucocutánea, rigidez generalizada, signo de Trousseau y Chvostek positivo) y fue trasladada a la unidad de cuidados intensivos (UCI) para su monitorización y manejo.
Los laboratorios de su ingreso evidenciaron una hipocalcemia grave: calcio iónico de 0,6 mmol/L (rango normal (RN), 1,15-1,33 mmol/L) y sérico de 5,4 mg/dL (RN, 8,6-10 mg/dL), albúmina de 4 g/dL (RN, 3,5-5,2 g/dL), hormona paratiroidea normal: 25 pg/mL (RN, 10-65 pg/mL), déficit de vitamina D: 18,8 ng/mL (RN, >30 ng/mL), hipomagnesemia grave: 0,59 mEq/L (RN, 1,59-2,56 mg/dL), hipopotasemia leve: 3,1 mmol/L (RN, 3,5-5,5 mmol/L), por lo que se inició la reposición endovenosa de calcio, magnesio y potasio.
Cuatro meses antes se había realizado una endoscopia digestiva superior que se reportó como normal, con Helicobacter pylori negativo. Ante esto se consideró la posibilidad de que la diarrea crónica fuera una manifestación de actividad del LES, por lo que se realizó una enterorresonancia para evaluar un posible compromiso, extensión y localización; sin embargo se reportó dentro de la normalidad, y en los laboratorios no se evidenció el consumo de complemento sérico (C3,C4), los anticuerpos anti-ADN de doble cadena fueron negativos y no se encontró sedimento urinario activo, ni hallazgos distintos a la anemia en el hemograma que sugirieran actividad del LES dada por calculadoras de clinimetría como SLEDAI-2K e índice usualmente alto en complicaciones como vasculitis o enteritis lúpica, por lo cual se descartó estos últimos diagnósticos y la actividad de la enfermedad de base.
Igualmente, se descartaron exposiciones a tóxicos y causas infecciosas como virales, bacterianas, parasitarias, así como el virus de la inmunodeficiencia humana (VIH) e infección por Clostridium difficile, Giardia lamblia, entre otras. Se planteó entonces el diagnóstico diferencial entre EC con otras causas de malabsorción como pancreatitis crónica y enfermedad de Crohn. Por la sospecha diagnóstica se solicitaron los siguientes estudios serológicos: anticuerpos antitransglutaminasa tisular IgA (0,2 U/mL, RN <10 U/mL), antigliadina IgA (<0,1 U/mL, RN <20 U/mL) e IgG (<0,5 U/mL, RN <20 U/mL), con valores dentro de la normalidad y niveles bajos de IgA total (0,02 g/Lm RN: 0,7-4 g/L); la enteroscopia no encontró alteraciones pancreáticas, pero mostró bulboduodenitis erosiva, con atrofia de vellosidades y un aumento de linfocitos intraepiteliales en la biopsia bulboduodenal y distal que, junto con el estudio inmunohistoquímico, permitieron concluir el diagnóstico de EC tipo Marsh 3a (Figuras 1 y 2).
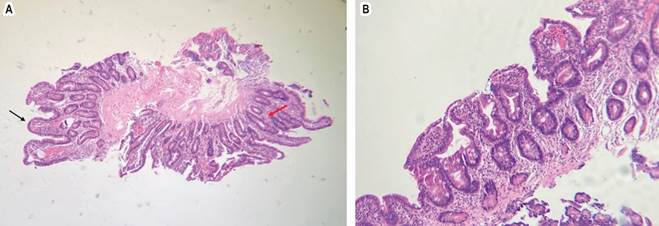
Fuente: archivo de los autores.
Figura 1 H-E x100. A. Se observa ensanchamiento y aplanamiento moderado de algunas vellosidades (flecha negra). En otras áreas presenta vellosidades conservadas, pero con hiperplasia de las criptas (flecha roja). B. Se observa atrofia moderada de las vellosidades.
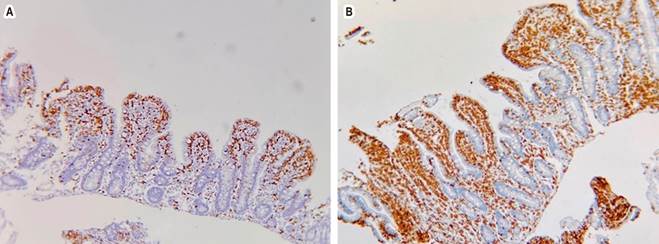
Fuente: archivo de los autores.
Figura 2 Estudio inmunohistoquímico con CD3 (A) y CD8 (B). Se observa un aumento de linfocitos intraepiteliales con más de 40 x 100 células.
Este se reafirmó con la respuesta clínica positiva al manejo con dieta libre de gluten (DLG), y luego de 15 días después del egreso se logró el control de la sintomatología gastrointestinal, muscular y la corrección de las deficiencias nutricionales. El LES, por su parte, permaneció en remisión continua.
Discusión
Los pacientes con LES pueden presentar manifestaciones gastrointestinales, y son más frecuentes las náuseas y el vómito (53%), seguido de anorexia (49%) y dolor abdominal (19%)6. No obstante, dentro del diagnóstico diferencial de dolor abdominal y diarrea de características clínicas malabsortivas se deberían considerar insuficiencia pancreática exocrina, sobrecrecimiento bacteriano en el intestino delgado, enfermedad hepática y la EC6; esta última comparte una naturaleza autoinmune con el LES, pero a pesar de esto su coexistencia sigue siendo rara7.
En la EC, la malabsorción intestinal puede manifestarse con pérdida de peso, hipoproteinemia, osteoporosis precoz, deficiencia de vitaminas liposolubles y minerales, ferropenia y deficiencia de vitamina B12 como en la paciente del caso8. Puede encontrarse hipocalcemia grave y tetania en alrededor del 10%9. El mecanismo de hipocalcemia en la EC es complejo y multifactorial, el cual depende de la pérdida de superficie vellosa producto de la atrofia de vellosidades, la malabsorción de ácidos grasos, el deterioro de los mecanismos de transporte del calcio intestinal por deficiencia de calbindina en los enterocitos, deterioro en la absorción del calcio por déficit de vitamina D e hipomagnesemia secundaria a malabsorción, con la consecuente alteración de la hormona paratiroides tanto en su producción como en su función, lo que lleva, a su vez, a exacerbar aún más el cuadro de hipocalcemia10.
En el diagnóstico de la EC, las pruebas serológicas deben realizarse siempre con ingesta de gluten y deben incluir niveles séricos de IgA total, dado que el déficit de esta inmunoglobulina puede dar resultados falsos negativos. En caso de suceder, los anticuerpos IgG antipéptido deaminado de gliadina o antitransglutaminasa de tipo IgG podrían ser de utilidad; sin embargo, suelen también ser negativos3. Los hallazgos endoscópicos en este último contexto cobran especial importancia. La esofagogastroduodenoscopia puede revelar cambios en la mucosa: atrofia de vellosidades, áreas de mucosa cuarteada, patrón en mosaico, entre otros, que pueden ser tan sutiles para pasar inadvertidos; por esta razón, se recomienda su exploración aunque el aspecto de la mucosa sea normal2.
La EC seronegativa, a pesar de ser rara, es la causa más común de atrofia de vellosidades seronegativa (AVSN), lo que representa el 31% al 45% en cohortes de pacientes con anticuerpos negativos2,11,12. En este subtipo de pacientes es necesario considerar otras causas menos frecuentes como infecciones hasta en el 27%, usualmente Giardia, pero también Helicobacter pylori, VIH, tuberculosis; trastornos autoinmunes como tiroiditis de Hashimoto, enfermedad de Crohn, síndrome de Sjögren, colangitis biliar primaria; enteropatía por fármacos, especialmente antiinflamatorios no esteroideos (AINE) e inhibidores de angiotensina II. Existen particularidades en esta población, la EC seronegativa se presenta en mujeres más tarde en la vida, hacia los 50 años, en etnia de raza blanca (en raza no blanca hasta dos tercios de las atrofias de vellosidades son de causa infecciosa)11,12; además, en la inmunohistoquímica de todos los pacientes con AVSN hay tinción positiva para linfocitos intraepiteliales citotóxicos T-CD8, sin embargo, la tinción positiva para T-CD4 se documenta en pacientes con causa de AVSN no EC que pueden imitar una EC refractaria11.
La AVSN que se expone en este caso se presentó en una mujer mucho más joven de lo reportado en la EC seronegativa, de etnia mestiza; no obstante, tenía el patrón típico en la inmunohistoquímica, con tinción positiva para T-CD8 y negativa para T-CD4. En la AVSN, el examen histopatológico de la biopsia duodenal con muestreo múltiple surge entonces actualmente como la prueba más concluyente para la presencia de EC y, junto con la respuesta a la DLG, brindan como en la paciente del caso un diagnóstico confiable2. Aziz y colaboradores demostraron que, en la EC seronegativa, la supervivencia es menor comparada con la EC seropositiva en un seguimiento a 14 años, la malabsorción es usual y se relacionan más con la presencia de otras enfermedades autoinmunes coexistentes; por consiguiente, requieren un estudio más amplio y un seguimiento más estrecho11. En este grupo puntual de pacientes, los reportes de hipocalcemia grave no son conocidos y es una particularidad del caso que se describe.
En pacientes con LES se ha encontrado que los anticuerpos antigliadina son los más frecuentes, sensibles y específicos13,14. No obstante, se debe considerar, por un lado, que como lo informaron Zidouni y colaboradores15 no todos los casos de LES y EC son seropositivos; en el otro extremo, Rensch y colaboradores13 estudiaron 103 pacientes con LES, 24 fueron positivos para anticuerpos antigliadina, pero no se encontró evidencia endoscópica ni histológica de EC, lo cual sugiere que en el LES hay una hiperexpresión de anticuerpos antigliadina, son falsos positivos en el 23% y no están asociados en realidad con la EC. Con lo comentado, teniendo en cuenta que en los estudios se ha estimado una prevalencia de EC del 3% en poblaciones de pacientes con LES, 5 veces más alta que en la población general, independiente de la seropositividad, es indispensable valerse de los hallazgos endoscópicos, histológicos, el HLA-DQ2/DQ8 y la respuesta a la suspensión del gluten para realizar un diagnóstico fiable de EC. El LES se puede manifestar antes o después de la EC, con un margen promedio de 5 años con diarrea, dolor abdominal, náuseas/vómitos, aftosis oral recurrente y anemia, que deben tomarse como signos y síntomas con los que se debe sospechar esta asociación14.
Conclusión
Los casos de EC seronegativa no son comunes y requieren un estudio completo de otras entidades que pueden generar AVSN en población no blanca, principalmente infecciosas, pero también tóxicas e inmunes. Su menor supervivencia, mayor asociación con otras enfermedades autoinmunes y con malabsorción hacen imperioso un seguimiento estrecho que evite complicaciones tan graves como la hipocalcemia que se reporta. La EC debe sospecharse en pacientes con LES que inicien con diarrea, dolor abdominal, náuseas/vómitos, aftosis oral recurrente y anemia. Para su estudio, se debe recurrir al estudio endoscópico, histológico y evaluar la respuesta a la suspensión del gluten, dada la probabilidad de falsos positivos y negativos con anticuerpos como antigliadina. Debido al buen pronóstico con el tratamiento, un diagnóstico precoz puede mejorar la calidad de vida y disminuir la morbilidad.
Agradecimientos
Ninguno declarado por los autores.
REFERENCIAS
1. King JA, Jeong J, Underwood FE, Quan J, Panaccione N, Windsor JW, et al. Incidence of Celiac Disease Is Increasing Over Time: A Systematic Review and Meta-analysis. Am J Gastroenterol. 2020;115(4):507-25. https://doi.org/10.14309/ajg.0000000000000523 [ Links ]
2. Caio G, Volta U, Sapone A, Leffler DA, De Giorgio R, Catassi C, et al. Celiac disease: a comprehensive current review. BMC Med. 2019;17(1):1-20. https://doi.org/10.1186/s12916-019-1380-z [ Links ]
3. Rubin JE, Crowe SE. Celiac disease. Ann Intern Med. 2020;172(1):ITC1-16. https://doi.org/10.7326/AITC202001070 [ Links ]
4. Dahan S, Shor DBA, Comaneshter D, Tekes-Manova D, Shovman O, Amital H, et al. All disease begins in the gut: Celiac disease co-existence with SLE. Autoimmun Rev. 2016;15(8):848-53. https://doi.org/10.1016/j.autrev.2016.06.003 [ Links ]
5. Courtney PA, Patterson RN, Lee RJE, McMillan SA. Systemic lupus erythematosus and coeliac disease. Lupus. 2004;13(3):214. https://doi.org/10.1191/0961203304lu512xx [ Links ]
6. Ebert EC, Hagspiel KD. Gastrointestinal and hepatic manifestations of systemic lupus erythematosus. J Clin Gastroenterol. 2011;45(5):436-41. https://doi.org/10.1097/MCG.0b013e31820f81b8 [ Links ]
7. Tian XP, Zhang X. Gastrointestinal involvement in systemic lupus erythematosus: insight into pathogenesis, diagnosis and treatment. World J Gastroenterol. 2010;16(24):2971-7. https://doi.org/10.3748/wjg.v16.i24.2971 [ Links ]
8. Mooney PD, Hadjivassiliou M, Sanders DS. Coeliac disease. BMJ. 2014;348:g1561. https://doi.org/10.1136/bmj.g1561 [ Links ]
9. Ross JR, Gibb SP, Hoffman DE, Clerkin EP, Dotter WE, Hurxthal LM. Gluten Enteropathy and Skeletal Disease. JAMA. 1966;196(3):270-4. https://doi.org/10.1001/jama.1966.03100160120035 [ Links ]
10. Staun M, Jarnum S. Measurement of the 10,000-molecular weight calcium-binding protein in small-intestinal biopsy specimens from patients with malabsorption syndromes. Scand J Gastroenterol. 1988;23(7):827-32. https://doi.org/10.3109/00365528809090768 [ Links ]
11. Aziz I, Peerally MF, Barnes JH, Kandasamy V, Whiteley JC, Partridge D, et al. The clinical and phenotypical assessment of seronegative villous atrophy; a prospective UK centre experience evaluating 200 adult cases over a 15-year period (2000-2015). Gut. 2017;66(9):1563-72. https://doi.org/10.1136/gutjnl-2016-312271 [ Links ]
12. Volta U, Caio G, Boschetti E, Giancola F, Rhoden KJ, Ruggeri E, et al. Seronegative celiac disease: shedding light on an obscure clinical entity. Dig Liver Dis. 2017;48(9):1018-22. https://doi.org/10.1016/j.dld.2016.05.024 [ Links ]
13. Rensch MJ, Szyjkowski R, Shaffer RT, Fink S, Kopecky C, Grissmer L, et al. The prevalence of celiac disease autoantibodies in patients with systemic lupus erythematosus. Am J Gastroenterol. 2001;96(4):1113-5. https://doi.org/10.1111/j.1572-0241.2001.03753.x [ Links ]
14. Soltani Z, Baghdadi A, Nejadhosseinian M, Faezi ST, Shahbazkhani B, Mousavi SA, et al. Celiac disease in patients with systemic lupus erythematosus. Reumatologia. 2021;59(2):85-9. https://doi.org/10.5114/reum.2021.105416 [ Links ]
15. Zitouni M, Daoud W, Kallel M, Makni S. Association entre lupus érythémateux systémique et maladie coeliaque: cinq cas. Revue du rhumatisme. 2004;71(7):630-32. https://doi.org/10.1016/S1169-8330(03)00392-2 [ Links ]
Citación: Mejía-Cardona AF, Rivera-Martínez WA, Suárez-Correa J, Escobar-Stein J. Hipocalcemia grave como manifestación atípica de enfermedad celíaca seronegativa en un paciente con lupus eritematoso sistémico: reporte de un caso. Revista. colomb. Gastroenterol. 2023;38(4):529-533. https://doi.org/10.22516/25007440.971
Consideraciones éticas Este artículo fue elaborado después de obtener el consentimiento informado del paciente para tratar y divulgar su historial médico con fines científicos y académicos.
Recibido: 21 de Septiembre de 2022; Aprobado: 26 de Mayo de 2023











 text in
text in 



