Introducción
Los cánceres de colon y gástrico hacen parte de los seis cánceres más comunes y con mayor mortalidad en el mundo1. En Colombia, el cáncer gástrico (CG) para el 2020 fue el tercero en incidencia después del de mama y pulmón, y el primero en mortalidad. El cáncer colorrectal (CCR) fue el cuarto en incidencia y mortalidad para este mismo año2.
La tasa de supervivencia relativa a 5 años para el CCR es del 65% en general, pero oscila entre el 72% y el 91% para los pacientes con diagnóstico de cáncer con compromiso locorregional y hasta el 15% para la enfermedad en etapa avanzada3. La tasa de supervivencia media a 5 años para el CG en Estados Unidos es del 31% y en Europa es del 26%4, mientras que se han notificado tasas de supervivencia a 5 años superiores al 65% para la enfermedad localizada, lo que subraya la importancia del diagnóstico precoz5.
Está demostrado que los estudios endoscópicos con biopsia son una herramienta eficaz para detectar lesiones preneoplásicas y neoplásicas del tracto gastrointestinal superior e inferior6,7. La polipectomía puede reducir casi un 30% la incidencia de la mortalidad global por CCR (cáncer de colon: 29%-37%, cáncer de recto: 27%, respectivamente)6.
Los términos cáncer posendoscopia o poscolonoscopia, perdido o de intervalo se han utilizado indiscriminadamente para describir cánceres del tracto gastrointestinal que se diagnostican durante el intervalo entre un estudio endoscópico informado como normal y el posterior examen fijado como de seguimiento8-10.
Múltiples estudios han buscado la causa de este evento. La importancia de identificar el CCR y el CG posendoscopia es que se han reconocido como marcadores de calidad de la endoscopia11 y colonoscopia12. Se ha establecido que mejorar la calidad de la colonoscopia puede reducir la prevalencia del cáncer o resultar en una detección más temprana del cáncer en más del 50% de los casos13. En 2014, Singh y colaboradores publicaron un metaanálisis que describía una prevalencia de 3,7% del cáncer colorrectal poscolonoscopia (CCRPC)14. Hasta la fecha, poco se ha explorado sobre las implicaciones de la calidad de la endoscopia digestiva superior. Estudios han descrito prevalencias entre el 25,8% y el 0,2% de cáncer gástrico posendoscopia (CGPE); sin embargo, se sabe poco sobre sus características, incidencia y causas15.
Para comparar estas neoplasias se hace un símil a lo realizado en Vidas paralelas por el escritor griego Plutarco16, autor de uno de los estudios biográficos pioneros de la historia. Escrita entre los años 96 d. C. y 117 d. C., la obra se caracteriza principalmente por su particular estructura, al tomar a dos personajes, uno griego y otro romano, relacionados a través de una dedicación o característica que Plutarco consideraba definitoria, y relatar sus vidas en detalle comparando a ambas figuras al final. Pretendemos en este estudio hacer un paralelo entre el cáncer colorrectal y gástrico posendoscopia en los siguientes términos: 1) describir las características demográficas, clínicas y hallazgos endoscópicos de dos cohortes, una con CGPE y uno con cáncer de CCRPC; 2) determinar la tasa de CGPE y CCRPC; 3) comparar los hallazgos demográficos, clínicos, de histología y endoscópicos entre los dos grupos estudiados, y 4) determinar la supervivencia de los pacientes con CGPE y CCRPC y compararla con los otros cánceres gástricos y de colon y recto sin estudios endoscópicos previos negativos para neoplasia.
Pacientes y métodos
A partir de la consulta de cirugía oncológica gastrointestinal de tres centros de cuarto nivel del área metropolitana de la ciudad de Medellín, Colombia, se recolectaron los casos de CG y CCR posendoscopia y colonoscopia entre los años 2012 y 2021.
Recolección y manejo de los datos
Con base en esta información, se hace la comparación entre dos cohortes de pacientes cuyos datos son manejados de forma ambispectiva; una cohorte de CGPE y otra de CCRPC entre 2012 y 2021. En estas cohortes se analizaron a los pacientes que tuvieron un diagnóstico de CG o CCR en el intervalo de 6 meses a 3 años después de un estudio endoscópico sin hallazgo de neoplasia. En este estudio se comparan las dos cohortes según características demográficas (edad, sexo), aspectos clínicos, endoscópicos, grado de diferenciación, etapa tumoral (la cual se determinó en los respectivos estudios según la décima edición del sistema cTNM del Comité Conjunto Estadounidense sobre el Cáncer, la supervivencia (la cual se estableció a partir de la fecha de CGPE y CCRPC y la fecha de muerte) y las posibles causas que llevaron a que no se haya detectado oportunamente (relacionadas con la calidad de la endoscopia o colonoscopia o no relacionadas).
Definiciones
Cuando se disponía de más de una endoscopia o colonoscopia por paciente, se consideró para el análisis la exploración más reciente. El periodo para los cánceres perdidos se definió como 36 meses desde la última endoscopia o colonoscopia negativa. La tasa de cánceres perdidos se calculó dividiendo el número de cánceres perdidos por la suma del número de cánceres perdidos más el número total de cánceres diagnosticados que cumplieron con los criterios de inclusión durante el periodo de estudio, según lo sugerido por la Organización Mundial de Endoscopia (OME).
El tiempo de supervivencia global se definió como el periodo entre la fecha de muerte independientemente de la causa, y la fecha de la endoscopia o colonoscopia cuando se diagnosticó histológicamente el cáncer, según se obtuvo del informe de endoscopia; es decir, la segunda endoscopia o colonoscopia en los casos de CGPE o CCRPC.
Criterios de inclusión y exclusión
El principal criterio de inclusión fue el hallazgo de pacientes con diagnóstico histopatológico de adenocarcinoma gástrico o colorrectal, realizado durante el periodo de estudio, y contar con un año de seguimiento. Se incluyó a los pacientes con antecedentes de cirugías previas (colectomías o gastrectomías) o las personas diagnosticadas con CCR o CG en una institución externa y remitidas para su manejo a las instituciones del estudio. Se excluyó a los pacientes cuyos cánceres gástricos (6 pacientes) o colorrectales (4 pacientes) fueran diagnosticados por imágenes, a los pacientes con antecedentes de síndrome de poliposis adenomatosa familiar que invariablemente los llevará a CCR (3 pacientes) y a pacientes con enfermedad inflamatoria intestinal (2 pacientes con enfermedad de Crohn y 9 pacientes con colitis ulcerativa).
Análisis estadístico
La media, la desviación estándar, la mediana y el rango se calcularon para las variables continuas, los conteos de frecuencia y los porcentajes para los datos categóricos. Se calcularon los intervalos de confianza (IC) del 95% para las proporciones mediante el método de Wilson. Los datos fueron analizados con métodos paramétricos para datos continuos normalmente distribuidos (prueba t) y métodos no paramétricos (prueba U de Mann-Whitney) para distribuciones continuas no distribuidas normalmente.
Para los datos categóricos se utilizaron las pruebas exactas de chi cuadrado y Fisher. Con el fin de disminuir el riesgo de error de tipo I, solo se incluyeron en el análisis aquellas variables previamente informadas como factores de riesgo para el cáncer gástrico de intervalo (CGI) o con una relación fisiopatológica plausible con CGI.
Las probabilidades de supervivencia a uno y dos años se calcularon para CGI y adenocarcinoma gástrico sin intervalo mediante el método de Kaplan-Meier. La prueba de Log-Rank se utilizó para evaluar las diferencias de supervivencia global. Todos los análisis fueron bilaterales (de dos colas) y los valores p inferiores a 0,05 se consideraron significativos. Todos los cálculos estadísticos se realizaron en la institución promotora con el software IBM SPSS versión 24.
Consideraciones éticas
Todos los procedimientos se ajustaron a las normas éticas del comité responsable de la experimentación humana (institucional y nacional) y a la Declaración de Helsinki de 1964 y versiones posteriores. Se protegió la confidencialidad de los datos. Los autores declaran que este artículo no contiene información personal que permita identificar a los pacientes. Se compararon datos ya analizados de dos estudios, que en su momento fueron obtenidos de una fuente secundaria sin ninguna intervención sobre los pacientes, por lo que no requiere consentimiento informado.
Resultados
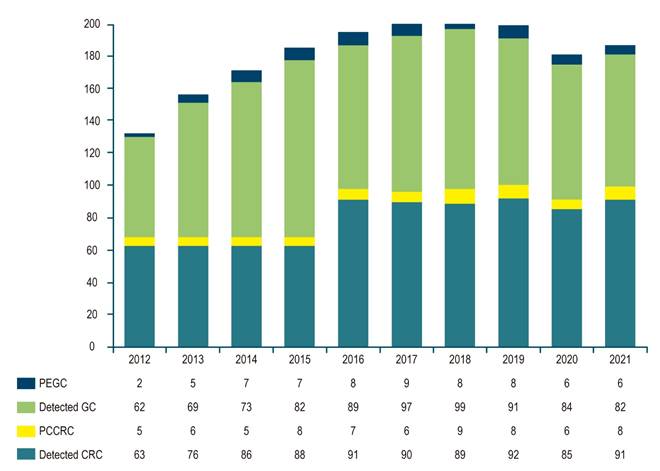
En total se comparó a 128 pacientes entre las dos cohortes, 66 pacientes con CGPE que corresponden a una tasa del 7,3% de los pacientes evaluados (828 con cáncer gástrico en 10 años evaluados) y 68 pacientes con CCRPC, correspondientes a una tasa de 6,9% de los pacientes con CCR evaluados (919 con cáncer colorrectal en 10 años evaluados) (Figura 1).
Elaborada por los autores.
Figura 1 Cantidad de casos detectados de CG/CGPE y CCR/CCRPC entre 2012 y 2021.
Aspectos demográficos
La mediana de la edad fue de 74 años en el grupo de CCRPC y de 66 años en el grupo de CGPE. Los pacientes con cánceres poscolonoscopia presentaron una mediana de edad mayor (8 años mayores) que los pacientes de la cohorte con cánceres posendoscopia (74 frente a 66 años), diferencia significativa en el análisis con la t de Student (p = 0,0012).
La distribución por sexo muestra un predominio de los hombres para el CGPE (69% frente a 31%), mientras en el CCRPC no se encontraron diferencias de acuerdo con el sexo (53% frente a 47%). Se conserva el predominio en hombres ya conocido en el cáncer gástrico (2:1). Las características de los dos grupos de pacientes se recogen en la Tabla 1.
Tabla 1 Características de los pacientes con CGPE y CCRPC
| Característica | CGPE (n = 66) Tasa: 7,3% (%) | CCRPC (n = 68) Tasa: 6,9% (%) | p | |
|---|---|---|---|---|
| Cáncer posendoscopia/poscolonoscopia | Sí | 66 | 68 | 0,591 |
| No | 762 | 851 | ||
| Edad en años (promedio) | 66 ± 16,6 | 74 ± 8,6 | 0,001 | |
| Edad | < 55 | 13 (19) | 9 (13) | 0,344 |
| 55-65 | 14 (21) | 10 (15) | ||
| 65-75 | 28 (43) | 28 (41) | ||
| > 75 | 11 (17) | 21 (31) | ||
| Sexo | Hombre | 46 (69) | 36 (53) | 0,09 |
| Mujer | 20 (31) | 32 (47) | ||
| Estudio por cribado | Sí | 30 (46) | 18 (26) | 0.004 |
| No | 36 (54) | 50 (74) | ||
| Lesiones premalignas | Sí | 32 (48) | 25 (37) | 0,260 |
| No | 34 (52) | 43 (63) | ||
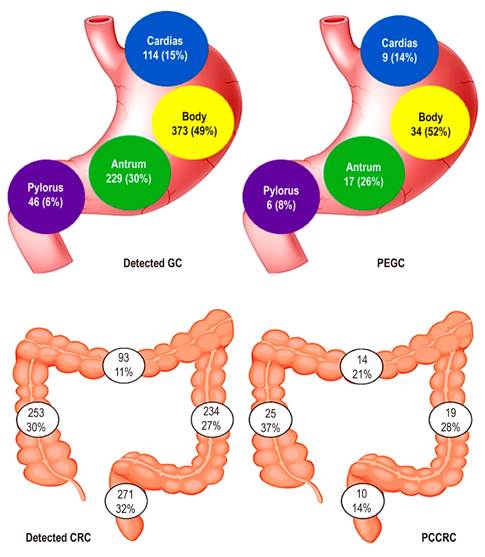
| Ubicación | Cardias-fondo: 9 (14) | Colon derecho: 25 (37) | 0,002 | |
| Cuerpo: 34 (52) | Transverso: 14 (21) | |||
| Antro: 17 (26) | Colon izq.: 19 (28) | |||
| Píloro: 6 (8) | Recto: 10 (14) | |||
| Diferenciación | Bien | 28 (42) | 50 (74) | 0,001 |
| Mal | 38 (58) | 18 (26) | ||
| Cáncer temprano | Sí | 14 (21) | 10 (15) | 0,768 |
| No | 52 (79) | 58 (85) | ||
| Estadio | 0/I | 14 (21) | 10 (15) | < 0,01 |
| II | 13(19) | 25 (37) | ||
| III | 16 (24) | 30 (44) | ||
| IV | 23 (36) | 3 (4) | ||
Tabla elaborada por los autores.
Aspectos clínicos
En la cohorte de CGPE, la indicación de la endoscopia fue más frecuentemente por síntomas de alarma como disfagia, hematemesis, melenas, emesis y síndrome constitucional (54%), mientras que en el grupo de CCRPC la indicación de la colonoscopia fue más frecuente por las manifestaciones de alarma como sangrado rectal, anemia, dolor abdominal o cambios en el hábito intestinal (74%), con una diferencia significativa (p = 0,004). En otras palabras, los estudios por cribado o tamizaje fueron más frecuentemente realizados en la cohorte con CGPE (46%) que en los pacientes con CCRPC (26%).
Aspectos endoscópicos
El hallazgo de lesiones premalignas concomitantes fue más evidente en los CGPE (48%) que en los CCRPC (37%), sin evidenciarse diferencias significativas (p = 0,260).
El tiempo medio entre la esofagogastroduodenoscopia negativa y el diagnóstico de CGI fue de 14,4 meses (rango: 2-34,6). Los hallazgos más comunes en la esofagogastroduodenoscopia negativa fueron gastritis (73%), metaplasia intestinal (36%), atrofia gástrica (45%) y úlcera gástrica (29%). 2% tuvieron una esofagogastroduodenoscopia reportada como normal. El tiempo medio entre la colonoscopia negativa y el diagnostico de CCRPC fue de 22,8 meses. La diverticulosis fue más frecuente en este grupo (41,2%) que en los pacientes con cáncer detectado en la primera colonoscopia.
Con respecto a la ubicación de las lesiones pasadas por alto en el estómago, no se encontraron diferencias al evaluarlas en su ubicación del cardias/fondo, cuerpo, antro y píloro (p = 0,925), mientras que sí se demostró un significativo compromiso tumoral proximal (colon derecho y transverso) en los CCRPC (p = 0,006) (Figura 2).
Aspectos histológicos
En los pacientes con CGPE, el grado de diferenciación histológica más frecuente fue de la variedad mal diferenciada (58%), mientras en el CCRPC fue menor (26%), diferencias estadísticamente significativas (p = 0,001) No se encontraron diferencias en los hallazgos de CG o CCR tempranos (21% frente a 19%, p = 0,768).
Estado tumoral
En el CGPE se evidenció que el 21% de los pacientes se encontraban en etapas tempranas (estadios 0 y I) comparados con el 15% en CCRPC, y se demostraron unos estados más avanzados en los pacientes con CGPE (36%) que en la cohorte con CCRPC (4%) (p < 0,001).
Análisis causal según la OME para el CCRPC
En el cáncer colorrectal poscolonoscopia se evaluó a 62 de los 68 pacientes acerca de este tema, y se encontró que el 61,3% de los casos se presentaron como consecuencia de una colonoscopia inadecuadamente realizada (Tabla 2).
Tabla 2 Análisis causal del CCRPC según la OME
| Característica | Pacientes CCRPC (%) |
|---|---|
| n | 68 |
| Lesión omitida, con colonoscopia previa adecuada | 18 (29) |
| Lesión omitida, con colonoscopia previa inadecuada | 38 (61,3) |
| Lesiones detectadas no resecadas | 0 (0) |
| Resección incompleta de lesión previamente identificada | 6 (9,7) |
Tabla elaborada por los autores.
Supervivencia
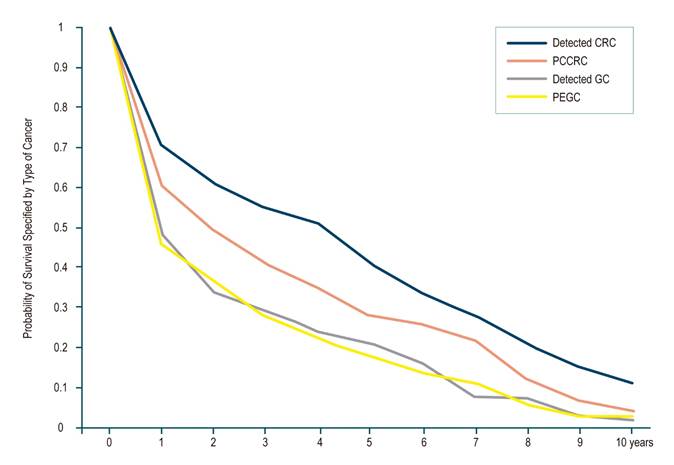
Las curvas de sobrevida de Kaplan-Meier para pacientes con CGPE y CCRPC se presentan en la Figura 3. El 72% de los pacientes tuvieron una endoscopia alta negativa menos de 2 años antes del diagnóstico de CG.
Elaborada por los autores.
Figura 3 Curva de sobrevida para los cáncer detectados versus los cánceres de intervalo.
La probabilidad de supervivencia específica del cáncer a para CCRPC fue del 73,4% a 1 año (intervalo de confianza [IC] del 95%: 72,2%-74,7%), 61% a 3 años (IC 95%: 56,3%-65,4%), 58% a 5 años (IC 95%: 54%-62%) y 55,2% a 10 años (IC 95%: 51%-60%), y es menor que en CCRD; 83,0% a 1 año (IC 95%: 82,3%-85%), 71,5% a 3 años (IC 95%: 70,3%-72,5%), 67% a 5 años (IC 95%: 65,6%-67,6%) y 63,0% a 10 años (IC 95%: 62,0%-65,3%). La sobrevida en CGPE se evaluó a 1 y 2 años y no se encontraron diferencias estadísticamente significativas con el CG detectado (Tabla 3).
Tabla 3 Supervivencia entre el CG inadvertido y el detectado
| Supervivencia a 1 año (%) | Supervivencia a 2 años (%) | Supervivencia media en meses | |
|---|---|---|---|
| CGPE | 45,7% (36,9%-61,3%) | 37,2% (30,3%-37,6%) | 12 (5,7-26) |
| CG detectado | 48,4% (44,1%-53,4%) | 34,4% (24,1%-47,7%) | 13 (11,2-15,7) |
| Global | 49,8% (45,1%-53,7%) | 36,7% (33,8%-38,2%) | 12,8 (6,1-13,7) |
Tabla elaborada por los autores.
Discusión
La endoscopia alta y la colonoscopia son fundamentales en el diagnóstico, prevención y tratamiento del CG y el CCR. Sin embargo, en el último decenio nos hemos enfrentado a la creciente evidencia de que la endoscopia alta y la colonoscopia tienen una considerable tasa de falsos negativos u omisión del CG y el CCR, como lo sugieren estudios poblacionales17,18. La posibilidad de que se pasen por alto cánceres, en el pasado y en el futuro, está presente en nuestras mentes y en las de nuestros pacientes19. Hasta la fecha, las tasas de omisión en la endoscopia alta no se han evaluado en la misma medida que la colonoscopia, y solo hasta hace 20 años se publicó el primer estudio sobre la omisión de cánceres gastrointestinales altos en poblaciones occidentales20.
Este es el primer estudio en nuestro país que evalúa y compara las tasas de omisión o de intervalo del CG y CCR posendoscopia y poscolonoscopia, en el que se tomaron como referencia dos cohortes de pacientes manejados en centros oncológicos y con diagnóstico previo de CG y CCR, respectivamente. Con base en los cálculos sugeridos por la OME, en el CGPE se encontró una tasa de 7,3%, lo que se encuentra dentro del rango de lo reportado en la literatura mundial (4,6% a 14,3%), aunque lo esperado es que esta tasa esté por debajo del 5%21. De nuevo, según lo sugerido por la OME, la tasa de CCRPC en nuestro estudio fue del 6,9%, valor que es mayor a la tasa coreana del 0,1%22, la turca del 1,8%23, o la portuguesa del 3,8%24, pero comparable al 7,9% en Suecia25, 7,9% en Hong Kong26, 7,4% en Reino Unido27 y 7,6% en Bélgica28, e inferior al 8,6% de Dinamarca29, al 9,4% de Estados Unidos30 y al 12,8% de Israel31.
Es relevante subrayar que no existe una definición unificada de CG o CCR posendoscopia o poscolonoscopia, lo que evidencia grandes diferencias entre los autores principalmente en el tiempo durante la realización de los dos estudios endoscópicos (oscila entre 3 y 5 años); ni siquiera hay uniformidad en el método de su cálculo como tasa, índice o porcentaje32. En 2018 se publicó el consenso de la OME sobre el cáncer colorrectal poscolonoscopia y posimagenología33, con el objetivo de estandarizar la terminología, identificación, análisis y notificación de este evento. La OME recomienda el término cáncer colorrectal poscolonoscopia para los cánceres que aparecen después de una colonoscopia en la que no se diagnostica cáncer, y lo subdividen en cánceres de intervalo (cuando el cáncer se identifica antes del próximo examen de detección o vigilancia recomendado) y cánceres que no son de intervalo.
El CGPE no ha mostrado en nuestra serie una ubicación anatómica preponderante, mientras que se encontró más frecuentemente en el estómago posquirúrgico10. Contrario al CGPE en el CCRPC, la ubicación de las lesiones en el lado derecho ha demostrado ser un factor de riesgo para el cáncer poscolonoscopia. En este estudio se identificó una mayor cantidad de cáncer de colon poscolonoscopia en el colon derecho, lo que se relaciona con reportes previos25,34-36, y puede estar asociado con procedimientos incompletos o a mala preparación debido a que el colon derecho es más difícil de limpiar con los agentes orales, los puntos de referencia son menos claros y es más difícil técnicamente alcanzar el colon proximal y mantener una posición adecuada del colonoscopio para las polipectomías. Se encontró, además, una relación entre el cáncer colorrectal poscolonoscopia y un diagnóstico previo de diverticulosis, también en relación con lo reportado en la literatura25,34. La enfermedad diverticular dificulta la realización de la colonoscopia por el aumento del dolor del paciente, la alteración de la mucosa de las zonas afectadas y el riesgo de confundir el tejido neoplásico con una zona de inflamación diverticular37. Estos hallazgos deben alertar a los colonoscopistas cuando realicen el estudio a pacientes de alto riesgo (enfermedad inflamatoria intestinal, síndromes polipósicos adenomatosos) y cuando valoren el colon derecho. Cuando se considera que no se ha logrado una adecuada valoración de un segmento intestinal o cuando no se ha alcanzado una intubación cecal profunda, se debe recomendar la repetición del estudio o la realización de un procedimiento diferente para descartar neoplasias no observadas durante el estudio inicial.
Con el hallazgo y comparación de las tasas de CGPE y CCRPC se pretende llamar la atención sobre un problema que, de otro modo, estaría “fuera del radar” para la mayoría de los endoscopistas y servicios de endoscopia. Existe una conciencia limitada del cáncer posendoscopia y poscolonoscopia en la práctica diaria porque es un evento relativamente raro. Además, no es fácil relacionar el cáncer con una endoscopia o colonoscopia previa porque los dos eventos están separados por meses e incluso años. La mayoría de las veces los endoscopistas o colonoscopistas desconocen un cáncer inadvertido que ocurre varios años después de estudio índice. También existe, tal vez, la complacencia de que un cáncer posendoscopia o colonoscopia es un tumor de rápido crecimiento en lugar de una lesión inadvertida o resecada de manera incompleta, o que las lesiones faltantes son algo que les sucede a otros colegas, o que es demasiado raro como para preocuparse. Por otro lado, desde la perspectiva del paciente, es muy importante porque puede significar la diferencia entre tener cáncer o no, tener o no tratamiento para un tumor en estadio avanzado, o tener un peor pronóstico por retraso en el diagnóstico. Finalmente, existen costos adicionales para el sistema de salud debido al retraso en el diagnóstico.
De forma unánime, se sabe que los cánceres posendoscopia o poscolonoscopia son en su mayoría de veces (no menos de la mitad de ellos) entidades prevenibles38. Estudios demuestran una diferencia de más de 10 veces en las tasas de CCRPC entre los colonoscopistas. Los médicos individuales con bajas tasas de ejecución de colonoscopia, detección de pólipos y resección de pólipos tenían más probabilidades de tener CCRPC28.
Los aportes que deja este estudio son, en primer lugar, que si se pueden reducir las tasas de CGPE y CCRPC, se puede reducir la incidencia de CG y CCR y mejorar el pronóstico de los pacientes diagnosticados con la enfermedad; en segundo lugar, el refuerzo de la literatura previa acerca de que la endoscopia o la colonoscopia de alta calidad reducirán las tasas de CGPE y CCRPC11,39; y en tercer lugar, la evidencia clínica con respecto a las características de estas neoplasias inadvertidas, como en el CCRPC, su ubicación proximal, la afectación de la sobrevida, y son pacientes más añosos, mientras que los pacientes con CGPE eran más jóvenes, con tumores más indiferenciados y en estados más avanzados.
Los avances recientes en el equipo de endoscopia (endoscopio de alta definición) y la técnica (imágenes de banda estrecha [NBI], cromoendoscopia, entre otros) han reducido progresivamente la tasa de cánceres gastrointestinales inadvertidos40. Otro interesante actor en este escenario es el papel de la inteligencia artificial (IA) como elemento diagnóstico de apoyo. Recientemente, la adopción de la IA redujo el riesgo de no detectar una neoplasia colorrectal en aproximadamente un 50%, en comparación con una colonoscopia estándar. Esto se debió principalmente a la disminución de la tasa de omisión de neoplasias planas de < 10 mm tanto en el colon proximal como en el distal; además, la IA puede mejorar la detección de neoplasias tempranas41,42.
Conclusiones
La tasa de cánceres inadvertidos posendoscopia o poscolonoscopia es de 7,3% y 6,9%, con diferencias entre los CGPE y los CCRPC en cuanto a la indicación del estudio (más síntomas en CCRPC), ubicaciones más proximales en CCRPC, grado de indiferenciación y estados del tumor más avanzados en CGPE y con una pobre sobrevida para el CCRPC. Luego de conocer estas tasas, es indispensable establecer medidas por las diferentes asociaciones que las impacten para lograr la meta sugerida por la OCE de mantenerlas por debajo del 5%.