Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Revista colombiana de Gastroenterología
versão impressa ISSN 0120-9957versão On-line ISSN 2500-7440
Rev. colomb. Gastroenterol. vol.39 no.1 Bogotá jan./mar. 2024 Epub 16-Maio-2024
https://doi.org/10.22516/25007440.1044
Reporte de casos
Hepatitis autoinmune seronegativa: reporte de un caso
1Specialist in Internal Medicine, Nuevo Hospital Monte España. Managua, Nicaragua.
2Specialist in Pathology, High Specialization in Gastrointestinal Pathology. Nuevo Hospital Monte España. Managua, Nicaragua.
La hepatitis autoinmune (HAI) es una enfermedad inflamatoria inmunomediada la cual requiere para su diagnóstico la integración de anomalías histológicas, hallazgos de laboratorio característicos, positividad de autoanticuerpos y exclusión de otras enfermedades hepáticas. Se presenta el caso de una paciente femenina de 28 años con un cuadro de ictericia generalizada de una semana de evolución asociado a dolor abdominal difuso e intermitente. Las pruebas hepáticas revelaron lesión hepatocelular (factor R= 17,6) con transaminasemia grave (aspartato-aminotransferasa [AST]: 1,502 UI/L, alanina-aminotransferasa [ALT]: 2,029 UI/L) e hiperbilirrubinemia conjugada (bilirrubina sérica total: 10,9 mg/dL, bilirrubina directa: 8,50 mg/dL). Las pruebas serológicas para virus hepatotropos fueron negativas, así como los autoanticuerpos para hepatitis autoinmune. La biopsia hepática percutánea reveló hallazgos compatibles de hepatitis autoinmune. Se calculó el puntaje revisado del Grupo Internacional de Hepatitis Autoinmune (IAIHG) de 1999 pretratamiento, en el que se obtuvo un puntaje de 16, por lo que se diagnosticó como HAI grave definitiva. La paciente fue manejada con esteroides orales y se obtuvo una mejoría clínica y bioquímica, por lo que fue egresada a los siete días de hospitalización, sin eventualidades. Mantener un alto índice de sospecha de HAI, a pesar de la negatividad inicial de los autoanticuerpos, y complementar el abordaje diagnóstico con biopsia hepática percutánea permite el diagnóstico y tratamiento oportuno de este grupo de pacientes, de modo que se previene la progresión a cirrosis avanzada y sus complicaciones.
Palabras clave: Hepatitis autoinmune seronegativa; biopsia hepática; autoanticuerpos; transaminasemia; lesión hepatocelular
Autoimmune hepatitis (AIH) is an immune-mediated inflammatory disease that requires the integration of histological abnormalities, characteristic laboratory findings, autoantibody positivity, and exclusion of other liver diseases for diagnosis. The case of a 28-year-old female patient with a week-long history of generalized jaundice associated with diffuse and intermittent abdominal pain is presented. Liver tests revealed hepatocellular injury (R factor = 17.6) with severe transaminitis (aspartate aminotransferase [AST]: 1.502 IU/L, alanine aminotransferase [ALT]: 2.029 IU/L) and conjugated hyperbilirubinemia (total serum bilirubin: 10.9 mg/dL, direct bilirubin: 8.50 mg/dL). Serological tests for hepatotropic viruses were negative, as were autoantibodies for autoimmune hepatitis. Percutaneous liver biopsy revealed findings compatible with autoimmune hepatitis. The revised 1999 International Autoimmune Hepatitis Group (IAIHG) score was calculated pretreatment, resulting in a score of 16, thus diagnosing it as definitive severe AIH. The patient was treated with oral steroids, obtaining clinical and biochemical improvement, so she was discharged after seven days of hospitalization without incidents. Maintaining a high index of suspicion for AIH, despite the initial negativity of autoantibodies, and complementing the diagnostic approach with percutaneous liver biopsy allow the timely diagnosis and treatment of this group of patients, thus preventing progression to advanced cirrhosis and its complications.
Keywords: Seronegative autoimmune hepatitis; liver biopsy; autoantibodies; transaminitis; hepatocellular injury
Introducción
La hepatitis autoinmune (HAI) es una enfermedad inflamatoria inmunomediada y sin elementos diagnósticos distintivos, la cual requiere la presencia de anomalías histológicas, hallazgos de laboratorio característicos, positividad de autoanticuerpos y exclusión de otras enfermedades hepáticas como hepatitis viral, enfermedades hereditarias, metabólicas y colestásicas, entre otras1,2. Múltiples factores contribuyen a la duda diagnóstica en HAI: su amplio espectro de presentaciones, ausencia de características patognomónicas y variabilidad en la respuesta al tratamiento3.
Presentación del caso
Se presenta el caso de una paciente femenina de 28 años de edad, la cual niega antecedentes patológicos personales, uso de medicamentos o hepatotóxicos, historia de consumo de alcohol u otros hábitos tóxicos, sin antecedentes familiares patológicos de enfermedades autoinmunes; con un cuadro de ictericia cutánea, mucosas y escleras de una semana de evolución, asociado a dolor abdominal difuso e intermitente. Acudió a urgencias debido a la persistencia de ictericia y aparición de prurito generalizado. Al ingreso, se observó con signos vitales normales, y en la exploración física tenía ictericia generalizada y dolor abdominal a la palpación profunda del cuadrante superior derecho, el resto del examen físico resultó sin alteraciones.
Se solicitaron exámenes iniciales de laboratorio que no revelaron anormalidades, además de las descritas en la Tabla 1. Se calculó el factor R (Fórmula: ALT del paciente/límite superior normal de ALT ¸ fosfatasa alcalina del paciente/límite superior normal de fosfatasa alcalina) para evaluar el patrón predominante de alteración de las pruebas hepáticas y se obtuvo un resultado de 17,6, sugerente de lesión hepática de tipo hepatocelular (el factor R > 5 define lesión hepatocelular, < 2: lesión colestásica, y de 2-5: patrón mixto)4. El examen general de orina (EGO) reportó urobilinógeno positivo. Los marcadores inflamatorios procalcitonina y proteína C-reactiva (PCR) fueron negativos.
Tabla 1 Pruebas hepáticas antes y después del inicio de la terapia con esteroides orales
ALT: alanina-aminotransferasa; AST: aspartato-aminotransferasa; BD: bilirrubina directa; BI: bilirrubina indirecta; BST: bilirrubina sérica total; FA: fosfatasa alcalina; GGT: γ-glutamil transferasa; IgG: inmunoglobulina G; INR: índice internacional normalizado; NR: no reportado. Tabla elaborada por los autores.
Se realizó un ultrasonido abdominal, el cual concluyó: hígado de forma y tamaño normales, sin alteraciones en la vesícula biliar o conductos biliares; en el Doppler color, los vasos intrahepáticos mostraron captación normal. Se envió un panel de virus hepatotropos: anti-HVA IgM, antígeno de superficie del VHB (HbsAg), ELISA Anti-VHC, anticuerpo antiantígeno central del VHB (anti-HBc) IGM y anti-VHE IgM, que resultaron negativos; así como un panel de virus no hepatotropos negativo (virus del herpes, varicela zóster, citomegalovirus, Epstein-Barr, todos inmunoglobulina G [IgG] e inmunoglobulina M [IgM] negativos), y una prueba rápida de virus de la inmunodeficiencia humana (VIH) de cuarta generación no reactiva. Se enviaron autoanticuerpos para hepatitis autoinmune: anticuerpos antinucleares (ANA), anticuerpos antimúsculo liso (ASMA), anticuerpos microsomales de hígado y riñón (anti-LKM1), anticuerpos anticitosol hepático (anti-LC1) y anticuerpos frente al antígeno soluble hepático (anti-SLA) negativos. Se indicó una cuantificación de IgG en valores de 4316,1 mg/dL (valor de referencia: 600-1600 mg/dL).
Se solicitó la toma de biopsia hepática percutánea con hallazgos histológicos compatibles con HAI (Figura 1): infiltrado linfoplasmocitario portal y periportal (actividad de interfase), afectación lobulillar y necrosis hepática, necrosis pericentral, sin lesión ductal y con tinción tricrómica de Masson que no reveló depósito de colágeno. Se calculó el puntaje revisado del Grupo Internacional de Hepatitis Autoinmune (IAIHG) de 1999 pretratamiento5, y se obtuvieron 16 puntos en dicha escala, por lo que se diagnosticó como HAI definitiva.
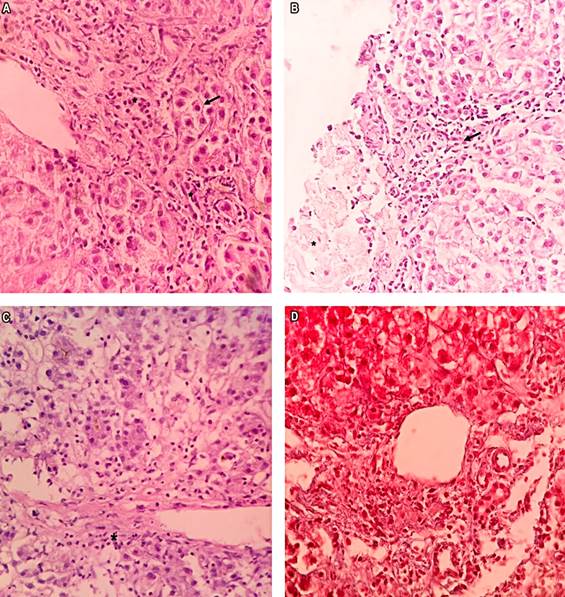
Figura 1 A. *: actividad de interfase. Flechas: hepatocitos de aspecto regenerativo (tinción hematoxilina/eosina [H/E]: 20x). B. *: necroinflamación moderada (grado 2) a nivel del lobulillo, flecha: infiltrado inflamatorio linfoplasmocitario (tinción H/E: 20x). C. *: inflamación y necrosis en torno a una vena central. Necrosis de interfase centrolobulillar (grado 1). D. Tinción tricrómica de Masson, 20x sin depósito de colágeno, estadio 0. Actividad grado I. D. Preservación de membranas basales de conductos biliares
Se inició el tratamiento de inducción según las recomendaciones de la guía clínica de la Asociación Estadounidense para el estudio de Enfermedades Hepáticas (AASLD)6, con prednisona en dosis de 60 mg/día, y se obtuvo una adecuada respuesta clínica y bioquímica, con normalización del índice internacional normalizado (INR) y reducción de los niveles de transaminasemia al tercer día de la terapia con esteroides. La paciente egresó a los siete días de hospitalización y se agregaron 50 mg de azatioprina a las 2 semanas de tratamiento. En el seguimiento a los tres meses, se encontraba asintomática y en remisión bioquímica con pruebas hepáticas y valores de IgG normales (Tabla 1).
Discusión
La HAI es una enfermedad que ocurre globalmente en todas las etnias y edades con una distribución bimodal: un pico entre los 10 y 18 años y otro entre la cuarta y la sexta décadas de la vida, y predomina en el sexo femenino, en una relación de 3:1. La incidencia estimada varía a nivel mundial, desde 0,67 hasta 3 casos por 100 000 personas-año2,6,7. En una cohorte retrospectiva colombiana recientemente publicada, el 80% de los pacientes fueron mujeres, con una mediana de edad de 49 años8.
Los mecanismos fisiopatológicos precisos que conducen al desarrollo de autoinmunidad hepática son elusivos; se plantea un origen multifactorial que incluye fenómenos genéticos y epigenéticos, mecanismos de regulación autoinmune aberrantes y desencadenantes ambientales7,9. La pérdida de la autotolerancia a los autoantígenos hepáticos inicia la respuesta inmunológica, los linfocitos T regulatorios (Tregs) son incapaces de prevenir la respuesta inmunitaria a autoantígenos frente a desencadenantes ambientales tales como infecciones virales o xenobióticos. Posteriormente, las células presentadoras de antígenos (CPA) presentan péptidos autoantigénicos a receptores α/β de células T (TCR) en células Th CD4+ inexpertas. La secreción de citocinas específicas induce la producción de autoanticuerpos por células B, el desarrollo de células B reguladoras (Breg), la activación de macrófagos y la citotoxicidad patogénica mediada por células Th17 CD4+. La generación de infiltrados inflamatorios de células efectoras que causan citotoxicidad periportal y lobular conduce a destrucción necroinflamatoria de los hepatocitos, lo que resulta en la activación de células estrelladas periportales, las cuales amplifican la respuesta inmunitaria local y causan fibrosis portal progresiva que culmina en cirrosis en ausencia de terapia inmunosupresora6,7.
La ausencia de características patognomónicas hace que el diagnóstico sea desafiante y de exclusión. El espectro de manifestaciones clínicas es variable y difiere de acuerdo con la raza, desde la ausencia de signos y síntomas de enfermedad hepática hasta formas graves de hepatitis6,7. Aproximadamente, un 25%-75% de los pacientes se presentan con un inicio agudo (< 30 días). La insuficiencia hepática aguda ocurre en un 3%-6% de los pacientes2. La mayoría se presenta después del desarrollo de síntomas crónicos inespecíficos (fatiga, malestar y artralgias). El examen físico puede ser normal, ocasionalmente aparecen hepatomegalia, esplenomegalia dolorosa y, cuando se desarrolla cirrosis franca, se pueden encontrar signos clínicos de hepatopatía crónica: eritema palmar, telangiectasias, ginecomastia, entre otros2,6,7.
Los autoanticuerpos son de utilidad diagnóstica durante la presentación aguda de HAI3. Los ANA se detectan en el 80%, los ASMA en el 63% y los anti-LKM1 en un 3%6. 49% de los pacientes tienen ANA, ASMA o anti-LKM1 como hallazgos serológicos aislados, y 51% tendrán múltiples anticuerpos. Los ANA son no detectables o se encuentran en títulos bajos en un 30%-40% de los pacientes10. Los niveles séricos de IgG son normales en el 25%-39%3,6,7.
Los autoanticuerpos circulantes se encuentran ausentes en promedio en un 10% de los pacientes11-13. La prevalencia reportada de seronegatividad es variable según la región geográfica y la naturaleza de los estudios: En una cohorte china de 167 pacientes, el 10,2% eran seronegativos10; en un estudio de 278 pacientes en Medellín, el 8,6% se presentó con seronegatividad14; mientras que en un estudio europeo de 126 pacientes con hepatitis criptogénica, el 34% fue categorizado como HAI seronegativa por el puntaje diagnóstico del IAIHG15. La seronegatividad podría resultar de la incapacidad para detectar los complejos antígeno-anticuerpo por los ensayos actuales, la presencia de solo anticuerpos para los cuales no hay pruebas disponibles comercialmente, o fluctuaciones en los niveles de los mismos13. Los pacientes con HAI seronegativa suelen presentarse más frecuentemente como HAI grave en comparación con HAI seropositiva (50% frente a 20,3%), presuntamente por la disfunción inmunitaria inducida por insuficiencia hepática; sin embargo, la respuesta al tratamiento suele ser similar16.
La biopsia hepática en HAI es necesaria y obligatoria para confirmar el diagnóstico, determinar la gravedad y el grado de actividad inflamatoria, así como para excluir otras enfermedades. La hepatitis de interfase es el elemento distintivo en HAI. De acuerdo con los criterios simplificados del IAIHG del 2008, la presencia de hepatitis de interfase, aún en ausencia de los otros elementos típicos, está en acuerdo con el diagnóstico de HAI, y se acompaña de infiltración plasmocitaria en el 66%, emperipolesis en el 65% y hepatitis lobular en el 47%6,17,18.
Se han propuesto escalas diagnósticas para asistir y estandarizar el proceso diagnóstico de HAI; la primera de las mismas fue introducida por el IAIHG en 199319, se revisó en 19995 y en el 2008 se publicó el puntaje simplificado20. La escala de 1993 resultaba compleja y, además de los parámetros clínicos, bioquímicos, histológicos y genéticos, también evaluaba la respuesta al tratamiento19. El puntaje revisado de 1999 aún se consideraba demasiado complejo y falló al realizar la diferenciación entre HAI y los síndromes colestásicos21.
El puntaje simplificado se propone como una herramienta práctica y fácil de usar en la clínica, que requiere solo cuatro variables: autoanticuerpos, hipergammaglobulinemia, histología y exclusión de hepatitis viral20. Los puntajes simplificado y revisado tienen precisión diagnóstica similar en pacientes con elementos típicos de HAI; sin embargo, el puntaje simplificado puede no ser aplicable para casos de HAI con elementos atípicos o seronegativa, por lo que se recomienda aplicar en dichos casos el puntaje revisado de 199922,23. Asimismo, este parece ser superior en el diagnóstico de HAI de inicio agudo con presentación grave3.
Conclusiones
Los casos de HAI son relativamente infrecuentes en la práctica clínica y constituyen un reto diagnóstico que requiere integrar elementos clínicos, paraclínicos e histopatológicos compatibles. El uso de escalas diagnósticas, tales como la escala revisada del IAIHG o la escala simplificada, facilita la estandarización durante el proceso diagnóstico. La terapia óptima con corticosteroides e inmunosupresores permite la remisión de la inflamación hepática y la regresión de la fibrosis hepática; por tanto, previene la progresión a cirrosis avanzada y sus complicaciones.
REFERENCIAS
1. Komori A. Recent updates on the management of autoimmune hepatitis. Clin Mol Hepatol. 2021;27(1):58-69. https://doi.org/10.3350/cmh.2020.0189 [ Links ]
2. European Association for the Study of the Liver. EASL Clinical Practice Guidelines: Autoimmune hepatitis. J Hepatol. 2015;63(4):971-1004. https://doi.org/10.1016/j.jhep.2015.06.030 [ Links ]
3. Rahim MN, Miquel R, Heneghan MA. Approach to the patient with acute severe autoimmune hepatitis. JHEP Reports. 2020;2(6):100149. https://doi.org/10.1016/j.jhepr.2020.100149 [ Links ]
4. Kwo PY, Cohen SM, Lim JK. ACG clinical guideline: evaluation of abnormal liver chemistries. Am J Gastroenterol. 2017;112(1):18-35. https://doi.org/10.1038/ajg.2016.517 [ Links ]
5. Alvarez F, Berg PA, Bianchi FB, Bianchi L, Burroughs AK, Cancado EL, et al. International Autoimmune Hepatitis Group Report: review of criteria for diagnosis of autoimmune hepatitis. J Hepatol. 1999;31(5):929-38. https://doi.org/10.1016/S0168-8278(99)80297-9 [ Links ]
6. Mack CL, Adams D, Assis DN, Kerkar N, Manns MP, Mayo MJ, et al. Diagnosis and management of autoimmune hepatitis in adults and children: 2019 practice guidance and guidelines from the American Association for the Study of Liver Diseases. Hepatology. 2020;72(2):671-722. https://doi.org/10.1002/hep.31065 [ Links ]
7. Mieli-Vergani G, Vergani D, Czaja AJ, Manns MP, Krawitt EL, Vierling JM, et al. Autoimmune hepatitis. Nat Rev Dis Primers. 2018;4:18017. https://doi.org/10.1038/nrdp.2018.17 [ Links ]
8. Díaz Ramírez GS, Jimenez Rivera DF, Escobar DM, Vargas Potes CJ, Rojas Rodríguez CA, Rojas Rojas N.E. Caracterización de pacientes con diagnóstico de hepatitis autoinmune en un hospital de cuarto nivel de Cali, 2014-2020. Revista. colomb. Gastroenterol.. 2023;38(1):2-11. https://doi.org/10.22516/25007440.907 [ Links ]
9. Muratori L, Lohse AW, Lenzi M. Diagnosis and management of autoimmune hepatitis. BMJ. 2023;380:e070201. https://doi.org/10.1136/bmj-2022-070201 [ Links ]
10. Wang QX, Jiang WJ, Miao Q, Xiao X, Zhang HY, Huang SS, et al. Clinical and histological features of autoantibody-negative autoimmune hepatitis in Chinese patients: a single center experience. J Dig Dis. 2013;14(4):175-80. https://doi.org/10.1111/1751-2980.12022 [ Links ]
11. Wang Q, Yang F, Miao Q, Krawitt EL, Gershwin ME, Ma X. The clinical phenotypes of autoimmune hepatitis: A comprehensive review. J Autoimmun. 2016;66:98-107. https://doi.org/10.1016/j.jaut.2015.10.006 [ Links ]
12. Krawitt EL. Autoimmune hepatitis. N Engl J Med. 2006;354(1):54-66. https://doi.org/10.1056/NEJMra050408 [ Links ]
13. Bhumi SA, Wu GY. Seronegative Autoimmune Hepatitis. J Clin Transl Hepatol. 2023;11(2):459-465. https://doi.org/10.14218/JCTH.2022.00235 [ Links ]
14. Díaz-Ramírez GS, Marín-Zuluaga JI, Donado-Gómez JH, Muñoz-Maya O, Santos-Sánchez O, Restrepo-Gutiérrez JC. Caracterización de los pacientes con hepatitis autoinmune de un hospital universitario, Medellín-Colombia: estudio de cohorte. Gastroenterol Hepatol. 2018;41(2):87-96. https://doi.org/10.1016/j.gastrohep.2017.09.003 [ Links ]
15. Heringlake S, Schütte A, Flemming P, Schmiegel W, Manns MP, Tillmann HL. Presumed cryptogenic liver disease in Germany: High prevalence of autoantibody-negative autoimmune hepatitis, low prevalence of NASH, no evidence for occult viral etiology. Z Gastroenterol. 2009;47(5):417-23. https://doi.org/10.1055/s-0028-1109146 [ Links ]
16. Sonthalia N, Rathi P, Jain S, Surude R, Mohite A, Pawar S, et al. Seronegative autoimmune hepatitis presents with more severe disease but has similar outcomes as compared to seropositive patients. J Clin Exp Hepatol. 2016;6:S81-S2. https://doi.org/10.1016/j.jceh.2016.06.135 [ Links ]
17. Beer A, Dienes HP. Autoimmune hepatitis-is histology conclusive? Ann Transl Med. 2021;9(8):733. https://doi.org/10.21037/atm-20-5084 [ Links ]
18. Covelli C, Sacchi D, Sarcognato S, Cazzagon N, Grillo F, Baciorri F, Fanni D, Cacciatore M, Maffeis V, Guido M. Pathology of autoimmune hepatitis. Pathologica. 2021;113(3):185-193. https://doi.org/10.32074/1591-951X-241 [ Links ]
19. Johnson PJ, McFarlane IG. Meeting report: International Autoimmune Hepatitis Group. Hepatology. 1993;18(4):998-1005. https://doi.org/10.1002/hep.1840180435 [ Links ]
20. Hennes EM, Zeniya M, Czaja AJ, Parés A, Dalekos GN, Krawitt EL, et al. Simplified criteria for the diagnosis of autoimmune hepatitis. Hepatology. 2008;48(1):169-76. https://doi.org/10.1002/hep.22322 [ Links ]
21. Kaya M, Angulo P, Lindor KD. Overlap of autoimmune hepatitis and primary sclerosing cholangitis: an evaluation of a modified scoring system. J Hepatol. 2000;33(4):537-42. https://doi.org/10.1034/j.1600-0641.2000.033004537.x [ Links ]
22. Sherigar JM, Yavgeniy A, Guss D, Ngo N, Mohanty S. Seronegative Autoimmune Hepatitis A Clinically Challenging Difficult Diagnosis. Case Rep Med. 2017;2017:3516234. https://doi.org/10.1155/2017/3516234 [ Links ]
23. Vierling JM. Autoimmune Hepatitis and Overlap Syndromes: Diagnosis and Management. Clin Gastroenterol Hepatol. 2015;13(12):2088-108. https://doi.org/10.1016/j.cgh.2015.08.012 [ Links ]
Citación: Marín-López C, Morales-Córdoba NJ, Bello-Martínez FA, Loredo-Mayorga MC. Hepatitis autoinmune seronegativa: reporte de un caso. Revista. colomb. Gastroenterol. 2024;39(1):99-104. https://doi.org/10.22516/25007440.1044
Recibido: 13 de Marzo de 2023; Aprobado: 17 de Noviembre de 2023











 texto em
texto em 



