Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Agronomía Colombiana
Print version ISSN 0120-9965
Agron. colomb. vol.23 no.2 Bogotá July/Dez. 2005
SUELOS, FERTILIZACIÓN Y MANEJO DE AGUAS
La toxicidad por exceso de Mn y Zn disminuye la producción de materia seca, los pigmentos foliares y la calidad del fruto en fresa (Fragaria sp. cv. Camarosa)
Manganese and zinc toxicity reduce dry matter production, leaf pigment and fruit quality in strawberries (Fragaria sp. cv. Camarosa)
Fánor Casierra-Posada1 y Jeimy Poveda2
1 Profesor asociado, Facultad de Ciencias Agropecuarias, Universidad Pedagógica y Tecnológica de Colombia, Tunja. e-mail: fanor@gmx.net
2 Bióloga, Facultad de Ciencias, Universidad Pedagógica y Tecnológica de Colombia, Tunja. e-mail: jeimypo@hotmail.com
Fecha de recepción: 21 de abril de 2005. Aceptado para publicación: 21 de noviembre de 2005
Resumen
Aunque el zinc y el manganeso son nutrientes minerales esenciales a bajas concentraciones, son muy tóxicos en cantidades altas en el suelo. Algunos fungicidas pueden incrementar el contenido de Zn y Mn en plantas cultivadas y en el suelo, si se utilizan en programas de protección vegetal. Se llevó a cabo un ensayo con el objeto de estudiar la respuesta de plantas de fresa (Fragaria sp. cv. Camarosa) a niveles elevados de Zn y Mn en el suelo. Las plantas de fresa crecieron en materas llenas con suelo en un invernadero en Tunja (Colombia). Se le adicionó gradualmente 350 mg de Zn ó 150 mg de Mn, como ZnSO4.7H2O y MnSO4. H2O, respectivamente, por kilogramo de suelo secado al aire. Las plantas se cosecharon 16 semanas luego de empezados los tratamientos. Se determinó: área foliar total; producción de materia seca; contenido de clorofila a, clorofila b y carotenos en hojas; contenido de sólidos solubles totales y diámetro longitudinal en frutos. Los resultados indicaron que altas concentraciones de Zn y Mn reducen el área foliar y la producción de materia seca. La calidad de la fruta se afectó por estos metales en el suelo: en plantas tratadas con altas concentraciones, los sólidos solubles totales de los frutos fueron menores que en los testigos, se les redujo el diámetro y disminuyó el contenido de clorofila y carotenos en las hojas. Se evidenció una mayor toxicidad del Zn para las plantas que del Mn.
Palabras claves adicionales: metales pesados, estrés, área foliar, clorofila, carotenos.
Abstract
Although zinc and manganese are essential mineral nutrients when used in low concentrations, they are very toxic to many crops when used in high concentrations in soil. Some fungicides can increase Zn and Mn contents in crops and soil when they are used in plant protection programmes. An assay using plant pots where Zn and Mn were added was carried out to study strawberry plant (Fragaria sp. cv. Camarosa) response to high levels of these heavy metals in soil. The strawberry plants were grown in greenhouses in Tunja (Colombia). 350 or 150 mg of Zn or Mn per kilogram of air dried soil was gradually added to the pots as ZnSO4.7H2O and MnSO4.H2O, respectively. Plants were harvested 16 weeks after beginning the treatment. Total leaf area, dry matter production, chlorophyll a, b and carotenoid content in leaves, total soluble solids and longitudinal diameter of fruit were measured. The results indicated that high concentrations of the tested heavy metals reduced the leaf area and reduced the plants' total dry matter production. Fruit quality was also severely affected by Zn and Mn supply in soil: plants treated with high concentrations presented reduced total soluble solid content in fruit, reduced fruit diameter and reduced chlorophyll and carotene content in leaves. The evaluated parameters revealed that Zn was more toxic to plants compared to Mn.
Additional key words: heavy metals, stress, leaf area, chlorophyll, carotenoids.
Introducción
EL SUELO ES UNA CAPA DELGADA ubicada en la interfase entre la litosfera y la atmósfera, que constituye un componente básico de los ecosistemas terrestres al suministrar los nutrientes minerales y el agua esenciales para la vida. Sin embargo, la contaminación de éstos con metales pesados por actividades antrópicas, tales como la minería metálica, la fundición y refinación de minerales, como el oxido de zinc obtenido a partir de la blenda (ZnS), el óxido o sulfato de manganeso (MnO ó MnSO4) y el uso frecuente de fungicidas en la agricultura, entre otros, ha tenido como consecuencia efectos negativos sobre los ecosistemas terrestres impactados (Kim y Kim, 1999). El uso de pesticidas que incluyen Zn y Mn en sus ingredientes activos es muy frecuente en los programas de protección fitosanitaria y es así como estos metales representan altas fuentes de contaminación en la agricultura (Cañizares-Villanueva, 2000).
En el caso de las especies vegetales, cada planta es capaz de crecer y reproducirse en forma óptima en un rango de concentración de iones presentes en el suelo, de acuerdo a una interacción entre el genotipo con su ambiente (Macnair, 1993; Farago, 1994; Grotz et al., 1998; Macnair et al., 2000; Schat et al., 2000). Sin embargo, si las concentraciones aumentan por encima del umbral de tolerancia de la especie, comienzan a evidenciarse los efectos de la toxicidad, que conllevan alteraciones fisiológicas con influencias negativas sobre el crecimiento y la reproducción de las plantas, incluso la muerte; por tanto, todas las plantas responden a incrementos en la concentración de metales en el suelo, sean éstos nutrientes esenciales o no (Baker y Walker, 1989; Ernst et al., 1992).
Las plantas que crecen en ambientes contaminados por metales aumentan los iones de metales tóxicos y los compartimentan eficazmente en varias partes, principalmente en las raíces y las hojas más viejas y en organelos de la célula donde exista un menor riesgo de daño por su acumulación en los órganos del vegetal (Prasad, 1998).
Ernst (1996) y Hall (2002) mencionan la existencia de dos tipos de mecanismos que pueden explicar la resistencia en las plantas a la toxicidad de iones metálicos, como son: la anulación, que involucra varias maneras de prevenir el acceso de los iones tóxicos a los sitios designados, y la tolerancia, mediante la resistencia a la entrada de los iones metálicos al simplasma. Como mecanismo de resistencia al exceso de metales en el sustrato se reportan estrategias de adaptación como: exudación y excreción de ácidos orgánicos, transporte y almacenamiento en vacuolas, interferencia y restricción de paredes celulares, complejos en el simplasma, entre otros (Davies et al., 1991; Brune et al., 1994; Casierra-Posada, 2001 y 2002).
Se conocen como metales pesados aquéllos con una densidad por encima de 4,5 g · cm-3, entre los que se encuentran: Ag, As, Au, Bi, Cd, Co, Cu, Cr, Fe, Hg, Mn, Mo, Ni, Pb, Pt, Sb, Sn, Ti, Zn y Zr, entre otros (Ernst, 1996). Estos metales inhiben la biosíntesis de clorofila y particularmente de la ácido deshidrogenasa y la reductasa, disminuyendo la proporción total de clorofila a y b en las plantas y, por tanto, provocando un descenso en la fotosíntesis. En cuanto a los carotenos, son menos afectados por estos metales, dando como resultado un porcentaje más bajo, con respecto a la clorofila en plantas superiores (Prasad, 1998 y Krupa et al., 1996).
En las plantas, el Zn influye sobre los procesos fotosintéticos, siendo un componente esencial de varios sistemas de enzimas para la producción de energía, la regulación y síntesis de proteínas, el mantenimiento de la integridad de la membrana de la raíz; así mismo, interviene en el crecimiento y la fisiología de la planta. Se dice que este elemento tiene un papel en la resistencia/ tolerancia a organismos patógenos (Webb, 1994).
Los síntomas de toxicidad por Zn incluyen clorosis y crecimiento reducido de la planta; actúa inhibiendo la fijación de CO2, el transporte de los hidratos de carbono en el floema y altera la permeabilidad de la membrana celular (Efroymson et al., 1997; Marschner, 1998). Haslett et al. (2001) argumentan que este metal es muy móvil en el floema, independiente de la forma de aplicación, ya que, al adicionar ZnSO4 a plantas de Triticum aestivum por vía foliar y en las raíces, la acumulación se notó en las regiones meristemáticas, en la base de las hojas y de la raíz, exhibiendo además inhibición en el crecimiento del retoño. En plantas de Phaseolus vulgaris, Ramani y Kannan (1985) encontraron que la región de crecimiento activa tiene más capacidad para acumular Zn, puesto que, al exponer plantas a este metal, se acumuló en los cloroplastos, tallos, hojas secundarias y retoños. Puschenreiter y Horak (2000) hallaron acumulaciones de Zn en partes comestibles del centeno y el trigo. Además, se ha encontrado que los iones zinc interfieren en los movimientos estomáticos, perturbando los flujos de agua a través de la membranas (Yang et al., 2004).
Con respecto al Mn, por las interacciones que existen con el hierro, se le atribuyen síntomas de toxicidad que corresponden a los de deficiencia de hierro, y viceversa. Los requerimientos por Mn de la planta se encuentran en el tejido de los retoños en niveles entre 20 y 40 mg· kg-1 y las reacciones de toxicidad resultan cuando los tejidos han acumulado de 200 a 5.300 mg· kg-1 (Reisenauer, 1994).
Los síntomas de toxicidad por Mn incluyen clorosis marginal y necrosis de hojas y raíces café oscuras, sólo después de que el follaje ha sido afectado. El exceso de Mn interfiere con las enzimas, disminuye la respiración y está relacionado con la destrucción de auxinas (Foy et al., 1978; Marschner, 1998). Con respecto a su movilidad, este elemento se distribuye y se disipa uniformemente en las raíces (Wallace et al., 1977). En plantas dePhaseolus sp., Solanum sp., Chrysanthemum sp. y Lycopersicum sp. se ha observado oscurecimiento de venas de la hoja por acumulación de cristales oscuros de MnO2 insoluble en los tejidos dentro o junto a las venas, o en ambos lados de la hoja. En Brassica sp. y Lactuca sp., los síntomas de su toxicidad se evidencian como clorosis intervenal en hojas (Schubert, 1992).
En este estudio se decidió evaluar la toxicidad por concentraciones altas de Zn y Mn en plantas de fresa, ya que estos vegetales son muy sensibles al exceso de contaminantes (Maas, 1992) y, por otro lado, en los programas de protección vegetal de este cultivo se utilizan con mucha frecuencia productos agroquímicos a base de estos dos metales. Con este fin, se emplearon parámetros comúnmente utilizados para cuantificar el crecimiento y la calidad de la fruta.
Materiales y métodos
Para determinar el efecto del exceso de Mn y Zn sobre el crecimiento, la acumulación de materia seca y la calidad de fruta en plantas de fresa, se utilizó el cultivar 'Camarosa', recientemente introducido en la zona de estudio. Antes de la siembra, en invernaderos de la Universidad Pedagógica y Tecnológica de Colombia (Tunja), los estolones de fresa se mantuvieron a temperatura de 7 °C durante dos semanas y posteriormente se colocaron en materas plásticas con capacidad para 2 kg de suelo.
Una vez las plantas iniciaron la brotación, se aplicó al suelo de cada matera una mezcla de fertilizante comercial de alta solubilidad. Los siguientes valores se aplicaron en g· kg-1 de suelo seco: 0,4 de N; 0,03 de P2O5,; 0,05 de K2O; 0,0005 de CaO; 0,0013 de MgO; 0,00137 de S; 0,0002 de B; 0,00014 de Cu; 0,00012 de Fe; 0,0013 de Mn; 0,00005 de Mo y 0,0002 de Zn. Los tratamientos para inducir la toxicidad fueron 350 mg· kg-1 de Zn y 150 mg· kg-1 de Mn, aplicados al suelo como ZnSO4.7H2O y MnSO4.H2O, respectivamente. La diferencia en las concentraciones de metal aplicadas se debió a que los dos metales estudiados tienen distinto grado de toxicidad para las plantas, según Wallnöfer y Engelhardt (1995). Las sales se aplicaron gradualmente a cada matera, de manera que la cantidad total de la sal se aplicara en un periodo de cuatro semanas. A lo largo del ensayo, el suelo de las materas se mantuvo cercano a la capacidad de campo. La cantidad de agua para aplicar diariamente a las materas se calculó con base en el peso de la matera con la planta, referido al peso del día anterior, de manera que las materas no llegaran al punto de marchitez temporal ni sobrepasaran la capacidad de campo.
16 semanas después de terminar los tratamientos con los metales pesados, se cosecharon las plantas y se determinó: el área foliar mediante un medidor Li-Cor 1000 (Li-Cor Corp., Lincoln, NE); la acumulación de materia seca total, con base en el peso seco; el contenido de clorofila a, b y carotenos en hojas, por absorbancia en matriz de metanol a 470, 664 y 648 nm, en un espectrómetro Spectronic 401 (Milton-Roy Co., Ivyland, PA).
En cuanto a los parámetros para determinar la calidad de fruta, se midieron los sólidos solubles totales (SST) con un refractómetro manual, expresados en grados Brix, y se cuantificó el contenido de ácidos orgánicos por titulación, como porcentaje de ácido cítrico.
El arreglo estadístico fue en bloques al azar, con cinco replicaciones. Los resultados obtenidos se analizaron mediante una tabla Anova para determinar la significancia. La diferencia entre promedios se determinó con la prueba Tukey. Los análisis estadísticos se realizaron con la versión 11.5 de SPSS. En los resultados, las figuras se presentan en formato de barras con su respectiva desviación estándar y el resultado de la prueba Tukey (P < 0,01).
Resultados y discusión
Las plantas tratadas con exceso de Zn presentaron una clorosis generalizada en las hojas jóvenes. Estas hojas mostraron también la aparición, a lo largo de las nervaduras, de puntos rojizos en el extremo proximal, que luego se ampliaban y coalecían hasta formar una mancha rojiza extendida desde el extremo proximal hasta el distal de las hojas. En las hojas adultas se notó la presencia inicial de un halo rojizo en los bordes, luego éstas adquirían una tonalidad anaranjada generalizada y, por último, se necrosaban. En algunos frutos se encontró que el receptáculo floral no se desarrollaba en toda su magnitud, sino por sectores, resultando con apariencia malformada.
En el caso del Mn, la toxicidad tuvo como consecuencia una clorosis generalizada en las hojas jóvenes, con presencia de pequeñas zonas necróticas en los bordes dentados y en los extremos distales de los sépalos. Estos puntos necróticos inhibieron la expansión de las hojas jóvenes en crecimiento, dando como resultado hojas malformadas con apariencia ondulada y recogidas en los bordes. Algunas plantas presentaron tonalidades rojizas a lo largo de las nervaduras de hojas jóvenes, que luego se generalizaron a todas las nervaduras de las hojas adultas, mientras que las zonas intervenales no presentaron modificaciones considerables en el color. También se observó que en el extremo distal del receptáculo floral no hubo crecimiento, de manera que se formó un fruto redondeado, en lugar del alargado, característico de la variedad; además, los aquenios de los frutos fueron de color marrón, mientras que los controles presentaron frutos con aquenios de color verde amarillento característico.
La sintomatología encontrada para la toxicidad por Zn y Mn en plantas de fresa es común a muchas especies cultivadas. Al respecto, Bergmann (1986) describió la toxicidad por estos dos metales en varias especies vegetales, coincideindo en gran parte con las observaciones hechas en este estudio.
La exposición de las plantas de fresa a los dos metales pesados probados tuvo como consecuencia la reducción del área foliar total de las plantas (figura 1). Las plantas expuestas a exceso de Mn desarrollaron 60% del área foliar total de los controles, mientras que las plantas expuestas a Zn desarrollaron sólo el 31%; se encontró una diferencia altamente significativa para la concentración del metal en el suelo. Tanto este resultado, como los siguientes, indican claramente que, entre ambos metales, el Zn tiene consecuencias más negativas sobre las variables evaluadas de crecimiento y calidad de fruta.
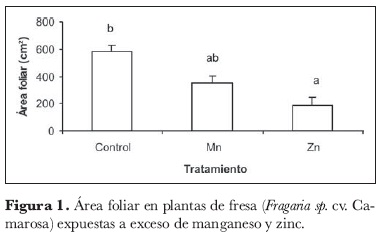
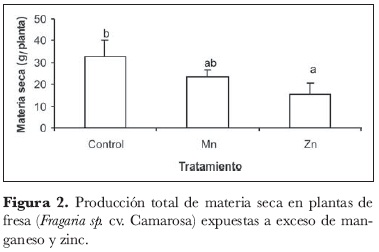
De hecho, el Zn limita la fijación de CO2 y el flujo de electrones desde el momento en que sucede la fotólisis del agua hasta cuando los electrones alcanzan el fotosistema II. Por otro lado, dado que el Mn tiene participación activa en la fotooxidación del agua, se asume que el Zn desplaza al Mn en ese punto, lo cual se demuestra con el antagonismo encontrado entre ambos metales (Wallnöfer y Engelhardt, 1995). Con base en estos argumentos, la reducción del área foliar y la disminución en la producción total de materia seca por planta en las plantas tratadas con exceso de Zn (figura 2) serían consecuencia de la irregularidad en el funcionamiento del aparato fotosintético por exceso de este metal. Se encontró diferencia significativa (5%) para la producción de materia seca total por planta en dependencia de la concentración del metal en el sustrato, como muestra la figura 2. Por otro lado, la reducción en el crecimiento se puede justificar con el reporte de Wallnöfer y Engelhardt (1995), en el que se menciona que el exceso de Zn disminuye la biosíntesis de giberelinas y de triptofano, precursor primario de la auxina ácido indol-3-acético y responsable en gran parte de la división celular.
El análisis estadístico dio como resultado una diferencia altamente significativa (1%) en lo referente al contenido de los tres pigmentos analizados en hojas frescas.
El contenido total en hojas de clorofilas a y b, así como de carotenos, se vio fuertemente afectado por el exceso de metales en el sustrato. En la figura 3 se observa que en las plantas expuestas a exceso de Zn el contenido de pigmentos fue menor que en las expuestas a Mn. Este resultado está muy relacionado con los resultados discutidos arriba, pues el exceso de metales en el sustrato tiene como consecuencia una reducción de los parámetros que determinan el crecimiento, entre ellos, el contenido de pigmentos fotosintéticos. Por tanto, la reducción del crecimiento es un efecto de la disminución en la tasa de asimilación neta, afectada negativamente por la disminución de los pigmentos responsables de la captura de los quanta. Este resultado se puede explicar con el hallazgo de Tumperley et al. (1973) de Zn acumulado en los cloroplastos de algunas plantas arbóreas, de manera tal que el exceso del metal en estos organelos celulares condujo a la reducción del contenido de pigmentos fotosintéticos. Por su parte, Ernst (1996) menciona una información no publicada de Mathys (1972) en la que el Zn se encontró más concentrado en hojas cloróticas que en hojas sanas de Agrotis capillaris, Festuca ovina y Cardaminopsis halleri. El mismo autor comenta una posible sustitución del Mg por el Zn en el estroma de los cloroplastos en caso de exceso de este último metal, pues se ha encontrado que, cuando se presenta toxicidad por Zn, la cantidad de este elemento puede llegar a ser equivalente al contenido de Mg; por tanto, es de esperarse la reducción del contenido de clorofilas, dada la función del Mg como centro del anillo tetrapirrólico en la molécula de clorofila.
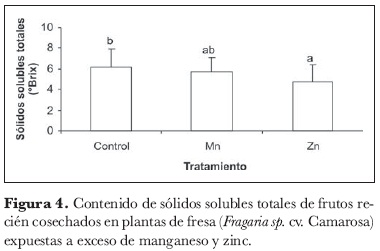
En cuanto a los parámetros medidos para determinar la calidad de fruta -pH del jugo, acidez titulable e índice de madurez (SST/acidez titulable)-, no arrojaron diferencias altamente significativas con respecto a los tratamientos con exceso de metales pesados. Por otro lado, el contenido de SST en frutos se vio afectado por los tratamientos evaluados (figura 4): es así, como los frutos de las plantas tratadas con exceso de Zn y de Mn se encontraron respectivamente 78,17% y 92,18% de los SST en los testigos al momento de la cosecha. En cuanto a este parámetro, de nuevo las plantas tratadas con exceso de Zn fueron más afectadas por la toxicidad del metal que las plantas tratadas con Mn; este hecho coincide con lo propuesto por Wallnöfer y Engelhardt (1995) al afirmar que uno de los objetivos de ataque de la toxicidad por Zn es el transporte por el floema, de manera que los carbohidratos se acumulan en las hojas primarias y no pueden traslocarse a los órganos de demanda, como sucede en uno o dos días en Phaseolus vulgaris, ocasionándose una fuerte reducción en el transporte basípeto de asimilados y la consecuente acumulación de sacarosa y almidón en las hojas.
Para efectos de contraste, es de anotar que los valores, tanto de la acidez titulable como de los SST en las plantas de control, estuvieron por debajo de los valores reportados por Koyuncu (2004) para la variedad 'Camarosa'; en consecuencia, esta variedad presentó en las condiciones de invernadero en Colombia unas características de calidad de fruta inferiores a la misma variedad cultivada en Turquía.
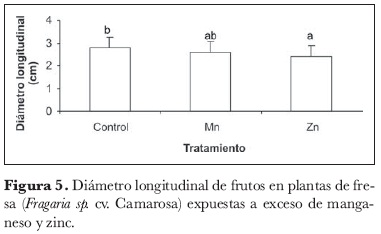
El diámetro longitudinal de los frutos fue otro de los parámetros afectados por el exceso de estos dos metales en el suelo (figura 5), con una diferencia significativa. Al respecto, Puschenreiter y Horak (2000) encontraron acumulación de Zn en las partes comestibles de algunos cereales, situación que puede interpretarse en la fresa como una consecuencia de la acción de demanda de fotoasimilados de los frutos durante su crecimiento y desarrollo y, por esta razón, una vez se encuentra el metal dentro del fruto, ejerce una acción inhibitoria del crecimiento, potencializada por la reducción general de la producción de materia seca en la planta, como se discutió más arriba.
En términos generales, la exposición de los vegetales a los metales pesados reduce el crecimiento y demerita la calidad de la fruta. Entre el Zn y el Mn, es el primero el que tiene consecuencias más negativas para el desarrollo normal del vegetal, por lo que se debe ser muy prudente con pulverizaciones o adiciones al suelo de productos ricos en este metal, pues su acumulación en el suelo o en los tejidos de la planta pueden acarrear consecuencias graves, no sólo para el vegetal, sino también para los seres humanos y los animales, a los que también afecta en su salud. Queda aún por determinar la distribución y acumulación de los metales evaluados en los órganos comestibles de la fresa, para esclarecer el riesgo que representa el exceso de metales pesados para los consumidores.
Agradecimientos
Este estudio fue desarrollado con recursos del Instituto Colombiano para el Desarrollo de la Ciencia y la Tecnología Francisco José de Caldas (Colciencias) y de la Dirección de Investigaciones (DIN) de la Universidad Pedagógica y Tecnológica de Colombia, en el marco del proyecto DIN-9001-063, "Evaluación del crecimiento y desarrollo de plantas de fresa (Fragaria sp.) expuestas a metales pesados".
Literatura citada
Baker, A.J.M. y P.L. Walker. 1989. Physiological responses of plants to heavy metals and the quantification of tolerance and toxicity. Chem. Special. Bioavailab. 1, 7-17. [ Links ]
Bergmann, W. 1986. Ernährungstörungen bei Kulturpflanzen. Gustav Fischer Verlag, Jena. 306 p. [ Links ]
Brune, A., W. Urbach y K.J. Dietz. 1994. Compartmentation and transport of zinc in barley primary leaves as basic mechanisms involved in zinc tolerance. Plant, Cell Environ. 17, 153-162. [ Links ]
Cañizares-Villanueva, R.O. 2000. Biosorción de metales pesados mediante el uso de biomasa microbiana. Revista Latinoamericana de Microbiología 42, 131-143. [ Links ]
Casierra-Posada, F. 2001. Fundamentos fisiológicos, bioquímicos y anatómicos del estrés por aluminio en vegetales. Revista Comalfi 28(2), 8-19. [ Links ]
Casierra-Posada, F. 2002. Alteraciones inducidas por aluminio en el citoesqueleto de las plantas. Revista Comalfi 29(2), 23-32. [ Links ]
Davies, K.L., M.S. Davies y D. Francis. 1991. Zinc-induced vacuolation in root meristematic cells of Festuca rubra L. Plant, Cell Environ. 14, 399-406. [ Links ]
Efroymson, R.A., M.E. Will, G.W. Suter y A.C. Wooten. 1997. Toxicological benchmarks for screening contaminants of potential concern for effects on terrestrial plants. Department of Energy, Office of Environmental Management Activities at the East Tennessee Technology Park. 123 p. [ Links ]
Ernst, W.H. 1996. Schwermetalle. pp.191-220. En: Brunold, Ch., A. Rüegesegger y R. Brändle (eds). Stress bei Pflanzen. UTB für Wissenschaft. Verlag Paul Haupt, Stuttgart. [ Links ]
Ernst, W.H., J. Verkleij y W. Schat. 1992. Metal tolerance in plants. Acta Bot. Neth. 41, 229-248. [ Links ]
Farago, M. 1994. Plants and the chemical elements: biochemistry, uptake, tolerance and toxicity. VCH Verlasgesellschaft, Weinheim. 292 p. [ Links ]
Foy, C.D., R.L. Chaney y M.C. White. 1978. The physiology of metal toxicity in plants. Annu. Rev. Plant Physiol. 29, 511-556. [ Links ]
Grotz, N., T. Fox, E. Connolly, W. Park, M.L. Guerinot y D. Eide. 1998. Identificaction of a family of zinc transporter genes from Arabidopsis that respond to zinc deficiency. Proc. Nat. Acad. Sci. 95, 7220-7224. [ Links ]
Hall. J.L. 2002. Cellular mechanisms for heavy metal detoxification and tolerance. J. Exp. Bot. 53 (366), 1-11. [ Links ]
Haslett, B.S., R.J. Reid y Z. Rengel. 2001. Zinc mobility in wheat: uptake and distribution of zinc applied to leaves or roots. Ann. Bot. 87, 379-386. [ Links ]
Kim K.H. y S.H. Kim. 1999. Heavy metal pollution of agricultural soils in central regions of Korea. Water, Air & Soil Pollution 111, 109-122. [ Links ]
Koyuncu, M.A. 2004. Quality changes of three strawberry cultivars during the cold storage. Europ. J. Hort. Sci. 69(5), 193-200. [ Links ]
Krupa, Z., M. Baranowska y D. Orzol. 1996. Can anthocyanins be considered as heavy metal stress indicator in higher plants? Acta Physiol. Plant. 18, 147-151. [ Links ]
Maas, J.L. 1992. Compendoim of strawberry diseases. APS Press, St. Paul, MN. pp. 42-55. [ Links ]
Macnair, M.R. 1993. The genetics of metal tolerance in vascular plants. New Phytologist 124, 541-559. [ Links ]
Macnair, M.R., G.H. Tilstone y S.E. Smith. 2000. The genetics of metal tolerance and accumulation in higher plants. pp. 235-250. En: Terry N. y G. Banuelos (eds.). Phytoremediation of contaminated soil and water. CRC Press, Boca Raton, FL. [ Links ]
Marschner, H. 1998. Mineral nutrition of higher plants. Academic Press, San Diego, CA. pp. 313-396. [ Links ]
Prasad, M.N.V. 1998. Metal-biomolecule complexes in plants: ocurrence, functions, and applications. Analusis 26 (6), 25-28. [ Links ]
Puschenreiter, M. y O. Horak. 2000. Einfluß verschiedener Bodenparameter auf den Transferfaktor Boden-Pflanze von Cd, Cu und Zn für Weizen und Roggen. Die Bodenkultur 51(1), 3-10. [ Links ]
Ramani, S. y S. Kannan. 1985. Studies on translocation of zinc in bean plants: evidence for retranslocation during new growth. J. Plant Physiol. 121, 313-318. [ Links ]
Reisenauer, H.M. 1994. Biochemistry of metal micronutrients in the rhizosphere. pp. 147-164. En: A.J. Manthey, E.D. Crowley y G.D. Luster (eds.). The interactions of manganese and iron. CRC Press, Boca Raton, FL. [ Links ]
Schat, H., M. Llugany y R. Bernhard. 2000. Metal-specific patterns of tolerance, uptake and transport of heavy metals in hyperaccumulating and nonhyperaccumulating metallophytes. pp. 171-188. En: N. Terry y G. Banuelos (eds.). Phytoremediation of contaminated soil and water. CRC Press, Boca Raton, FL. [ Links ]
Schubert, T. S. 1992. Manganese toxicity of plants in florida. Plant Pathol. Circ. 353. [ Links ]
Tumperley, M.H., R.R. Brooks y P.J. Peterson. 1973. The distribution of nickel, copper, zinc and iron in tree leaves. J. Exp. Bot. 24, 889-895. [ Links ]
Wallace, A., G.V. Alexander y F.M. Chaudhry. 1977. Phytotoxicity and some interactions of the essential trace metals iron, manganese, molybdenum, zinc, copper, and boron. Comm. Soil Sci. Plant Anal. 8(9), 741-50. [ Links ]
Wallnöfer, P.R. y G. Engelhardt. 1995. Schadstoffe aus dem Boden. pp. 118-140. En: B. Hock y E.F. Elstner (eds.). Schadwirkungen auf Pflanzen. Spektrum, Berlin. [ Links ]
Webb, J.M. 1994. Biochemistry of metal micronutrients in the rhizosphere. pp. 183-199. En: A.J. Manthey, E.D. Crowley y G.D. Luster (eds.). Recent aspects of Mn and Zn absortion and translocation in cereals. CRC Press, Boca Raton, FL. [ Links ]
Yang, H.M., X.Y. Zhang y G.X. Wang. 2004. Effects of heavy metals on stomatal movements in broad bean leaves. J. Plant Physiol. 51(4), 464-468. [ Links ]














