Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Agronomía Colombiana
versão impressa ISSN 0120-9965
Agron. colomb. v.23 n.2 Bogotá jul./dez. 2005
Efecto del uso del suelo sobre hongos solubilizadores de fosfato y bacterias diazotróficas en el páramo de Guerrero (Cundinamarca)
The effect of land use on phosphate solubilising fungi and diazotrophic bacteria on the bleak uplands of páramo of Guerrero, Cundinamarca department
Claudia Moratto1, Luis Joel Martínez2, Hernando Valencia3 y Jimena Sánchez4
1 Microbióloga industrial, Programa de maestría en Microbiología, Facultad de Ciencias, Universidad Nacional de Colombia, Bogotá. e-mail: ccmorattos@unal.edu.co
2 Profesor asociado, Facultad de Agronomía, Universidad Nacional de Colombia, Bogotá. e-mail: ljmartinezm@unal.edu.co
3 Profesor asociado, Facultad de Ciencias, Universidad Nacional de Colombia, Bogotá. e-mail: havalenciaz@unal.edu.co
4 Profesora asistente, Facultad de Ciencias, Universidad Nacional de Colombia, Bogotá. e-mail: jsanchezn@unal.edu.co
Fecha de recepción: 29 de julio de 2005. Aceptado para publicación: 21 de noviembre de 2005
Resumen
Se determinó el efecto del uso del suelo sobre las poblaciones de hongos solubilizadores de fosfato (HSF) y bacterias fijadoras biológicas de nitrógeno (BFN), aislando y caracterizando especies de estos grupos bajo cuatro condiciones de uso diferentes: cultivos de papa 'Parda Pastusa' (p), cultivo de papa 'Pastusa Suprema' (s), suelos cultivados con papa actualmente en descanso (d) y suelos de bosque (b). Se aislaron hongos en estado activo, mediante la técnica de lavado del suelo (14 géneros), micelios estériles, con clamidosporas y tipo basidiomycete. Se presentó baja incidencia de mucorales en suelos cultivados y en descanso, a excepción de Mucor racemosus. En (d) predominaron especies de los géneros Circinella, Mucor y Zygorrhynchus, evidenciándose la selección de hongos por efecto de uso del suelo. La determinación cuantitativa de la actividad solubilizadora evaluada en medio líquido, registró porcentajes altos en los hongos Trichocladium canadense, Mucor sp1 y Penicillium sp2, aislados de (d) y (b), los cuales solubilizaron más de 15% del fosfato. No hubo relación entre el fósforo solubilizado y la biomasa, pero sí entre éste y el pH. En las BFN se comprobó el efecto significativo de la condición de uso del suelo sobre los recuentos de sus poblaciones. Se identificaron cuatro morfotipos aislados de (d), dos de (p), tres de (s) y tres morfotipos de (b), correspondientes a especies de los géneros Azospirillum, Beijerinckia, Pseudomonas y Derxia. Se evidenció una respuesta sensible al uso del suelo por parte de los grupos funcionales estudiados.
Palabras claves adicionales: microorganismos del suelo, micelio activo, bioindicadores de calidad del suelo.
Abstract
The effect of land use on phosphate-solubilising fungi (PSF) and nitrogen-fixing bacteria (NFB) populations was investigated. The soils selected were that from two potato crop varieties ['Parda Pastusa' (p) and 'Pastusa Suprema' (s)], agricultural soil at present lying fallow (d) and soil from beneath forested areas (b). Active fungi (14 genera) and sterile chlamydospore -and basidiomycete-like mycelia were isolated by washing the soil. Mucorales presented low incidence in cultivated soil, except for Mucor racemosus. Circinella, Mucor and Zygorrhynchus genera were predominant in forest (b) soil. The most efficient calcium phosphate solubilisation assessed in liquid medium was registered for Trichocladium canadiense, Mucor sp1 and Penicillium sp2 isolated from (d) and (b), (>15% P- solubilisation). No correlation was found between fungal biomass and P solubilising efficiency; however, there was negative correlation with pH. Qualitative differences were found between land use and PSF, while significant differences were registered between NFB and bacterial populations. Azospirillum, Beijerinckia, Pseudomonas and Derxia dizotrophic bacterial species were isolated. The study revealed the functional groups' sensitive response to the microorganisms being evaluated, according to land use.
Additional key words: soil microorganisms, active mycelium, soil quality bioindicators.
Introducción
EN COLOMBIA, LOS BOSQUES ALTOANDINOS y los páramos ubicados en la alta montaña tropical juegan un papel importante como generadores, reguladores y almacenadores del recurso hídrico, por su riqueza paisajística, el albergue de gran número de especies animales y vegetales endémicas, así como de la microbiota asociada al suelo, que es la base del sustento para el establecimiento y desarrollo de las comunidades vegetales allí encontradas (Castaño, 2002; García et al., 2005). En la actualidad, el ecosistema de páramo ha sido un recurso sobre-explotado y desplazado por otros tipos de paisajes semiurbanos y agrícolas (Castaño, 2002).
Es vital conocer los cambios que ocurren en este eco-sistema por la acción antrópica, para la adopción de medidas de protección y recuperación. Por esta razón, en los últimos años ha crecido la necesidad de conocer el impacto que producen las prácticas agrícolas implementadas a lo largo de muchos años, en especial con cultivos de papa, sobre la diversidad biológica presente en la región paramuna.
La comunidad microbiana es el componente funcional más importante de la biota del suelo, ya que juega un papel importante en el flujo de energía, la transformación de nutrientes y el ciclaje de elementos en el ambiente (Filip, 2002; Hoffman et al., 2003). Las actividades de estos organismos son irremplazables en las transformaciones de la materia orgánica, pues la biomasa microbiana contribuye en la formación del humus, la conservación de la estructura del suelo y la biodegradación de contaminantes (Hoffman et al., 2003). Los microorganismos influyen directamente sobre la fertilidad y productividad de suelos agrícolas, en particular, con respecto a la disponibilidad de nutrientes, la supresión de enfermedades para las plantas nativas (Van Elsas et al., 2002; Anderson, 2003), así como la degradación de diferentes plaguicidas, derivando de ellos energía y nutrientes para su metabolismo (Das et al., 2003). Esto demuestra que un buen estatus de los microorganismos del suelo (alta cantidad, actividad y/o diversidad) es un prerrequisito de su buena calidad y fertilidad (Foissner, 1999; Hoffman et al., 2003). Además, el componente microbiológico del suelo es potencialmente uno de los indicadores biológicos sensibles utilizados para evidenciar disturbios o perturbaciones en él (Pankhurst y Doube, 1997). En algunos casos, cambios en las poblaciones microbianas o en sus actividades pueden predecir modificaciones detectables en las propiedades físicas y químicas del suelo (Nielsen y Winding 2002).
Uno de los enfoques usados para estudiar la calidad de los suelos es medir funciones microbianas tales como las transformaciones específicas de carbono, nitrógeno y fósforo, puesto que afectan directamente la disponibilidad de nutrientes y, por tanto, pueden reflejar mejor los cambios en el funcionamiento del ecosistema y la calidad de los suelos (Pankhurst y Doube, 1997). Además, las funciones, el tamaño y la composición de las poblaciones microbianas han sido usados para ver los cambios en la biota en respuesta al uso del suelo y, por tanto, son indica-dores de su estado biológico (Pankhurst y Doube 1997).
Con base en lo anterior, se planteó esta investigación, cuyo objetivo fue aislar, identificar y cuantificar hongos solubilizadores de fosfato (HSP) y bacterias fijadoras biológicas de N (BFN) y determinar el efecto del uso del suelo (cultivos de papa, suelos cultivados en descanso y bosque) sobre estos grupos funcionales de microorganismos.
Materiales y métodos
Área de estudio
La investigación se realizó en el municipio de Zipaquirá (Cundinamarca), vereda Páramo Guerrero Oriental, finca Puente de tierra (04° 08' latitud norte, 74° 02' longitud oeste), a una altitud de 3.373 msnm. El principal uso que se le da a estos suelos es el cultivo de papa, en rotación con pastos; también se encuentran algunos relictos de bosques naturales. La toma de muestras se realizó en: suelos cultivados con papa Solanum tuberosum variedad 'Parda Pastusa' (p) y variedad 'Pastusa Suprema' (s); suelos que se encuentran en descanso (d), utilizados durante 25 años alternado cultivos de papa y pastos, y suelos de bosque (b). Los muestreos se realizaron en tres épocas del año (septiembre y noviembre de 2004 y enero de 2005). Los suelos (p) y (s) correspondieron a tres estados fonológicos diferentes (emergencia, floración y cosecha), cuyas cosechas pertenecen al segundo período de siembra luego del arado.
Los agroquímicos empleados para ambos cultivos de papa incluyeron: Manzate® (3 kg· ha), Tamaron® (900 mL· ha-1), Cosmoin-d® (750 mL· ha-1), Cosmoquel-balance® (1,5 kg· ha-1), Lorsban® (1,5 L· ha-1), Carbofuran® (1,5 L· ha-1), Methavin® (300 g· ha), Cymoxanyl® (1,5 kg· ha-1), Validacin® (1,5 L· ha-1), Sandofan® (1,5 kg· ha-1) y Rhodax® (2 kg· ha-1). En el caso de la varie-dad 'Pastusa Suprema', se realizaron tres aplicaciones y para la variedad 'Parda Pastusa', siete.
En los suelos en descanso predomina Calamagrostis sp. y en suelos de bosque se encuentran especies de Weinmannia, Hypericum, Hesperomeles, Diplostephium, entre otras.
Toma de muestras
En los suelos con cultivos el muestreo se realizó en forma aleatoria, tomando 10 plantas al azar, tres puntos por cada planta. Las muestras fueron tomadas en la base de las plantas, cubriendo el área cercana a la raíz en los primeros 15 cm del suelo (n = 3), según Valencia (2005). En los sitios en descanso y de bosque, se realizó un muestreo tipo extensivo al azar, en tres transectos de aproximadamente 2 x 2 m, tomando cinco submuestras de 20 g de los primeros 15 cm de suelo. Todas las submuestras se mezclaron para obtener una muestra integrada de 300-400 g de cada tipo de uso de suelo (n = 3). A todas las muestras de suelo se les midió el pH en campo con un potenciómetro digital. Adicionalmente, se les determinó la textura por el método de Bouyoucos y el contenido de C orgánico por el método de Walkley-Black, a partir del cual se calculó el porcentaje de materia orgánica y de N total; la capacidad de intercambio cationico se determinó por el método de Bray II mediante desplazamiento con NaCl y P, según la metodología del laboratorio de Agua y Suelos de la Facultad de Agronomía, Universidad Nacional de Colombia (tabla 1).
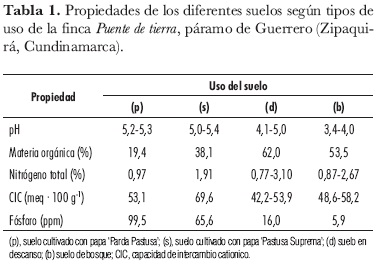
El pH fue extremadamente ácido, muy fuertemente ácido y fuertemente ácido para los suelos de bosque, en descanso y de cultivos, respectivamente. Por otro lado, los suelos (d) y (b) presentaron una textura franca y franca arcillosa, respectivamente, mientras que en los suelos cultivados (p) y (s) fue franca arenosa. El porcentaje de materia orgánica (MO) indicó contenidos altos en todos los tipos de uso, ya que superaron el 10%. De igual modo, en el porcentaje de N total se registraron valores altos en todos los suelos con diferente uso. El estimativo conceptual de la capacidad de intercambio catiónico fue alto (>20 meq· 100 g-1 de suelo) para todos los suelos. El P disponible presentó los valores más altos en los cultivos de papa 'Parda Pastusa' y 'Parda Suprema' (99,5 y 65,6 ppm, respectivamente) por efecto de la fertilización y para los suelos en descanso y bosque fue 16,0 y 5,9 ppm, respectivamente.
Aislamiento de hongos del suelo y selección de HSF a partir de micelio activo
Se aislaron hongos a partir de partículas de suelo mediante la técnica de lavado del suelo que, según Gams y Domsch (1967), permite el aislamiento de micelios adheridos a las partículas en estado activo y no, a partir de esporas y/o propágulos, como es lo usual por el método con diluciones de suelo. Las partículas se pasaron con ayuda de pinzas estériles a diferentes medios de cultivo; para el caso de hongos del suelo en estado de micelio activo, se utilizó agar-harina de maíz (Cabello y Arambarri, 2002), mientras que para el aislamiento de HSF el medio empleado fue el SRS (Sundara Rao y Sinha, 1963). Se colocaron cinco partículas por cada caja de Petri, para un total de 50 partículas por réplica (n = 3) para cada medio de cultivo empleado. Se incubaron a temperatura ambiente durante 8 d, para proceder luego a la determinación del porcentaje de colonización de partículas. Las cepas aisladas se transfirieron a cajas que contenían papa-dextrosa-agar (PDA), extracto de malta (AEM) y agar Czapeck (ACZ), para su purificación e identificación taxonómica siguiendo las claves propuestas de Von Arx (1974) y Domsch et al. (1980).
Capacidad relativa de solubilización de fosfatos
Se determinó la eficiencia relativa de solubilización de los aislamientos sobre el medio original de aislamiento (SRS), según Sundara Rao y Sinha (1963), en el que las colonias que desarrollan actividad solubilizadora se detectan mediante la formación de halos de transparencia y/o la acidificación del medio alrededor de ellas. Se tomó cada una de las cepas puras de HSP y se realizó un repique (disco de 8 mm de diámetro) en medio SRS (n = 4). Se dejó incubar a temperatura ambiente, registrando a los 10 d el diámetro de la colonia y de los halos de solubilización. Se calculó la relación diámetro de solubilización por diámetro de la colonia por cien para determinar la eficiencia de solubilización (Lapeyre et al., 1990).
Solubilización de Ca3(PO4)2 en medio líquido
Aquellas cepas de hongos que presentaron mayor halo de solubilización, se inocularon en medio SRS sólido y se dejaron durante 7 d a temperatura ambiente. Posteriormente, se prepararon tubos con 45 mL de medio SRS líquido con Ca3(PO4)2 como fuente mineral de fosfato (poco soluble) y sin indicador de pH, manteniéndose una concentración de P equivalente a 2,29 g· L-1 de P2O5. Estas alícuotas fueron inoculadas con discos de micelio de 8 mm de diámetro de los hongos con 8 d de crecimiento en SRS sólido, utilizando dos réplicas para cada aislamiento (Narsian et al., 1993). Se incubaron a temperatura ambiente durante 7 d con agitación constante de 160 rpm. Los controles negativos se realizaron utilizando alícuotas de 45 mL del medio sin inóculo, incubados bajo las mismas condiciones. Se tuvo un control positivo con un microorganismo de referencia (Penicillium janthinellum) utilizado como solubilizador de fosfato en un producto comercial (Fosfosol®).
Luego del período de incubación, las muestras fueron centrifugadas a 7.000 rpm por 10 min. Se registró el pH de cada muestra y se determinó el contenido de P disponible presente mediante un análisis espectrofotométrico, utilizando el método del molibdovanadato por medio de la prueba analítica Spectroquant® Fósforo (VM) Merck. Finalmente, se determinó la biomasa alcanzada para cada hongo por diferencia de peso, a través de filtración al vacío y secado a 95 °C por 24 h (Cunningham y Kuiack, 1992).
Recuento de bacterias fijadoras de N
Las muestras se procesaron para el conteo de células viables por series de dilución y la siembra en placa con medio NFB (Nitrogen Free Broth) (n = 3), que permite el aislamiento selectivo de bacterias con el sistema enzimático de la nitrogenasa (Döbereiner, 1994). Se incubaron a temperatura ambiente durante 3-5 d. Se realizaron los recuentos y la descripción macro y microscópica de los aislamientos obtenidos de las diluciones más altas.
Para la caracterización de las cepas, se tomaron colonias puras a partir de medio sólido para su identificación, utilizando el sistema analítico de paneles de identificación rápida BBL Crystal®. Adicionalmente, se realizaron pruebas bioquímicas complementarias para todos los morfotipos, tales como: prueba de oxidasa; fermentación de lactosa, glucosa, maltosa y sacarosa; reducción de nitratos; rojo de metilo (MR); prueba de Voges-Proskauer (VP), de citrato, de TSI (siglas en inglés de triple azúcar hierro), de LIA (siglas en inglés de agarlisina-hierro), de SIM (siglas en inglés de medio selectivo inductor de brotes) e hidrólisis de gelatina (Koneman, 2001). Para aquellos morfotipos que presuntamente pertenecían al género Azospirillum, se realizó la descripción morfológica de colonias en medio rojo congo, según Stanley et al. (1994).
Análisis estadístico
Con ayuda del programa Statgraphics versión 5.0, se realizaron análisis de regresión simple para determinar la relación entre el P solubilizado y la biomasa producida, así como su relación con el pH. Se realizó un análisis de varianza de una sola vía, para ver si había diferencias entre los hongos por su actividad solubilizadora, y la prueba de comparaciones múltiples de Duncan, para establecer cuáles eran los hongos con mayor o menor actividad solubilizadora. Para los recuentos de BFN se realizó un análisis de varianza factorial, con el fin de ver el efecto del tipo de uso del suelo sobre sus poblaciones, y una prueba de comparaciones múltiples de Duncan, para establecer en qué tipo de uso del suelo se presentó el mayor o menor número de BFN.
Resultados y discusión
Se obtuvo un total de 1.096 aislamientos distribuidos entre los cuatro suelos con diferente uso, a partir de un total de 1.800 partículas de suelo analizadas. El porcentaje de colonización por hongos en estado activo fue similar en los cuatro tipos de uso estudiados, con un rango entre 79% y 100% (figura 1).
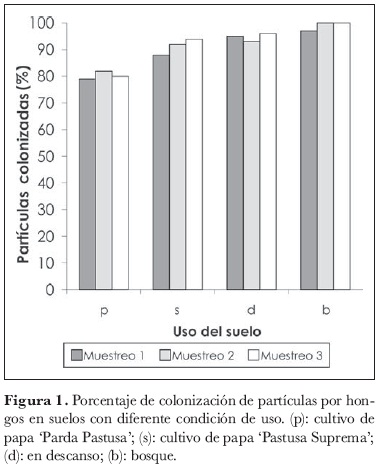
El medio agar-harina de maíz sirve de sustrato a un espectro amplio de hongos. No se presentaron diferencias en el porcentaje de colonización de las partículas lavadas, pero sí, en los morfotipos de hongos obtenidos con respecto al uso del suelo (tabla 2).
Se identificaron 14 géneros de microhongos, además de cinco en estado de micelio estéril, un micelio con presencia abundante de clamidosporas y uno del tipo basidiomycete. Los suelos en descanso y de bosque presentaron el mayor número de morfotipos de hongos (doce cada uno), con relación a los suelos cultivados con las dos variedades de papa [seis y ocho morfotipos para (p) y (s), respectivamente] (tabla 2); esto puede deberse a que aquéllos se hallan respectivamente en proceso de recuperación y no intervenidos, situación en la que se puede encontrar mayor cantidad de microorganismos funcionando de forma activa, mientras que en los suelos cultivados puede ocurrir la inhibición de ciertos grupos por efecto de los agroquímicos empleados (Nielsen y Winding, 2002), evidenciada gracias a la técnica de aislamiento empleada. Wardle et al. (1994) también registraron una reducción de las poblaciones de hongos activos en suelos cultivados con aplicación de plaguicidas y fertilizantes y una alta presencia de hongos en estados latentes, como propágulos de resistencia. En cuanto a los suelos cultivados, los de la variedad 'Parda Suprema' presentaron un ligero aumento en el número de morfotipos aislados (seis) con respecto a los de la variedad 'Parda Pastusa' (ocho), posiblemente por la menor aplicación de agroquímicos en estos suelos.
En los aislamientos de los microhongos, Mucor racemosus presentó una distribución amplia, excepto en los suelos de bosque, de donde no se aisló. Esta especie ha sido reportada habitando ambientes extremos y con diferentes grados de contaminación; es un hongo típico del suelo y la fertilización con NPK estimula su crecimiento (Domsch et al., 1980). Estos resultados ayudan a explicar el que se haya encontrado preferentemente en suelos de cultivo activo y en suelos en descanso.
En los suelos cultivados se encontraron aislamientos de Cylindrocarpon, género que se caracteriza por presentar un alto número de especies fitopatógenas que afectan cultivos de papa. De la misma forma, especies de los géneros Trichoderma y Gliocladium roseum, ahora reclasificado como Clonostachys rosea (Schroers et al., 1999), se aislaron de los suelos cultivados; estos hongos son micoparásitos de muchos hongos patógenos de plantas, aun de aquéllos que afectan a la papa (Li et al., 2002; Harman et al., 2004). En el caso de especies de Trichoderma, los mecanismos clásicos para biocontrol, además del micoparasitismo, incluyen antibiosis, competencia e inducción de respuestas de defensa en las plantas hospederas (Altomare et al., 1999).
En los suelos en descanso se presentaron dos especies de Trichocladium y una de Alternaria, comúnmente reportados como hongos celulolíticos, pero no se encontraron en los suelos de bosque y cultivos. Es probable que estas especies se seleccionaran, ya que su crecimiento es favorecido cuando las condiciones de uso se modifican. En contraste, otras cepas nativas, como Mucor sp1 y sp2, ven reprimida su actividad y no logran permanecer en los suelos donde se implementan las prácticas del monocultivo de papa.
Respecto al micelio de basidiomycete, se ha encontrado que ciertas especies de macrobasidiomycetes son potencialmente más importantes en la determinación de las tasas de descomposición y mineralización de nutrientes, además de ser vulnerables a disturbios debidos, en especial, al estrés por humedad y a las sales provenientes de fertilización (Lodge et al., 1996); esto podría explicar el hecho de haberlo aislado únicamente de los suelos de bosque.
En general, se presentaron especies exclusivas en los suelos con diferente uso. La técnica empleada de aislamiento a partir de su estado activo permitió diferenciarlas de aquellas especies provenientes de propágulos obtenidos por técnicas de aislamiento a partir de diluciones. En los suelos con las dos variedades de papa ('Parda Pastusa' y 'Parda Suprema'), se aislaron Trichoderma sp1, micelio con clamidosporas y Mucor racemosus, que se encontró además en el suelo en descanso. Es de anotar que, tanto en el suelo en descanso como de bosque, los aislamientos registrados corresponden a especies o morfotipos exclusivos, con excepción de Mucor racemosus, como se indicó arriba. De otra parte, es importante señalar que los mucorales Circinella sp., Mucor sp1, Mucor sp2 y Zygorrhynchus sp., presentes sólo en suelos de bosque, pueden ser microorganismos de interés como indicadores de uso, dada su sensibilidad a los fungicidas. Los microhongos tipo micelio estéril predominaron en el suelo en descanso, así como dos especies de Trichocladium (T. asperum y T. canadense).
Capacidad relativa de solubilización
Los valores más altos del índice de solubilización se presentaron en las cepas de Mucor sp1, Penicillium sp2, aislamientos s2 y d5 y Mucor racemosus (tabla 3). En todos los aislamientos hubo acidificación del medio de cultivo, evidenciado por el color del indicador de pH. Los aislamientos donde se presentaron los índices más bajos de solubilización fueron: Alternaria sp, seguido por Trichoderma koningii, Trichocladium canadense y Penicillium sp4. Estos valores superaron en algunos casos al mayor valor registrado por Valero (2003) para la bacteria Pseudomonas sp., con un índice de solubilización de 2,04 en ensayos en cultivos de arroz evaluados con la misma metodología.
Actividad solubilizadora de Ca3(PO4)2 en medio líquido
Los porcentajes más altos de P solubilizado se obtuvieron para los aislamientos d2, b2 y b6, correspondientes a Trichocladium canadense, Mucor sp1 y Penicillium sp2, que solubilizaron más de 15% del P insoluble presente en el medio (tabla 3). Trichocladium canadense presentó el porcentaje de solubilización más alto (17,4%), mientras que la especie T. asperum mostró uno de los valores más bajos (3,47%).
Los aislamientos con menor capacidad solubilizadora de fosfato fueron p1, b4, d3 y s2, pertenecientes a los diferentes tipos de uso del suelo. Estos datos fueron confirmados con la prueba de Duncan, en la que este grupo de hongos resultó con la menor actividad solubilizadora. De la misma forma, los porcentajes de solubilización obtenidos para todos los aislamientos fueron más bajos, respecto al control empleado (Penicilliumn janthinellum), pero mayores a los registrados por Cepeda et al. (2005) para hongos aislados en el páramo el Granizo, en donde el mayor porcentaje de solubilización fue para Penicillium spinulosum (16,35%) y el menor, para Mucor circinelloides (2,31%), evaluados con la misma metodología.
La mayor eficiencia de solubilización fue encontrada en hongos aislados en suelos con uso en descanso y de bosque. Probablemente la aplicación de fertilizantes inhibe la actividad solubilizadora de microhongos en cultivos de papa 'Parda Pastusa' y 'Parda suprema', en donde se registraron valores altos de P (>40 ppm) en el suelo. En otras investigaciones, se ha encontrado que la actividad solubilizadora de fosfato en diferentes microorganismos es afectada por la presencia de fosfatos solubles en el medio (Mikanová y Novaková, 2002). Al respecto, Goldstein (1986) comprobó que el incremento de la concentración de fosfato dicálcico en el medio de cultivo genera represión de la solubilización de fosfatos minerales en Erwinia herbicola. Esta bacteria inhibe parcialmente su capacidad de solubilización a partir 1 mM de fosfato dicálcico y completamente a una concentración de 20 mM. Chhonkar y Subba-Rao (1967) determinaron la actividad solubilizadora de fosfato mineral de varios hongos en un medio que contenía también una fuente de fosfato soluble (KH2PO4), comprobando la inhibición de la solubilización con el fosfato soluble y una alta actividad solubilizadora en el medio sin esta fuente de fosfato. Este efecto inhibitorio in vitro de altas concentraciones de fosfatos disponibles sobre la actividad solubilizadora microbiana presenta analogía en condiciones de campo. Así, las bajas concentraciones de P disponible encontrado en los suelos en descanso y de bosque (<20 ppm) propician el crecimiento y la actividad solubilizadora de los hongos.
Los altos valores de solubilización registrados para los aislamientos b2 y b6, correspondientes a Mucor sp1 y Penicillium sp2, coinciden con los resultados obtenidos en medio sólido. En contraste, los aislamientos s3, d2, d6, b1, b3 y b5, que corresponden a Penicillium sp4, Trichocladium canadense, Alternaria sp., Penicillium sp1, Mucor sp. y Humicola grisea, presentaron porcentajes altos de solubilización en medio líquido y los índices relativos de solubilización más bajos. De la misma forma, Gliocladium catenulatum, micelio de basidiomycete, micelio con clamidiosporas sp1, Trichocladium asperum y los aislamientos b4, p1, d3 y s2 presentaron índices relativamente altos en medio sólido, aunque las eficiencias de solubilización fueron las más bajas. Esto coincide con resultados obtenidos por otros autores, en los que no siempre una evaluación en medio sólido concuerda con lo obtenido en medio líquido (Whitelaw et al., 1999). Estos mismos investigadores comprobaron que el método cuantitativo es más sensible, lo que está acorde con los resultados obtenidos en ensayos de eficiencia en pruebas de campo. Los aislamientos s3 y b6, correspondientes a especies de Penicillium, registraron valores altos del porcentaje de solubilización. Es bien conocida la capacidad solubilizadora de fosfato entre especies de este género (Whitelaw et al., 1999), con las que se han desarrollado biofertilizantes comerciales, como es el caso del Fosfosol ® en el país.
Relación de P soluble y biomasa producida por HSF después de incubación
El análisis de varianza demostró que la biomasa producida no es estadísticamente significativa (P > 0,05). El análisis de regresión entre el logaritmo natural del P solubilizado y la biomasa mostró una relación baja entre las dos variables, puesto que la biomasa explica sólo un 9,56% de la variabilidad en el P soluble. Los aislamientos que solubilizaron mayor cantidad de P en el medio (d2, b2, b6, b3 y s3) produjeron cantidades similares de biomasa, con respecto a cepas con menor capacidad solubilizadora y al control. El aislamiento b3, perteneciente a una especie de mucoral, si bien presentó una baja producción de biomasa, su porcentaje de P solubilizado se encontró entre los valores más altos (14,72%). Esto permitió evidenciar el hecho de que una alta producción de biomasa no está necesariamente acompañada de una alta capacidad de solubilización de fosfatos.
Relación de fósforo soluble y pH
El análisis de varianza mostró que el pH es significativo, con un 95% de confianza (P < 0,05). El análisis de regresión para el P solubilizado (ppm) y el pH producido por las cepas de HSP luego del período de incubación estableció que el pH explica un 54,9% del P solubilizado. El pH está inversamente relacionado con el P solubilizado, como se observa en la figura 2 (m = -88,6). En estas condiciones experimentales, una disminución en 0,1 unidades del pH implica el aumento en 8,9 ppm del P solubilizado. Así mismo, las cepas que solubilizaron más P en el medio registraron valores de pH más bajos (4,4-4,6), como fue el caso de Trichocladium canadense, Mucor sp1, Penicillium sp2. Esto permite inferir que la producción de ácidos orgánicos es el principal mecanismo utilizado por estos microorganismos para la solubilización de fosfatos, como se registra en otros trabajos (Halstead y Mc Kerchner, 1975). La producción de ácidos orgánicos por los microorganismos solubilizadores de fosfato, además de ser una alternativa promisoria en la solubilización de fosfatos, puede emplearse con éxito en el tratamiento de contaminantes, en la extracción de varios metales provenientes de minerales que los contienen y también en el contexto de la fertilización mineral para incrementar la productividad de los cultivos (Vassilev et al., 1995).
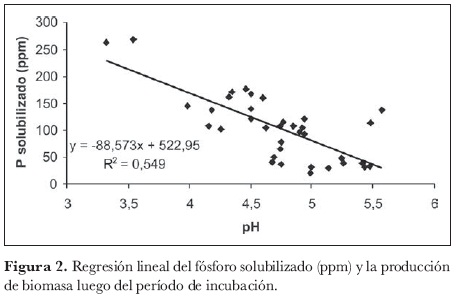
El hecho de que ciertos microorganismos del suelo sean capaces de disolver formas no solubles de compuestos fosfatados, abre la posibilidad de inducir la solubilización microbiana de fosfatos en el suelo (Goenadi et al., 2000), puesto que se ha visto que hongos que poseen actividad solubilizadora también participan en la promoción del crecimiento vegetal (Whitelaw et al., 1998).
Recuento y aislamiento de bacterias diazótrofas
El mayor recuento de bacterias fijadoras de N se obtuvo en los suelos de bosque, excepto para el primer muestreo, en el que se registró el menor valor (tabla 4) por corresponder a una muestra del mantillo y no edáfica. Se observó un efecto estadísticamente significativo del uso del suelo sobre los recuentos de poblaciones de bacterias diazotróficas, con el mayor valor para los suelos que se encuentran en descanso, con respecto a los cultivados.
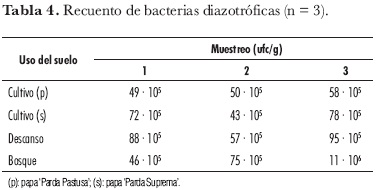
Estos últimos no presentaron diferencias significativas (P > 0,05). En forma análoga se ha comprobado un efecto significativo del uso del suelo sobre la abundancia de las poblaciones nativas de rizobios (Escobar, 2003).
Las muestras de suelo en el cultivo de papa 'Parda Pastusa' presentaron el menor número de bacterias diazotróficas, debido posiblemente a la mayor aplicación de agroquímicos requeridos en esta variedad. Es conocida la inhibición de poblaciones de BFN en presencia de altas concentraciones de N combinado, como úrea, nitratos y amonio (Balows et al., 1992). Por otro lado, se registraron los valores más altos de los recuentos de BFN en el tercer muestreo (cosecha), debido a que en esta época ya no se hace ninguna aplicación a los cultivos.
Se sabe que factores ambientales, tales como disponibilidad de fuentes de C y energía, presencia de N fijado, pH y humedad, afectan la abundancia y distribución de diazótrofos. La fijación de N por diazótrofos de vida libre se favorece en ambientes en donde hay deficiencia de N asimilable (Balows et al., 1992). Adicionalmente, los aislamientos de bacterias diazotróficas de los suelos en cultivo de papa pertenecen a géneros conocidos por presentar gránulos de reserva. Se ha reportado que la acumulación, degradación y utilización de poli Β-hidroxibutirato por parte de las bacterias en condiciones de estrés es un mecanismo que favorece su establecimiento, proliferación, supervivencia y competencia, especialmente en ambientes donde las fuentes de C y energía son limitadas (Park et al., 2005).
Los suelos en descanso (d), donde los recuentos de BFN fueron altos, presentaron la mayor variedad de morfotipos (cuatro), en comparación con los demás tipos de uso del suelo: en suelos cultivados, dos morfotipos en suelos (p) y tres morfotipos predominantes en suelos (s), y en suelos (b), tres morfotipos (tabla 5). Se sabe que la fijación biológica es una forma eficiente de incorporar N, con un papel importante en la actividad microbiana y, en consecuencia, en procesos de remediación, recuperación y fertilidad del suelo (Zahran, 2001; Bossuyt et al., 2001).
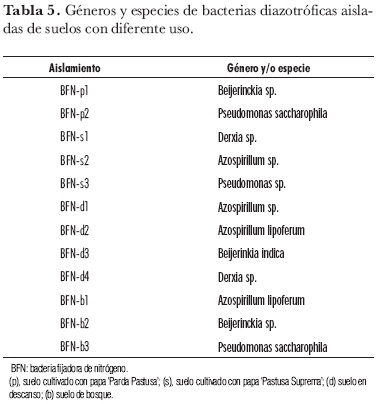
Los resultados de las pruebas bioquímicas revelaron especies de los géneros Azospirillum, Beijerinckia, Pseudomonas y Derxia (tabla 5). Estos géneros han sido ampliamente reconocidos como BFN de vida libre (Balows, 1992).
Las especies del género Derxia, encontradas en los suelos (s) y (d), están ampliamente distribuidas en suelos tropicales con alta humedad. En condiciones de páramo, los suelos presentan por lo general un contenido alto de humedad; este factor, junto con las condiciones de pH, favorecieron su presencia en estos suelos.
De otro lado, especies del género Beijerinckia, encontradas en los suelos (p) y (d), se caracterizan por habitar suelos muy ácidos de las regiones tropicales y sus requerimientos minerales están generalmente relacionados con el estado mineral de los suelos, estos microorganismos pueden ser usados como indicadores del contenido de hierro en suelos tropicales, puesto que pueden tolerar niveles extremadamente altos. En este caso los niveles de hierro fueron 180 ppm para (p) y 114 ppm para (d). También soportan valores de pH bajos (5,5-4,0 y algunas veces hasta 3,0) (Ballows, 1992), lo que explica el hecho de encontrarlos también en los suelos de bosque.
En suelos cultivados y de bosque se encontraron cepas pertenecientes a Pseudomonas. Estos microorganismos han sido aislados de la rizósfera de diversos cultivos de plantas (Park et al., 2005). Además, es bien conocida su versatilidad bioquímica, por la variedad de fuentes de C que pueden asimilar, permitiendo la colonización de varios ambientes (Madigan et al., 1998).
En general, los resultados obtenidos demuestran que grupos funcionales de microorganismos, como son los HSF y las BFN, pueden ser susceptibles a las perturbaciones que ocurren con el cambio en el uso del suelo, reduciendo el número de sus poblaciones y su diversidad en cuanto a morfotipos aislados. Se observó que en suelos en descanso y de bosque, con relación a los suelos de cultivos existen condiciones más favorables para el desarrollo de hongos, puesto que en los dos primeros se obtuvo mayor variedad de morfotipos, con predominancia de mucorales en los suelos de bosque. Estos suelos, de donde se originaron los sistemas agrícolas en estudio, mostraron morfotipos de hongos exclusivos, altas poblaciones de BFN y cepas de HSF con alta eficiencia de solubilización de fosfato.
La técnica de lavado del suelo empleada en este estudio, con la que se obtienen hongos a partir del estado de micelio activo, permitió el aislamiento de especies y/o morfotipos exclusivos de hongos según la condición de uso del suelo, diferenciándolos de aquellas especies provenientes de propágulos que se obtienen por aislamiento a partir de diluciones.
Nutrientes como el N y el P son limitantes del crecimiento vegetal; por esta razón, es fundamental el estudio y seguimiento de los grupos funcionales de microorganismos tratados en este trabajo, conjuntamente con los procesos fundamentales que ellos median, para poder diseñar estrategias que conduzcan al manejo sostenible de estos sistemas agrícolas, ya que la inhibición o disminución de las poblaciones en cuestión afecta directamente la fertilidad y la productividad de los suelos.
Agradecimientos
Los autores expresan su agradecimiento al Instituto para el Desarrollo de la Ciencia y la Tecnología Francisco José de Caldas (Colciencias), el Servicio Nacional de Aprendizaje (Sena) y la División de Investigación sede Bogotá de la Universidad Nacional de Colombia (DIB) por el apoyo financiero de esta investigación, parte del proyecto "Modelo para evaluar la calidad de las tierras dedicadas al cultivo de la papa en Cundinamarca". Igualmente al laboratorio de Microbiología del Suelo, Departamento de Biología, Universidad Nacional de Colombia, sede Bogotá, por la cofinanciación de este proyecto.
Literatura citada
Altomare, C., W.A. Norvell, T. Björkman y G.E Harman. 1999. Solubilization of phosphates and micronutrients by the plantgrowth-promoting and biocontrol fungus Trichoderma harzianum Rifai 1295-22. Appl. Environ. Microbiol. 65 (7), 2926-2933. [ Links ]
Anderson, T.H. 2003. Microbial eco-physiological indicators to asses soil quality. Agr. Ecosys. Environ. 98, 285-293. [ Links ]
Balows, A., H.G. Truper, M. Dworkin, W. Harder y K.H. Schleifer. 1992. The prokaryotes. A handbook on the biology of bacteria: ecophysiology, isolation, identification, applications. 2nd edition. New York. 4126 p. [ Links ]
Bossuyt, H., K. Denef, J. Six, S.D. Frey, R. Merckx y K. Paustian. 2001. Influence of microbial populations and residue quality on aggregate stability. Appl. Soil. Ecol. 16,195-208. [ Links ]
Cabello, M. y A. Arambarrí. 2002. Diversity in soil fungi from undisturbed and disturbed Celtis tala Gill. ex Planch and Scutia buxifolia Reiss forests in the eastern Buenos Aires province (Argentina). Microbiol. Res. 157(2), 115-125. [ Links ]
Castaño, C. (ed.). 2002. Páramos y ecosistemas altoandinos de Colombia en condición Hotspot y Global climatic tensor. Instituto de Hidrología, Meteorología y Estudios Ambientales (Ideam). Bogotá. 387 p. [ Links ]
Cepeda, M.L., A.M. Gamboa, H. Valencia y A. Lozano. 2005. Hongos solubilizadores de fosfatos minerales aislados de la rizósfera de Espeletia grandiflora del páramo el Granizo. En: Bonilla, M.A. (ed). Estrategias adaptativas de plantas del páramo y del bosque altoandino en la cordillera Oriental de Colombia. Departamento de Biología, Facultad de Ciencias, Universidad Nacional de Colombia, Bogotá. 353 p. [ Links ]
Chonkar, P.K. y N.S. Subba-Rao. 1967. Phosphate solubilization by fungi associated with legume root nodules. Can. J. Microbiol. 13, 749-753. [ Links ]
Cunningham, J. y K. Kuiack. 1992. Production of citric and oxalic acids and solubilization of calciumphosphate by Penicillium bilaii. Appl. Environ. Microbiol. 58, 1451-1458. [ Links ]
Das, A.C., A. Debnath y D. Mukherjee. 2003. Effect of the herbicides oxadiazon and oxyfluorfen on phosphates solubilizing microorganisms and their persistence in rice fields. Chemosphere 53, 217-221. [ Links ]
Dobereiner, J. 1994. Isolation and identification of aerobic N2 fixing bacteria from soil and plants. pp.1-16. En: Methods in applied soil microbiology and biochemistry. Academic Press, London. [ Links ]
Domsch K.H. y W. Gams. 1980. Compendium of soil fungi. Vol. 1, 2. Academic Press, London. 859 p. [ Links ]
Escobar, L.F. 2003. Efecto del sistema de uso del suelo sobre la abundancia de poblaciones nativas de rizobios en la microcuenca Potrerillo, departamento del Cauca. Trabajo de grado. Facultad de Ciencias, Pontificia Universidad Javeriana, Bogotá [ Links ].
Filip, Z. 2002. International approach to assessing soil quality by ecologically-related biological parameters. Agr. Ecosys. Environ. 88, 169-174. [ Links ]
Foissner, W. 1999. Soil protozoa as bioindicator: pros and cons, methods, diversity, representative examples. Agr. Ecosys. Environ. 74, 95-112. [ Links ]
Gams, W. y K.H. Domsch. 1967. Beiträge zur Anwendung der Bodenwaschtechnik für die Isolierung von Bodenpilzen mit selektiven Verfahren. Zentbl. Bakt. Parasit. Kde Abt. 1 Suppl. 1, 461-485. [ Links ]
García, J.F., D.C. García y M. Correa. 2005. Incidencia de micorrizas arbusculares y vesículo-arbusculares como estrategia adaptativa de plantas del páramo y del bosque altoandino. En: Bonilla, M.A. (ed.). Estrategias adaptativas de plantas del páramo y del bosque altoandino en la cordillera Oriental de Colombia. Departamento de Biología, Facultad de Ciencias, Universidad Nacional de Colombia, Bogotá. 353 p. [ Links ]
Goenadi, D., H. Siswanto y Y. Sugiarto. 2000. Bioactivation of poorly soluble phosphate rocks with a phosphorus-solubilizing fungus. Soil Sci. Soc. Amer. J. 64, 927-932. [ Links ]
Goldstein, A.H. 1986. Bacterial solubilization of mineral phosphates: historical perspective and future prospects. Amer. J. Alternat. Agric. 1, 51-57. [ Links ]
Halstead, R.L. y R.B. McKercher. 1975. Biochemistry and cycling of phosphorus. En: Paul, E.A. y A.D. McLaren (eds.). Soil biochemistry. Vol. 4. Marcel Dekker, New York. pp. 50-54. [ Links ]
Harman, G.E., C.R. Howell, A. Viterbo, I. Chet y M. Lorito. 2004. Trichoderma species opportunistic, avirulent plant symbionts. Nature Microbiol. Rev. 2, 43-56. [ Links ]
Hoffman, J., J. Bezchlebová, L. Dusek, L. Dolezal, I. Holoubek, P. Andel, A. Ansorgová y S. Maly. 2003. Novel approach to monitoring of the soil biological quality. Environ. Intl. 28, 771-778. [ Links ]
Holt, J.G., N.R. Krieg, P.H.A. Sneath, J.T. Staley y S.T. Williams (eds.). 1994. Bergey´s manual of determinative bacteriology. Ninth edition. William and Wilkins, Baltimore, MD. 787 p. [ Links ]
Koneman, E.W. 2001. Diagnóstico microbiológico: texto y atlas a color. Quinta edición. Editorial Médica Panamericana, Buenos Aires. 533 p. [ Links ]
Lapeyre, R., J. Ranger y D. Vairelles. 1990. Phosphate-solubilizing activity of ectomycorrhizal fungi in vitro. Can. J. Microbiol. 69, 342-346. [ Links ]
Li, G.Q., H.C. Huang, E.G. Kokko y S.N. Acharya. 2002. Ultrastructural study of mycoparasitism of Gliocladium roseum on Botrytis cinerea. Bot. Bull. Acad. Sin. 43, 211-218. [ Links ]
Lodge, D.J., D.L. Hawksworth y B.J. Ritchie. 1996. Microbial diversity and tropical forest functioning. En: Orians, G.H., R. Dirzo y J.H. Cushman.(eds.). Biodiversity and ecosystem processes in tropical forests. Springer-Verlag, Berlin. pp. 69-100. [ Links ]
Madigan, M.T., J.M. Martinko y J. Parker. 1998. Brock biology of microorganisms. Prentice Hall Iberia, Madrid. 986 p. [ Links ]
Mikanová, O. y J. Novaková. 2002. Evaluation of the P-solubilizing activity of soil microorganisms and its sensitivity to soluble phosphate. Rostl. Vyr. 48(9), 397-400. [ Links ]
Narsian, V., J. Thakkar y H. Patel. 1993. Solubilization of natural rock phosphates and pure insoluble inorganic phosphates by Aspergillus awamori. Indian J. Expt. Biol. 31, 747-749. [ Links ]
Nielsen, M.N y A. Winding. 2002. Microorganisms as indicators of soil health. Technical report (388). National Environmental Research Institute, Denmark. 84 p. [ Links ]
Pankhurst, C. y B.M. Doube. 1997. Biological indicators of soil health. CAB International, Washington. 451 p. [ Links ]
Park, M., C. Kim, J. Yang, H. Lee, W. Shin, S. Kim y T. Sa. 2005. Isolation and characterization of diazotrophic growth promoting bacteria from rhizosphere of agricultural crops of Korea. Microbiol. Res. 160, 127-133. [ Links ]
Schroers, H.J., G.J. Samuels, K.A. Seifert y W. Gams. 1999. Classification of the mycoparasite Gliocladium roseum in Clonostachys as C. rosea, its relationship to Bionectria ochroleuca, and notes on other Gliocladium-like fungi. Mycologia 91(2), 365-385. [ Links ]
Steenhoudt, O. y J. Vanderleyden. 2000. Azospirillum, a free-living nitrogen-fixing bacterium closely associated with grasses: gene-tic, biochemical and ecological aspects. FEMS Microbiol. Rev. 24(488), 487-506. [ Links ]
Sundara, R. y M. Sinha. 1963. Organisms phosphate solubilizers in soil. Soil Sci. Plant Nutr. 9(2), 45-49. [ Links ]
Valencia, H. 2005. Manual de prácticas en microbiología. Departamento de Biología, Facultad de Ciencias, Universidad Nacional de Colombia, Bogotá. 140 p. [ Links ]
Valero, V.N. 2003. Potencial biofertilizante de bacterias diazotrofas y solubilizadoras de fosfatos asociadas al cultivo de arroz (Oryza sativa L.). Tesis de maestría. Facultad de Ciencias, Universidad Nacional de Colombia, Bogotá [ Links ].
Van Elsas, J.D., P. Garbeva y J. Salles. 2002. Effects of agronomical measures on the microbial diversity of soils as related to the suppression of soil-borne plant pathogens. Biodegradation 13, 29-40. [ Links ]
Vassilev, N., M. Baca, M. Vassileva, I. Franco y R. Azcon. 1995. Rock phosphate solubilization by Aspergillus niger grown on sugar-beat waste medium. Appl. Microbiol. Biotechnol. 44, 546-549. [ Links ]
Von Arx, J.A. 1974. The genera of fungi sporulating in culture. AR Gantner Verlag y Strauß and Cramer GmbH, Leutershausen (Germany). 315 p. [ Links ]
Wardle, D.A., K.S. Nicholoson y A. Rahman. 1994. Influence of herbicide applications on the decomposition, microbial biomass, and microbial activity of pasture shoot and root litter. New Zealand J. Agr. Res. 37, 29-39. [ Links ]
Weber, O.B., L.M. Cruz, J.I. Baldani y J.D. Bereiner. 2001. Herbaspirillum-like bacteria in banana plants. Braz. J. Microbiol. 32(3), 201-205. [ Links ]
Whitelaw, M. 1998. Growth promotion of plants inoculated with phosphate solubilizing fungi. Soil Biol. Biochem. 33, 4-19. [ Links ]
Whitelaw, M., T. Harden y K. Helyar. 1999. Phosphate solubilisation in solution culture by the soil fungus Penicillium radicum. Soil Biol. Biochem. 31, 655-665. [ Links ]
Zahran, H.H. 2001. Rhizobia from wild legumes: diversity, taxonomy, ecology, nitrogen fixation and biotechnology. J. Biotechnol. 91, 143-153. [ Links ]














