Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Agronomía Colombiana
Print version ISSN 0120-9965
Agron. colomb. vol.24 no.1 Bogotá Jan./June 2006
FISIOLOGÍA DE CULTIVOS
Implicaciones fisiológicas de la osmorregulación en plantas
Physiological implications of osmoregulation in plants
Loyla Rodríguez-Pérez1
1 Profesora, Universidad de Cundinamarca, sede Fusagasugá y Universidad de Ciencias Aplicadas y Ambientales (UDCA), Bogotá. e-mail: loylarp@yahoo.com
Resumen:
En condiciones naturales, las plantas están expuestas a condiciones ambientales cambiantes que determinan respuestas complejas que influyen en el crecimiento, desarrollo y productividad de los cultivos. Las condiciones de sequía y salinidad en los suelos son las mayores causas de estrés en los cultivos y ocasionan pérdidas económicas en la agricultura mundial. Tanto la sequía como la salinidad resultan en estrés osmótico, que inhibe el crecimiento y causa perturbaciones a nivel metabólico. El reconocimiento de los mecanismos bioquímicos y fisiológicos involucrados en la osmorregulación ante estrés osmótico permite implementar nuevas estrategias para el manejo y mejoramiento de los cultivos en condiciones de estrés hídrico y salino. El transporte de agua por acuaporinas, el cierre estomático, la síntesis de osmolitos compatibles, el transporte de iones a través de sistemas selectivos de sodio y potasio y los no selectivos localizados en las membranas biológicas y la etrusión y ompartimentalización de sodio, son mecanismos reconocidos en las plantas para adaptarse y tolerar cambios en el potencial hídrico. La osmorregulación da a las plantas capacidad para tolerar condiciones de escasez de agua y salinidad elevada, con la expresión de mecanismos adaptativos que evitan disminución de la fotosíntesis, alteraciones en la traslocación y distribución de fotoasimilados y pérdidas en rendimiento, hechos significativos en el funcionamiento normal de la planta y en la productividad de los cultivos. Este artículo tiene como objetivo revisar los hallazgos más recientes sobre el proceso de osmorregulación en plantas cultivadas expuestas a estrés por déficit hídrico y por salinidad en el suelo.
Palabras claves adicionales: ajuste osmótico, estrés, salinidad, sequía.
Abstract:
Under natural conditions, the plants are exposed to changing environmental conditions that determine complex respuests that influence in the growth, development and productivity of the crops. The conditions of drought and salinity in the soils are the greater causes of stress in the crops and cause lost economic in the world agriculture. The drought as the salinity are osmotic stress that inhibits the growth and cause interferences at metabolic level. The recognition of the biochemical and physiologic mechanisms involved in the osmoregulation involved in the osmotic stress allows to implement new strategies for the handling and improvement of the cultivations under conditions of stress hidric and saline. Different mechanisms are recognized through which the plants manage to adapt and to tolerate the changes in the water potential, between which stand: the water transport by acuaporins, the estomatic closing, the synthesis of compatible osmolites, the ión transport through selective systems of sodium and potassium and those not selective located in the biological membranes and the etrution and compartimentalization of sodium. The osmoregulation confers to the plants the capacity to tolerate conditions of drought and high salinity, with the expression of adaptative mechanisms that avoid the reduction of the photosynthesis, alterations in the allocation photoasimilates and losses in yield, facts that have significant transcendency in the normal physiology of the plant and in the productivity of the crops. The present review has as central objective, to report the discoveries more recent envelope the smorregulation process in exposed cultivated plants to stress by water deficit and by salinity in the soils.
Additional keyword: osmotic adjustment, stress, salinity, drought.
Introducción
LA DISTRIBUCIÓN DE LAS PLANTAS sobre la tierra depende de la presencia e intensidad de diversos factores bióticos y abióticos. En condiciones naturales, las plantas se encuentran continuamente sometidas a situaciones ambientales cambiantes, lo que trae como consecuencia una serie de estímulos que influyen en el desarrollo y productividad de los cultivos. Entre los factores que generan estrés se incluyen principalmente aquéllos provenientes de: la acción de organismos vivos y de alguna actividad antropogénica; las variaciones en las condiciones ambientales, tales como temperaturas altas o bajas; la salinidad excesiva; la escasez o el exceso de agua; los cambios en la intensidad de la luz y la carencia de nutrientes; estos aspectos afectan en mayor o menor escala la vida de las plantas (Cushman, 2001; Chynnusamyy et al, 2005).
Las condiciones de sequía y salinidad en el suelo son factores que limitan la productividad de los cultivos en el mundo. Levitt (1980) define el estrés ambiental como un cambio en las condiciones del medio que reduce el crecimiento. Los estreses ambientales provocan en las plantas respuestas complejas y constituyen un problema fundamental para la agricultura, ya que influyen sobre la supervivencia y la productividad de los cultivos. Las respuestas vegetales se manifiestan a nivel celular, tisular u orgánico y afectan los procesos bioquímicos, fisiológicos y del desarrollo (Larcher, 2003). Son caracteres de variación continua controlados por un importante número de genes, cuya expresión es inducida bajo condiciones de estrés abiótico, los cuales codifican proteínas funcionales y proteínas regulatorias específicas. Entre proteínas funcionales se destacan: las proteínas de membrana, las proteinasas, los factores de protección o macromoléculas(chaperonasyproteínasabundantesen la embriogénesis tardía), las proteínas reguladoras de la síntesis de compuestos osmoprotectores y las enzimas desintoxicantes. En las proteínas regulatodas se incluyen: los factores de transcripción, las proteínas reguladoras cinasas, las fosfatasas y las fosfolipasas (Shinozaki y Yamaguchi, 1997).
La agricultura es la principal consumidora de agua en el mundo y uno de los factores más limitantes para el futuro. Las reservas de agua en el planeta han ido disminuyendo con el creciente aumento de la población y de las prácticas agrícolas (IFPRI, 2005). Debido a que la agricultura consume 70% del agua utilizada por el hombre, es importante ahorrar este recurso, implementando técnicas agrícolas que tiendan a reducir su consumo. La disponibilidad de agua es uno de los factores cruciales que modula el crecimiento de las plantas; en el estrés hídrico incluye tanto la sequía como la salinidad, factores importantes para la agricultura, ya que impiden a los cultivos desarrollar su potencial genético (Zhu, 2002; Zhu, 2003).
El presente artículo tiene como objetivo central hacer una revisión sobre los hallazgos más recientes sobre el proceso de osmorregulación en plantas cultivadas expuestas a estrés por déficit hídrico y por salinidad en el suelo.
Importancia del agua en las plantas
El agua es el componente predominante de los organismos y, por tal razón, interviene en la regulación de los procesos biológicos. Es importante para las plantas por el papel crucial que cumple en los procesos fisiológicos y por la gran cantidad que requieren (Steudle, 2000; Andreev, 2001). El agua comprende 80% a 90% de la biomasa de tejidos vegetales, presente en varias formas: como constituyente del protoplasma; como agua de hidratación asociada con iones, disolviendo sustancias orgánicas y macromoléculas, llenando espacios entre estructuras finas del protoplasma y la pared celular, almacenada en las vacuolas y, finalmente, como agua intersticial, que actúa como medio transportador en los espacios intercelulares y en los tejidos de conducción del xilema y el floema (Larcher, 2003; Zyalalov, 2004).
Por su polaridad, el agua actúa como solvente universal, disolviendo gran cantidad de iones y metabolitos orgánicos polares, como azúcares, aminoácidos y proteínas, compuestos críticos para el metabolismo. A nivel de la planta completa, el agua es el medio que transporta carbohidratos, nutrientes y fitohormonas indispensables para el metabolismo vegetal. En condiciones de alta concentración de solutos, las células ejercen presión de turgencia contra las paredes celulares, lo que soporta el crecimiento celular. Cuando las células pierden turgencia, no llevan a cabo el alargamiento y expansión y, si esto ocurre por periodos largos de tiempo, la planta se deshidrata y muere (Zyalalov, 2004).
El uso eficiente de agua por las plantas terrestres favorece el balance energético de la hoja, ya que el agua evaporada desde las células del mesófilo enfría las superficies foliares (Larcher, 2003; Zyalalov, 2004). La corriente transpiratoria también favorece el transporte de nutrientes inorgánicos procedentes del suelo y el transporte de solutos orgánicos, aminoácidos y fitohormonas desde la raíz a los órganos en transpiración, aunque se destaca que el transporte por el xilema también ocurre en ausencia de transpiración (Larcher, 2003; Zyalalov, 2004; Canny, 2001; Steudle, 2000; Andreev, 2001).
Potencial hídrico
La ósmosis es un proceso central en todos los seres vivos, que transporta el agua por el simplasto de las plantas para mantener su contenido a nivel celular. El estado del agua en los suelos, las plantas y la atmósfera es descrito en términos de potencial hídrico (Ψ) y consta de varios componentes importantes para las células y sus alrededores: el potencial osmótico (Ψs) está determinado por la concentración de sustancias osmóticamente activas; el potencial mátrico (Ψm) registra la capacidad de adsorción de las matrices celulares; el potencial de presión registra (Ψp) las presiones en exceso que actúan sobre un sistema y el potencial gravitacional (Ψg) es consecuencia de las diferencias de altura con el nivel de referencia
(Larcher, 2003). En dos compartimientos de diferente potencial hídrico separados por una membrana semipermeable, el agua se mueve desde el compartimiento de un alto potencial hídrico hacia el de bajo potencial hídrico. Las diferencias en potencial hídrico ofrecen la posibilidad de ocurrencia de un proceso que permite mantener la homeostasis celular, ya sea por transporte de agua y otras sustancias entre células, tejidos y órganos (iones, carbohidratos, aminoácidos, etc.) a favor de gradientes de potencial hídrico (Zyalalov, 2004; Canny,
2001; Steudle, 2000; Andreev, 2001).
Mecanismos de osmorregulación y transporte de agua
El movimiento de agua en tejidos vegetales es de importancia crucial para el crecimiento de la planta y ocurre básicamente a través de tres rutas: el apoplasto, el simplasto y la ruta transcelular. Esta última es definida como el transporte de agua a través de cada célula, a través del plasmalema y tonoplasto de cada célula sin involucrar plasmodesmos (Zyalalov, 2004; Steudle, 2000). Las raíces de la mayoría de angiospermas poseen endodermis, tejido con una estructura impermeable al agua, que es la banda de Caspary ubicada en las paredes radiales de las células. El córtex es permeable al agua y ésta puede moverse por el apoplasto y el simplasto hasta llegar a la endodermis, donde se mueve simplásticamente en raíces jóvenes y apoplásticamente en raíces adultas. En el córtex y la estela, las células están conectadas por plasmodesmos y el movimiento de agua puede ser vía el simplasto, el apoplasto, transcelular o por una combinación de estas rutas (Zyalalov, 2004; Canny, 2001; Steudle, 2000).
Para sobrevivir y desarrollarse de forma normal, las plantas perciben constantemente cambios en el ambiente circundante y responden a través de una variedad de mecanismos moleculares. Los procesos por los cuales las células vegetales son sensibles a modificaciones extracelulares son de importancia crucial para la supervivencia vegetal y, en consecuencia, para el mantenimiento de la vida animal. Uno de los estreses abióticos más importantes para la productividad de los cultivos se relaciona con la deshidratación vegetal bajo niveles de alta salinidad, sequía y condiciones de baja temperatura. Cada uno de estos factores genera estrés hiperosmótico, caracterizado por el incremento en la concentración de solutos en
la célula y el descenso en la presión de turgencia por pérdida de agua (Zyalalov, 2004). La deshidratación de las células induce la biosíntesis, la descompartimentalización y el transporte de la fitohormona ácido absícico (ABA), que induce el cierre de los estomas para reducir la transpiración (Zhu, 2003). El uso de componentes comunes y vías de respuesta vegetal relacionadas con estreses permite a las plantas responder parcialmente a un rango de condiciones adversas después de ser expuestas a un tipo de estrés específico (Boudsocq, 2005; Zyalalov, 2004; Canny, 2001; Steudle, 2000; Andreev, 2001).
Aun cuando la irrigación no esté disponible, el conocimiento de las relaciones hídricas puede contribuir al diseño y propuesta de estrategias de manejo de cultivos, en los que la esistencia a la sequía pueda ser un rasgo importante para seleccionar. Este conocimiento también provee elementos para el manejo de los cultivos y asegura que el estrés hídrico sea minimizado en fases críticas del crecimiento (Cushman, 2001).
Cada vez que el contenido de agua cambia durante la hidratación o la deshidratación, o cuando el contenido de solutos se incrementa o disminuye, ocurren cambios en la concentración de solutos en el citosol bajo el control regulatorio de la célula. La respuesta pasiva es definida como ajuste osmótico y la respuesta completa es denominada osmorregulación. Inicialmente, se pensó que el ajuste osmótico ocurría tan sólo en plantas sometidas a altas salinidades, pero después se estudiaron casos en los que las plantas crecían en suelos secos y se realizaron muchos trabajos para determinar el efecto del estrés hídrico sobre el crecimiento vegetal (Cushman, 2001; Zyalalov, 2004; Steudle, 2000; Andreev, 2001).
El ajuste osmótico proporciona un medio de mantenimiento del contenido de agua en la célula, importante para la actividad celular (Aharon et al., 2003; Javot et al., 2003; Bartels y Ramanjalu, 2005). Debido a que la pérdida de agua puede incrementar la concentración de solutos en la célula, las moléculas que regulan el metabolismo pueden ser afectadas. Así, algunos iones inorgánicos, tales como potasio, calcio, magnesio y cloro, no pueden ser metabolizados o incorporados dentro de la estructura celular y se acumulan en situaciones de deshidratación (Zyalalov, 2004; Canny, 2001; Steudle, 2000; Andreev, 2001). Ya que estos iones juegan papeles de regulación de enzimas, la actividad enzimática puede verse afectada; de esta forma, las enzimas que requieran K+ pueden ser afectadas si la concentración de este ión se incrementa. Además de los efectos de la pérdida de agua sobre su concentración, las plantas expuestas a altas salinidades externas presentan un problema extra de altas concentraciones de NaCl, y muchas enzimas se verán inhibidas por altas concentraciones de sal, aun en plantas halófitas (Zyalalov, 2004; Canny, 2001; Steudle, 2000; Andreev, 2001).
Acuaporinas y mantenimiento de la turgencia
Las acuaporinas (AQP) son canales por los que se transporta agua en las células vegetales y juegan un papel dinámico en el mantenimiento de la homeostasis celular bajo condiciones que requieren modificaciones en el flujo de agua. Puede requerirse cambios en el suministro y la asignación de agua para restablecer las alteraciones en el potencial osmótico celular y, por lo tanto, es posible que la actividad de las AQP sea crucial (Uehlein et al., 2003; Maurel et al., 2002). Estímulos ambientales como la sequía y la salinidad inducen incrementos en los niveles de ácido abscícico (ABA), asociado a la percepción del estrés osmótico en el tonoplasto y en la membrana plasmática (Maurel et al., 2002).
Evidencias recientes soportan el papel de las AQP en el mantenimiento de las relaciones hídricas y proveen información sobre su función en la tolerancia al estrés por sequía (Aharon et al., 2003; Javot et al., 2003; Bartels y Ramanjalu, 2005). El estrés hídrico y el estrés salino requieren cambios en el flujo de agua para permitir a las células y a los tejidos adaptarse a esta situación. La tasa de flujo del agua dentro y fuera de las células está determinada por el gradiente de potencial hídrico, que actúa como fuerza de conducción para el transporte. Las proteínas AQP facilitan la osmosis por formación de canales, como alternativa de difusión de agua a través de la membrana celular, incrementando la permeabilidad de ésta (Tyerman et al., 2002).
De acuerdo a su secuencia proteínica y localización en la membrana celular, las AQP pueden ser clasificadas en cuatro superfamilias:proteínas intrínsecas de la membrana plasmática (PIP), proteínas intrínsecas del tonoplasto (TIP,siglas en inglés de tonoplast intrinsic proteins),proteínas intrínsecas-nodulina (NIP, siglas en inglés de nodulin intrinsic proteins) y proteínas intrínsecas pequeñas (SIP,siglas en inglés de small intrinsic proteins) (Bartels y Ramanjulu, 2005; Smith-Espinosa et al., 2003, Sánchez, 2003).
Las AQP están conformadas por seis dominios transmembrana unidos por las asas A, B, C, D, E y F (figura 1). Presentan segmentos intracelulares amino y carboxilo terminal y la mayoría son tetraméricas, aunque algunas pueden formar oligómeros más pequeños, como la AQP4. La permeabilidad de las AQP al agua es alta, del orden de 3·109 moléculas de agua por segundo. La fosforilación dependiente de Ca2+ causa una estimulación en su actividad (Javot y Maurel, 2002; Bartels y Ramanjulu, 2005; Smith-Espinosa et al., 2003; Tyerman et al., 2002; Hill et al., 2004; Sánchez, 2003).
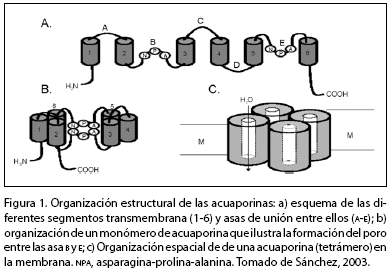
Por su localización subcelular, las acuaporinas PIP y TIP parecen ser buenas candidatas para regular de manera diferencial el transporte de agua en el tonoplasto y en la membrana plasmática. La regulación de las PIP en las células de la raíz juega un papel clave en el control del suministro de agua, mientras que el papel de las TIP se relaciona con el control del transporte de agua transcelular (Javot y Maurel, 2002; Bartels y Ramanjulu, 2005).
Es importante destacar que las AQP se expresan preferencialmente en la elongación celular. El equilibrio eficiente del agua entre células vecinas en tejidos en expansión puede ser requerido para facilitar el suministro de agua desde los tejidos vasculares y permitir el crecimiento inducido a favor de gradientes de potencial hídrico (Javot y Maurel, 2002). Es interesante observar que los tipos celulares que corresponden a puntos de convergencia para el flujo radial de agua parecen ser ricos en canales de agua, en particular, en el caso de las células de la epidermis, de la endodermis y de las células que rodean los vasos de xilema. Una membrana rica en AQP puede ser necesaria para facilitar el flujo intenso de agua a través de estas células. Aquéllas pueden representar puntos críticos en los que puede ejercerse un control eficiente del suministro de agua (Javot y Maurel, 2002; Bartels y Ramanjulu, 2005; Smith-Espinosa et al., 2003; Tyerman et al., 2002; Hill et al., 2004).
Compuestos osmoprotectores
El ajuste osmótico mantiene el contenido celular de agua cuando se presenta una reducción en el potencial osmótico, como consecuencia de la acumulación de solutos orgánicos en el citoplasma y en la vacuola en situaciones de estrés por salinidad en el suelo (Serraj y Sinclair, 2002). Los solutos compatibles (osmolitos, citosolutos) son metabolitos hidrofílicos, entre los que se destacan azúcares (sacarosa y fructosa), aminoácidos (prolina y betaína), glicerol, manitol y otros metabolitos de bajo peso molecular (Chen y Murata, 2002). Los solutos compatibles no interfieren con el metabolismo normal de las células; se acumulan en el citoplasma y en la vacuola en altas concentraciones bajo condiciones de estrés osmótico, tienen un papel primario en el mantenimiento de la disminución del potencial osmótico en el citosol y están involucrados en la estabilidad de proteínas y estructuras celulares (Zhu, 2003; Cushman, 2001; Bartels y Ramanjalu, 2005).
En general, son varios los efectos de los solutos compatibles en las plantas: los azúcares interactúan con las cabezas polares de los fosfolípidos para prevenir la fusión de la membrana (Chen y Murata, 2002). Las plantas sujetas a estrés muestran acumulación de prolina y otros aminoácidos; el papel que juegan estos aminoácidos es variable: pueden actuar como osmolitos en la regulación del transporte de iones y en la detoxificación de metales pesados; además tienen efecto en la síntesis y la actividad enzimática (Ray, 2002). En trigo se observa que la actividad de glucanil kinasa (GK), prolina y clicina betaína se incrementa durante el estrés y tienen mayor actividad en los brotes que en las raíces (Nayyar, 2003). En plantas de maíz se observa un incremento considerable en la acumulación de prolina; igualmente, se presenta un incremento en la actividad de la enzima prolina deshidrogenada (PDH), tanto en maíz com en trigo. Los brotes de maíz bajo estrés muestran potenciales hídricos altos y en las dos especies se presenta un incremento en la concentración de osmolitos (Ghoulam et al., 2002; Nayyar, 2003).
También, en caña de azúcar la acumulación de prolina aumenta en las plantas sometidas a estrés salino, especialmente en raíces y vainas foliares, siendo este incremento mayor para el genotipo sensible, excepto en la lámina foliar de la hoja más joven (García et al., 2003).
Efecto de las sales sobre las plantas y la productividad de los cultivos
De acuerdo con la tolerancia a las condiciones de salinidad en el suelo, las plantas pueden ser clasificadas en aquéllas que requieren o toleran altas concentraciones de sales, o halófitas, y las que no toleran la presencia excesiva de sales, o glicófitas. Existen categorías intermedias entre ambos grupos -pseudohalófitas-, así como plantas que, sin ser halófitas, requieren sodio como elemento esencial. La sensibilidad de las plantas a las sales cambia durante el desarrollo fenológico, dependiendo de la especie, el cultivar y factores ambientales (Munns, 2002).
En las últimas décadas, las investigaciones sobre los efectos de la salinidad de los suelos en los cultivos reflejan la importancia de este problema para la agricultura mundial. El estrés salino es uno de los factores ambientales adversos que influye sobre aspectos de la fisiología de las plantas, lo que a su vez limita la productividad de los cultivos de interés económico. La salinidad reduce la capacidad de las plantas para absorber agua, ocasionando una reducción en el crecimiento (Munns, 2002). Altas concentraciones de sales en la solución externa de las células vegetales ocasiona varios efectos, que pueden resumirse fundamentalmente en tres tipos: sequía osmótica, toxicidad debida a la excesiva absorción de cloro y sodio y un desbalance nutricional (Trinchant et al., 2004; Karimi et al., 2005).
El estrés osmóticoes provocado por el bajo potencial hídrico en el suelo y reduce los rendimientos de una amplia variedad de cultivos en el mundo y el nivel de ácido abscísico (ABA) se incrementa, desencadenando el cierre estomático y el ajuste osmótico, entre otras respuestas (Zhu, 2003; Taylor et al., 2000; Zhu, 2002).
La toxicidad debida a la excesiva absorción de cloro y sodio produce clorosis marginal de la hoja y con ello, una disminución del área fotosintética, lo que determina reducciones en la fotosíntesis neta, como resultado del aumento de la respiración en los órganos de la planta. La respiración de mantenimiento incrementa los requerimientos de carbohidratos para producir la energía necesaria para el transporte de iones, la compartimentalización de iones y la reparación de daños celulares. Otros efectos de la toxicidad de sales son la disminución en la síntesis de proteínas, disminución en la conductancia estomática, síntesis de pared celular y expansión celular (Bartels y Ramanjulu, 2005; Munns, 2002). El desbalance nutricional afecta la absorción y el transporte de otros nutrientes, influyendo de esta manera sobre la disponibilidad de Zn, Fe, P, Ca, K, Mg, Mn y Cu, entre otros (Munns, 2002).
Transportadores de alta y baja afinidad para K+ y Na+
La homeostasis de la concentración de iones intracelular es fundamental para la fisiología de las células vivas. La regulación del flujo iónico es necesaria para que las células mantengan baja la concentración de iones tóxicos y para la acumulación de iones esenciales. Las células vegetales emplean el transporte activo primario, mediado por ATPasas-H+, y el transporte activo secundario, mediado por canales y cotransportadores, para mantener en el citosol concentraciones altas de K+ y bajas de Na+. El equilibrio intracelular de Na+ y K+ es importante para las actividades de muchas enzimas citosólicas y para mantener el potencial de membrana, importante para el transporte de iones (Bartels y Ramanjulu, 2005; Munns, 2002).
Bajo estrés salino, el mantenimiento de la homeostasis de K+ y Na+ es de vital importancia en células vegetales; así mismo, es de gran importancia para la agricultura entender cómo las plantas toleran concentraciones excesivas de Na+ en el suelo, ya que la salinidad de suelos causa grandes pérdidas de rendimiento en los cultivos (Hasegawa et al., 2000). Las concentraciones altas de Na+ en el suelo limitan el suministro de K+ a las células de la raíz. Cuando el Na+ ingresa a las células, se acumula en niveles altos y es tóxico para las enzimas citosólicas; por lo tanto, este desequilibrio de Na+ bajo condiciones de estrés salino conduce a respuestas fisiológicas que afectan los proceso de división y crecimiento a nivel celular (Tester y Davenport, 2003; Zhu, 2003; Shi et al., 2003). En la actualidad, hay mayor comprensión sobre los sistemas de transporte y mecanismos regulatorios que median la relación Na+/K+ en células vegetales; éstos corresponden a los sistemas de transporte de alta y baja afinidad ubicados en el plasmalema y en el tonoplasto (Demidchik et al., 2002; Zhu, 2002; Zhu, 2003). Las proteínas integrales de membrana actúan como transportadoras, sufriendo un cambio corformacional durante el transporte del ión y operando en contra de gradientes de concentración energizados por gradientes electroquímicos (antiporte Na+/H+, simporte K+/ H+, simporte K+/Na+) (Berthmieau et al., 2003; Sul et al., 2003). Un tipo de transportador de los iones Na+ y K+ bien reconocido es el perteneciente a la familia de los HKT, identificado y evaluado en Arabidopsis (Rus et al., 2004; Máser et al., 2002; Fu y Luan, 1998), arroz (Horié et al., 2001; Garciadeblas et al., 2003; Fukuda et al., 2004) y trigo (Laurie et al., 2002), entre otros.
El HKT, transportador de alta afinidad para K+ y descrito en Arabidopsis, funciona acoplado al Na+ y contribuye al suministro de este ión en suelos salinos. Bajo concentraciones altas de Na+, el HKT puede tener más importancia fisiológica en el transporte de Na+ que en el de K+ (Rus, et al., 2004; Máser et al., 2002; Fu y Luan, 1998).
En arroz (Oryza sativa cv. Nipponbare) se demostró que el suministro de Na+ y K+ está mediado por diferentes transportadores y que el K+ se bloquea por el transportador de Na+. La expresión del OsHKT1 y el HKT4 demuestra que éstos son transportadores de alta y baja afinidad para Na+. Los transportadores OsHKT están involucrados en el transporte de Na+ en arroz, y el OsHKT1 media específicamente el suministro de Na+ en las raíces cuando estas plantas son deficientes en K+ (Garciadeblas et al., 2003; Horie et al., 2001; Horie y Schoeder, 2004; Fukuda, 2004).
En el estudio publicado por Laurie et al. (2002), el gen que codifica la expresión del transportador de alta afinidad para K+, el HKT1, fue aislado de raíces de trigo y se sugiere que media el transporte acoplado de H+ con alta afinidad para K+. Investigaciones posteriores mostraron que el HKT1 es energizado a través del transporte acoplado de Na+, más que de H+. Este resultado sugiere que el suministro de K+ de alta afinidad en plantas es conducido por el gradiente electroquímico de Na+, que además soporta la función del HKT1 como transportador
de K+ en plantas de trigo.
Canales selectivos para cationes
El genoma vegetal codifica múltiples canales que median el transporte de los iones Na+ y K+. Estos canales transportan iones desde la solución del suelo y secretan los iones dentro la corriente xilemática. En contraste con los transportadores, los canales iónicos conducen rápidamente los iones Na+ y K+ (Davenport et al., 2005). Los canales monovalentes de cationes se han clasificado en tres grupos, dependiendo de su comportamiento electrofisiológico y de la selectividad iónica (Tyerman, 2002): los canales rectificadores de la entrada de K+ (KIR) constituyen la vía para el suministro de K+ de alta afinidad en las raíces de las plantas; los canales rectificadores de la liberación de K+ (KOR), presentes en diferentes especies vegetales y tejidos, son altamente selectivos para la liberación de K+ en el xilema para transportarlo hacía los brotes de las plantas (Gilliam y Tester, 2005; Kohler et al., 2002) y los canales NSC, no selectivos de cationes -o VIC, canales independientes de voltaje-, son particularmente abundantes en el tonoplasto de las células vegetales y tienen baja afinidad selectiva para K+ y Na+, comparada con los KIR y los KOR (Demidchik y Tester, 2002; Schroeder y Horie, 2004; Essah et al., 2003). Los NSC se han caracterizado en raíces de plantas, epidermis de la hoja y células oclusivas, o ‘guardias’. Estudios recientes muestran que la entrada de Na+ a través de los NSC es mucho más alta que por los canales KIR. Estas propiedades sugieren que en las células en las plantas los canales NSC funcionan como la mejor vía de transporte de Na+ (Davenport et al., 2005; Maathuis y Sander, 2001; Schroeder y Horie, 2004; Essah et al., 2003).
Canales de aniones
Las células vegetales contienen canales iónicos que regulan la entrada de aniones desde el ambiente externo y participan en la turgencia y la osmorregulación, en los movimientos estomáticos y el transporte de nutrientes. Estos canales se agrupan de acuerdo a la forma como son activados: por despolarización de la membrana, por hiperpolarización y por estiramiento. Los canales aniónicos juegan un papel importante en la regulación de los gradientes iónicos intracelulares y se han descrito en el plasmalema, el tonoplasto, la membrana de los tilacoides y la membrana interna de la mitocondria. En plantas, se identificaron dos conductancias aniónicas distintas en el parénquima xilemático: la conductancia aniónica rápida (QUAC) y la conductancia aniónica lenta (SLAC). La conductancia QUAC fue relacionada con el transporte de los aniones nitrato y cloro hacia el xilema (Kohler et al., 2002; Gilliham y Tester, 2005; De Boer y Volvok, 2003).
Compartimentalización y etrusión de Na+
Existen dos mecanismos para controlar estrictamente la concentración de Na+ y prevenir su exceso en el simplasto de las células vegetales: uno permite la compartimentalización
de Na+ en la vacuola mediada por aniportes Na+/H+ localizados en el tonoplasto (Horié y Schroender, 2004; Yokoy et al., 2002; Fukuda et al., 2004) y el otro, el transporte de Na+ hacia el apoplasto, a través de antiportes Na+/H+ ubicados en la membrana citoplasmática. La capacidad para evitar la toxicidad por Na+ y controlar el flujo de iones es crítica en las células vegetales en condiciones de estrés salino (Munns, 2002; Qiu et al., 2004; Qiu et al., 2002; Benito y Rodríguez, 2003). En plantas superiores, se ha identificado un antiporte Na+/H+, el SOS1 (siglas en inglés de salt overly sensitive 1), que juega un papel importante en la etrusión de sodio desde las células epidérmicas de la raíz bajo condiciones de estrés salino. El eflujo de sodio a través del antiporte SOS1 es vital para la tolerancia a sales de las células meristemáticas de la raíz y de los ápices de brotes, ya que éstas no poseen grandes vacuolas para compartimetalizar el sodio. El eflujo de sodio a través de SOS1 bajo estrés salino es regulado por el complejo kinasa SOS2- SOS3.
En Arabidopsis, por ejemplo, el estrés salino induce un incremento en la concentración de calcio, percibido por el SOS3, proteína sensora de Ca+2 que activa al SOS2; a su vez, el SOS2 fosforila el antiporte SOS1 y lo activa. Además, el incremento de calcio en el citosol bajo condiciones de estrés salino parece estar regulado por acumulación de ABA (Chinnusamy., et al 2005). Por otro lado, el SOS2 también posee la capacidad de activar el antiporte Na+/H+ ubicado en el tonoplastode células adultas de la raíz, para secuestrar sodio en
la vacuolas (Chinnusamy et al., 2005).
Papel del ABA en la osmorregulación
El ácido abscísico (ABA) juega un papel crucial en diferentes aspectos de la osmorregulación en casos de estrés hídrico y salino durante el crecimiento vegetativo. El papel del ABA como señal de estrés a larga distancia producida en la raíz está bien establecido. Usualmente, este fitorregulador es sintetizado en el citosol de las células de la raíz, se transporta por el apoplasto de la raíz y es conducido vía xilema con la corriente transpiratoria a los brotes (Steudle, 2000; Coursol et al., 2003; Zyalalov, 2004). La reducción de la transpiración a través de los estomas es una respuesta crucial regulada por ABA en plantas expuestas a estrés. El cierre de los poros estomáticos en las hojas es un mecanismo por el cual las plantas uperiores regulan el balance hídrico. Las células oclusivas o guardias, que integran el poro estomático, responden a cambios en los niveles hídricos. El cierre estomático inducido por el ABA es mediado por la reducción en la presión de turgencia de las células guardias, que requieren un eflujo de K+ y Cl-, la remoción de sacarosa y la conversión de ácido málico en malato e H+. El ABA activa un canal de entrada de calcio, ocasionando un incremento en la concentración de Ca+2 en el citosol de las células guardias, la inhibición de los canales de entrada de K+ y la activación de los canales de salida de K+; todo esto conlleva un incremento del potencial hídrico, la salida de agua y la pérdida de turgencia de las células guardias, lo que conduce al cierre estomático (Coursol et al., 2003; Pandey y Assmann, 2004; Assmann y Wang, 2001; Inman-Barber y Smith, 2005; Zyalalov, 2004; Steudle, 2000) .
Conclusiones
La comprensión de los mecanismos bioquímicos y fisiológicos involucrados en la osmorregulación que exhiben las plantas en condiciones de estrés hídrico y salino plantea un desafío futuro de gran importancia, teniendo en cuenta la pérdida de tierras cultivables a causa de la salinización y la erosión de suelos en todo el mundo. Al estudiar la respuesta de las plantas frente al estrés ambiental, se reconocen diferentes procesos por los cuales las plantas logran adaptarse y soportar los cambios que ocurren en su potencial hídrico por escasez de agua o salinidad elevada. El cierre estomático evita la reducción del potencial hídrico e involucra ajustes fisiológicos y metabólicos. La síntesis de ciertos metabolitos, como minoácidos, azúcares solubles, polioles, poliaminas, fructanos y pigmentos (carotenoides, antocianos, betalaínas) no interfiere en el metabolismo celular, juega un papel determinante
en el mantenimiento de la turgencia celular. Estos metabolitos interactúan con lípidos y proteínas, previniendo posibles alteraciones de las membranas celulares y disociando complejos proteicos e inactivación de enzimas. Las plantas expuestas a altas concentraciones extracelulares de sales transportan iones a través de los sistemas selectivos de K+ y Na+ y de los no selectivos localizados en las membranas celular y vacuolar. La osmorregulación confiere a las plantas la capacidad de tolerar condiciones de escasez de agua y salinidad elevadas, con la expresión de mecanismos adaptativos que evitan la disminución de la fotosíntesis, las alteraciones en la traslocación y la distribución de fotoasimilados y las pérdidas en rendimiento; hechos que tienen trascendencia significativa en el normal funcionamiento de la planta y en la productividad de los cultivos.
Literatura citada
Andreev, I. 2001. Functions of the vacuole in higher plants cells. Russian J. Plant Physiol. 48 (5), 777-787. [ Links ]
Assmann, S y X. Wang. 2001. From milliseconds to millions of years: guard cells and environmental responses. Plant Biol. 4, 421-428. [ Links ]
Bartels , D y S. Ramanjulu. 2005. Drought and salt tolerance in plants. Plant Sciences 24, 23-58. [ Links ]
Benito, B y A. Rodríguez. 2003. Molecular cloning and characterization of a sodium-pump ATPase of the moss Physcomitrella patens. Plant J. 36, 382-389. [ Links ]
Berthomieu, P., G. Conéjéro, A. Nublat, W. Brackenbury, C. Lambert, C. Savio, N. Uozumi, S. Oiki, K. Yamada y F. Cellier. 2003. Functional analysis of AtHKT1 in Arabidopsis shows that Na+ recirculation by the phloem is crucial for salt tolerance. EMBO J. 22, 2004-2014 [ Links ]
Boudsocq, M y C. Laurière. 2005. Osmotic signaling in plants. Multiple pathways mediated by emerging kinase families. Plant Physiol. 138, 1185-1194 . [ Links ]
Canny, M. 2001. Contributions to the debate on water transport. Am. J. Bot. 88, 43-46. [ Links ]
Coursol, S., L. Fan, H. Le Stunff, S. Spiegel, S. Gilroy y S. Assmann. 2003. Sphingolipid signalling in Arabidopsis guard cells involves heterotrimeric G proteins. Nature 423, 651-654. [ Links ]
Cushman, J.C. 2001. Osmoregulation in plants: implications for agriculture. Am. Zool 41, 758-769. [ Links ]
Chen, T y N. Murata. 2002. Enhancement of tolerance of abiotic stress by metabolic engineering of betaines and other compatible solutes. Plant Biol. 5, 250-257. [ Links ]
Chinnusamy, V., A. Jagendorf y J. Zhu. 2005. Understanding and improving salt tolerance in plants. Crop Science 45, 437-448. [ Links ]
Davenport, R., R. James, A. Zakrisson, M. Tester y R. Munns. 2005. Control of sodium transport in durum wheat. Plant Physiol. 137, 807-818. [ Links ]
De Boer, A y V. Volkov. 2003. Logistics of water and salt transport through the plant: structure and functioning of the xylem. Plant Cell Environ. 26, 87-101. [ Links ]
Demidchik, V y M. Tester. 2002. Sodium fluxes through nonselective cation in the plasma membrane of protoplasts from Arabidopsis roots. Plant Physiol. 128, 379-387. [ Links ]
Essah, P., R. Davenport y M. Tester. 2003. Sodium influx and accumulation in Arabidopsis. Plant Physiol. 133, 307-318. [ Links ]
Fu, H y S. Luan. 1998. AtKUP1: a dual affinity transporter from Arabidopsis. Plant Cell 10, 63-73. [ Links ]
Fukuda, A., A. Nakamura, A. Tagiri, H. Tanaka, A. Miyao, H. Hirochika y Y. Tanaka. 2004. Function, intracellular localization and the importance in salt tolerance of a vacuolar Na+/H+ antiporter from rice. Plant Cell Physiol. 45, 146-159. [ Links ]
García, M y E. Medina. 2003. Crecimiento y acumulación de prolina en dos genotipos de caña de azúcar sometidos a salinización con cloruro de sodio. Agronomía Colombiana 20, 168-179. [ Links ]
Garciadeblás, B., M. Senn, M. Bañuelos y A. Rodríguez. 2003. Sodium transport and HKT transporters: the rice model. The Plant J. 34(6), 788-799. [ Links ]
Ghoulam. C., A. Foursy y K. Fares. 2002. Effects of salt stress on growth, inorganic ions and proline accumulation in relation to osmotic adjustment in five sugar beet cultivars. Environ. Exp. Bot. 47, 39-50. [ Links ]
Gilliham, M y M. Tester. 2005. The regulation of anion loading to the maize root xylem. Plant Physiol. 137, 819-828. [ Links ]
Hasegawa, P., R. Bressan, A. Zhu y H. Bohnert. 2000. Plant cellular and molecular responses to high salinity. Annu. Rev. Plant. Physiol. Plant Mol. Biol. 51, 463-499. [ Links ]
Hill, A., B. Shachar-Hill y Y. Shachar-Hill. 2004. What are aquaporines for? J. Membrane Biol. 197, 1-32. [ Links ]
Horie, T., K. Yoshida, H. Nakayama, K. Yamada, S. Oiki y A. Shinmyo. 2001. Two types of HKT transporters with different properties of Na+ and K+ transport in Oryza sativa. The Plant J. 27(2), 129-142. [ Links ]
Horie, T y J. Schroeder. 2004. Sodium transporters in plants. Diverse genes and physiological functions . Plant Physiol. 136, 2457-2462. [ Links ]
Iman-Barber, N. y D. Smith. 2005. Water relations in sugarcane and response to water deficits. Field Crops Research 92(2-3), 185-202. [ Links ]
IFPRI (International Food Policy and Research Institute). 2002. Global water outlook to 2005: an impending crisis. International Food Policy and Research Institute, Washington DC. http://ifpri.cgiar.org/media/water. [ Links ]
Javot, H y C. Maurel. 2002. The role of aquaporins in root water uptake. Annals of Botany 90, 301-313. [ Links ]
Javot, H., V. Lauvergeat, V. Santoni, F. Martin, J. Güçlü, J. Vinh, J Heyes, K. Franck, A. Schäffner y D. Bouchez. 2003. Role of a single aquaporin isoform in root water uptake. Plant Cell 15, 509-522. [ Links ]
Karimi, G., M. Ghorbanli, H. Heidari, R. Khavari y M. Assareh. 2005. The effects of NaCl on growth, water relations, osmolytes and ion content in Kochia prostrate. Biologia Plantarum 49 (2), 301-304. [ Links ]
Kohler, B., A. Hills y M. Blatt. 2003. Control of guard cell ion channels by hydrogen peroxide and abscisic acid indicates their action through alternate signaling pathways. Plant Physiol. 131, 385-388 [ Links ]
Larcher, W. 2003. Physiological plant ecology. 4th ed. Springer, Germany. p. 231. [ Links ]
Lauri, E., K. feeney, F. Maathuis, P. Heard, S. Brown y R. Leigh. 2002. A role for HKT1 in sodium uptake by wheat roots. The Plant J. 32(2), 139-154. Levitt, J. 1980. Responses of plants to environmental stress. 2nd. edition. Academic Press, New York. [ Links ]
Maathuis, F y D. Sander. 2001. Sodium uptake in Arabidopsis roots is regulated by cyclic nucleotides. Plant Physiol. 127, 1617-1625 [ Links ]
Máser, P., B. Eckelman, R. Vaidyanathan, T. Horie, D. Fairbairn, M. Kubo, M. Yamagami, K. Gamaguchy, M. Nishimura y A. Uozumi. 2002. Altered shoot/root Na+ distribution and bifurcating salt sensitivity in Arabidopsis by genetic disruption of the Na+ transporter AtHKT1. Febs. Lett. 531, 157-161 [ Links ]
Munns, R. 2002. Comparative physiology of salt and water stress. Plant Cell Environ. 25, 239-250. [ Links ]
Nayyar, H. 2003. Variation in osmoregulation in differentially drought-sensitive wheat genotypes involves calcium. Biologia Plantarum 47 (4), 541-547. [ Links ]
Pandey, S. y S. Assmann. 2004. The Arabidopsis putative G proteincoupled receptor GCRI interacts with the G protein a subunit GPAI and regulates abscisic acid signalling. Plant Cell 16, 1616-1632. [ Links ]
Rai, V. 2002. Role of amino acids in plants responses to stresses. Biologia Plantarum 45(4), 481-487. [ Links ]
Rus, A., B. Lee, A. Muñoz, A. Sharkhuu, J. Zhu, R. Bressan y P. Hasegawa. 2004. AtHKT1 facilitates Na+ homeostasis and K+ nutrition in planta. Plant Physiol. 136, 2500-2511. [ Links ]
Qiu, Q., Y. Guo, M. Dietrich, K. Schumaker y J. Zhu. 2002. Regulation of SOS1, a plasma membrane Na+/H+ exchanger in Arabidopsis thaliana, by SOS2 and SOS3. Proc. Natl. Acad. Sci. 99, 8436-8441. [ Links ]
Qiu, Q., Y. Guo, F. Quintero, J. Pardo, K. Schumaker, y J. Zhu. 2004. Regulation of vacuolar Na+/H+ exchange in Arabidopsis thaliana by the salt-overly-sensitive (SOS) pathway. J. Biol. Chem. 279, 207-215. [ Links ]
Sánchez, C. 2003. Acuaporinas: proteínas mediadoras del transporte de agua. Colombia Médica 34 (4), 220-227. [ Links ]
Serraj, R y T. Sinclair. 2002. Osmolyte accumulation: Can it really help increase in crop yield under drought conditions? Plant Cell Environ. 25, 333- 341. [ Links ]
Shi, H., B. Lee, S. Wu, S y J. Zhu. 2003. Overexpression of a plasma membrane Na+/H+ antiporter gene improves salt tolerance in Arabidopsis thaliana. Nat Biotechnol. 21, 81-85. [ Links ]
Shinozaki, K y K. Yamaguchi-Shinozaki. 1997. Gene expression and signal transduction in water-stress response. Plant Physiol. 115, 327-334. [ Links ]
Smith-Espinoza, C., A. Richter, F. Salamini y D. Bartels. 2003. Dissecting the response to dehydration and salt (NaCl) in the resurrection plant Craterostigma plantagenium. Plant Cell Environ. 26, 1307-1315. [ Links ]
Steudle, E. 2000. Water uptake by roots: effects of water deficit. J. Exp. Bot. 51(350), 1531-1542. [ Links ]
Sul, H., E. Balderas, R. Vera-Estrella, D. Golldack, F. Quigley, C. Zhao, O. Pantoja y H. Bohnert. 2003. Expression of the cation transporter McHKT1 in a halophyte. Plant. Mol. Biol. 52, 967-980 [ Links ]
Taylor, I., A. Burbidage y A. Thompson. J. 2000. Control of abscisic synthesis. J. Exp. Bot. 51, 1563-1574. [ Links ]
Tester, M. y R. Davenport. 2003. Na+ tolerance and Na+ transport in higher plants. Annals of Botany 91, 503-527. [ Links ]
Trinchant, J., A. Boscari, G. Spennato, G. van De Sype y D. Rudulier. 2004. Proline betaine accumulation and metabolism in alfalfa plants under sodium chloride stress. Exploring its compartmentalization in nodules. Plant Physiol. 135, 1583-1594. [ Links ]
Tyerman, S. 2002. Nonselective cation channels. Multiple functions and commonalities. Plant Physiol. 128, 327-328. [ Links ]
Tyerman, S.D., C. Niemietz y H. Bramley. 2002. Plant aquaporins: multifunctional water and solute channels with expanding roles. Plant Cell Environ. 25, 173-194. [ Links ]
Uehlein, N., C. Lovisolo, F. Siefritz y R. Kaldenhoff. 2003. The tobacco aquaporin NtAQP1 is a membrane CO2 pore with physiological functions. Nature 425, 734-737 [ Links ]
Vera-Estrella, R., B. Barkla, H. Bohnert y O. Pantoja. 2004. Novel regulation of aquaporins during osmotic stress. Plant Physiol. 135, 2318-2329. [ Links ]
Yokoi, S., F. Quintero, B. Cubero, M. Ruiz, R. Bressan, P. Hasegawa y J. Pardo. 2002. Differential expression and function of Arabidopsis thaliana NHX Na+/H+ antiporters in the salt stress response. Plant J. 30, 529-539. [ Links ]
Zyalalov, A. 2004. Water flows in higher plants: physiology, evolution, and system analysis. Russian J. Plant Physiol. 51(4), 547-555. [ Links ]
Zhu, J.K. 2000. Genetic analysis of plant salt tolerance using Arabidopsis. Plant Physiol. 124, 941-948 [ Links ]
Zhu, J.K. 2002. Salt and drought stress signal transduction in plants. Annu. Rev. Plant Physiol. Plant Molec. Biol. 53, 247-273. [ Links ]
Zhu, J.K. 2003. Salt and drought stress signal transduction in plants. Annu. Rev. Plant Biol. 53, 247-273. [ Links ]
Zhu, J.K. 2003. Regulation of ion homeostasis under salt stress. Plant Biol. 6, 441-445. [ Links ]














