Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Agronomía Colombiana
versão impressa ISSN 0120-9965
Agron. colomb. v.24 n.2 Bogotá jul./dez 2006
FITOMEJORAMIENTO, RECURSOS GENÉTICOS Y BIOLOGÍA MOLECULAR
María A. Martínez1 y José C. Pacheco2
1 Bióloga, Escuela de Ciencias Biológicas, Facultad de Ciencias, Universidad Pedagógica y Tecnológica de Colombia (UPTC), Tunja.
e-mail:maramca79@yahoo.com
2 Profesor titular, Escuela de Ciencias Biológicas, Facultad de Ciencias, Universidad Pedagógica y Tecnológica de Colombia (UPTC), Tunja.
e-mail:jopach@hotmail.com
Resumen:
Del género Furcraea hacen parte especies textiles de gran importancia en los mercados nacionales e internacionales, tanto por las características de la fibra como por el contenido de precursores de hormonas, corticoides, azúcares, ácidos grasos y biopesticidas que se encuentran en sus jugos. En esta investigación se desarrolló un protocolo para la micropropagación de Furcraea macrophylla B. a partir de ápices caulinares procedentes de bulbillos. Los cultivos in vitro se realizaron en medio MS modificado y suplementado con BA, TDZ, KIN y 2-IP en forma individual o en combinación con 2,69 µM de ANA. Después de 12 semanas de iniciados los cultivos, en la mayoría de los tratamientos ensayados los explantes desarrollaron brotes axilares. 100% de los brotes producidos enraizaron después de 30 d en medio MS modificado suplementado con 11,42 µM de AIA, con 2,46 µM de AIB o en ausencia de reguladores de crecimiento. Después de la etapa de endurecimiento, 94% de las plántulas sobrevivieron en condiciones ex vitro. El protocolo establecido para la micropropagación de F. macrophylla es un procedimiento efectivo con el que se podría suplir la demanda comercial de material vegetal seleccionado, en óptimo estado fitosanitario, en periodos relativamente cortos y a bajos costos.
Palabras clave adicionales: Agavaceae, brotes axilares, reguladores de crecimiento, fique
Abstract:
To the genus Furcraea belong textile species of great importance for the national and international markets, so much for the characteristics of their fiber as for the content of precursors of hormones, corticoides, sugars, fatty acids, biopesticides, and many other products in their juices. In this research, a protocol was developed for micropropagation of Furcraea macrophylla B., starting from shoots apex from bulbils. The in vitro cultures were carried out in modified MS and supplemented with BA, TDZ, KIN and 2-IP alone or in combination with 2.69 µM NAA. After 12 weeks of initiation the cultures, in most of the achieved treatments, the explants developed axillary shoots. One hundred percent produced shoots rooted after 30 days in modified MS medium supplemented with 11.42 µM IAA, or with 2.46 µM IBA, or without growth regulators. After the hardening stage, 94% of the plantlets survived under ex vitro conditions. The established protocol for micropropagation of F. macrophylla is an effective procedure to supply the commercial demand of selected plant material, with good phytosanitary conditions, in relatively short periods and at low cost.
Additional key words: Agavaceae, axillary shoots, growth regulators, furcraea.
Introducción
LA FAMILIA AGAVACEA COMPRENDE 18 géneros y 600 especies propias de zonas tropicales y subtropicales, perfectamente adaptadas para sobrevivir en condiciones semidesérticas. Varias de estas especies son de interés económico por su valor ornamental o por ser fuente de productos de interés (Devesa, 1997). Los géneros Agave y Furcraea son los más representativos de la familia Agavacea. Los ágaves comprenden plantas textiles, como el sisal (A. sisalana) y el henequén (A. fourcroydes); ornamentales (A. victoria-reginae) y para producción de bebidas (A. tequilana). Las furcraeas comprenden plantas textiles, como borde de oro (F. castilla), uña de águila (F. macrophylla) y cenizo (F. cabuya), entre otras.
En Colombia se conoce con el nombre de fique a las plantas que pertenecen al género Furcraea, que comprende aproximadamente 20 especies, algunas de ellas utilizadas para extraer de sus hojas la fibra textil conocida como cabuya. De la planta sólo se aprovecha 4% de la hoja, que corresponde a la fibra; el 96% restante son jugos y fibras cortas. Este bajo porcentaje de aprovechamiento de las plantas hace que los cultivos no sean rentables, razón por la que las plantaciones fueron abandonadas y/o erradicadas en décadas anteriores. Sin embargo, las investigaciones realizadas en los últimos años han creado nuevas expectativas para el aprovechamiento integral de la planta. En su jugo se han encontrado, entre otros compuestos, precursores de productos hormonales, corticoides, ácidos grasos, azúcares, sulfatos y sustancias con actividad biopesticida (MAVDT et al., 2002). Además, tanto la fibra larga como la fibra corta son materia prima para la industria y la artesanía. Pero, a pesar de estas expectativas, el aprovechamiento integral del fique a gran escala enfrenta la falta de genotipos seleccionados y de material vegetativo suficiente para la renovación y establecimiento de nuevas plantaciones.
El fique es una planta monocotiledónea, de crecimiento lento, con un ciclo de vida largo (aproximadamente, 20 años), florece sólo una vez hacia el final de su ciclo de vida y raramente produce semillas fértiles. Por tanto, el mejoramiento y la propagación sexual presentan serias dificultades. La propagación ocurre principalmente a través de bulbillos, que son yemas epígeas o axilares de la inflorescencia que se producen en el maguey (flor), y a través de hijuelos que crecen en el tronco de la planta.
Para la propagación in vitro de agaváceas, se han aplicado diferentes técnicas de cultivo, utilizando segmentos caulinares y foliares, bulbillos, semillas, callos, meristemos, yemas, embriones zigóticos (tabla 1). La mayoría de estas técnicas se ha enfocado a la multiplicación masiva a través de brotes adventicios y/o axilares y la producción de embriones somáticos. Se ha reportado: organogénesis directa e indirecta para diversas especies, como A. arizonica (Powers y Backhaus, 1989) y A. fourcroydes (Muñoz et al., 2004; Eastmond et al., 2000; Madrigal et al., 1989; Robert et al., 1987), A. sisalana (Binh et al., 1990), Agave sp. (Groenewald et al., 1977) y A. tequilana (Castro et al., 1990); proliferación de brotes directamente del explante original, para A. fourcroydes (Robert et al., 1987), A. sisalana (Das, 1992) y A. schidigera (Rodríguez et al., 1996a); proliferación de brotes adventicios a partir de callos, en A. sisalana (Hazra et al., 2002; Nikam, 1997) y A. cocui (Yépez et al., 2004); proliferación por brotes axilares en A. parrasana (Santacruz et al., 1999); embriogénesis somática en especies ornamentales, como A. victoria-reginae (Martínez et al., 2003; Rodríguez et al., 1996b) y especies textiles, como A. sisalana (Nikam et al., 2003) y A. fourcroydes (González et al., 2001).
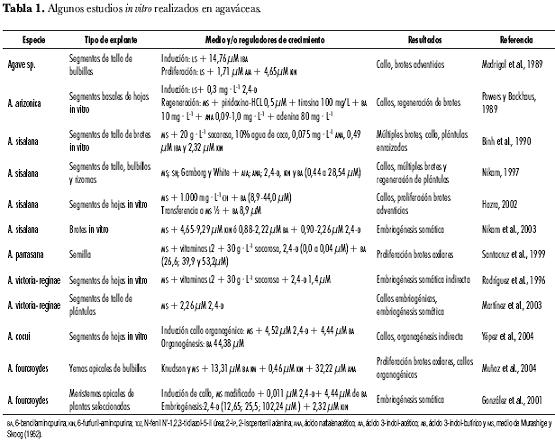
En especies del género Furcraea no se han encontrado reportes sobre manipulación in vitro de tejidos. En esta investigación se desarrolló un protocolo para micropropagación de F. macropylla B. a través de brotes axilares, utilizando como explantes primarios ápices caulinares extraídos de bulbillos procedentes de plantas seleccionadas.
Materiales y métodos3
Material vegetal
Se seleccionaron plantas madre de 15-20 años, con hojas productivas de 3 m, inflorescencia vigorosa con una producción de hasta 3.000 bulbillos. Los bulbillos utilizados como fuente de explantes primarios se seleccionaron teniendo en cuenta un tamaño uniforme, de 10 a 12 cm de longitud y 3 cm de diámetro basal.
A los bulbillos seleccionados se les eliminaron las hojas de color verde, conservando la pequeña porción caulinar para facilitar la manipulación; la desinfección superficial se realizó en cámara de flujo laminar, así: inmersión en agua destilada estéril más Tween 20 (0,5 mL por 100 mL) durante 10 min, con agitación continua; inmersión en alcohol al 70% durante 1 min y en hipoclorito de Ca (Ca(OCl)2, 5-10%) durante 25 min; finalmente se enjuagaron 4 veces consecutivas, 3 min cada una, con agua destilada estéril. La escisión de los ápices caulinares se realizó con ayuda de bisturí y estereoscopio, eliminando progresivamente las hojas en desarrollo. Los ápices caulinares escindidos, con un tamaño de 0,7 a 1,0 cm (figura 1a), comprenden el meristemo, los primordios foliares y las primeras hojas en desarrollo.

Inducción y proliferación de brotes axilares
Para inducir la formación de yemas y promover el desarrollo de brotes axilares, los ápices caulinares se cultivaron en medio MS (Murashige y Skoog, 1962) con macroelementos y Fe-EDTA disminuidos a la mitad de la concentración original, suplementado con BA (13,31 ó 22,19 µM), 2-IP (24,61 ó 34,4 µM), KIN (32,52 ó 46,47 µM) ó TDZ (0,045, 0,225 ó 0,45 µM) en combinación con 2,69 µM de ANA. Los explantes se mantuvieron en los mismos medios durante 180 d, transfiriéndolos a medio fresco cada 45 d. Para el establecimiento de cadenas proliferativas, después de la tercera transferencia, los brotes de longitud ≥ 1,5 cm se individualizaron y subcultivaron en los mismos medios utilizados durante la etapa de inducción. Esta última etapa se repitió cada 60 d.
Enraizamiento de brotes axilares
Para estimular la formación de raíces, se cultivaron brotes de longitud ≥ 3 cm durante 4 semanas en el mismo medio utilizado para inducción y proliferación de brotes, al que se le adicionó 20 g· L-1 de sacarosa y se suplementó o no con 11,42 µM de AIA ó 2,46 µM de AIB.
Condiciones generales de cultivo
A todos los medios utilizados se les ajustó el pH a 5,7 con HCl (0,1 N) ó KOH (0,1 N), se solidificaron con 7,5 g· L-1 de agar y se esterilizaron en autoclave a 121 ºC y 1 kg· cm-2 de presión durante 20 min. Los explantes se cultivaron en recipientes de vidrio de 5 y 50 mL con alícuotas de 3 y 25 mL de medio para las etapas de inducción y multiplicación, respectivamente. Los cultivos se incubaron a 25 ± 1 ºC y con fotoperíodo de 16 h suministrado por lámparas Silvana de 75 W.
Aclimatización
Los brotes enraizados se extrajeron de los recipientes de cultivo, se les eliminó el agar adherido a las raíces y se sesumergieron en una solución fungicida de Benlate® (1,0 g· L-1); luego se sembraron en vasos plásticos de 200 mL que contenían un sustrato estéril preparado con cascarilla de arroz, tierra y arena en proporción 2:1:1. Las plántulas se mantuvieron en invernadero en módulos cubiertos con plástico durante 15 d y, posteriormente, en módulos descubiertos durante 20 d.
Análisis estadístico
Los datos obtenidos se analizaron aplicando análisis de varianza (Anova) y la prueba F, utilizando el programa SPSS Windows versión 11.5 (SPSS Inc.). Cuando el Anova indicó diferencias entre las medias de los tratamientos, se aplicó la prueba DHS (diferencia honestamente significativa) de Tukey para determinar los tratamientos que presentaron diferencias significativas.
Para establecer la efectividad de los tratamientos ensayados durante dos ciclos de proliferación, la media de brotes por explante se estimó mediante la relación:
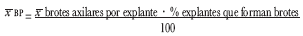
En cada tratamiento se cultivaron 20 unidades experimentales y cada tratamiento se repitió 2 veces.
Resultados y discusión
Los procesos organogénicos relacionados con neoformación de meristemos axilares, así como con su desarrollo, pueden ser suprimidos o retardados mientras los meristemos apicales estén activos. La inducción, crecimiento, desarrollo y proliferación de brotes axilares son, por lo general procesos promovidos por la incorporación de reguladores de crecimiento al medio de cultivo; comúnmente, las citoquininas suprimen la dominancia del meristemo apical y promueven la formación de brotes axilares.
Las citoquininas influyen sobre el desarrollo y fisiología de los vegetales, incluyendo germinación de se millas, control de la dominancia apical, interacción planta-patógeno, desarrollo de flores y frutos y senescencia de hojas, entre otros. Estos procesos también son influenciados por otros estímulos –como la luz y otros fitorreguladores–, y los resultados fisiológicos y de desarrollo reflejan respuestas altamente dependientes de tales estímulos (Shimizu y Mori, 2001; Haberer y Kieber, 2002). Se ha observado que cultivos de callos indiferenciados de zanahoria forman brotes o raíces, dependiendo de la cantidad relativa de citoquininas a auxinas en el medio de cultivo, y que la proporción –más que la cantidad absoluta– de esas dos hormonas determina la respuesta (Skoog y Miller, 1957). Según George (1996), una proporción auxina-citoquinina balanceada mantiene las células en un estado indiferenciado, mientras que una proporción alta de citoquinina a auxina promueve el desarrollo de brotes y una proporción baja promueve el desarrollo de raíces.
En esta investigación, 72-98% de los ápices caulinares inducidos in vitro en presencia de las diferentes concentraciones de BA, KIN y 2-IP, combinadas con ANA, fueron viables y la formación de brotes axilares fue evidente después de 8 semanas de cultivo (figuras 1a-d). Esta respuesta concuerda con las obtenidas en cultivos in vitro de otras agaváceas, como A. arizonica (Powers y Backhaus, 1989), A. cantala (Binh et al., 1987), A. fourcroydes (Robert et al., 1996) y A. victoria-reginae (Rodríguez et al., 1996b), en las que un requerimiento de concentraciones moderadas a bajas de 2,4-D, IBA ó ANA, en combinación con una citoquinina, fue efectivo para inducir procesos organogénicos conducentes a la formación de brotes. Sin embargo, en otras agaváceas, como A. sisalana (Das, 1992) y A. parrasana (Santacruz et al., 1999), la proliferación de brotes fue inducida en presencia de citoquininas sin requerirse la adición de auxinas al medio de cultivo.
En los cultivos in vitro de ápices caulinares de F. macrophylla B., la presencia de BA, KIN, 2-iP ó TDZ en combinación con 0,5 mg· L-1 de ANA en el medio de cultivo afectó el porcentaje de explantes que formaron brotes axilares y, por ende, la media de brotes por explante (x) (tabla 2). Los porcentajes de ápices caulinares que formaron brotes axilares fueron más elevados cuando se cultivaron en medio suplementado con KIN en concentraciones de 46,47 µM (98%) y de 32,52 µM (95%). En los cultivos de explantes realizados en medio con BA (13,31 y 22,19 µM) y con 2-iP (24,61 y 34,4 µM) en combinación con ANA se cuantificó 73-81% de explantes con brotes axilares. En los ápices caulinares cultivados en los medios con TDZ (0,225 y 0,45 µM) se cuantificaron los porcentajes más bajos (24% y 9%) de explantes que formaron brotes axilares. Sin embargo, el TDZ promovió en cada ápice caulinar el desarrollo de un brote con 3 a 4 hojas de longitud mayor a 10 cm. En cambio, en cultivos de ápices tomados de brotes de Yucca aloifolia L, otra agávacea, se ha registrado un alto número de brotes (brotes por explante, 6,6), en cultivos realizados en medio suplementado con 4,5 µM de TDZ combinado con 1,1 µM de ANA (Atta-Alla y Van Staden, 1997).
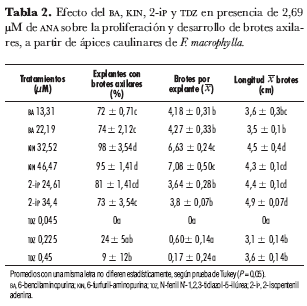
Mediante análisis de varianza aplicado a los datos de brotes producidos (x BP) en los cultivos de ápices caulinares en presencia de las citoquininas combinadas con ANA, se establecieron diferencias significativas entre los tratamientos (Fc: 193,415; Ft: 3,23; α = 0,05), presentándose el valor más alto en los cultivos suplementados con KIN 46,47 µM (x BP = 7,08) y 32,52 µM (6,63); valores medios se registraron en presencia de BA 13,31 µM (4,18) y 22,19 µM (4,27), 2-IP 24,61 µM (3,64) y 34,4 µM (3,8). En contraste, en los tratamientos en que se adicionó al medio de cultivo TDZ combinado con ANA, la producción de brotes por explante fue inferior a 1. En otras especies de agaváceas se han reportado medias de brotes por explante significativamente más elevadas; en cultivo de brotes axilares de A. parrasana (Santacruz et al., 1999), la media de brotes por explante fue de 25,5 a 23,8 en MS suplementado con 2,4-D (0 a 0,04 µM) en combinación con BA (13.3; 26,6; 39,9 y 53,2 µM); mientras que en cultivos de callos organogénicos de A. sisalana (Nikam, 1997) en MS suplementado con 0,5 mg· L-1 de KIN se reportó una media de 27,7 brotes por explante. En cuanto al tamaño de los brotes producidos en la diferentes tratamientos realizados en esta investigación, la mayor longitud promedio (4,3-4,9 cm) la presentaron los brotes cultivados en presencia de KIN y 2IP, mientras que en presencia de BA y TDZ los brotes alcanzaron 3,1 a 3,6 cm de longitud.
Enraizamiento
Entre 90% y 100% de los brotes desarrollados (longitud ≥ 3 cm) enraizaron después de 15 a 30 d de cultivo en medio suplementado con AIA (figura 1e) o AIB, o en medio sin auxinas. El AIA en el medio de cultivo fue más efectivo (100%) para inducción y desarrollo radicular que el AIB (92%) y que el medio sin auxinas (90%). Aunque en todos los tratamientos ensayados se cuantificaron altos porcentajes de brotes enraizados, la diferencia más notoria entre ellos fue el menor tiempo que requirieron para enraizar los brotes cultivados en presencia de auxinas, comparado con el tiempo requerido por aquellos cultivados en ausencia de ellas (tabla 3). En este sentido, Villalobos et al. (1991) y Yépez et al. (2004) han reportado que brotes de A. atroviensis y A. cocui, respectivamente, pueden enraizar cultivándolos en medio sin auxinas, aunque la formación y desarrollo radicular puede estimularse más rápidamente si los brotes se cultivan en medio con sales diluidas al 50% y suplementado con 2,46 µM de AIB. Resultados semejantes reportaron Santacruz et al. (1999), quienes indujeron enraizamiento de brotes de A. parrasana en medio sin auxinas o suplementado con 9,8-39,2 µM de AIB, sin observar diferencias significativas entre los tratamientos. Además, Hazra et al. (2002) reportaron enraizamiento de brotes de A. sisalana 20-25 d después de iniciado el cultivo en MS suplementado con 11,42 µM de AIA. En otras especies de agávaceas, como A. arizonica (Powers y Backhaus, 1989), A. cantala, A. furcroydes (Binh et al., 1990), A. sisalana (Binh et al., 1990; Das, 1992), el cultivo de los brotes en medio basal fue suficiente para estimular la formación y el desarrollo de raíces.

Aclimatización
En condiciones de invernadero, la disminución progresiva de la humedad relativa y el incremento de la intensidad de luz, así como la siembra en un sustrato compuesto por cascarilla de arroz molida, arena de río y tierra en proporción 1:1:1, fueron condiciones físicas favorables para el proceso de aclimatización de plántulas, obteniéndose después de 30 d de iniciado 94% de plántulas viables con apariencia normal y crecimiento activo (figura 1f).
Conclusión
El proceso de micropropagación de F. macrophylla, a partir de ápices caulinares procedentes de bulbillos hasta regenerar y endurecer plántulas, implica un periodo de 8 meses; posteriormente, cada ciclo proliferativo se desarrolla en 60 d. Este protocolo puede aplicarse para selección in vitro de materiales élites y para su propagación en gran escala.
Agradecimientos
Los autores expresan sus agradecimientos al Convenio del Instituto Colombiano para el Desarrollo de la Ciencia y la Tecnología ‘Francisco José de Caldas’ (Colciencias) y el Banco Interamericano de Desarrollo (Bid) y a la Dirección de Investigaciones de la Universidad Pedagógica y Tecnológica de Colombia (UPTC) por el aporte económico asignado para el desarrollo de este trabajo. A los integrantes del grupo de investigación Bioplasma- UPTC, a la Cadena Productiva del Fique Regional Boyacá y a la Cadena Productiva Nacional del Fique (Cadefique), por su interés en la realización de esta investigación, así como a todos los cultivadores de fique que suministraron el material vegetal utilizado en ella.
3 Abreviaturas: BA, 6-bencilaminopurina; KIN, 6-furfuril-aminopurina; TDZ, N-fenil N’-1,2,3-tidiazol-5-il úrea; 2-IP, 2-isopentenil adenina; ANA, ácido
naftalenacético; AIA, ácido 3-indol-acético; AIB, ácido 3-indol-butírico y MS, medio de Murashige y Skoog (1962).
Literatura citada
Atta-Alla, H. y Van Staden. 1997. Micropropagation and establishment of Yucca aloifolia. Plant Cell Tiss. Org. Cult. 48, 209-212. [ Links ]
Binh, L.T., L.T. Muoi, H.T.K. Oanh, T.D. Thang y D.T. Pong. 1990. Rapid propagation of agave by in vitro tissue culture. Plant Cell Tiss. Org. Cult. 23, 67-70. [ Links ]
Castro, C.L., V.M. Loyola, J.L. Chan y M.L. Robert. 1990. Glutamate dehydrogenase activity in normal and vitrified plants of Agave tequilana Weber propagated in vitro. Plant Cell Tiss. Org. Cult. 22, 147-151. [ Links ]
Das, T. 1992. Micropropagation of Agave sisalana. Plant Cell Tiss. Org. Cult. 31, 253-255. [ Links ]
Devesa, J. 1997. Plantas con semillas, familia Agavaceae. En: Izco, J., E. Barreno, M. Costa y J. Devesa (eds.). Botánica. Interamericana McGraw-Hill, España. 781 p. [ Links ]
Eastmond, A., J.L. Herrera y M.L. Robert. 2000. Contribución a la biotecnología del henequén. pp. 59-71. En: Eastmond, A., J.L. Herrera y M.L. Robert. (eds.). La biotecnología aplicada al henequén: alternativas para el futuro. Centro de Investigación Científica de Yucatán (CICY), México. [ Links ]
George, E. 1993/1996. Plant propagation by tissue culture. In practice. Part 2. Exegetics, Easter Press, England. 786 p. [ Links ]
González, G., S. Alemán, F. Barredo y M.L. Robert. 2001. Embriogénesis somática en Agave fourcroydes Lem. Biotecnología Vegetal 2(1), 3-8. [ Links ]
Groenewald, E.G., D.C.J. Wessels y A. Koeleman. 1977. Callus formation and subsequent plant regeneration from seed tissue of an Agave species (Agavaceae). Z. Planzenphysiol. 81, 369-373. [ Links ]
Haberer, G. y J.J. Kieber. 2002. Cytokinins. New insights into a classic phytohormone. Plant Physiol. 128, 354-362. [ Links ]
Harza, S.K., S. Das y A.K. Das. 2002. Sisal plant regeneration via organogenesis. Plant Cell Tiss. Org. Cult. 70, 235-240. [ Links ]
Martínez, P.A., L.P. Ortega, V. Chávez y R. Bye. 2003. Somatic embryogenesis and organogenesis of Agave victoria-reginae: considerations for its conservation. Plant Cell Tiss. Org. Cult. 74, 135-142. [ Links ]
Madrigal, L.R., E.F. Pineda y J.l. Rodríguez. 1990. Agave. pp. 206- 227. En: Ammirato, P.V., D.A. Evans, W.R. Sharp y Y.P.S. Bajaj. (eds.). Handbook of plant cell culture. Vol. 5. Ornamental species. Mc Graw-Hill Publishing Co., New York. [ Links ]
Ministerio de Ambiente, Vivienda y Desarrollo Territorial [MAVDT], Sociedad de Agricultores de Colombia [SAC] y Federación Nacional de Cultivadores de Fique [Fedefique]. 2002. Guía ambiental para el subsector fiquero. Bogotá. 63 p.
Muñoz, P.Y., L.A. Pérez, T.S. Pérez, P. Alcántara, M. Sagrera y C. Pimentel. 2004. Metodología para el mejoramiento genético del henequén (Agave fourcroydes Lem.) con el empleo de técnicas biotecnológicas. En: http://www.bioplantas.cu/bioinformática/taller 04 BV.pdf; consulta: febrero 2004. [ Links ]
Murashige, T. y F. Skoog. 1962. A revised medium for rapid growth and bioassays with tobacco tissue cultures. Physiol. Plantarum 15, 473-493. [ Links ]
Nikam, T.D. 1997. High frequency shoot regeneration in Agave sisalana. Plant Cell, Tiss. Org. Cult. 51, 225-228. [ Links ]
Nikam, T.D., G.M. Bansude y A. Kumar. 2003. Somatic embryogenesis in sisal (Agave sisalana Perr. Ex. Engelm). Plant Cell Rpt. 22, 188-194. [ Links ]
Powers, D.E. y R.A. Backhaus. 1989. In vitro propagation of Agave arizonica Gentry & Weber. Plant Cell Tiss. Org. Cult. 16, 57-60. [ Links ]
Robert, M.L., J.L. Herrera, F. Contreras y K.N. Scorer. 1987. In vitro propagation of Agave fourcroydes Lem. (Henequen). Plant Cell Tiss. Org. Cult. 8, 37-48. [ Links ]
Rodríguez, G.B., M.A. Gutiérrez y R.F. Santacruz. 1996a. Métodos de propagación biotecnológicos y convencionales en agaváceas para zonas áridas. pp. 57-86. En: Izquierdo, J. y G. Palomino (eds.). Técnicas convencionales y biotecnológicas para la propagación de plantas de zonas áridas. Fao Regional Office for the Latin American and Caribean Region, Santiago de Chile. [ Links ]
Rodríguez, G.B., M.A. Gutiérrez y D.B. Acosta. 1996b. Somatic embryogenesis of Agave victoria-reginae Moore. Plant Cell Tiss. Org. Cult. 46, 85-87. [ Links ]
Santacruz, R.F., P.H. Gutiérrez, y G.B. Rodríguez. 1999. Efficient in vitro propagation of Agave parrasana Berger. Plant Cell Tiss.Org. Cult. 56, 163-167. [ Links ]
Shimizu, S.S. y H. Mori. 2001. Control of outgrowth and dormancy in axillary buds. Plant Physiol. 127, 1403-1413. [ Links ]
Skoog, F. y C.O. Miller. 1957. Chemical regulation of growth and organ formation in plant tissues cultured in vitro. Symp. Soc. Exp. Biol. 11, 118-131. [ Links ]
Villalobos, V.V., M.J. Mejía y A.H. Escobar. 1991. Micropropagación de opuntias y ágaves. pp. 643-650. En: Roca, W.M. y L.A. Mroginski. (eds.). Cultivo de tejidos en agricultura. Fundamentos y aplicaciones. Centro Internacional de Agricultura Tropical (CIAT), Cali (Colombia). [ Links ]
Yépez, G., E. García y E. Vargas. 2004. Notas preliminares sobre la propagación clonal in vitro de Agave cocui Trel. En: http://www.investigación.unefm.edu.ve.pdf; consulta: junio 2004. [ Links ]














