Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Agronomía Colombiana
Print version ISSN 0120-9965
Agron. colomb. vol.24 no.2 Bogotá July/Dec. 2006
Fánor Casierra-Posada1, Wilson A. Pérez2 y Fernando Portilla3
1 Profesor asociado, Facultad de Ciencias Agropecuarias, Universidad Pedagógica y Tecnológica de Colombia (UPTC), Tunja.
e-mail:fcasierra@tunja.uptc.edu.co
2 Ingeniero agrónomo, Universidad Pedagógica y Tecnológica de Colombia (UPTC), Tunja.
e-mail: wilitoperezsanchez@yahoo.es
3 Ingeniero agrónomo, Universidad Pedagógica y Tecnológica de Colombia (UPTC), Tunja.
e-mail: fepofu@latinmail.com
Resumen:
El género Furcraea es miembro de la familia Agavaceae y es endémico de América Tropical, específicamente de la región andina de Colombia y Venezuela, aunque se le encuentra de manera natural desde el sur de México hasta Brasil. Una cantidad de especies de Furcraea se cultivan en climas cálidos como plantas ornamentales en todo el mundo y para la obtención de fibras a partir de las hojas. Con el objeto de determinar las respuestas fisiológicas a la salinidad, plantas de especies locales de fique (Furcraea macrophylla, F. castilla y F. cabuya) se expusieron a 20, 40, 60 y 80 mmoles de NaCl durante cinco meses. Las plantas de control no se trataron con la sal. El experimento se realizó en un invernadero en Tunja (Colombia). Las plantas se obtuvieron a partir de bulbillos. Éstos crecieron en materas con suelo, se regaron dos veces por semana, evitándose el exceso de agua después de la salinizacion inducida del suelo. Los resultados mostraron que la salinidad del suelo disminuyó la producción total de materia seca, la eficiencia agronómica en el uso del agua (WUE, siglas en inglés de water use efficiency), la relación raíz/parte aérea, la densidad específica de las hojas y el área foliar. La salinidad por NaCl indujo también una modificación en el patrón de distribución de materia seca en las especies evaluadas. La salinidad tuvo poco efecto sobre la evapotranspiración. Las especies consideradas mostraron diferencias genotípicas en cuanto a la tolerancia a la salinidad en la mayoría de los parámetros evaluados.
Palabras claves adicionales: F. macrofphylla, F. cabuya, F. castilla, evapotranspiración, área foliar, salinidad,WUE
Abstract:
The genus Furcraea is a member of Agavaceae family endemic to Tropical America, especially to the Andean region of Colombia and Venezuela, although naturally is distributed from Mexico down to Brazil. A number of Furcraea species are cultivated in warm climates worldwide as ornamentals and for leaf fibers. In order to determine physiological responses to salinity, plants of local furcraea species (Furcreaea castilla, F. macrophylla, and F. cabuya) were exposed to 20, 40, 60, or 80 millimolar NaCl for five months. Control plants were salt-untreated. The experiment was carried out in a greenhouse in Tunja, Colombia. Plants were obtained from bulbils and grown in pots with soil that were irrigated two times a week and the water excess was avoided after induced soil salinization. Results showed that increased salinity in soil reduced total dry matter production, agronomic water use efficiency (WUE), root-shoot ratio, specific leaf density, and leaf area. Additionally, the NaCl salinity modified dry matter partitioning pattern in the evaluated species. Evapotranspiration was slightly influenced by salinity. The studied species showed genotypic differences in salt tolerance for most of the evaluated parameters.
Additional key words: F. macrofphylla, F. cabuya, F. castilla, evapotranspiration, leaf area, salinity, WUE
Introducción
EL GÉNERO FURCRAEA pertenece a la familia Agavaceae, es endémico de América Tropical, específicamente en la región andina de Colombia y Venezuela, y se distribuye tanto en localidades continentales como insulares, desde México hasta Bolivia, incluyendo todas las islas del Caribe. En total se delimitan 25 especies reunidas en dos subgéneros. El subgénero Roezlia agrupa cuatro especies que crecen en México y Guatemala, mientras que el subgénero Furcraea incluye 21 especies de distribución neotropical. Con base en su morfología y distribución, se reconocen cuatro patrones de distribución geográfica, que son: región mesoamericana de montaña, región caribeña, región andina y región amazónica (Ministerio de Agricultura y Desarrollo Rural, 2005a; García-Mendoza, 1998).
En Colombia, el cultivo de fique participó con 0,07% en la valoración total de la producción agrícola en 2004. El área cultivada varió entre 15.388 y 22.176 ha entre 1994 y 2004. Para 2004, el área sembrada en fique abarcó 16.333 ha, de las cuales 38,3% se cultivaron en Cauca, 29,0% en Nariño y 26,3% en Santander (Ministerio de Agricultura y Desarrollo Rural, 2005b).
En relación con el género Furcraea (Agavaceae), se han realizado investigaciones de gran relevancia orientadas al desarrollo de claves para su identificación, descripción, sinonimia, distribución, hábitat y fenología (García- Mendoza, 1998); se ha estudiado su filogenia con base en análisis de DNA (Bogler y Simpson, 1995; Bogler y Simpson, 1996); se ha caracterizado su sistema de producción y sus aplicaciones agroindustriales (Ministerio de Agricultura y Desarrollo Rural, 2005; Simmons- Boyce et al., 2004; Itabashi et al., 1999; Pérez, 1974); sin embargo, es poco lo que se conoce sobre su fisiología, aunque se reporta como una especie de metabolismo CAM (siglas en inglés de Cassulacean acid metabolism) (Alonso, 2005; Francis, 2003).
La temperatura puede influir en los procesos fisiológicos básicos de representantes de la familia Agavacea, como fotosíntesis y respiración, que determinan en gran parte la cantidad de azúcares que se forman en las hojas y, posteriormente, se transportan y almacenan en el tallo. Trabajos previos en especies que presentan el metabolismo CAM, como Agave tequilana, Opuntia ficus-indica y Stenocereus queretaronesis, han revelado que temperaturas cálidas reducen la fotosíntesis e incrementan la respiración (Nobel et al., 1998; Pimienta- Barrios et al., 2000). También se ha encontrado que A. tequilana es una planta sensible al daño por temperaturas bajas (-7 °C) (Nobel et al., 1998). La fotosíntesis en A. tequiliana se incrementa por temperaturas promedio frescas diurnas (22-25 °C) y nocturnas (14- 16 °C), pero disminuye por temperaturas promedio cálidas durante el día (> 28 °C) y la noche (> 20 °C). La respuesta fotosintética a la temperatura se empleó para definir intervalos térmicos de estratificación, que incluyen promedios anuales de temperatura nocturna y diurna (Ruiz-Corral et al., 2002).
Las plantas perennes de desierto deben hacer frente al calor extremo y a la sequía y mantener una toma neta de CO2 durante todo el año. Uno de los grupos de plantas más acordes para los ambientes de desierto son las plantas CAM, caracterizadas por fluctuaciones diurnas en el contenido de ácidos en sus tejidos, así como por la apertura de los estomas durante la noche (Geydan y Melgarejo, 2005; Lüttge, 2004; Hartstock y Nobel, 1976; Szarek y Ting, 1975; Ting y Szarek, 1975, Szarek et al., 1973). A pesar de que existen 18 familias de plantas que tienen especies CAM (Ting y Szarek, 1975), su fisiología se ha estudiado relativamente poco bajo condiciones naturales.
Las plantas CAM se encuentran generalmente en regiones que tienen temperaturas frescas en la noche, lo que favorece la apertura de los estomas (Geydan y Melgarejo, 2005; Lüttge, 2004; Gentry, 1972; Neales, 1973; Nishida, 1963; Ting et al., 1967). Esta apertura en horas de la noche minimiza la pérdida de agua por transpiración, puesto que la temperatura de los tejidos es más baja y, por tanto, los gradientes de la concentración del vapor de agua desde la hoja al aire son considerablemente menores que los valores en el día. El índice del flujo de CO2 disminuye cuando la temperatura del cojín de O. phaeacantha aumenta (Nisbet y Patten, 1974). De hecho, el grado óptimo de temperatura para la fijación oscura del CO2 por las plantas de CAM es bajo y se encuentra alrededor de los 15 °C (Kluge et al., 1973; Neales, 1973), aunque pueden ocurrir variaciones estacionales como consecuencia de la temperatura (Nisbet y Patten, 1974). A. deserti (Agavaceae) es una planta común en los desiertos mexicanos, que puede soportar heladas y años muy secos (Gentry, 1972; Munz, 1974; Nobel, 1976). El primer reporte de que los estomas de plantas del género Agave se abren en la noche, como es característico de las plantas CAM, fueron hechos independientemente por Neales et al. (1968) y Ehrler (1969). Este último encontró que la pérdida de agua por transpiración en A. americana en un período de 70 d era 71 veces el aumento en el peso seco, lo que representa una muy buena eficiencia en el uso del agua (WUE) (Szarek y Ting, 1975; Ting y Szarek, 1975; Szarek et al., 1973). Los estudios realizados por Neales et al. (1968) en cuanto a mediciones de fotosíntesis y transpiración en A. americana demostraron claramente la naturaleza CAENM de esta planta.
Se ha encontrado que la respuesta relativa al estado nutricional de 10 especies de cactus mostró alta correlación entre el nivel de nutrientes en el clorénquima y la acumulación nocturna de ácido, índice del metabolismo CAM, con el nitrógeno. La segunda correlación más alta estuvo relacionada con el sodio, en la que la acumulación ácida nocturna presentó una correlación negativa con el nivel de sodio en clorénquima (Nobel, 1983). Se ha reportado que la aplicación de 100 milimoles de NaCl redujo el crecimiento alrededor de 50% en Ferocactus acanthodes y Trichocereus chilensis. Por otra parte, una concentración de 400-600 milimoles de NaCl puede inducir que la planta halófita anual Mesembryanthemum crystallinum cambie de fotosíntesis C3 a CAM (Winter, 1979; Winter y Von Willert,1972). En Cereus validus se encontró que el metabolismo CAM se inhibe 67% como consecuencia de la salinidad por NaCl (Nobel et al., 1984)
En las planicies salinas sudamericanas crecen varias especies cactáceas y bromeliáceas que son plantas CAM obligadas (Ragonese, 1951). Se ha sugerido que el cactus de las salinas C. validus se podría utilizar como planta cultivada en el desierto de Sonora (Yensen et al., 1981); además, se ha reportado que los cactus en las llanuras salinas cerca de Chichiriviche (Venezuela) están expuestos a condiciones altamente salinas del suelo únicamente durante la estación seca y en esa temporada no presentan raíces activas para la absorción, por lo que no acumulan NaCl (Walter, 1962). Durante el resto del año, la alta precipitación limita el estrés salino.
El objetivo de este trabajo fue la evaluación de la evapotranspiración, la eficiencia agronómica en el uso del agua, el peso seco total, la distribución de materia seca en los diferentes órganos, la relación raíz/parte aérea, el peso específico de las hojas y el área foliar en las especies locales de fique F. castilla, F. macrophylla y F. cabuya, mantenidas bajo diferentes niveles de salinidad por NaCl en condiciones de invernadero.
Materiales y métodos
Con el objeto de determinar el efecto de la salinidad por NaCl sobre el consumo de agua y la distribución de materia seca en plantas de fique (Furcraea sp. Vent), se evaluaron las especies locales F. macrofphylla, F. cabuya y F. castilla. El material vegetal se obtuvo a partir de bulbillos colectados de plantas que crecían en forma silvestre en los municipios de San Pablo de Borbur, Tinjacá y Arcabuco (Boyacá, Colombia) y que se desarrollaron en bolsas plásticas con capacidad para 3 kg de suelo. Después de que las plántulas desarrollaron cerca de cuatro hojas, se inició la salinización del suelo en las bolsas. Los tratamientos para inducir la salinidad con NaCl fueron 0, 20, 40, 60 y 80 milimol· kg-1 de suelo seco al aire, los cuales indujeron valores de conductividad eléctrica de 2,3; 3,9; 5,8; 8,5 y 9,8 dS· m-1, respectivamente.
Los tratamientos se impusieron a las plantas aproximadamente 60 d después de la brotación. La cantidad total de NaCl se aplicó gradualmente al suelo de cada bolsa a lo largo de un periodo cercano a 4 semanas, según la metodología implementada por Casierra-Posada y García (2005). Durante el ensayo, la humedad del suelo de las bolsas se mantuvo cercana a la capacidad de campo. La cantidad de agua diaria para regar las materas se calculó con base en el peso de la matera y en la pérdida de agua con respecto al peso de la misma el día anterior, de manera que el suelo en las materas no llegara al punto de marchitez temporal ni sobrepasara la capacidad de campo.
Las plantas se cosecharon 5 meses después de terminar los tratamientos con la sal, momento en el que se determinó: el área foliar, mediante un analizador Li- Cor® 3000A (Li-Cor, USA); la acumulación de fitomasa en hojas, tallos y raíces, mediante el secado de los diferentes órganos a 70 °C durante 48 h; la relación raíz/parte aérea, como el cociente del peso seco de la raíz y de la parte aérea (hojas y tallo); la evapotranspiración, como la sumatoria del agua aportada a cada matera durante todo el ensayo; el peso específico de las hojas, expresado como el cociente entre el peso seco de las hojas y el área foliar y, finalmente, la eficiencia agronómica en el uso del agua (WUE), que se calculó como el total de materia seca producida por planta dividido entre la cantidad de agua evapotranspirada y se expresó en gramos por litro.
El diseño estadístico usado fue en bloques al azar con siete replicaciones. Los resultados obtenidos se sometieron a un análisis de varianza clásico para determinar la significancia. La diferencia entre promedios se determinó mediante la prueba de comparación de Tukey. Los análisis estadísticos se realizaron con la versión 11.5 de SPSS® (Statistical Package for the Social Sciences). Las figuras se presentan en formato de barras con su respectiva desviación estándar.
Resultados y discusión
Evapotranspiración
La concentración de sales en el sustrato ni su interacción con las especies estudiadas produjeron diferencia significativa en cuanto a la evapotranspiración; sin embargo, se presentaron diferencias altamente significativas entre las especies comparadas. Las especies F. cabuya y F. macrophylla evapotranspiraron respectivamente 5,5 y 11,7% más que la variedad F. castilla (figura 1).
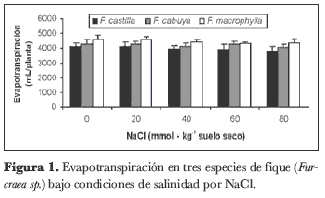
Respecto a las especies evaluadas, se presentó una relación inversa entre la cantidad de agua evapotranspirada y el área foliar, como se discutirá más adelante, de modo que el área foliar debió tener poca influencia sobre la cantidad de agua evaporada por las diferentes especies, mientras que las diferencias en los valores de la evapotranspiración pudieron ser la consecuencia de la cantidad de estomas que presenta cada una de las variedades evaluadas, dado que la cantidad de estomas presentes en las hojas es un resultado del genotipo.
A pesar de que no se presentaron diferencias significativas en la evapotranspiración como resultado de la concentración de NaCl en el sustrato, las tres especies tratadas presentaron una relación inversa entre el agua evapotranspirada y la concentración de NaCl en el sustrato. Esto corresponde a un mecanismo de adaptación de las plantas a las condiciones de salinidad, como sucede con algunas plantas con plasticidad fenotípica para pasar de metabolismo C3 a CAM –como M. crystallinum–, que reducen la transpiración bajo condiciones de salinidad, con lo que disminuyen el transporte de iones tóxicos a la parte aérea (Marschner, 1998; Cushman et al., 1990). Por otro lado, las sales en el sustrato les reducen su potencial osmótico, lo que representa una limitante para la toma de agua; por tanto, las plantas deben reducir el potencial osmótico de sus raíces por debajo del que presenta el sustrato para poder tomar el agua del suelo. Al contrario de lo encontrado en el presente trabajo, plantas de Rubus sp. expuestas a salinidad por NaCl mostraron alta sensibilidad a ella, reduciéndose la evapotranspiración de manera directamente proporcional a la concentración de sales en el sustrato (Casierra-Posada y Hernández, 2006). A pesar de estas apreciaciones, la diferencia en la reducción del agua evapotranspirada en función de la concentración de sales en el sustrato fue mínima en comparación con la presentada por M. crystallinum, lo que implica que las especies del género Furcraea estudiadas presentan un mecanismo eficiente de adaptación a la salinidad, que puede estar representado por la acumulación de compuestos osmoprotectores en las raíces.
Eficiencia agronómica en el uso del agua
Esta variable fue afectada notablemente por los factores salinidad y especie, en los que se encontraron diferencias altamente significativas (P < 0,01). La interacción entre los dos factores individuales evaluados no mostró diferencia significativa. La cantidad de materia seca producida por litro de agua evapotranspirada se redujo en proporción de 23,2%, 17,6%, 29,2% y 40,2% para las concentraciones de NaCl de 20, 40, 60 y 80 milimoles, respectivamente, en relación con las plantas de control sin NaCl. En cuanto a la especie, se encontró que F. cabuya y F. castilla presentaron una WUE 45,1% y 120,7% superior a la presentada por F. macrophylla (figura 2).
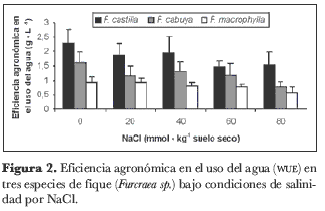
Por lo regular, tanto las plantas CAM como los cactus presentan una WUE cuatro veces mayor que las plantas de metabolismo C4 (Snyman, 2005; Nobel, 1995), pero, bajo condiciones de estrés salino, el efecto de la salinidad sobre la WUE sigue diversos patrones según la naturaleza de sales (Bhattarai, 2005). Si el estrés salino se debe a la toxicidad por iones, induce un incremento en la respiración o una disminución de la fotosíntesis; incluso a concentraciones bajas de sales (< 0,01 M), se incrementa la tasa respiratoria, con el respectivo incremento en el consumo de oxígeno, ya que, bajo condiciones de exceso de NaCl en el sustrato, el Na+ promueve la formación de ADP y fósforo inorgánico, a partir del ATP, y, por consiguiente, el ADP entra a la cadena respiratoria y promueve el incremento de la respiración (Kasumov y Abbasova, 1998). Tanto el aumento en la respiración como la disminución de la fotosíntesis conllevan una disminución en la cantidad de asimilados producidos, lo que tendrá como consecuencia la reducción en la materia seca acumulada en la planta por unidad de agua transpirada, dando como resultado una WUE baja (Hester et al., 2001). Sin embargo, si el estrés es el resultado del potencial osmótico bajo, las plantas responden cerrando los estomas. Debido a que la fotosíntesis se afecta menos por la conductancia de los estomas que por la transpiración, se espera que la WUE aumente con la salinidad (Ben-Gal et al., 2003; Brugnoli y Björkman, 1992; Nobel et al., 1984). Sin embargo, la WUE agronómica (peso seco por agua aplicada) y la salinidad muestran normalmente un comportamiento inversamente proporcional (Bhattarai, 2005), dado que la proporción del agua aportada por irrigación que se utiliza en la transpiración se reduce como consecuencia de la disminución en el potencial osmótico del sustrato (Gucci et al.1997). Esto concuerda con los resultados encontrados en el presente trabajo, aunque se debe mencionar que el comportamiento de la WUE agronómica bajo condiciones de salinidad tiene un marcado componente genotípico (Reina-Sánchez et al., 2005).
Peso seco por planta
Los factores salinidad y especie tuvieron una influencia notable en la producción total de materia seca por planta (figura 3). Es así como para ambos factores se encontró diferencia altamente significativa (P < 0,01). No se encontró diferencia estadísticamente significativa para la interacción de los dos factores. La salinidad en el sustrato redujo la cantidad de materia seca en las plantas, en el orden de 16,8%, 17,0%, 29,8% y 41,7%, para los niveles de 20, 40, 60 y 80 milimoles de NaCl, respectivamente, en comparación con las plantas de control. En lo relacionado con el factor especie, F. cabuya y F.castilla produjeron respectivamente 36,1% y 97,2% más materia seca por planta que la especie F. macrophylla.
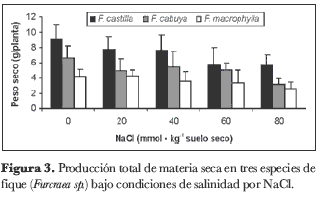
Tanto el crecimiento como la acumulación total de materia seca en las plantas son factores que por lo general se ven seriamente afectados por el exceso de sales en el sustrato, lo que puede ser la consecuencia de la disminución en la tasa fotosintética, del incremento en la respiración o de ambos procesos, en plantas expuestas a la salinidad. Al respecto, se ha reportado que el exceso de iones tóxicos, como N+ y Cl-, influye sobre la actividad enzimática y, por tanto, tiene consecuencias negativas sobre la fotosíntesis; además, la reacción de Hill se ve fuertemente afectada por deshidratación de los cloroplastos bajo condiciones de salinidad (Kreeb, 1996). Otros mecanismos por los que la salinidad reduce la tasa fotosintética son a través de la inducción de daños irreparables en el tonoplasto, por modificaciones tanto en su estructura como en su función; además, la toma de fotones disminuye con la reducción en la concentración de pigmentos fotosintéticos provocada por el exceso de sales (Kreeb y Chen, 1991).
La toma nocturna de CO2 y la acumulación de ácido málico en Cereus validus –planta cactácea con metabolismo CAM– se ven afectadas negativamente por la salinidad por NaCl en el suelo, en proporción de 67% y 49%, respectivamente (Nobel et al., 1984). Al respecto, las implicaciones de una toma reducida de CO2 por una planta completa son considerables, pues esto tiene como consecuencia una reducción en la producción de materia seca. El comportamiento de C. validus contrasta fuertemente con el de M. crystallinum –halófita facultativa de metabolismo CAM– bajo condiciones de salinidad por NaCl, dado que en M. crystallinum los niveles de Na+ se incrementan en el tejido fotosintético, pero no producen cambios en el ácido málico a lo largo de las 24 h del día ni en la fijación del CO2 en el estado CAM (Lüttge y Smith, 1984; Winter, 1979).
Distribución de materia seca en raíces, tallo y hojas
El porcentaje de acumulación de materia seca en las raíces de las plantas se vio afectado sólo por el factor salinidad, encontrándose diferencias altamente significativas (P < 0,01). El factor especie ni su interacción con la salinidad arrojaron diferencias estadísticamente significativas. Por otro lado, las variables acumulación de materia seca en el tallo y en las hojas fueron influenciadas sólo por el factor especie y no por el factor salinidad, también con diferencias altamente significativas (figura 4), sin que hubiera diferencias debidas a la interacción especie × salinidad. La concentración de NaCl en el sustrato redujo el porcentaje de la masa radicular en 15,1%, 19,6%, 40,1% y 43,1% para los tratamientos con 20, 40, 60 y 80 milimoles de la sal, respectivamente, en comparación con las plantas de control sin NaCl. Las especies F. cabuya y F. macrophylla acumularon, respectivamente, 35,5% y 94,7% más de materia seca en los tallos, en comparación con la especie F. castilla. En cuanto a la proporción de materia seca acumulada en las hojas, las especies F. macrophylla y F. castilla presentaron 27,7% y 38,2% más materia seca acumulada en las hojas que la especie F. cabuya.
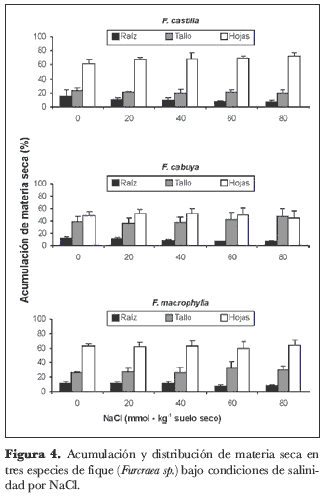
Vale la pena resaltar que la salinidad modificó el patrón de distribución de materia seca en las raíces, tallos y hojas, en las tres especies evaluadas. Es sí como en la variedad F. castilla, el modelo de acumulación se alteró como consecuencia del incremento en la concentración de NaCl en el sustrato, de manera que la acumulación de fitomasa en las hojas se incrementó proporcionalmente con la concentración de NaCl en el suelo, mientras que en las raíces sucedió lo contrario. Por su parte, la proporción de materia seca acumulada en los tallos mostró poca variación con el incremento de la sal. Por último, en las especies F. cabuya y F. macrophylla, la proporción de materia seca acumulada en las raíces disminuyó con el incremento en la salinidad, en lo tallos aumentó y en las hojas la variación fue mínima (figura 4). Estos resultados muestran que las plantas del género Furcraea tienen respuestas diferenciales, de acuerdo con la especie, en la distribución de materia seca al exponer las plantas a la salinidad. Esta respuesta puede ser la consecuencia de diferencias genotípicas en la acumulación de sodio y cloro en los diferentes órganos del vegetal, como sucedió con C. validus y Opuntia ficus-indica, plantas cactáceas tipo CAM. En estas especies, los niveles del Na eran similares en las raíces y los órganos aéreos cuando las plantas crecían en sustrato sin exceso de sales; en la medida en que la concentración del NaCl se incrementó en el sustrato, la concentración del Na+ y Cl- aumentó más rápidamente en las raíces que en la parte aérea (Nobel et al., 1984; Nobel, 1983).
El incremento en el contenido de N+ en los tejidos altera también, por antagonismo, la concentración de K+ en ellos. En plantas de C. validus expuestas a NaCl la concentración de K+ en la parte aérea aumentó cerca de 25% con una concentración de 200 milimoles de NaCl y 110% con 400 milimoles de la sal. Estos tratamientos con NaCl redujeron la biomasa de la parte aérea en 25% y 42%, respectivamente; por tanto, el aumento en la concentración del K+ en la parte aérea de plantas tratadas con NaCI se podría explicar porque se concentra a causa de la deshidratación inducida por la salinidad en los órganos aéreos. El aumento del contenido de K+ en el nivel más alto de NaCl fue mayor al que podría ser considerado solamente por la deshidratación; de hecho, cuando se aplicaron más de 200 milimoles de NaCl, un poco de K+ se movió de la raíz a la parte aérea, al parecer en respuesta al aumento de Na+ de las raíces (Nobel et al., 1984). Se evidencia que la exposición de plantas CAM a contenidos elevados de NaCl provoca desórdenes fisiológicos que empiezan por la toma excesiva de iones Na+ y Cl- que le permiten al vegetal alterar su potencial osmótico para lograr la entrada de agua a las raíces. Una vez en el interior del vegetal, los iones Na+ y Cl-, al encontrarse en exceso, desencadenan reacciones de toxicidad y antagonismo con otros iones esenciales, por lo que los vegetales se ven en la necesidad de acumular esos iones en órganos en donde causen el menor daño posible, lo que altera el patrón de acumulación de iones en los tejidos y, por tanto, la acumulación de materia seca en los diferentes órganos.
Por otro lado, se ha reportado que la sensibilidad de las especies o los cultivares a la salinidad presenta diferentes patrones, de acuerdo con la ontogenia (Marschner, 1998), de modo que la tolerancia se puede incrementar o reducir en función, no sólo de la especie o cultivar (Romero-Aranda et al., 2001; Reina-Sánchez et al., 2005; Gucci et al., 1997), sino también de los factores ambientales (Marschner, 1998). Por estas razones, las especies de Furcraea evaluadas mostraron diferencias en cuanto al patrón de acumulación de materia seca, cuando se expusieron a concentraciones altas de NaCl, ya que el genotipo juega un papel determinante en la posibilidad de respuesta de la especie a la salinidad.
Relación raíz/parte aérea
El análisis de los valores de la relación raíz/parte aérea arrojó diferencias altamente significativas (P < 0,01) sólo para el factor salinidad. La interacción especie × salinidad no mostró diferencia significativa. No se presentó diferencia estadísticamente significativa entre las especies evaluadas. En las tres especies, el valor de la relación raíz/parte aérea tuvo un comportamiento inversamente proporcional a la concentración de NaCl en el sustrato (figura 5); la relación se redujo, en promedio, 19,6%, 24,6%, 44,9% y 47,4% para las concentraciones de 20, 40, 60 y 80 milimoles de NaCl en el sustrato, respectivamente, en relación con las plantas de control.
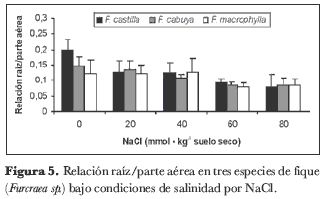
La relación raíz/parte aérea es un factor dependiente de la distribución de los fotoasimilados, cuya producción y distribución está supeditada a los estímulos ambientales, como la exposición de la parte aérea al CO2, entre otros (Rogers et al., 1996). Además, esta relación depende también de la capacidad del vegetal para modificar la distribución de materia seca, de manera que le permita tolerar las condiciones adversas en que se desarrolla, como se discutió arriba. En cuanto a esta variable, se ha encontrado que por lo general el valor de esta relación se incrementa ligeramente en forma proporcional a la salinidad en el sustrato (Gonçalves et al., 2001), lo que significa que se sacrifica la acumulación de biomasa en los órganos aéreos a favor de su depósito en las raíces, con lo que la planta podría explorar un mayor volumen de suelo hasta encontrar horizontes con menor acumulación de sales. A pesar de esto, en este trabajo se encontró una disminución en la relación raíz/parte aérea, lo que implica una relación inversamente proporcional entre la concentración de NaCl en el sustrato y el crecimiento de la masa radicular, como ya se discutió para la acumulación y distribución de materia seca en los diferentes órganos. Con esta estrategia adaptativa de las especies de Furcraea evaluadas, las plantas podrían desarrollar una mayor área fotosintética, la que, complementada con el metabolismo CAM, podría suplir el efecto negativo que les causa la salinidad con respecto a la tasa fotosintética y, por ende, a la producción de fitomasa.
Peso específico de las hojas
El peso específico de las hojas se vio severamente afectado por los factores salinidad y especie, para los que se presentaron diferencias altamente significativas (P < 0,01). Para el promedio de las tres especies, la salinidad provocó una reducción de esta variable en una proporción de 10,5%, 11,2%, 20,7% y 30,9%, en comparación con el control, para concentraciones de NaCl de 20, 40, 60 y 80 milimoles en el sustrato, respectivamente (figura 6). En cuanto a las especies evaluadas, independientemente del nivel de salinidad, el mayor promedio del peso específico de las hojas lo presentó F. castilla (2,7 mg· cm-2), seguido por F. macrophylla (2,6 mg· cm-2) y, por último, por F. cabuya (2,1 mg· cm-2).
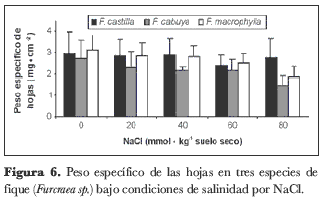
El ajuste osmótico es una respuesta adaptativa fundamental de las células vegetales que se exponen a la salinidad (Keles y Öncel, 2004; Roosens et al., 1999; Gucci et al., 1997). Algunos solutos orgánicos neutrales pueden desempeñar un papel importante en el equilibrio de la presión osmótica del citoplasma con el de la vacuola. La cantidad de solutos aumenta con el incremento en la salinidad en muchas especies (Greenway y Munns, 1980), lo que normalmente tiene como consecuencia un aumento en el peso específico de las hojas (Casierra-Posada y Hernández, 2006; Casierra-Posada y García, 2005). Sin embargo, en el presente trabajo, el incremento en el nivel de NaCl en el sustrato redujo el peso específico de las hojas de las especies estudiadas, lo que podría ser consecuencia de las modificaciones que la salinidad induce en la anatomía de las hojas, incrementando su suculencia (Longstreth y Nobel, 1979; Poljakoff-Mayber, 1975; Wignarajah et al., 1975).
Área foliar
Mientras que la concentración de NaCl en el sustrato no indujo diferencias significativas para la variable área foliar, el análisis estadístico para el factor especie mostró diferencias altamente significativas (P < 0,01). A pesar de que no hubo diferencia estadísticamente significativa, la salinidad indujo una reducción del área foliar en el orden de 3,9%, 4,3%, 8,8% y 13,6%, respecto al control, para concentraciones de 20, 40, 60 y 80 milimoles de NaCl en el sustrato, respectivamente (figura 7). La mayor área foliar la presentó F. castilla (181,1 cm²), seguida por F. cabuya (116,3 cm²) y por F. macrophylla (87,4 cm²).
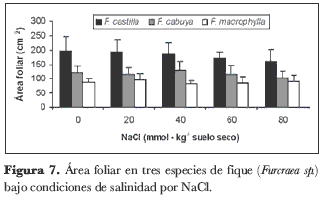
Se ha reportado que, en cultivos sin estrés, el determinante principal de la producción de la biomasa es la cantidad de radiación fotosintéticamente activa (PAR, siglas en inglés de photosintetic active radiation) que absorben (Idinoba et al., 2002). El crecimiento del cultivo se puede describir como el producto de la PAR incidente, la fracción de la PAR interceptada por las hojas verdes y la eficiencia con que la PAR es usada en el proceso de fotosíntesis. Mientras que la PAR depende de la localización y de la época del año, el coeficiente estacional depende de la duración y del área eficiente del pabellón (Chapman y Edmeades, 1996). La salinidad tiene efectos negativos sobre el desarrollo de la hoja y del pabellón, lo que lleva a una producción reducida de biomasa y a una disminución en la interceptación de la PAR (Kozlowski, 1997). La eficiencia del uso de la radiación (RUE, siglas en inglés de radiation use efficiency) depende de la distribución de la luz directa y difusa dentro del pabellón y de la eficiencia con que la fotosíntesis ocurre en la hoja. Por tanto, dado que el estrés salino tiene un efecto directo sobre el desarrollo del pabellón y sobre la eficiencia de la fotosíntesis, también ejerce un efecto negativo sobre la RUE en ambientes salinos (Muchow et al., 1993). Lo anterior lo corroboran Alvino et al. (2002), quienes registraron una disminución del RUE con un aumento en salinidad. A pesar de estas apreciaciones y de que la salinidad tuvo un efecto mínimo sobre la reducción en el área foliar en las especies evaluadas en el presente trabajo, la concentración de NaCl afectó negativamente la producción de materia seca en las plantas y la eficiencia agronómica en el uso del agua, entre otros factores, lo que en conjunto sería la resultante de una tasa fotosintética reducida, como consecuencia del efecto desfavorable del NaCl.
Agradecimientos
Los autores agradecen a José Constantino Pacheco por su colaboración en la realización de este trabajo. Este estudio se desarrolló con el apoyo de la Dirección de Investigaciones (DIN) de la Universidad Pedagógica y Tecnológica de Colombia (UPTC), en el marco del plan de trabajo del grupo de investigación Ecofisiología vegetal, adscrito al programa de Ingeniería Agronómica de la Facultad de Ciencias Agropecuarias, Tunja.
Literatura citada
Alonso, M.S. 2005. Valorisation de la bagasse de l’Agave tequilana W. cv. azul: caractérisation, étude de la digestibilité et de la fermentation des sucres. Tesis doctoral. Institut National Polytechnique de Toulouse, Toulouse. 201 p.
Alvino, A., R. Andria, S. Delfine, A. Lavini y P. Zanetti. 2002. Effect of water and salinity stress on radiation absorption and efficiency of sunflower. Ital. J. Agron. 4, 53-60. [ Links ]
Bhattarai, S.P. 2005. The physiology of water use efficiency of crops subjected to subsurface drip irrigation, oxygation and salinity in a heavy clay soil. Tesis doctoral. School of Biological and Environmental Sciences, Faculty of Arts, Health and Sciences, Central Queensland University, Rockhampton (Australia). pp. 101-129. [ Links ]
Ben-Gal, A., L. Karlberg, P.E. Jansson y U. Shani. 2003. Temporal robustness of linear relationships between production and transpiration. Plant Soil 251, 211-218. [ Links ]
Bogler, D.J. y B.B. Simpson. 1995. A chloroplast DNA study of the Agavaceae. Syst. Bot. 20(2), 191-205. [ Links ]
Bogler, D.J. y B.B. Simpson. 1996. Phylogeny of Agavaceae based on its rDNA sequence variation. Am. J. Bot. 83(9), 1225-1235. [ Links ]
Brugnoli, E. y O. Björkman. 1992. Growth of cotton under continuous salinity stress: Influence on allocation pattern, stomatal and non-stomatal components of photosynthesis and dissipation of excess light energy. Planta 187, 335-345. [ Links ]
Casierra-Posada, F. y N. García. 2005. Crecimiento y distribución de materia seca en cultivares de fresa (Fragaria sp.) bajo estrés salino. Agronomía Colombiana 23(1), 83-89. [ Links ]
Casierra-Posada, F. y H.L. Hernández. 2006. Evapotranspiración y distribución de materia seca en plantas de mora (Rubus sp.) bajo estrés salino. Revista UDCA Actualidad y Divulgación Científica 9(1), 85-95. [ Links ]
Chapman, S.C. y G.O. Edmeades. 1996. Differences in radiation use efficiency among lines in a tropical maize population. En: “Proceedings of the 8th Australian Agronomy Conference”, Toowoomba, Queensland, Australia. http://www.regional.org.au/au/asa/1996/contributed/136chapman.htm
Cushman, J.C., C.B. Michalowski y H.J. Bohnert. 1990. Developmental control of crassulacean acid metabolism inducibility by salt stress in common Ice Plant. Plant Physiol. 94, 1137-1142. [ Links ]
Ehrler, W.L. 1969. Daytime stomatal closure in Agave americana as related to enhanced water-use efficiency. En: Hoff, C.C. y M.L. Riedesel (eds.). Physiological systems in semiarid environments. University of New Mexico Press, Albuquerque. pp. 239-247. [ Links ]
Francis, J.K. 2003. Furcraea foetida L (Haw). U.S. Department of Agriculture, Forest Service, International Institute of Tropical Forestry, Jardín Botánico Sur. En: http://www.fs.fed.us/global/iitf/pdf/shrubs/Furcraea%20foetida.pdf [ Links ]
García-Mendoza, A.J. 1998. Revisión taxonómica del género Furcraea (Agavaceae) en México y Guatemala. UNAM, Instituto de Biología. Informe final resultado de proyecto Conabio. México. 67 p. Gentry, H. S. 1972. The Agave family in Sonora. Agricultural Research Service, USDA, Washington, D.C. pp. 1-5, 17-18, 134- 138. [ Links ]
Geydan, T.D. y L.M. Melgarejo. 2005. Metabolismo ácido de las crasuláceas. Acta Biológica Colombiana 10(2), 3-15. [ Links ]
Gonçalves, R., F.J.A. Fernandez y F.F. Ferreira. 2001. Distribução de materia seca e composição química das raízes, caule e fohlas de goiabeira submetida a estresse salino. Pesqui. Agropecu. Bras. 36(1), 79-88. [ Links ]
Greenway, H. y R. Munns. 1980. Mechanisms of salt tolerance in nonhalophytes. Annu. Rev. Plant. Phys. 31, 149-190. [ Links ]
Gucci, R., L. Lombardini y M. Tattini. 1997. Analysis of leaf water relations in leaves of two Olive (Olea europaea) cultivars differing in tolerance to salinity. Tree Physiol. 17, 13-21. [ Links ]
Hartstock, T.L. y P.S. Nobel. 1976. Watering converts a CAM plant to daytime CO2 uptake. Nature 262, 574-576. [ Links ]
Hester, M. W., I. A. Mendelssohn y K. L. McKee. 2001. Species and population variation to salinity stress in Panicum hemitomon, Spartina patens, and Spartina alterniflora: Morphological and physiological constraints. Environ. Exp. Bot. 46, 277-297. [ Links ]
Idinoba, M.E., P.A. Idinoba y A.S. Gbadegesin. 2002. Radiation interception and its efficiency for dry matter production in three crop species in the transitional humid zone of Nigeria. Agronomie 22, 273-281. [ Links ]
Itabashi, M., K. Segawa, Y. Ikeda, S. Kondo, H. Naganawa, T. Koyano y K. Umezawa. 1999. A new bioactive steroidal saponin, furcreastatin, from the plant Furcraea foetida. Carbohyd. Res. 323(1-4), 57-62. [ Links ]
Kazumov, N.A. y Z.I. Abbasova. 1998. Effects of salt stress on the respiratory components of some plants. Turk. J. Bot. 22, 389-396. [ Links ]
Keles, Y. y I. Öncel. 2004. Growth and solute composition in two wheat species experiencing combined influence of stress conditions. Russ. J. Plant Physiol. 51( 2), 203-208. [ Links ]
Kluge, M., O.L. Lange, M. Eichmann y R. Schmid. 1973. Diurnaler Saurerhythmus bei Tillandsia usneoides: Untersuchungen über den Weg des Kohlenstoffs sowie die Abhängigkeit des CO2-Gaswechsels von Lichtintensität, Temperatur und Wassergehalt der Pflanze. Planta 112, 357-372. [ Links ]
Kozlowski, T.T. 1997. Response of woody plants to flooding and salinity. Tree Physiol. Monog. 1, 1-29. [ Links ]
Kreeb, K.H. 1996. Salzstress. En: Stress bei Pflanzen. Brunold, C., A. Rüegsegger y R. Brändle (eds.). Editorial Paul Haupt, Stuttgart. pp. 149-172. [ Links ]
Kreeb, K. y T. Chen. 1991. Combination effects of water and salt stress on growth, hydratation and pigment composition in wheat. En: Esser, G. y C. Over-Dieck (eds.) Modern ecology, basic and applied aspects. pp. 215-231. [ Links ]
Longstreth, D.J. y P.S. Nobel. 1979. Salinity effects on leaf anatomy. Plant Physiol. 63, 700-703. [ Links ]
Lüttge, U. 2004. Ecophysiology of crassulacean acid metabolism (CAM). Ann. Bot. 93, 629-652. [ Links ]
Lüttge, U y J.A.C. Smith. 1984. Structural, biophysical, and biochemical aspects of the role of leaves in plant adaptation to salinity and water stress. En: Staples, R.C. y G.H. Toenniessen (eds.). Salinity tolerance in plants: strategies for crop improvement. John Wiley and Sons, New York. pp. 125-150. [ Links ]
Marschner, H. 1998. Mineral nutrition of higher plants. Academic Press, London. pp. 657-680. [ Links ]
Ministerio de Agricultura y Desarrollo Rural. 2005a. Acuerdo para el fomento de la producción y la competitividad del subsector del fique. Corpoica, IICA, Bogotá. 46 p.
Ministerio de Agricultura y Desarrollo Rural. 2005b. Anuario estadístico. Información tomada de URPA-Boyacá en medio magnético.
Muchow, R.C., M.J. Robertson y B.C. Pengelly. 1993. Radiation use efficiency of soybean, mungbean and cowpea under different environmental conditions. Field Crop Res. 32, 1-16. [ Links ]
Munz, P.A. 1974. A flora of Southern California. University of California Press, Berkeley. 864 p. [ Links ]
Neales, T. F. 1973. The effect of night temperature on CO2 assimilation, transpiration, and water use efficiency in Agave americana L. Aust. J. Biol. Sci. 26, 705-714. [ Links ]
Neales, T. F., A.A. Patterson y V.J. Hartney. 1968. Physiological adaptation to drought in the carbon assimilation and water loss of xerophytes. Nature 219, 469-472. [ Links ]
Nisbet, R.A. y T. Patten. 1974. Seasonal temperature acclimation of a prickly-pear cactus in south-central Arizona. Oecologia 15, 345-352. [ Links ]
Nishida, K. 1963. Studies on stomatal movement of crassulacean plants in relation to the acid metabolism. Physiol. Plant. 16, 281-298. [ Links ]
Nobel, P.S. 1976. Water relations and photosynthesis of a desert CAM plant, Agave deserti. Plant Physiol. 58, 576-582. [ Links ]
Nobel, P.S. 1983. Nutrient levels in cacti-relation to nocturnal acid accumulation and growth. Am. J. Bot. 70, 1244-1253. [ Links ]
Nobel, P.S. 1995. Environmental biology. En: Barbera, G., P. Inglese y E. Pimienta-Barrios (eds.). Agroecology, cultivation and uses of cactus pear. FAO Plant production and protection paper 132. 36-48 pp. [ Links ]
Nobel, P.S., M. Castañeda, G. North, E. Pimienta-Barrios y J.A. Ruiz-Corral. 1998. Temperature influences on leaf CO2 exchange, cell viability and cultivation range for Agave tequilana. J. Arid Environ. 39,1-9. [ Links ]
Nobel, P.S., U. Lüttge, S. Heuer y E. Ball. 1984. Influence of applied NaCl on Crassulacean acid metabolism and ionic levels in a cactus Cereus validus. Plant Physiol. 75, 799-803. [ Links ]
Pérez, J.A. 1974. El fique. Su taxonomía, cultivo y tecnología. 2ª edición. Compañía de Empaque SA, Editorial Colina. 115 p. [ Links ]
Pimienta-Barrios, E., J. Zañudo, E. Yepez y P.S. Nobel. 2000. Seasonal variation of net CO2 uptake for cactus pear (Opuntia ficusindica) and pitayo (Stenocereus queretaroensis) in a semiarid environment. J. Arid Environ. 44, 73-83. [ Links ]
Poljakoff-Mayber, A. 1975 Morphological and anatomical changes in plants as a response to salinity stress. En: Poljakoff-Mayber, A. y J. Gale (eds.). Plants in saline environments-Ecological studies 15. Springer-Verlag, Berlin. pp. 97-117. [ Links ]
Ragonese, A.E. 1951. La vegetación de la República Argentina. II. Estudio fitosociológico de las salinas grandes. Rev. Invest. Agríc. 5, 1-233. [ Links ]
Reina-Sánchez, A., R. Romero-Aranda y J. Cuartero. 2005. Plant water uptake and water use efficiency of greenhouse tomato cultivars irrigated with saline water. Agr. Water Mgt. 78, 54-56. [ Links ]
Rogers, H.H., S.A. Prior, G.B. Runion y R.J. Mitchell. 1996. Root to shoot ratio of crops as influenced by CO2. Plant Soil 187(2), 229-248. [ Links ]
Romero-Aranda, R., T. Soria y J. Cuartero. 2001. Tomato plantwater uptake and plant-water relationships under saline growth conditions. Plant Sci. 160, 265-272. [ Links ]
Roosens, N.H., R. Willem, Y. Li, I. Verbruggen, M. Biesemans y M. Jacobs. 1999. Proline metabolism in the wild-type and in a salttolerant mutant of Nicotiana plumbaginifolia studied by 13C-nuclear magnetic resonance imaging. Plant Physiol. 121, 1281-1290. [ Links ]
Ruiz-Corral, J.A., E. Pimienta-Barrios y J. Zañudo-Hernández. 2002.
Regiones térmicas óptimas y marginales para el cultivo de Agave tequilana en el estado de Jalisco. Agrociencia 36, 41-53.
Simmons-Boyce, J.L., W.F. Tinto, S. McLean y W.F. Reynolds. 2004. Saponins from Furcraea selloa var. marginata. Fitoterapia 75(7- 8), 634-638. [ Links ]
Snyman, H.A. 2005. A case study on in situ rooting profiles and Water-Use Efficiency of cactus pears, Opuntia ficus-indica and O. robusta. Proceedings of the Professional Association for Cactus Development. J. Prof. Assoc. Cactus 7, 1-21. [ Links ]
Szarek, S.R., H.B. Johnson, y I.P. Ting. 1973. Drought adaptation in Opuntia basilaris. Significance of recycling carbon through Crassulacean acid metabolism. Plant Physiol. 52, 539-541. [ Links ]
Szarek, S.R. y I.P. Ting. 1975. Photosynthetic efficiency of CAM plants in relation to C3 and C4 plants. En: Marcelle, R. (ed.). Environmental and biological control of photosynthesis. W. Junk, The Hague. pp. 289-297. [ Links ]
Ting, I.P. y S.R. Szarek. 1975. Drought adaptation in Crassulacean acid metabolism plants. En: Hadley, N.F. (ed.). Environmental physiology of desert organisms. Dowden, Hutchinson and Ross, Stroudsburg (PA). pp. 152-167. [ Links ]
Ting, I. P., M.L.D. Thompson y W.M. Dugger. 1967. Leaf resistance to water vapor transfer in succulent plants: Effect of thermoperiod. Am. J. Bot. 54, 245-251. [ Links ]
Walter, H. 1962. Die Vegetation der Erde in ökophysiologischer Betrachtung. Bd. 1: Die tropischen und subtropischen Zonen . Ed 3, VEB Gustav Fischer Verlag, Jena. 538 p. [ Links ]
Wignarajah, K, D.H. Jennings y J.F. Handley. 1975 The effect of salinity on growth of Phaseolus vulgaris L. I. Anatomical changes in the first trifoliate leaf. Ann. Bot. 39, 1029-1038. [ Links ]
Winter, K. 1979. Photosynthetic and water relationships of higher plants in a saline environment. En: Jefferies, Rl y A.J. Davy, (eds.). Ecological processes in coastal environments. Blackwell, Oxford. pp. 297-320 [ Links ]
Winter K, D.J. y D.J. Von Willert. 1972. NaCI-induzierter Crassulaceansaurestoffwechsel bei Mesembryanthemum crystallinum. Z. Pflanzenphysiol. 67, 166-170. [ Links ]
Yensen, N.P., M.R. Fontes, E.P. Glenn y R.S. Felger. 1981 New salt tolerant crops for the sonoran desert. Desert Plants 3, 111-118. [ Links ]














